人乳、牛乳、羊乳miRNA表达谱及功能分析







摘 要:目的:分析人乳、羊乳和牛乳的外泌体miRNA表达谱,并分析其潜在的功能。方法:基于GEO数据库,分析牛乳、羊乳、人乳中miRNA表达谱。基于multiMiR软件包预测人乳、牛乳、羊乳共同表达的miRNA的靶基因并利用基因本体分析(GO分析)、KEGG数据库富集等方法分析人乳、牛乳、羊乳中共同表达的miRNA的靶基因参与的功能。结果:在40个人乳样本中,共检测到1 898个miRNA,其中1 850个为特异性表达。相比之下,28个牛乳样本中有132个已知miRNA,其中83个特异性表达;而3个羊乳样本则表达了84个miRNA,其中28个为特异性表达。牛乳和羊乳有27个共同表达的miRNA,人乳和羊乳有26个,而人乳和牛乳则有19个。3种乳汁中共同表达的miRNA仅有3种,分别是miR-107,miR-22-3p和miR-30a-5p。另外,let-7家族和miR-148家族在人乳、牛乳和羊乳中均高表达。人乳、牛乳和羊乳中高表达的miRNA均参与蛋白代谢、mRNA代谢、组蛋白修饰相关的功能。而人乳、牛乳中共同表达的miRNA参与细胞周期、蛋白质加工相关的功能。结论:人乳、羊乳和牛乳miRNA存在明显差异,但有一些共同表达的miRNA。这些共同表达的miRNA在物种间保守,并且参与一些重要的生物功能。
关键词:外泌体;母乳;微小核糖核酸
miRNA Expression Profile and Functional Analysis of Human Milk, Bovine Milk and Goat Milk
ZENG Xiaoling1, ZHANG Jihua2, MA Ling2, WANG Jiaqi1, LI Wei1, WANG Wenxian3*
(1.Hunan Nutritional and Health Products Engineering and Technology Research Center, Changsha 410000, China; 2.Child Health Care Medical Division, Shanghai Children’s Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200062, China; 3.Department of Clinical Nutrition, School of Medicine and Technology, Shanghai Jiao Tong University School of Medicine, Shanghai 200135, China)
Abstract: Objective: To analyze the expression profiles of exosome miRNA in human milk, goat milk and bovine milk, and to analyze their potential functions. Method: miRNA expression profiles in bovine milk, goat milk and human milk were analyzed based on GEO database. multiMiR software package is used to predict the target genes of miRNA co-expressed in bovine milk, human milk and goat milk, and to analyze the participation functions of the target genes of miRNA co-expressed in bovine milk, human milk and goat milk by gene ontology analysis (GO analysis) and KEGG database enrichment. Result: In 40 human milk samples, a total of 1 898 miRNAs were detected, of which 1 850 were specifically expressed. In contrast, there were 132 known miRNAs in 28 milk samples, 83 of which were specifically expressed; three goat milk samples expressed 84 miRNAs, of which 28 were specifically expressed. There were 27 miRNAs co-expressed in bovine and goat milk, 26 in human and goat milk, and 19 in human and bovine milk. 3 miRNAs were co-expressed in the three kinds of milk, namely miR-107, miR-22-3p and miR-30a-5p. In addition, let-7 family and miR-148 family were highly expressed in human milk, bovine milk and goat milk. The highly expressed miRNAs in human milk, bovine milk and goat milk are involved in proteasomal protein catabolic process, regulation of mRNA metabolic process and histone modification. The miRNAs co-expressed in human milk and bovine milk are involved in cell cycle and protein processing in endoplasmic reticulum. Conclusion: There are significant differences in miRNA between human milk, goat milk and bovine milk, but there are some common miRNA. These co-expressed miRNAs are conserved across species and are involved in several important biological functions.
Keywords: exosome; human milk; miRNA
乳汁是哺乳动物母亲为新生儿提供营养和免疫保护的重要物质,哺乳是哺乳动物特有的一种行为,对新生儿的喂养至关重要[1-2]。人乳、羊乳和牛乳作为常见的哺乳动物乳汁,不仅在营养成分上存在差异,而且在生物活性物质方面也有所不同[3]。近年来,外泌体miRNA因其在细胞间通讯和基因表达调控中的重要作用而受到广泛关注。外泌体miRNA是一类小分子非编码RNA,能通过外泌体在细胞间传递,影响受体细胞的基因表达和功能[4]。因此,研究不同乳汁中外泌体miRNA的表达谱及其潜在功能,对于了解乳汁的营养价值和生物活性具有重要意义。
尽管已有研究开始关注于单一乳汁中外泌体miRNA的表达和功能,但对不同乳汁中外泌体miRNA的比较研究仍然较少[5]。此外,由于物种间的生物学差异,不同乳汁中外泌体miRNA的表达谱可能存在显著差异,但也可能有一些保守的表达模式。这些保守的miRNA可能在哺乳动物乳汁的生物学功能中起重要作用。因此,本研究旨在通过分析人乳、羊乳和牛乳的外泌体miRNA表达谱,识别特异性和共同表达的miRNA,并进一步探讨这些miRNA的潜在功能。为实现这一目标,基于GEO数据库中的miRNA表达数据,采用multiMiR软件包预测共同表达miRNA的靶基因,并利用基因本体分析(GO分析)和KEGG数据库富集分析等方法,探究这些miRNA在不同乳汁中的功能。通过这些分析,期望揭示不同乳汁中外泌体miRNA的表达差异,以及它们在哺乳动物乳汁中的保守性和生物学意义,为开发新型功能性食品和深入了解乳汁的营养价值提供理论依据。
1 对象和方法
1.1 研究对象
研究对象来自GEO数据库,其中人乳样本来自16个健康产妇的成熟乳,所有产妇年龄在33±2.4岁,所有样本在产后3~15个月取材[6]。羊乳样本来自于内蒙古农业和畜牧业科学研究院,样本来自3只鄂尔多斯绵羊,年龄为2岁,取材时间为哺乳中期。牛乳样本来源于4只健康奶牛,分别在第1天、第
4天早上和晚上取的乳汁。
1.2 研究方法
1.2.1 人乳、羊乳、牛乳外泌体miRNA数据下载
人乳外泌体miRNA表达谱来源于GSE216498,羊乳miRNA表达谱来源于GSE143779,牛乳外泌体miRNA来源于GSE232617。GEO数据框中分别下载以上3个数据集的miRNA表达量数据,分别进行归一化处理。
1.2.2 miRNA靶基因预测
本研究使用multiMiR软件包预测sRNA测序结果中所有miRNA的靶基因,所有结果均用于GO富集和KEGG富集分析。
1.2.3 富集分析
以基因本体(GO)数据库为参考,预测了人乳、牛乳、羊乳外泌体中miRNA的功能特性。以《京都基因组百科全书》(KEGG)数据库为参考,对样本溶液中目标基因所涉及的通路进行统计和比较。富集程度的显著性采用Fisher检验,同时采用Holm、Sidak、Bonferroni等方法降低假阳性率。
2 结果与分析
2.1 人乳、牛乳、羊乳miRNA的表达情况
人乳共40个样本,测出1 898个已知的miRNA;牛乳共28个样本,测出132个已知的miRNA;羊乳共3个样本,测出84个已知的miRNA;各组样本的miRNA全局表达情况如图1(a)(b)(c)所示。以人乳、牛乳、羊乳miRNA表达情况绘制Upset图来展示其交集情况。人乳中特异性表达的miRNA有1 850个,牛乳中特异性表达的miRNA有83个,羊乳中特异性表达的miRNA有28个。牛乳和羊乳共同表达的miRNA有27个,人乳和羊乳共同表达的miRNA有26个,人乳和牛乳共同表达的miRNA有19个。人乳、牛乳、羊乳共同表达的miRNA有3个,分别是miR-107、miR-22-3p、miR-30a-5p,详见图2。miR-107可以在多种人类细胞中发挥多种调控作用,如增殖,血管生成和脂质代谢,并可能在各种疾病中,如神经退行性疾病和癌症中发生改变[7-8]。miR-107的一个已知靶基因是NF1,其是一种肿瘤抑制基因,它在许多类型的癌症中被发现有突变。miR-107可通过直接靶向NF1的3’UTR来降低其表达[9]。miR-22-3p可以通过影响mRNA的稳定性和翻译来参与基因表达的转录后调控。miR-22-3p可以调控多种功能,如增殖,血管生成和脂质代谢,并可能在各种疾病中,如神经退行性疾病和癌症中发生改变[10]。miR-22-3p在人乳外泌体中丰富,可能有助于肠道发育,因为乳外泌体中的microRNAs能够抵抗婴儿的胃肠道消化[11]。miR-30a-5p属于miR-30a家族,研究表明miR-30a家族参与免疫细胞的发育。miR-30a通过靶向Th17发育过程中的关键调节因子IL-21R抑制Th17分化[12]。
柱状图表示交集大小,条形图表示集合大小,矩阵表示集合之间的交叠,矩阵的列表示每种交集组合,对应于柱状图的横坐标;矩阵的行表示集合,对应于条形图的纵坐标。
图2 人乳、牛乳、羊乳miRNA表达Upset图
2.2 不同物种乳汁中共同高表达的miRNA
由图3可知,miR-148a家族和let-7家族在人乳、牛乳、羊乳中均有高表达。人乳中高表达的是miR-148a-3p,牛乳和羊乳中高表达的是miR-148a。对于let-7家族,人乳中高表达的是let-7f-5p;牛乳中高表达的是let-7a-5p、let-7b、let-7c和let-7f;羊乳中高表达的是let-7b、let-7a、let-7c、let-7i和let-7f。据报道,MiR-148a-3p与能量代谢、胰岛素信号传导和脂肪生成途径有关[13-15]。let-7家族是人类最早发现的miRNA,在序列和功能上高度跨物种保守。它最初被发现与干细胞的增殖、发育和分化有关[16]。近年来,也有报道称let-7及其家族参与了神经炎症相关疾病的免疫调节[17]。
2.3 高表达miRNA靶基因GO富集
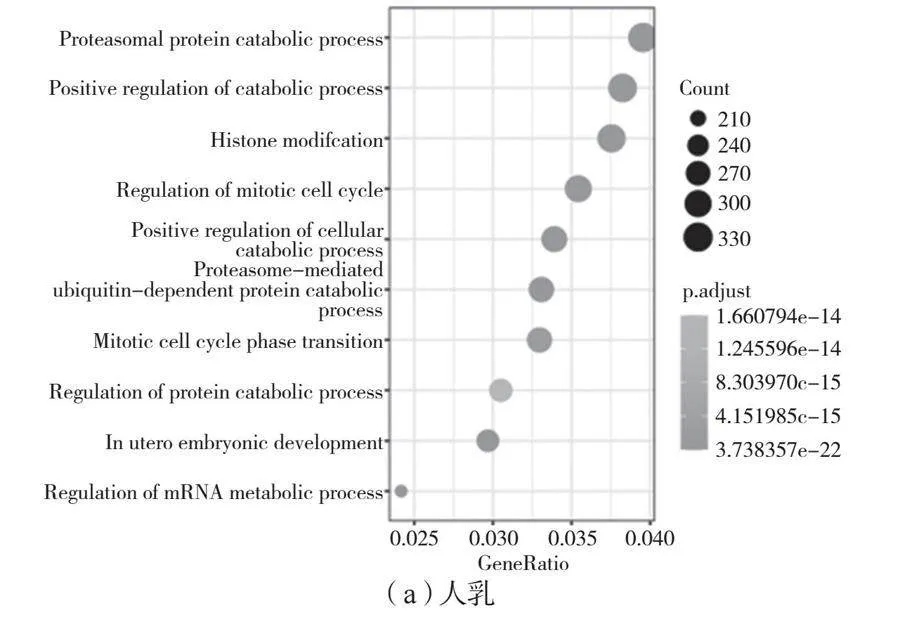
由图4可知,虽然人乳、牛乳、羊乳高表达miRNA种类不一致,但是从靶基因的GO富集结果来看,可以看到不同物种的乳中高表达的miRNA的靶基因基本上参与蛋白代谢(Proteasomal protein catabolic process)、mRNA代谢(Regulation of mRNA metabolic process)、组蛋白修饰(Histone modification)相关的功能。但是人乳外泌体miRNA的靶基因还参与子宫内胚胎发育(In utero embryonic development)。这主要是miR-181a-5p、miR-26a-5p、miR-92a-3p、miR-30家族、let-7f-5p和miR-22-3p的作用。
2.4 高表达miRNA靶基因KEGG通路富集
由图5可知,人乳、牛乳中高表达的miRNA的靶基因基本上都有在蛋白质加工(Protein processing in endoplasmic reticulum)、细胞周期(Cell cycle)等通路上富集。
2.5 共同表达的miRNA靶基因GO富集
由图6可知,基因本体分析(GO分析)显示人乳、牛乳和羊乳中共同表达的miRNA靶基因主要与细胞周期(Cell cycle)、蛋白质加工(Protein processing in endoplasmic reticulum)通路相关。说明这些基因可能在细胞生命周期的调控、蛋白质合成和加工等关键生物学过程中发挥重要作用。
2.6 共同表达的miRNA靶基因KEGG通路富集
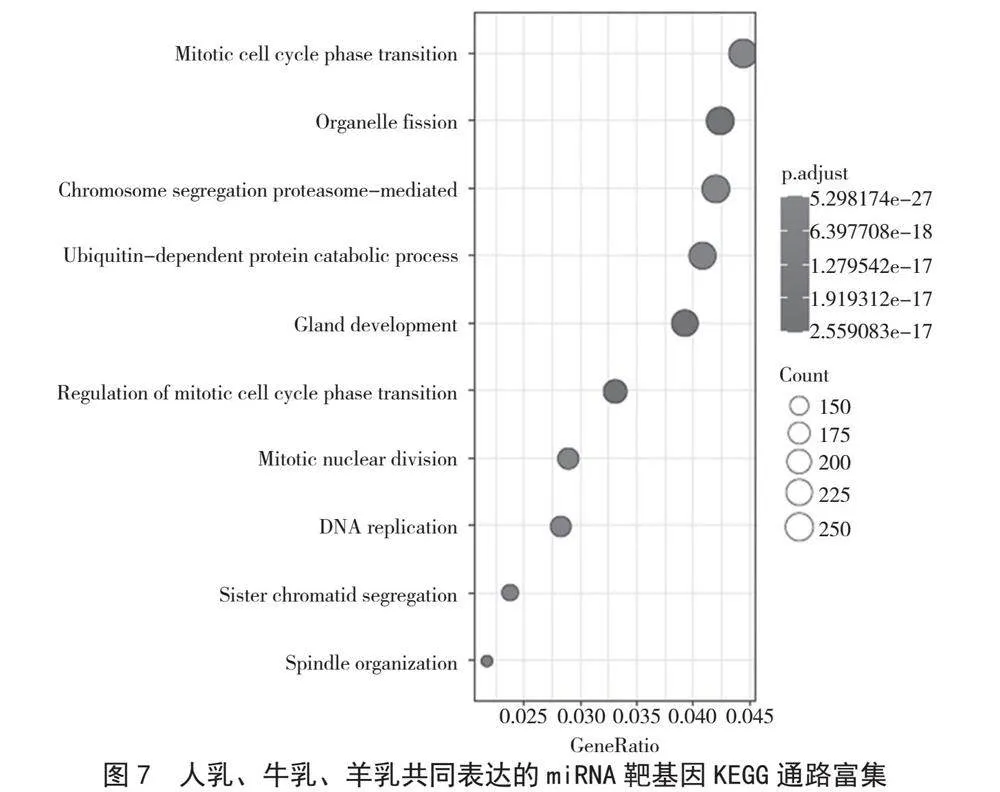
由图7可知,人乳、牛乳、羊乳中共同表达的miRNA的靶基因富集在有丝分裂细胞周期阶段转换(Mitotic cell cycle phase transition)、染色体分离(Chromosome segregation)、蛋白酶体介导的蛋白质分解过程(Proteasome-mediated ubiquitin-dependent protein catabolic process)、有丝分裂核分裂(Mitotic nuclear divisio)、DNA复制(DNA replication)和加工相关的通路上,说明这些miRNA的靶基因直接或间接地参与了细胞的基本生命过程,行使基本的生物学功能。
3 结论与讨论
在牛乳和羊乳中,已鉴定出的miRNA种类相对较少,而人乳中已鉴定出的miRNA种类则较为丰富。由于人类miRNA基因组的研究更为深入和广泛,已被命名的已知miRNA数量较多,因此在与参考基因组比对时,能够识别出较多的已知miRNA种类。相比之下,牛乳和羊乳的miRNA研究相对较少,导致已知的miRNA种类有限,因此在比对过程中识别出的miRNA种类也相应较少。另外有些高表达的miRNA在人乳、牛乳和羊乳中具有特异性的表达,如miR-22-3p只在人乳中特异性高表达,miR-21在羊乳中特异性高表达,而miR-3596在牛乳中特异性高表达。miR-22-3p与脂质代谢和神经系统调节有关[18-19],miR-21参与炎症调节[20],而miR-3596在产后的奶牛肝脏中高表达,可能参与奶牛产后的代谢状态改变[21]。
在人乳、牛乳和羊乳中,共同存在并表达着特定的miRNA,如miR-107、miR-22-3p以及miR-30a-5p。这些miRNA在跨物种层面上被检测到,表明它们在生物过程中的普遍性和潜在的关键作用。然而,尽管miR-22-3p在上述3种乳汁中均有表达,但其在人乳中的表达水平明显高于牛乳和羊乳。这一现象揭示了人乳、牛乳和羊乳在miRNA表达谱上存在的物种特异性及生理学差异。进一步推测,miR-22-3p在人乳中的高表达可能与特定的乳腺组织或细胞类型紧密相关,并且这种差异在不同哺乳动物物种之间可能表现得更为显著。
本研究采用人乳、牛乳和羊乳3种不同来源的样本,通过深度挖掘GEO数据库中的miRNA表达数据,进行了大规模的miRNA表达谱分析,为全面解析不同物种的乳汁中miRNA的表达模式提供了坚实的依据。除了探讨miRNA的表达谱之外,本文还对其潜在生物学功能进行分析,进一步加深了对人乳、牛乳和羊乳中miRNA表达情况的了解。通过识别不同乳汁中共同表达的miRNA,本研究揭示了这些miRNA在物种间的共同性与差异性,为未来的研究提供了有价值的线索。
参考文献
[1]MANINGAT P D,SEN P,RIJNKELS M,et al.Gene expression in the human mammary epithelium during lactation: the milk fat globule transcriptome[J].Physiological genomics,2009,37(1):12-22.
[2]PUPPEL K,GOŁĘBIEWSKI M,GRODKOWSKI G,
et al.Composition and factors affecting quality of bovine colostrum: a review[J].Animals,2019,9(12):1070.
[3]HENNE W M,STENMARK H,EMR S D.Molecular mechanisms of the membrane sculpting ESCRT pathway[J].Cold Spring Harbor Perspectives in Biology,2013,5(9):a016766.
[4]MELNIK B C,SCHMITZ G J B P,ENDOCRINOLOGY R C,et al.MicroRNAs:milk’s epigenetic regulators[J].Best Practice amp; Research Clinical Endocrinology amp; Metabolism,2017,31(4):427-442.
[5]GOLAN‐GERSTL R,ELBAUM SHIFF Y,MOSHAYOFF V,et al.Characterization and biological function of milk‐derived miRNAs[J].Molecular Nutrition amp; Food Research2017,61(10):1700009.
[6]ZONNEVELD M I,VAN HERWIJNEN M J C,FERNANDEZ‐GUTIERREZ M M,et al.Human milk extracellular vesicles target nodes in interconnected signalling pathways that enhance oral epithelial barrier function and dampen immune responses[J].Journal of Extracellular Vesicles,2021,10(5):e12071.
[7]TURCO C,DONZELLI S,FONTEMAGGI G.miR-15/107 microRNA gene group: characteristics and functional implications in cancer[J].Frontiers in Cell and Developmental Biology,2020,8:427.
[8]WANG S,ZHU W,XU J,et al.Interpreting the MicroRNA-15/107 family: interaction identification by combining network based and experiment supported approach[J].BMC Medical Genetics,2019,20:96.
[9]WANG S,MA G,ZHU H,et al.miR-107 regulates tumor progression by targeting NF1 in gastric cancer[J].Scientific Reports,2016,6(1):36531.
[10]ZHANG T,CHEN Y,LIN W,et al.Prognostic and immune-infiltrate significance of miR-222-3p and its target genes in thyroid cancer[J].Frontiers in Genetics,2021,12:710412.
[11]JIANG R,LÖNNERDAL B.Milk-Derived miR-22-3p Promotes proliferation of human intestinal epithelial cells (HIECs) by regulating gene expression[J].Nutrients,2022,14(22):4901.
[12]HAN J,FENG W,YAO R,et al.MiR-30a-centered molecular crosstalk regulates Th17 differentiation[J].Cellular amp; Molecular Immunology,2022,19(8):960-961.
[13]MELNIK B C,SCHMITZ G.MicroRNAs: milk’s epigenetic regulators[J].Best practice amp; research Clinical endocrinology amp; metabolism,2017,31(4):427-442.
[14]MIRRA P,NIGRO C,PREVENZANO I,et al.The destiny of glucose from a microRNA perspective[J].Frontiers in Endocrinology,2018,9:46.
[15]WAGSCHAL A,NAJAFI-SHOUSHTARI S H,WANG L,et al.Genome-wide identification of microRNAs regulating cholesterol and triglyceride homeostasis[J].Nat Med,2015,21(11):1290-1297.
[16]ROUSH S,SLACK F J.The let-7 family of microRNAs[J].Trends in Cell Biology,2008,18(10):505-516.
[17]GAUDET A D,FONKEN L K,WATKINS L R,
et al.MicroRNAs: roles in regulating neuroinflammation[J].The Neuroscientist,2018,24(3):221-245.
[18]HAN M,WANG S,FRITAH S,et al.Interfering with long non-coding RNA MIR22HG processing inhibits glioblastoma progression through suppression of Wnt/β-catenin signalling[J].Brain,2020,143(2):512-530.
[19]FANG H,YANG M,PAN Q,et al.MicroRNA-22-3p alleviates spinal cord ischemia/reperfusion injury by modulating M2 macrophage polarization via IRF5[J].J Neurochem,2021,156(1):106-120.
[20]KUMARSWAMY R,VOLKMANN I,THUM T.Regulation and function of miRNA-21 in health and disease[J].RNA Biol,2011,8(5):706-713.
[21]FATIMA A,LYNN D J,O’BOYLE P,et al.The miRNAome of the postpartum dairy cow liver in negative energy balance[J].BMC Genomics,2014,15:279.

