过表达带电多泡体蛋白2B基因抑制肾透明细胞癌细胞的增殖

摘要:目的 肾透明细胞癌中带电多泡体蛋白2B(CHMP2B)的表达水平与临床病理特征及预后的关系,探究CHMP2B 在肾透明细胞癌发生发展中的潜在作用机制。方法 从TCGA数据库下载并整理肾透明细胞癌的RNAseq数据并提取FPKM格式的数据,比较肿瘤样本与癌旁样本 CHMP2B的表达差异,根据其表达中位值分为高、低表达组,分析CHMP2B表达水平与临床病理特征的相关性,采用Kaplan-Meier模型进行生存分析,COX风险回归模型用于临床预后因素分析;使用ESTIMATE 算法分析CHMP2B与免疫和基质细胞浸润及肿瘤纯度的关系;使用Limma 包对CHMP2B筛选共表达基因,并进一步行GSVA富集分析。使用ESTIMATE算法和Timer数据库分析CHMP2B表达与免疫浸润的相关性;使用cBioPortal数据库分析CHMP2B的基因突变对肾透明细胞癌免疫治疗的影响;从HPA数据库获取CHMP2B蛋白质在肾透明细胞癌组织和正常组织的免疫组化表达情况;通过收集健康与肾癌患者外周血标本评价CHMP2B作为临床标志物的可能。通过细胞实验验证CHMP2B对肾癌细胞增殖与迁移的影响。结果 与癌旁组织相比较,CHMP2B在肾透明细胞癌组织中低表达,使其过表达会抑制肿瘤细胞增殖(Plt;0.01),其表达水平与年龄、性别、是否淋巴结转移以及分期等具有相关性(Plt;0.05)。生存分析结果显示CHMP2B低表达肾透明细胞癌患者生存预后更差(Plt;0.05),富集差异分析及共表达基因富集发现CHMP2B 在肾透明细胞癌中主要涉及病毒出芽、坏死性凋亡、内吞作用等,并涉及免疫调节过程。结论 CHMP2B在肾透明细胞癌组织中低表达,可有效影响肿瘤进展和肿瘤免疫过程,是一种有前途的预后分子标志物及治疗靶点。
关键词:肾透明细胞癌;带电多泡体蛋白2B;内体分选复合物;预后;免疫
肾癌是全球范围内常见的恶性肿瘤之一[1],约占所有新诊断癌症病例的3%[2]。男性的肾癌发病率普遍高于女性,发病风险约为女性的2倍[3],其发病率随着年龄的增长而增加,大多数肾癌病例发生在50 岁以上的中老年人群中[4]。肾透明细胞癌(KIRC)是最常见的肾细胞癌[5],目前大多依赖于手术治疗,包括肾部分切除术和根治性KIRC切除术[6],对早期和中期KIRC患者有显著效果。免疫靶向治疗、免疫检查点抑制剂以及免疫联合等新方案在转移性肾细胞癌和晚期KIRC患者的治疗中取得进展[7],也可用于手术后癌症复发风险高的人群,以帮助降低癌症复发的风险。这些新兴的治疗手段已取代了传统的细胞因子治疗方案,并且在一些研究中显示出较好的疗效,因此为癌症治疗和早期诊断发掘新的免疫治疗靶点极为重要。
内体分选复合物(ESCRT)是一种多亚基复合物,主要参与蛋白质的内吞溶酶体运输和自噬[8],具有丰富的功能和广泛的生物学作用。ESCRT能够协调参与细胞内多种关键过程,包括内吞作用、蛋白质降解、细胞分裂以及细胞信号传导等[9],因而在维持细胞内环境稳定和正常功能方面发挥着重要作用。ESCRT的各个亚基的突变或其相关蛋白表达水平的轻微变化,可能导致细胞结构与功能的显著改变[10],从而引发各种病理状态,包括肿瘤的发生和进展[11]。这些亚基通过调控内吞体的形成和功能,影响肿瘤细胞的生存及其与微环境的相互作用[12]。然而,由于不同ESCRT亚基的作用机制非常复杂,且不同类型的肿瘤在生物学特性上具有显著差异,各亚基对不同肿瘤类型的影响也呈现出多样性[13]。带电多泡体蛋白2B(CHMP2B)属于ESCRT-III,是CHMP 家族蛋白(CHMP1-7)成员之一[14],通常以自抑制状态存在于细胞质中。已有研究发现,CHMP2B亚基的突变与神经性退行性疾病密切相关[15]。在培养的海马神经元中,CHMP2B的敲低会导致神经元棘密度增加,这可能会导致神经可塑性下降[16]。在心脏疾病的研究中,CHMP2B被发现能够影响心肌自噬和神经元代谢,同时与肌肉萎缩等病理过程相关[17]。过量积累的CHMP2B可能与其他多种蛋白结合,形成淀粉样蛋白复合物,从而干扰ESCRT-III的正常生物学功能[18]。以上研究表明,CHMP2B的活性和表达水平对于维持蛋白质和细胞功能的稳定至关重要[19]。然而,目前针对CHMP2B功能缺失和过表达对细胞正常功能的影响,以及其在肿瘤发生与发展中的作用的研究仅限于验证CHMP2B促进细胞自噬死亡的功能[20],并探讨其对乳腺癌患者生存的积极影响[21],尚缺乏对CHMP2B在肿瘤生物学中的全面评估。本研究旨在深入探讨CHMP2B在不同肿瘤类型中的角色及其潜在机制,为未来的肿瘤治疗提供新见解。本研究通过网络肿瘤学TCGA数据库对KIRC患者测序样本的差异基因进行分析,并通过实验验证网络肿瘤学预测结果,将CHMP2B的生物学特性与KIRC发病机制相结合,探究CHMP2B对KIRC预后及免疫治疗的影响关系,为其开发利用于临床治疗,成为新的治理靶点提供理论基础。
1 材料和方法
1.1 生物信息学分析
1.1.1 数据来源 从TCGA数据库下载并整理TCGAKIRC患者肿瘤及癌旁样本的mRNA表达数据文件及临床数据文件的RNAseq 数据并提取FPKM格式的数据,去除无临床信息+去除重复,并用log2(value+1)均一化处理。
1.1.2 表达差异分析 在TCGA 队列中对目标基因CHMP2B KIRC 组织和正常组织中的表达水平进行比较。
1.1.3 预后相关性分析 对队列中不同患者的CHMP2B表达水平、性别、年龄、TNM分期、病理分级进行预后单因素及多因素COX回归,分析CHMP2B表达以及临床特征与预后的关系。利用TCGA 队列中CHMP2B基因表达中位数为临界值进行患者的预后分析,用Log‐rank 检验分析CHMP2B表达量与KIRC患者疾病特异性生存期及总生存期的相关性,并绘制Kaplan‐Meier生存曲线。
1.1.4 临床特征的相关性分析 探究CHMP2B表达在队列中不同TNM分期、病理分级患者中的表达差异,分析肿瘤发生发展的不同时期CHMP2B的表达趋势。
1.1.5 基因共表达及功能富集分析 运用TCGA数据库,以相关性系数gt;0.6、Plt;0.05为标准,通过R软件分析CHMP2B 在KIRC 患者中的共表达基因。将KIRCmRNA表达谱数据集导入R软件进行相关分析,获得CHMP2B与KIRCmRNA表达谱所有基因的相关系数,从GSEA官网下载基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析对应数据集文件(c5. go. v7.4 symbols. gmt 和c2. cp. kegg. v7.4. symbols.gmt)。使用R4.2.3 软件的“limma”、“orgHs. eg. db”、“clusterProfiler”及“enrichplot”包进行GSEA分析,展示差异有统计学意义(Plt;0.05)的前5个功能或通路。
1.1.6 泛癌数据采集 从TCGA数据库下载并整理33种肿瘤的RNAseq数据并提取FPKM格式的数据,采用Wilcoxon rank sum test 统计方法,用ggplot2 包对数据进行可视化。
1.1.7 肿瘤微环境 采用ESTIMATE 算法计算TCGA数据库中每个肿瘤组织的基质评分和免疫评分。通过标准化基因表达矩阵,应用CIBERSORT方法分析22种免疫细胞的比例,获得每个样本中免疫浸润细胞的含量,分析CHMP2B高低表达组与免疫浸润细胞的关系。
1.1.8 免疫表型评分 从TCGA数据库收集了含有免疫表型评分的数据,采用TCGA数据库对KIRC的肿瘤微环境进行分析。通过ESTIMATE算法对CHMP2B高、低表达组进行肿瘤微环境差异分析,计算免疫评分、基质评分以及ESTIMATE评分。
1.1.9 CHMP2B的表达与免疫检查点及免疫治疗疗效的相关性分析 采用TCGA数据库,通过R软件分析CHMP2B的表达与KIRC中免疫检查点的相关性,以Plt;0.05 为差异有统计学意义。利用TCGA数据库中KIRC患者免疫治疗的相关信息,比较CHMP2B高低表达组患者与免疫表型评分的相关性,评估CHMP2B的高低表达对免疫检查点抑制治疗的反应,以Plt;0.05为差异有统计学意义。同时评估KIRC肿瘤的肿瘤突变负荷。
1.1.10 CHMP2B免疫组化验证 使用HPA数据库中正常肾组织与KIRC组织的CHMP2B抗体免疫组化染色结果进行验证。
1.2 KIRC患者中CHMP2B表达情况及临床意义
1.2.1 研究对象 收集2022 年6 月~2023 年3 月在青岛市市立医院确诊的KIRC患者30 例,选取年龄40~60岁、性别相匹配的健康体检人员30 例为对照组。所有癌症患者均符合国际肾透明细胞癌数据联盟中KIRC的诊断标准。纳入标准:首次发病的癌症患者;临床病理资料完整(术前检查及检验结果完整);未接受过放化疗、激素治疗和生物治疗等抗肿瘤治疗;依从性良好,术后配合密切跟踪随访者。排除标准:合并免疫性疾病;合并急慢性炎性反应;合并其他恶性肿瘤;合并严重感染;基础疾病控制不佳。收集所有患者入院时空腹状态下外周静脉血,分离外周血单个核细胞,-80 ℃冰箱保存待测,临床血液的样本采集均通过患者书面知情同意。本研究通过青岛市市立医院伦理委员会批准(伦理批号:2024-KY-021)。
1.2.2 RT-PCR验证KIRC中CHMP2B的表达 采用外周血RNA提取试剂盒(天隆科技公司)提取血液中的总RNA,cDNA第一链合成试剂盒(上海赛默飞世尔科技有限公司),SYBR Green荧光定量PCR试剂盒(北京天根生化科技有限公司),引物由华大基因生物科技有限公司合成。RNA按照试剂盒说明书进行提取,进行浓度和纯度检测后合成cDNA进行实时荧光定量PCR。CHMP2B的引物序列为:上游引物:5'-AAGATGGCCAAAGCTCCATCA-3';下游引物:5'-AGCCTTGAGTTGCCGTTCA-3'。内参GAPDH上游引物:5'-GCACCGTCAAGGCTGAGAAC-3';下游引物:5'-TGGTGAAGACGCCAGTAAA-3',实验结果以2-ΔΔCt表示样本中目的基因的相对表达量。
1.3 CHMP2B对人肾透明细胞腺癌细胞(786-O)生长、迁移、侵袭能力的影响
1.3.1 细胞培养 786-O细胞(武汉普诺赛生命科技有限公司)在含有10%胎牛血清(武汉普诺赛生命科技有限公司)的RPMI 1640 培养基(武汉普诺赛生命科技有限公司)中培养,置于37 ℃的湿化培养箱中,含有5% CO2。
1.3.2 过表达质粒转染 将786-O细胞培养至80%汇合度后将pcDNA3.1-CHMP2B 以及pcDNA3.1-NC 通过Lipofectamine 3000 试剂(上海赛默飞世尔科技有限公司)转入,根据实验要求在24~48 h后进行实验。
1.3.3 CCK8实验 将786-O细胞培养至80%汇合度后分别转入pcDNA3.1-NC与pcDNA3.1-CHMP2B。24 h后,将转染阴性对照质粒与过表达质粒的786-O细胞进行消化计数后,吹打混匀接种至96孔培养板中(每孔加100 μL 完全培养基、5×103 细胞),设6 个复孔,放入37 ℃、5% CO2培养箱中培养,分别在培养6、12、24、48、72 h 后,向每孔加入10 μL CCK8 溶液(CCK8,APExBIO)(避光),37 ℃培养箱孵育2 h。用酶标仪测量吸光值A450 nm。
1.3.4 细胞划痕实验 采用划痕实验分析过表达CHMP2B基因对786-O细胞迁移的影响。在6 孔板底部用记号笔划线后,分别将同时转染的Vector-CHMP2B和Vector-NC细胞,以2×105密度接种于6 孔板中培养。当6 孔板中的细胞长到80%~90%后,用100 μL无菌枪头在培养板中于标记线垂直划线,形成线性无细胞区。PBS洗涤细胞2次,加入新鲜完整培养基。在划线后0和24 h,用显微镜在相同位置拍摄细胞向划痕迁移的过程。使用ImageJ 对图像进行定量分析。细胞迁移以细胞覆盖到初始无细胞区的百分比计算。本组实验进行5次独立生物学重复。
1.3.5 Transwell 小室实验 使用200 μL无血清培养基将1×104细胞接种于Transwell小室(康宁)上方,小室下方加入500 μL完全培养基,培养24 h 后,结晶紫染色。随机选取3个区域,高倍镜下拍照并计数细胞数,以3个高倍视野中细胞从上室向下室迁移的平均细胞数目来衡量其迁移能力。实验重复3次。
1.4 统计学分析
采用SPSS26.0统计软件对数据进行统计学分析,采用Shapiro-Wilk进行正态性检验,符合正态分布的计量资料采用两独立样本t检验进行比较,不符合正态分布的采用秩和检验比较。以Plt;0.05为差异有统计学意义。采用GraphPad Prism9软件进行绘图。
2 结果
2.1 CHMP2B在KIRC癌组织和癌旁样本中的表达和配对分析结果
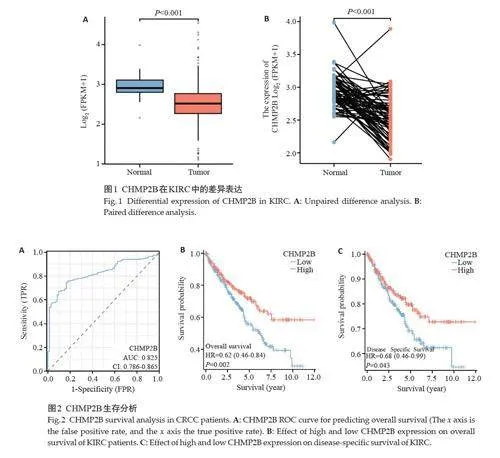
KIRC患者基因表达数据来自TCGA公共数据库的532例肿瘤组织及72例正常组织。CHMP2B在KIRC组织中较癌旁组织表达降低,差异有统计学意义(Plt;0.05,图1)。
2.2 CHMP2B表达与患者预后关系
CHMP2B低表达组患者生存预后较高表达组更差,差异有统计学意义(Plt;0.05,图2)。
2.3 CHMP2B表达与KIRC临床病理相关性分析结果
CHMP2B的表达水平与性别、分期以及分级等临床病理因素具有相关性(Plt;0.05,图3)。
2.4 患者预后因素的单因素及多因素分析结果
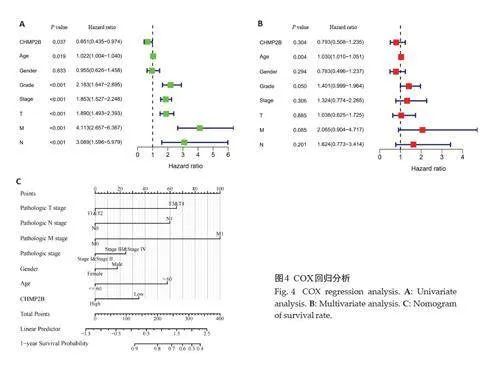
单因素显示CHMP2B、年龄、分级、分期等可作为KIRC患者独立预后因子影响患者预后(Plt;0.05,图4)。
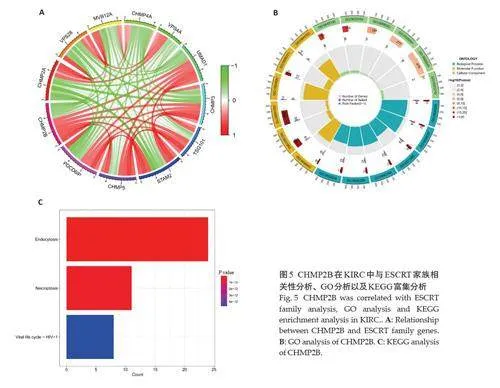
2.5 CHMP2B富集分析
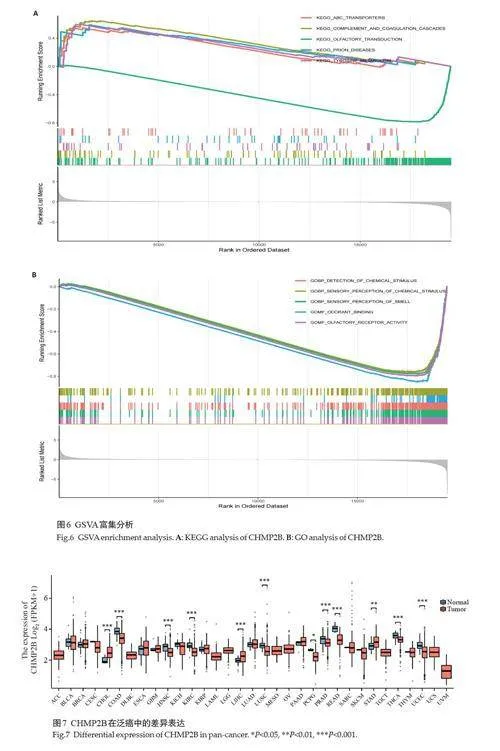
2.5.1 CHMP2B基因与ESCRT家族基因之间的共表达网络分析 选取ESCRT家族中与CHMP2B关系最强的前10个基因(图5A)。经富集分析,TCGA数据显示,CHMP2B 富集在ESCRTⅢ复合体拆解、病毒出芽、ESCRTⅢ复合体、两性细胞膜、两栖体、钙粘蛋白结合;KEGG分析显示,CHMP2B富集在坏死性凋亡、内吞作用、肌萎缩侧索硬化症等(图5B)。GSEA富集分析结果显示CHMP2B主要包括淋巴细胞和非淋巴细胞的免疫调节、磷脂的吞噬作用、补体的初始触发、抗原激活第二信使产生等功能(图5C)。
2.5.2 CHMP2B 差异基因的富集通路分析结果CHMP2B高表达组主要富集在ABC转运蛋白运输、朊病毒疾病、酪氨酸代谢、补体和凝血级联反应,调节PH,补体激活等功能上(图6A),低表达组主要富集于嗅觉传导、味觉传导、自身免疫性甲状腺病、胞质DNA感应通路、感知刺激检测等功能上(图6B)。
2.6 CHMP2B在泛癌中的差异表达分析
基于TIMER2.0 数据库,分析TCGA-33 种肿瘤CHMP2B的表达情况。结果显示,CHMP2B在胆管癌(CHOL)、结肠腺癌(COAD)、头颈部鳞状细胞癌(HNSC)、肾嫌色细胞癌(KICH)、KIRC、肝脏肝细胞癌(LIHC)和肺鳞状细胞癌(LUSC)、前列腺腺癌(PRAD)、直肠腺癌(PEAD)、胃腺癌(STAD)和甲状腺癌(THCA)、子宫内膜癌(UCEC)12 种癌症中均显著表达。在COAD、HNSC、KICH、KIRC、LUSC、PRAD、READ、THCA、UCEC中,CHMP2B在肿瘤组织中表达较正常组织下调。在TCGA中,CHMP2B在KIRC组织中的表达量相比较于正常组织的表达量降低(Plt;0.05,图7)。
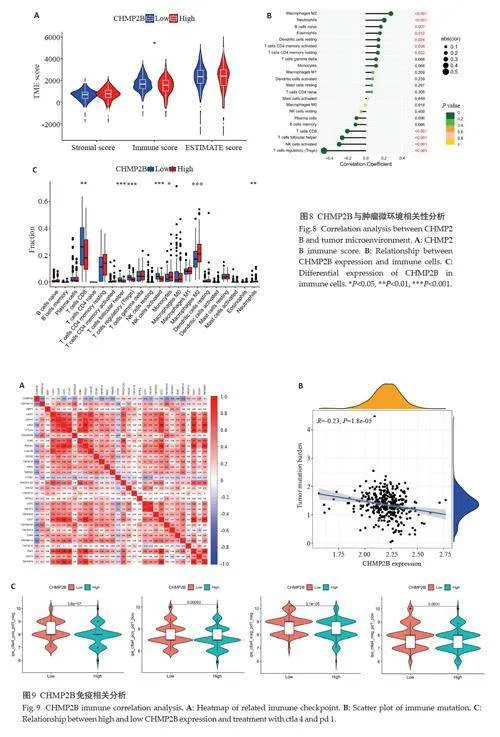
2.7 CHMP2B基因与KIRC肿瘤微环境相关性分析
采用CIBERSORT免疫评分对TCGA数据集进行免疫细胞浸润分析,结果显示CHMP2B的低表达组在免疫细胞得分中高于高表达组(Plt;0.05,图8A);CHMP2B表达与CD8+T细胞等抗肿瘤免疫活性细胞的浸润呈负相关关系(Plt;0.05,图8B)。CHMP2B在肿瘤浸润免疫细胞评分差异分析显示,CHMP2B 表达在CD8+T细胞、滤泡辅助T细胞、调节性T细胞、活化NK细胞、单核细胞及巨噬细胞M2、中心粒细胞之间的差异有统计学意义(Plt;0.05,图8C)。
2.8 CHMP2B的表达与免疫检查点及免疫治疗疗效的相关性
CHMP2B 与TNFRSF14 的相关性最强(图9A)。通过ips 评估CHMP2B表达与免疫检查点抑制剂的疗效差异,结果显示CHMP2B 低表达组ctla4+pd1- 、ctla4-pd1+、ctla4+pd1+免疫治疗评分高于高表达组(Plt;0.05,图9C),肿瘤突变负荷分析结果显示其与CHMP2B表达量呈负相关(Plt;0.05,图9B)。
2.9 免疫组化分析
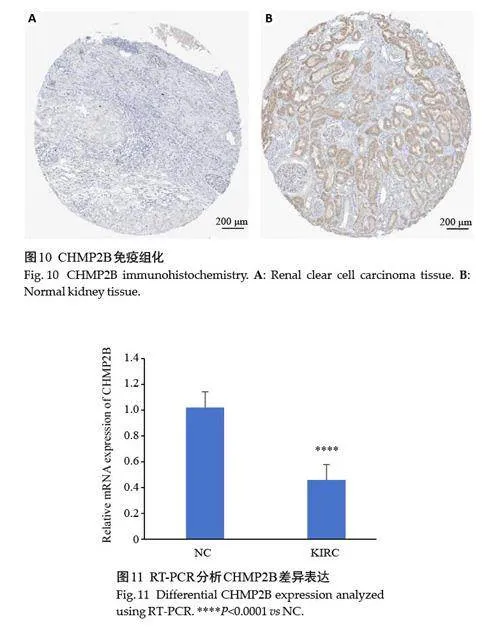
在HPA数据库中检索分析KIRC组织与肾正常组织的CHMP2B表达情况,发现癌组织免疫组化染色较正常组织更浅,CHMP2B蛋白在KIRC组织中的表达明显下调(图10)。
2.10 CHMP2B mRNA在KIRC患者外周血单个核细胞中表达降低
收集健康人群与KIRC患者的外周血并分离出其中的单个核细胞进行了qRT-PCR实验,结果表明,与健康对照组相比较,KIRC 患者外周血单个核细胞中CHMP2B基因mRNA表达降低(图11)。外周血单个核细胞是免疫细胞的主要组成部分,CHMP2B表达的下降可能与KIRC患者免疫系统功能的改变有关。
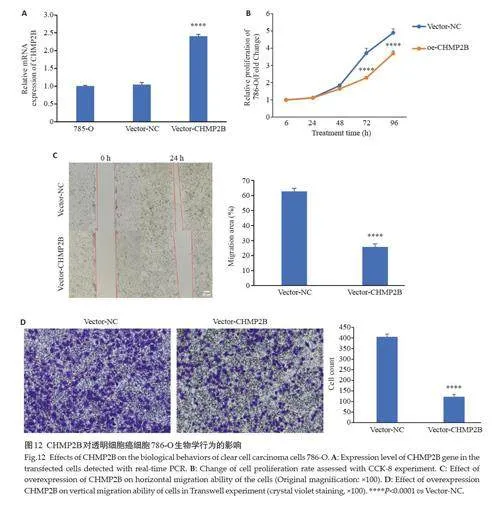
2.11 上调CHMP2B抑制了肾癌细胞786-O的增殖与迁移 qRT-PCR检测可见,与空白对照组比较,Vector-NC组CHMP2B mRNA 表达水平未明显改变(Pgt;0.05),Vector-CHMP2B组与前两组相比,CHMP2B mRNA表达水平升高(Plt;0.05,图12A)。利用CCK-8 实验分析786-O细胞增殖能力,发现上调CHMP2B表达的786-O细胞与对照组细胞相比增殖能力明显减弱(图12B)。Vector-CHMP2B组的细胞增殖随着肿瘤的进展和肿瘤转移在24、48、72、96 h均低于Vector-NC组(Plt;0.0001)。提高CHMP2B表达水平可抑制肿瘤细胞的进展,差异有统计学意义(Plt;0.05,图12C、D)。
3 讨论
肾细胞癌是泌尿生殖系统常见的恶性肿瘤,2020年全球新增KIRC 病例约43 万,死亡病例约18 万[22]。近年来,我国KIRC的发病率呈逐年上升的趋势[23],严重威胁着人们的健康。目前,超声波检查和CT扫描等影像学技术是常用的KIRC早期筛查方法[24],部分生物学标志物也用于KIRC的诊断。外科手术是KIRC初期阶段主要的治疗方法[25];同时,一些免疫检查点抑制剂(如抗PD-1和抗PD-L1药物)也应用于恢复患者免疫系统对肿瘤的抗肿瘤反应[26]。研究发现KIRC肿瘤微环境中的细胞[27]和分子相互作用与KIRC发生相关的分子机制如突变、基因表达异常和信号通路失调等密切相关[28],对肿瘤生长和转移具有重要影响。随着基因组学和分子生物学等技术的发展[29],已鉴定出与KIRC相关的基因变异[30]和新的致病基因[31],这些发现为个体化治疗提供了基础,有助于选择特定患者的治疗策略,因此探究治疗KIRC的有效靶点对KIRC的治疗十分重要。
目前,对CHMP2B在肿瘤进展中的作用的机制见解有限。因此,本研究针对CHMP2B在KIRC中的表达、预后价值、免疫相关性以及基因功能进行了全面深入的分析,并基于表观实验加以验证,表明了其在肿瘤进展过程中具有重要作用。研究结果显示CHMP2B在KIRC癌组织中的表达低于正常组织;生存分析结果显示,CHMP2B低表达组总生存期低于低风险组,提示CHMP2B的高表达与KIRC患者的预后密切相关且与临床病理分级具有相关性,同时风险评分与其他临床特征共同构建的列线图具有良好的预测准确性,可为临床医生治疗KIRC患者提供参考。富集分析结果显示,CHMP2B高表达与ABC转运蛋白运输、朊病毒疾病、酪氨酸代谢、补体和凝血级联反应,调节PH,补体激活等功能密切相关;研究也发现CHMP2B的表达与肿瘤突变负荷、肿瘤微环境等免疫相关因素密切相关。免疫检查点抑制剂是最新和最先进的癌症治疗方法,然而2/3的晚期KIRC 患者对免疫检查点抑制剂治疗反应不佳[32],这提示复杂的肿瘤微环境中存在多种信号传导途径来帮助肿瘤细胞逃避免疫治疗[33]。基因表达与免疫细胞浸润相关性分析结果显示,CHMP2B的表达水平与免疫浸润细胞呈高度相关,表明CHMP2B基因的异常表达会引起肿瘤免疫微环境素乱,进而导致KIRC的发生发展及免疫逃逸,提示KIRC在肿瘤免疫治疗方面具有重要价值。PCR及细胞基因过表达等实验证实,CHMP2B在KIRC与正常对照之间存在差异,且会影响肿瘤细胞的增殖、迁移、侵袭。尽管目前关于CHMP2B在KIRC中的研究较少,且其在KIRC发生发展中的具体作用机制仍未明确,但是随着研究的进一步深入,这些研究结果揭示了CHMP2B基因作为免疫治疗和预后生物标志物在肿瘤中可能发挥的作用,且基于CHMP2B构建的预后模型可较好地评估KIRC患者的预后情况。本研究基础实验验证了CHMP2B的预后功能,发现过表达CHMP2B会大大减少细胞生长、克隆的形成和移动,突出了CHMP2B在KIRC增殖和迁移中的重要作用。这为其成为KIRC新型生物标志物提供了新的思路和方向,为未来的KIRC的诊断、治疗和预后判断等提供新的研究方向,进一步推动KIRC的诊断、治疗和预后的研究进展。
综上,本研究采用CHMP2B创建了KIRC患者的预后模型,该模型准确预测了预后;风险评分类型与免疫微环境和不同功能具有相关性。根据功能验证结果,CHMP2B在KIRC的生长和进展中起着至关重要的作用。CHMP2B在786-O细胞中的过表达抑制其的侵袭和迁移,能够作为KIRC癌患者的预后生物标志物。但本研究存在一定的局限性,如缺少动物实验体外验证肿瘤生长,且样本量相对较小,也并未探究其的下游靶基因。未来将进一步验证CHMP2B在肿瘤细胞生理生化过程中的作用,并确定其作用轴,从而为KIRC进展和转移的干预提供新的见解。
参考文献:
[1] 陈 磊, 徐杰茹, 王 冕, 等. 1990-2019年中国肾透明细胞癌死亡趋势
及其年龄-时期-队列分析[J]. 中华疾病控制杂志, 2021, 25(9): 1026-
33, 1111.
[2] 张永贞, 杨国庆, 张思维, 等. 中国2009年肾及泌尿系统其他癌发病
和死亡分析[J]. 中国肿瘤, 2013, 22(5): 333-7.
[3] 李 凡, 管 维. 肾透明细胞癌诊疗相关进展[J]. 临床外科杂志,
2021, 29(2): 101-4.
[4] 李雁铭, 赵志刚. 肿瘤靶向药物研究进展[J]. 中国药业, 2021, 30
(21): 128-34.
[5] Ricketts CJ, De Cubas AA, Fan HH, et al. The cancer genome atlas
comprehensive molecular characterization of renal cell carcinoma
[J]. Cell Rep, 2018, 23(12): 3698.
[6] 赵广宁, 李黎明. 肾细胞癌临床治疗的新进展[J]. 医学综述, 2021,
27(8): 1545-50.
[7] Ha D, Yang NN, Nadithe V. Exosomes as therapeutic drug carriers
and delivery vehicles across biological membranes: current
perspectives and future challenges[J]. Acta Pharm Sin B, 2016, 6
(4): 287-96.
[8] 王 敏, 孙 倩. 内吞体运输必需分选复合物在肿瘤中的作用[J].中
国肿瘤临床, 2023, 50(13): 673-8.
[9] 李晓康. SIRT6保护衰老心肌减轻缺血再灌注损伤的机制研究[D].
西安: 中国人民解放军空军军医大学, 2022.
[10]Li HY, Ni HL, Li Y, et al. Tumors cells with mismatch repair
deficiency induce hyperactivation of pyroptosis resistant to cell
membrane damage but are more sensitive to co-treatment of IFN-γ
and TNF-α to PANoptosis[J]. Cell Death Discov, 2024, 10(1): 227.
[11]Guo Y, Shang A, Wang S, et al. Multidimensional Analysis of CHMP
family members in hepatocellular carcinoma[J]. Int J Gen Med,
2022, 15: 2877-94.
[12]Motooka Y, Toyokuni S. Ferroptosis as ultimate target of cancer
therapy[J]. Antioxid Redox Signal, 2023, 39(1/2/3): 206-23.
[13]陈晓睿, 王晓晨, 张宗亮, 等. 基于TCGA数据库探究ESCRT相关基
因对膀胱癌的潜在预后价值[J]. 标记免疫分析与临床, 2023, 30(9):
1531-8, 1620.
[14]Dai EY, Meng LJ, Kang R, et al. ESCRT-III-dependent membrane
repair blocks ferroptosis[J]. Biochem Biophys Res Commun, 2020,
522(2): 415-21.
[15]Liu J, Kang R, Tang DL. Signaling pathways and defense
mechanisms of ferroptosis[J]. FEBS J, 2022, 289(22): 7038-50.
[16]Li J, Belogortseva N, Porter D, et al. Chmp1A functions as a novel
tumor suppressor gene in human embryonic kidney and ductal
pancreatic tumor cells[J]. Cell Cycle, 2008, 7(18): 2886-93.
[17]蔚沐君. AMPK通过CHMP2B调控心肌自噬的机制研究[D]. 延安:
延安大学, 2023.
[18]Wu YP, Wu YG, Xu C, et al. CHMP1A suppresses the growth of
renal cell carcinoma cells via regulation of the PI3K/mTOR/p53
signaling pathway[J]. Genes Genomics, 2022, 44(7): 823-32.
[19]Hu BY, Jiang DW, Chen YY, et al. High CHMP4B expression is
associated with accelerated cell proliferation and resistance to
doxorubicin in hepatocellular carcinoma[J]. Tumour Biol, 2015, 36
(4): 2569-81.
[20]Gupta N, Sahar T, Khowal S, et al. Differential levels of CHMP2B,
LLPH, and SLC25A51 proteins in secondary renal amyloidosis[J].
Expert Rev Proteomics, 2021, 18(1): 65-73.
[21]Clayton EL, Milioto C, Muralidharan B, et al. Frontotemporal
dementia causative CHMP2B impairs neuronal endolysosomal
traffic-rescue by TMEM106B knockdown[J]. Brain, 2018, 141(12):
3428-42.
[22]Ljungberg B, Albiges L, Abu-Ghanem Y, et al. European association
of urology guidelines on renal cell carcinoma: the 2019 update[J].
Eur Urol, 2019, 75(5): 799-810.
[23]Mei SL, Alchahin AM, Tsea I, et al. Single-cell analysis of immune
and stroma cell remodeling in clear cell renal cell carcinoma primary
tumors and bone metastatic lesions[J]. Genome Med, 2024, 16(1): 1.
[24]Guo Y, Cui YQ, Li YY, et al. Cytoplasmic YAP1-mediated ESCRTIII
assembly promotes autophagic cell death and is ubiquitinated by
NEDD4L in breast cancer[J]. Cancer Commun, 2023, 43(5):
582-612.
[25]魏梦超, 石冰冰, 邢宝坤. 肾透明细胞癌综合诊治的研究进展[J]. 北
京医学, 2023, 45(7): 618-22.
[26]Bialek J, Yankulov S, Kawan F, et al. Role of nivolumab in the
modulation of PD-1 and PD-L1 expression in papillary and clear cell
renal carcinoma (RCC)[J]. Biomedicines, 2022, 10(12): 3244.
[27]中国抗癌协会泌尿男生殖系肿瘤专业委员会肾癌学组. 晚期肾透明
细胞癌一线靶向治疗的优化选择中国专家共识(2022)[J]. 临床泌尿
外科杂志, 2022, 37(5): 329-37.
[28]Huang Y, Xiong ZY, Wang JJ, et al. Correction to: TBC1D5 reverses
the capability of HIF-2 in tumor progression and lipid metabolism in
clear cell renal cell carcinoma by regulating the autophagy[J]. J
Transl Med, 2024, 22(1): 505.
[29]Karpova Y, Guo DP, Makhov P, et al. Poly(ADP) -ribosylation
inhibition: a promising approach for clear cell renal cell carcinoma
therapy[J]. Cancers, 2021, 13(19): 4973.
[30]周 莉, 盛锡楠. 晚期肾透明细胞癌的治疗规范——《CSCO肾透明
细胞癌诊疗指南2020》解读[J]. 肿瘤综合治疗电子杂志, 2020, 6
(4): 1-6.
[31]陈 峰. 靶向联合免疫检查点抑制剂治疗晚期肾透明细胞癌研究进
展及单中心初步疗效分析[D]. 济南: 山东大学, 2022.
[32]胡青岳, 翟 炜, 郑军华. 晚期肾透明细胞癌系统治疗现状与进展[J].
外科研究与新技术, 2023, 12(4): 237-42.
[33]Ugbode C, West RJH. Lessons learned from CHMP2B, implications
for frontotemporal dementia and amyotrophic lateral sclerosis[J].
Neurobiol Dis, 2021, 147: 105144.
(编辑:郎 朗)