益气养阴化浊通络方通过调控miR-21a-5p/FoxO1/PINK1介导的线粒体自噬减轻糖尿病肾病小鼠的足细胞损伤



摘要:目的 探讨益气养阴化浊通络方(YYHT)对高糖诱导小鼠肾足细胞(MPC5)损伤的保护作用及潜在机制。方法 大鼠分别灌胃19、38、76 g/kg YYHT及生理盐水1周制备低、中、高浓度含药血清和空白血清。体外培养MPC5,分为对照组(5.5 mmol /LD-葡萄糖+miR-21a-5p-inhibitor-NC+空白血清)、模型组(30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+空白血清)、YYHT-L(30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+低浓度含药血清)、YYHT-M(30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+中浓度含药血清)、YYHT-H(30 mmol/L D-葡萄糖+NC+高浓度含药血清)、miR-21a-5p 抑制剂组(30 mmol/L D-葡萄糖+miR-21a-5pinhibitor+空白血清)。qRT-PCR检测miR-21a-5p表达及FoxO1、PINK1、Parkin 的mRNA表达,Western blotting检测足细胞标志蛋白(Nephrin、Podocin)及FoxO1、PINK1、Parkin蛋白表达,MDC染色检测自噬荧光。将MPC5分为阴性对照组(30 mmol/L D-葡萄糖+miR-21a-5p-NC+空白血清)、miR-21a-5p-mimic 组(30 mmol/L D-葡萄糖+miR-21a-5p-mimic+空白血清)、YYHT-L(30 mmol/L D-葡萄糖+miR-21a-5p-mimic+低浓度含药血清)、YYHT-M(30 mmol/L D-葡萄糖+miR-21a-5pmimic+中浓度含药血清)、YYHT-H(30 mmol/L D-葡萄糖+miR-21a-5p-mimic+高浓度含药血清),荧光素酶报告基因实验检测miR-21a-5p/FoxO1 转录调控,RIP检测miR-21a-5p 与靶基因FoxO1 结合。结果 与对照组相比,模型组miR-21a-5p 表达升高(Plt;0.05),FoxO1、PINK1、Parkin mRNA表达降低(Plt;0.05),FoxO1、PINK1、Parkin、Nephrin、Podocin蛋白表达及自噬荧光降低(Plt;0.05);与模型组相比,不同剂量YYHT含药血清及miR-21a-5p-inhibitor促进Nephrin及Podocin蛋白表达(Plt;0.05),抑制miR-21a-5p表达(Plt;0.05),增强FoxO1、PINK1、Parkin 的mRNA和蛋白表达及自噬荧光(Plt;0.05)。与miR-21a-5p-NC组相比,miR-21a-5p-mimic组抑制FoxO1 转录(Plt;0.05),促进miR-21a-5p 与FoxO1 的结合(Plt;0.05);与miR-21a-5p 组相比,YYHT含药血清组促进FoxO1 转录(Plt;0.05),抑制miR-21a-5p 与FoxO1 的结合(Plt;0.05)。结论 益气养阴化浊通络方可能通过调节miR-21a-5p/FoxO1/PINK1介导的线粒体自噬,减轻高糖诱导的小鼠肾足细胞损伤。
关键词:糖尿病肾病;益气养阴化浊通络方;线粒体自噬;足细胞损伤;miR-21a-5p/FoxO1/PINK1
糖尿病肾病(DKD)是终末期肾脏病的重要原因,也是糖尿病(DM)累及微血管的主要并发症,全球约30%以上的DM患者将发展为DKD,严重威胁着患者的身心健康[1, 2]。DKD的发病机制复杂,目前认为与代谢、血流动力学、氧化应激、炎症及自噬等密切相关[3, 4]。足细胞是维持肾小球滤过屏障完整性的重要组成部分,其损伤是白蛋白尿产生和DKD发展的主要原因[5, 6]。研究发现线粒体自噬失衡是DKD足细胞损伤的关键机制[7]。高糖环境下的足细胞及DKD大鼠肾组织PINK1/Parkin通路的激活受到抑制,足细胞线粒体自噬平衡被打破,导致足细胞损伤[8]。FoxO1是叉头转录因子,其上调表达可激活PINK1/Parkin通路促进高糖诱导的足细胞和DKD小鼠线粒体自噬,从而降解功能失调的线粒体并减轻足细胞损伤和DKD进展[9]。miRNA在DKD疾病中发挥着重要作用,miR-21a-5p表达与DKD进展正相关[10]。miR-21a-5p在高糖培养足细胞中高表达,其靶向FoxO1 抑制足细胞线粒体自噬,沉默miR-21a-5p则促进FoxO1表达及自噬[11]。研究表明中药复方及其药物活性成分能够通过相关途径调控线粒体自噬发挥防治DKD的作用,同时PINK1/Parkin信号通路介导的线粒体自噬可作为临床治疗DKD的新靶标[12, 13]。但是中药复方是否能够通过调控miR-21a-5p/FoxO1/PINK1信号通路介导的线粒体自噬治疗DKD尚未见报道。
本课题组前期研究发现益气养阴化浊通络方治疗DKD临床疗效显著,不仅能降低DKD患者血糖、尿蛋白水平,还能增强抗氧化应激能力、减轻炎症和内皮细胞损伤,改善血流变,延缓DKD进展[14-16]。同时,益气养阴化浊通络方含药血清可促进高糖诱导的足细胞自噬标志物ATG5、Beclin-1、BNIP3 表达,从而增强足细胞线粒体自噬[17]。然而,益气养阴化浊通络方干预足细胞线粒体自噬的机制尚不清楚,是否能够通过miR-21/FoxO1/PINK1介导的线粒体自噬保护足细胞尚未见报道。本研究通过观察益气养阴化浊通络方含药血清对高糖诱导的小鼠肾足细胞损伤及miR-21a-5p/FoxO1/PINK1信号通路的影响,进一步探讨益气养阴化浊通络方改善足细胞损伤的作用机制,为DKD的临床治疗提供科学依据。
1 材料和方法
1.1 材料
1.1.1 动物与细胞 7~8周龄SPF级Wistar雌性大鼠50只,体质量为220~250 g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0011。所有动物实验操作和饲养均遵循实验动物福利及伦理要求,本研究通过南阳理工学院伦理委员会批准(伦理批号:南理工动伦审[2021]003 号)。小鼠肾足细胞(MPC5)购自武汉华尔纳生物科技有限公司。
1.1.2 药物与试剂 益气养阴化浊通络方药材生黄芪、怀牛膝、太子参、鬼箭羽、六月雪、制香附、水蛭等购自张仲景大药房,均符合2020 年版《中国药典》标准。益气养阴化浊通络方饮片加10倍量水浸泡1 h,煮沸后煎煮30 min,收集药液;药渣再加10倍量水煎30 min,收集药液。合并2次煎煮液,浓缩得到相当于原生药4 g/mL的水提物。
miR-21a-5p-mimic、miR-21a-5p-mimic-NC、miR-21a-5p-inhibitor、miR-21a-5p-inhibitor-nc 及GPmiRGLO载体由吉玛生物提供;jetPRIME 转染试剂(Polyplus);MDC自噬染色试剂盒(上海碧云天);BCA蛋白定量试剂盒、RevertAid First Strand cDNASynthesis Kit 试剂盒、ECL 化学发光试剂盒(ThermoFisher);SYBR Green qPCR 试剂盒(Roche);Trizol 总RNA抽提试剂盒(上海生工生物);miRNA抽提试剂盒(Omega);Bulge-Loop miRNA qRT-PCR 试剂盒(RiboBio) ,FoxO1 兔多抗、Podocin 兔多抗(Proteintech),Nephrin兔多抗、PINK1兔多抗、Parkin兔多抗(Abclonal),β-actin鼠多抗(Affinity),HRP标记羊抗兔、羊抗鼠(KPL);Protein A/G Agarose、Ago2、IgG鼠单抗(Santa Cruz);双荧光素酶检测试剂盒(Promega)。
1.1.3 仪器 核酸蛋白浓度分析仪(NanoDrop 2000,Thermo Fisher);实时荧光定量PCR 仪(ABI ViiA7,Thermo Fisher);倒置荧光显微镜(Ti-S,Nikon);蛋白电泳仪(Mini-PROTEAN 3,BIO-RAD)、凝胶成像分析系统(Gel Doc XR+,BIO-RAD);发光检测仪(GloMax 20/20,Promega)。
1.2 方法
1.2.1 益气养阴化浊通络方含药血清制备 将50 只Wistar大鼠适应性喂养1周后,随机分为空白血清组14只,益气养阴化浊通络方低、中、高剂量组各12只。
根据临床用药剂量及大鼠与成人体质量剂量折算,大鼠低、中、高剂量分别为成人临床等效剂量的1、2、4倍,按19、38、76 g/kg剂量灌胃,空白组以等量生理盐水灌胃,连续灌胃7 d,各组分别于末次灌药30 min后,2%戊巴比妥钠腹腔注射麻醉后腹主动脉采血,4 ℃下静置2 h,3000 r/min离心10 min,吸取上清液,用0.22 μm滤器过滤除菌,分装后置于-80 ℃冰箱中保存备用。
1.2.2 细胞培养及分组处理 MPC5 细胞置37 ℃、5%CO2培养箱,用含10%胎牛血清的1640培养基培养,当细胞融合达到80%,传代接种于细胞板,采用无血清培养液饥饿24 h,对于Western blotting、qRT-PCR 及MDC染色分析,将细胞分为对照组(5.5 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+空白血清)、模型组(30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+空白血清)、益气养阴化浊通络方低剂量组(YYHT-L,30 mmol/L D-葡萄糖+miR-21a-inhibitor-5p-NC+益气养阴化浊通络方低浓度含药血清)、中剂量组(YYHTM,30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+益气养阴化浊通络方中浓度含药血清)、高剂量组(YYHTH,30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor-NC+益气养阴化浊通络方高浓度含药血清)和miR-21a-5p 抑制剂组(30 mmol/L D-葡萄糖+miR-21a-5p-inhibitor+空白血清),各组先用相应D-葡萄糖处理24 h,然后转染miR-21a-5p-inhibitor-NC 或miR-21a-5p-inhibitor,24 h后再分别加入10%体积的相应血清,48 h后进行下一步处理。
1.2.3 Western blotting 将细胞1×106/孔接种于6孔板,分组及处理同1.2.2。收集细胞,抽提蛋白,BAC法定量蛋白浓度。配置12%聚丙烯酰胺凝胶电泳;转膜1 h将蛋白转印至PVDF 膜;5%牛血清白蛋白封闭1 h;分别加入兔源FoxO1(1∶2500)、PINK1(1∶2000)、Parkin(1∶2000)、Nephrin(1∶1000)、Podocin(1∶1000)及鼠源β-actin(1∶10 000)一抗,室温孵育2 h,TBST 漂洗5次;加入HRP标记的对应兔、鼠二抗(1∶10 000)室温孵育1.5 h,TBST漂洗5次;ECL化学发光试剂显色并用成像分析系统拍照,使用Image J对结果进行灰度分析,蛋白相对表达量=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.2.4 MDC染色 以2×105/孔接种于12孔板,分组及处理同1.2.2。Assay Buffer 洗涤1 次,根据MDC检测试剂盒说明书按照1∶1000 的比例用Assay Buffer 稀释MDC为1X,每孔加入1 mL MDC染色液,37 ℃避光孵育1 h,吸弃染液,用Assay Buffer洗涤2次后再加入1 mL,荧光显微镜下紫外激发光观察绿色荧光,平均荧光强度用Image J进行统计。
1.2.5 qRT-PCR 将细胞2×105/孔接种于12 孔板,分组及处理同1.2.2。收集细胞,分别提取细胞miRNA和总RNA,测定浓度,分别以miRNA或总RNA为模板使用相应的反转录试剂盒进行反转录,按照SYBR Green说明书进行qRT-PCR反应检测目的基因mRNA表达,引物由上海生工生物合成,序列见表1。对于miR-21水平的检测使用广州锐博生物合成的特定引物miR-21、对照U6。参照ABI ViiA7 RT-PCR软件推荐条件进行扩增反应,采用2- ΔΔCt法计算基因相对表达水平,以U6及β-actin作为内参基因。
1.2.6 荧光素酶报告基因实验 通过RNA22 及TargetScan在线工具预测小鼠miR-21a-5p的靶基因,发现小鼠FoxO1 能够与miR-21a-5p 3'UTR 结合,miR-21a-5p 及小鼠FOXO1 3'UTR核心序列见图1,其突变体序列相应位点突变为miR-21a-5p对应位置碱基。随后将FoxO1 3'UTR 野生体(FoxO1-WT)及突变体(FoxO1-MUT)克隆构建到GP-miRGLO载体,并经测序验证。选取测序正确的菌液提取无内毒素质粒,备用。
将1×105 MPC5 细胞接种于24 孔板,将细胞分为miR-21a-5p-mimic-NC组(30 mmol/L D-葡萄糖+miR-21a-5p-mimic-NC+空白血清)、miR-21a-5p-mimic 组(30 mmol/L D-葡萄糖+miR-21a-5p-mimic+空白血清)、YYHT-L组(30 mmol/L D-葡萄糖+miR-21a-5p-mimic+益气养阴化浊通络方低浓度含药血清)、YYHT-M组(30 mmol/L D-葡萄糖+miR-21a-5p-mimic+益气养阴化浊通络方中浓度含药血清)、YYHT-H组(30 mmol/LD-葡萄糖+miR-21a-5p-mimic+益气养阴化浊通络方高浓度含药血清),各组先用30 mmol/L D-葡萄糖处理24 h,然后在转染的同时转染FOXO1-WT 或FOXO1-MUT,24 h后分别加入10%体积的相应血清,48 h后分别加入双荧光素酶报告基因试剂,使用GloMax 20/20型发光检测仪检测萤火虫与海肾荧光,计算其比值,进行统计和分析。
1.2.7 RNA免疫共沉淀(RIP)分析 将2×106 MPC5细胞接种于60 mm培养皿,分组同1.2.6,各组先用30 mmol/LD-葡萄糖处理24 h,然后转染NC或miR-21,24 h 后分别加入10%体积的相应血清,48 h后收集细胞裂解,4℃12 000 r/min离心10 min收集上清,分别加入Protein A/GAgarose和Ago2抗体在4 ℃旋转混匀过夜进行孵育,然后洗脱,4 ℃ 2000 r/min离心5min,收集沉淀,尽可能避免RNA 降解并去除RNA 酶,将收集的沉淀用苯酚、氯仿萃取,异丙醇沉淀,无水乙醇洗脱,DEPC水溶解沉淀,即得到与miRNA结合的mRNA,测定浓度。通过qRT-PCR检测FoxO1的相对丰度。
1.3 统计学分析
使用GraphPad Prism 9.0软件进行数据统计分析。数据以均数±标准差表示,组间比较采用单因素方差分析,以Plt;0.05为差异有统计学意义。
2 结果
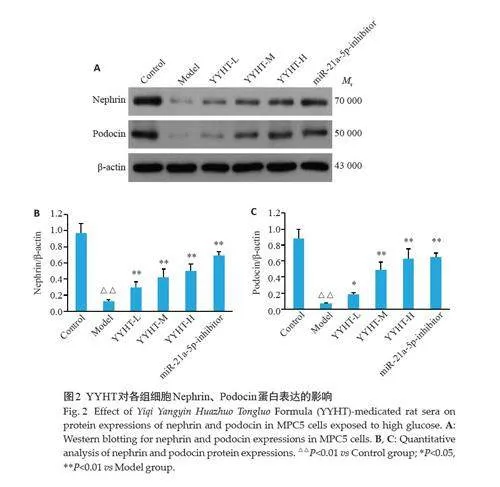
2.1 含药血清对足细胞标志蛋白Nephrin、Podocin表达的影响
与对照组相比,模型组Nephrin、Podocin的蛋白表达水平降低(Plt;0.05);与模型组相比,益气养阴化浊通络方含药血清低、中、高浓度组及miR-21a-5p-inhibitor组Nephrin、Podocin的蛋白表达水平升高(Plt;0.05,图2)。
2.2 含药血清对足细胞自噬的影响
与对照组相比,模型组自噬小体降低(Plt;0.05);与模型组相比,益气养阴化浊通络方含药血清低、中、高浓度组及miR-21a-5p-inhibitor组自噬小体增多(Plt;0.05,图3)。
2.3 含药血清对miR-21 及FoxO1、PINK1、ParkinmRNA表达的影响
与对照组相比,模型组miR-21a-5p 上调表达,FoxO1、PINK1、Parkin 的mRNA 表达水平降低(Plt;0.01);与模型组相比,益气养阴化浊通络方含药血清低、中、高浓度组及miR-21a-5p-inhibitor 组降低miR-21a-5p表达,升高FoxO1、PINK1、Parkin的mRNA表达水平(Plt;0.05,图4)。
2.4 含药血清对FoxO1、PINK1、Parkin蛋白表达的影响
与对照组相比,模型组FoxO1、PINK1、Parkin的蛋白表达水平降低(Plt;0.01);与模型组相比,益气养阴化浊通络方含药血清低、中、高浓度组及miR-21a-5pinhibitor组抑制FoxO1、PINK1、Parkin的蛋白表达水平(Plt;0.05,图5)。
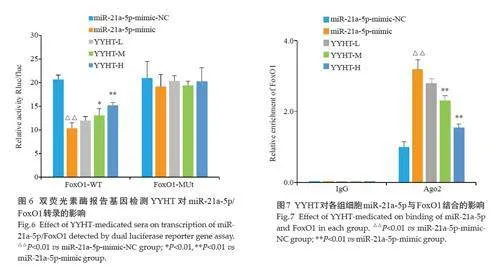
2.5 含药血清对miR-21 /FoxO1转录的影响
与miR-21a-5p-mimic-NC 组相比,miR-21a-5pmimic抑制野生型FoxO1 的荧光素酶活性(Plt;0.01),而对突变型FoxO1 的荧光素酶活性无影响(Pgt;0.05);与miR-21a-5p-mimic 组相比,益气养阴化浊通络方含药血清低、中、高浓度组促进野生型FoxO1 的荧光素酶活性(Plt;0.05),对突变型FoxO1 的荧光素酶活性无影响(Pgt;0.05,图6)。
2.6 含药血清对miR-21a-5p与FoxO1结合的影响
RIP 结果显示,IgG 抗体未能垂钓到FoxO1;与miR-21a-5p-mimic-NC 组相比,miR-21a-5p-mimic 组Ago2 体结合的FoxO1 升高(Plt;0.01);与miR-21a-5pmimic组相比,益气养阴化浊通络方含药血清低、中、高浓度组Ago2 抗体结合的FoxO1 含量依次降低,中、高剂量组差异有统计学意义(Plt;0.01,图7)。
3 讨论
DKD是DM的常见并发症之一,中医学并无DKD之病名,根据其症状特征及临床表现,可归属于中医学消渴病继发的“尿浊”“水肿”“关格”等范畴[18, 19]。本课题组经过十多年的临床研究,认为DKD早期病机特点是气阴两虚、浊邪阻络,故创制益气养阴化浊通络方治疗DKD,临床疗效显著。方中黄芪补肺健脾益气,生地黄养阴生津,故重用为君药。太子参补气健脾、生津润肺,助君药益气养阴;鬼箭羽活血化瘀,薏苡仁健脾利湿,共达去除浊邪之目的,俱为臣药。水蛭行善走窜,内达脏腑,外达经络,活血消癥;六月雪清热利湿,舒筋活络;白芥子善散“皮里膜外”之痰,通络,三药通经达络是属佐使之用。诸药相伍,通补并用、标本兼顾,具有益气养阴、化浊通络之效,共凑扶正祛邪之功。
足细胞是肾小球的主要组成部分,其结构的完整性与肾小球滤过屏障功能相关,Nephrin、podocin 等足细胞裂孔隔膜蛋白能够维持足细胞结构完整性。高糖环境下,Nephrin、podocin 表达下降,足细胞发生损伤,肾滤过膜结构的完整性和屏障功能遭到破坏,导致蛋白尿的产生[20]。因此,足细胞的损伤和缺失是导致肾脏疾病发生发展的主要原因,Nephrin、podocin 成为检测足细胞损伤的重要标志物[21]。本研究发现高糖诱导的足细胞Nephrin、podocin蛋白表达水平下调,益气养阴化浊通络方可增强Nephrin、podocin 蛋白表达,说明益气养阴化浊通络方可减轻足细胞损伤,具有保护足细胞的作用。
线粒体自噬是细胞通过选择性自噬途径特异性识别并清除损伤线粒体的过程,有助于及时清除功能失调的线粒体,避免氧自由基等有害物质释放,对线粒体稳态及细胞活性维持至关重要[22]。足细胞线粒体功能紊乱在DKD发生发展中起重要的作用,PINK1/parkin介导的线粒体自噬是参与调节足细胞线粒体自噬的重要通路[23]。Parkin 是线粒体E3 酯酶底物,正常情况下PINK1游离在细胞质中,当线粒体受到损伤时,PINK1磷酸化并募集Parkin于线粒体外膜上,激活线粒体自噬通路[24]。高糖环境下及DKD模型中,足细胞的PINK1、Parkin 和LC3 表达显著下降,而P62 的表达显著升高,表明足细胞的线粒体自噬受到抑制[25]。本研究发现益气养阴化浊通络方可增强高糖诱导的足细胞自噬小体荧光强度及线粒体自噬相关蛋白PINK1、Parkin 的表达,说明益气养阴化浊通络方可促进PINK1/Parkin 介导的足细胞线粒体自噬。
miRNA是一类参与基因转录后水平调控的内源性非编码单链小分子RNA,参与细胞生存、增殖、分化、凋亡和免疫反应等领域的生理和病理过程[26]。在DKD发生发展中,有许多不同的miRNAs 参与其中,miR-21a-5p在DKD发病机制中起着重要作用,miR-21a-5p表达水平与DKD肾脏病变程度及肾功能损伤呈正相关,其在正常肾脏组织中表达少,而在DKD病人和模型动物的肾组织和血浆中高表达[27-30]。本研究发现益气养阴化浊通络方可剂量依赖性减弱足细胞miR-21a-5p 表达,说明益气养阴化浊通络方可能通过降低miR-21a-5p表达,进而促进miR-21a-5p的某个调控自噬的靶基因表达。
FoxO1是叉头转录因子超家族成员,被认为是多种器官损伤的潜在抑制因子,涉及一系列细胞内信号转导,在细胞核中参与DNA修复、细胞周期、凋亡和自噬等相关因子的表达调控,越来越多的证据表明FoxO1介导的自噬参与DKD的发病机制[31, 32]。研究发现,DKD大鼠和高糖刺激的足细胞FoxO1 低表达,自噬受到抑制,黄芪甲苷治疗增强了高糖诱导的足细胞中标志蛋白的表达,通过激活Sirt1/FoxO1途径增强足细胞自噬[33]。高糖环境下FoxO1被磷酸化而丧失转录活性,线粒体自噬受到抑制,当足细胞中过表达FoxO1时,FoxO1能结合PINK1 基因的启动子并激活PINK1 转录,增加PINK1 表达,从而激活PINK1/Parkin 介导的足细胞线粒体自噬[9]。本研究发现高糖环境下,足细胞低表达FoxO1,益气养阴化浊通络方处理后可增强高糖诱导的足细胞FoxO1表达,说明益气养阴化浊通络方可能通过上调FoxO1促进线粒体自噬减轻足细胞损伤。在高糖培养的足细胞中,FoxO1具有正向调控自噬的作用,作为miR-21a-5p的靶蛋白,其表达可以被miR-21a-5p抑制,从而阻断自噬激活,同时阿曲生坦通过调节miR-21a-5p/FOXO1 轴减轻DKD小鼠的肾损伤,减轻高糖介导的足细胞自噬抑制[11]。本研究荧光素酶报告基因实验发现miR-21a-5p 显著抑制FoxO1-WT活性,益气养阴化浊通络方可减弱miR-21a-5p对FoxO1-WT的抑制活性,而对FoxO1-MUT 活性无明显作用,说明FoxO1 是miR-21a-5p 的靶基因,miR-21a-5p 可抑制FoxO1 的转录,同时益气养阴化浊通络方可抑制miR-21a-5p降解FoxO1,从而促进FoxO1转录。同时RIP实验发现益气养阴化浊通络方可抑制miR-21与FoxO1的结合,说明益气养阴化浊通络方可能通过下调miR-21a-5p 抑制FoxO1 的降解,进而改善高糖诱导的足细胞线粒体自噬紊乱。
综上所述,益气养阴化浊通络方能够下调miR-21a-5p 表达,增强自噬荧光,上调FoxO1 及PINK1、Parkin 表达,减轻足细胞损伤,表明益气养阴化浊通络方减轻DKD足细胞损伤的作用机制可能与靶向miR-21a-5p/FoxO1/PINK1 介导的线粒体自噬相关,本研究可为中医药防治DKD提供一定的科学依据。然而,中药复方成分复杂,参与疾病调节作用机制通路众多,且miR-21a-5p 调节靶基因繁多,益气养阴化浊通络方是否通过其他途径和靶基因参与自噬保护足细胞损伤在DKD治疗中发挥作用,仍需进一步深入研究。
参考文献:
[1] Wang N, Zhang C. Recent advances in the management of diabetic
kidney disease: slowing progression[J]. Int J Mol Sci, 2024, 25(6):
3086.
[2] Gupta S, Dominguez M, Golestaneh L. Diabetic kidney disease: an
update[J]. Med Clin North Am, 2023, 107(4): 689-705.
[3] DeFronzo RA, Reeves WB, Awad AS. Pathophysiology of diabetic
kidney disease: impact of SGLT2 inhibitors[J]. Nat Rev Nephrol,
2021, 17(5):319-34.
[4] Sugahara M, Pak WLW, Tanaka T, et al. Update on diagnosis,
pathophysiology, and management of diabetic kidney disease[J].
Nephrology, 2021, 26(6): 491-500.
[5] Hu SW, Hang X, Wei Y, et al. Crosstalk among podocytes,
glomerular endothelial cells and mesangial cells in diabetic kidney
disease: an updated review[J]. Cell Commun Signal, 2024, 22
(1): 136.
[6] Mohandes S, Doke T, Hu HL, et al. Molecular pathways that drive
diabetic kidney disease[J]. J Clin Invest, 2023, 133(4): e165654.
[7] Liu SM, Yuan YG, Xue Y, et al. Podocyte injury in diabetic kidney
disease: a focus on mitochondrial dysfunction[J]. Front Cell Dev
Biol, 2022, 10: 832887.
[8] Wu QR, Yan RZ, Yang HW, et al. Qing-Re-Xiao-Zheng-Yi-Qi
formula relieves kidney damage and activates mitophagy in diabetic
kidney disease[J]. Front Pharmacol, 2022, 13: 992597.
[9] Li W, Du MM, Wang QZ, et al. FoxO1 promotes mitophagy in the
podocytes of diabetic male mice via the PINK1/parkin pathway[J].
Endocrinology, 2017, 158(7): 2155-67.
[10]Mahtal N, Lenoir O, Tinel C, et al. MicroRNAs in kidney injury and
disease[J]. Nat Rev Nephrol, 2022, 18(10): 643-62.
[11]Wang J, Shen LY, Hong H, et al. Atrasentan alleviates high glucoseinduced
podocyte injury by the microRNA-21/forkhead box O1 axis
[J]. Eur J Pharmacol, 2019, 852: 142-50.
[12]Ma LL, Li J, Zhang XT, et al. Chinese botanical drugs targeting
mitophagy to alleviate diabetic kidney disease, a comprehensive
review[J]. Front Pharmacol, 2024, 15: 1360179.
[13]Li XD, Zhang Y, Xing XD, et al. Podocyte injury of diabetic
nephropathy: novel mechanism discovery and therapeutic prospects
[J]. Biomedecine Pharmacother, 2023, 168: 115670.
[14]郭东义, 张 鹏, 卞 华, 等. 益气养阴化浊通络方对早期糖尿病肾病患
者NF‑κB、MCP-1及IL-6的影响[J]. 河南中医, 2016, 36(8): 1386-8.
[15]张 鹏, 吕 芹, 郭东义, 等. 益气养阴化浊通络方对早期糖尿病肾脏
疾病患者内皮细胞及血液流变学的影响[J]. 科学技术与工程,
2016, 16(17): 119-22.
[16]韩 立, 吕 芹, 郭东义, 等. 益气养阴化浊通络方对早期糖尿病肾脏
疾病患者氧化应激的影响[J]. 科学技术与工程, 2016, 16(14): 23-6.
[17]郭克磊, 李颖利, 韩 立, 等. 益气养阴化浊通络方对高糖诱导小鼠肾
足细胞自噬ATG5、Beclin-1 及BNIP3 表达的影响[J]. 中国医院药
学杂志, 2023, 43(16): 1808-13.
[18]朱政洁, 马雷雷, 何立群. 从益气养阴、补肾活血论治糖尿病肾病
[J]. 中华中医药杂志, 2022, 37(12):7170-3.
[19]中华中医药学会, 北京中医药大学东直门医院, 北京中医药大学. 糖
尿病肾脏疾病中西医结合诊疗指南[J]. 北京中医药大学学报,
2024, 47(4): 580-92.
[20]Liu XQ, Jiang L, Li YY, et al. Wogonin protects glomerular
podocytes by targeting Bcl-2-mediated autophagy and apoptosis in
diabetic kidney disease[J]. Acta Pharmacol Sin, 2022, 43(1):
96-110.
[21]Gong L, Wang R, Wang XY, et al. Research progress of natural
active compounds on improving podocyte function to reduce
proteinuria in diabetic kidney disease[J]. Ren Fail, 2023, 45(2):
2290930.
[22]Wang SL, Long HJ, Hou LJ, et al. The mitophagy pathway and its
implications in human diseases[J]. Signal Transduct Target Ther,
2023, 8(1): 304.
[23]Zhang XF, Feng J, Li X, et al. Mitophagy in diabetic kidney disease
[J]. Front Cell Dev Biol, 2021, 9: 778011.
[24]Han R, Liu YT, Li SH, et al. PINK1-PRKN mediated mitophagy:
differences between in vitro and in vivo models[J]. Autophagy,
2023, 19(5): 1396-405.
[25]Han XD, Wang J, Li RL, et al. Placental mesenchymal stem cells
alleviate podocyte injury in diabetic kidney disease by modulating
mitophagy via the SIRT1-PGC-1alpha-TFAM pathway[J]. Int J
Mol Sci, 2023, 24(5): 4696.
[26]Dhas Y, Arshad N, Biswas N, et al. MicroRNA-21 silencing in
diabetic nephropathy: insights on therapeutic strategies[J].
Biomedicines, 2023, 11(9): 2583.
[27]Szostak J, Goramp;#x; cy A, Durys D, et al. The role of microRNA in
the pathogenesis of diabetic nephropathy[J]. Int J Mol Sci, 2023, 24
(7): 6214.
[28]Liu SJ, Wu WZ, Liao J, et al. MicroRNA-21: a critical pathogenic
factor of diabetic nephropathy[J]. Front Endocrinol, 2022, 13:
895010.
[29]Assmann TS, Recamonde-Mendoza M, Costa AR, et al. Circulating
miRNAs in diabetic kidney disease: case-control study and in silico
analyses[J]. Acta Diabetol, 2019, 56(1): 55-65.
[30]向珈谊, 张会芳, 梁露群, 等. miR-21通过下调PPAR-α参与脂质代
谢紊乱并促进糖尿病大鼠肾组织及肾小管上皮细胞纤维化病变
[J]. 中国病理生理杂志, 2021, 37(10): 1858-67.
[31]Orea-Soufi A, Paik J, Bragança J, et al. FOXO transcription factors
as therapeutic targets in human diseases[J]. Trends Pharmacol Sci,
2022, 43(12): 1070-84.
[32]Li XD, Wan TT, Li YB. Role of FoxO1 in regulating autophagy in
type 2 diabetes mellitus (Review) [J]. Exp Ther Med, 2021, 22
(1): 707.
[33]Xu YM, Xu C, Huang J, et al. Astragalus polysaccharide attenuates
diabetic nephropathy by reducing apoptosis and enhancing
autophagy through activation of Sirt1/FoxO1 pathway[J]. Int Urol
Nephrol, 2024, 56(9): 3067-78.
(编辑:吴锦雅)