马铃薯StSUT2基因启动子克隆及表达分析
摘" " 要:植物蔗糖转运蛋白(sucrose transporter,SUT)主要介导蔗糖质外体运输,在植物生长发育过程中发挥重要作用。为探讨马铃薯蔗糖转运蛋白基因StSUT2的表达模式,通过TOPO定向克隆了StSUT2基因上游1700 bp启动子序列,对其进行生物信息学分析;并利用荧光定量PCR技术检测了StSUT2基因在不同组织器官、不同光照时间下的表达特性。结果表明,马铃薯StSUT2启动子区域内存在多个光响应元件以及脱落酸等激素和胁迫响应元件;StSUT2基因于光照 4 h后在花和老叶中表达量较高;光照16 h后在花中表达量最高;此外,StSUT2在雄蕊和雌蕊中的表达量显著高于全花。综上,StSUT2在花器官尤其在花蕊组织的发育中发挥重要作用。研究结果可为深入研究马铃薯StSUT2的生物学功能提供参考。
关键词:马铃薯;StSUT2启动子;克隆;表达模式
中图分类号:S532 文献标志码:A 文章编号:1673-2871(2025)01-025-06
Promoter cloning and expression analysis of sucrose transporter gene StSUT2 in potato
GONG Huiling, YANG Yaqian, LIANG Jinyong, TIAN Ze, FENG Zaiping, BAO Jingting
(School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, Gansu, China)
Abstract: Plant sucrose transporter(SUT)mainly mediates the transport of sucrose extracellular vesicles and plays an important role in plant growth and development. To investigate the expression characteristics of sucrose transporter gene StSUT2, cloned the upstream 1700 bp promoter sequence of the StSUT2 gene using TOPO and performed bioinformatics analysis on it; and the expression pattern of StSUT2 gene in different organs and tissues after different light time was analyzed by qRT-PCR technology. The results showed that there are several photo-responsive elements, and other response elements such as abscisic acid, salicylic acid, auxin, anaerobic induction, defense and stress response in StSUT2 promoter region. StSUT2 has the highest expression level in flowers and old leaves after 4 h lighting, and in flowers after 16 h lighting, while StSUT2 has a certain expression level in young leave, mature leave, stem, root and stolon. Except for the old leave, StSUT2 expression level in various organs and tissues is not significantly affected by the light time. Furthermore, StSUT2 expression level was significantly higher in stamen and pistil than in whole flower, which suggests that StSUT2 plays an important role in the development of flower organs, especially in stamen tissue. These results provide a reference for intensive investigation of the biological function of StSUT2.
Key words: Potato; StSUT2 promoter; Cloning; Expression pattern
蔗糖是高等植物光合作用的产物,为植物的生长发育提供了主要的碳源和能源。在蔗糖的质外体转运途径中,植物蔗糖转运蛋白(sucrose transporter/sucrose cotransporter, SUT/SUC)作为一类具有蔗糖转运活性的载体介导蔗糖的装载、运输和卸载[1-3]。植物SUTs属于跨膜结合蛋白,属于目前已知的最大膜转运蛋白超家族之一的易化扩散载体超家族(major facilitator superfamily, MFS)[4]。基于高等植物蔗糖转运蛋白的氨基酸序列同源性及蔗糖亲和力的分析,Kühn和Grof[5]将SUT蛋白分为SUT1、SUT2、SUT3、SUT4和SUT5五个亚族,其中SUT3和SUT5为单子叶植物所特有。辣椒[6]和茶树[7]中分别鉴定出4种和7种SUTs基因,且具有组织特异性。Frost等[8]研究表明,干扰PtaSUT4基因的表达,影响源库蔗糖分配致使杨树叶片萎蔫、发育迟缓。植物SUTs不仅在植株生长发育、花器官发育[9-10]和结果率[11]、籽粒质量[12]等方面发挥重要作用,且参与了植物对非生物和生物胁迫的响应和调控。在低温胁迫下,玉米的ZmSUT4基因在不同组织中表达量相较于未处理时,至少上升2倍,揭示了ZmSUT4响应玉米低温耐受性[13];李宁等[6]发现CaSUTs基因在辣椒响应低温胁迫时被诱导。干旱胁迫下大豆幼苗叶片和根系的蔗糖转运蛋白基因GmSUT2表达水平上调[14]。盐胁迫下马铃薯根、茎和叶中的蔗糖转运蛋白基因StSUT2也被诱导表达,且StSUT2在烟草中超表达后增强了耐盐性[15];在拟南芥中过表达GmSUT4.2,有助于缓解盐胁迫造成的损伤[16];在大豆GmSUT4.2基因和西瓜ClSUT基因的启动子中发现激素和逆境响应等作用元件,过表达后大豆和西瓜对盐胁迫的耐受性增强[16-17];过量表达小麦蔗糖转运蛋白基因TaSUT1A增强了耐旱性[18]。因而,推测SUTs可能参与干旱胁迫、盐胁迫和低温胁迫的响应和调控。此外,SUTs在植物与微生物的互作中也发挥了重要作用[19],水稻蔗糖转运蛋白基因OsSUT2被敲除后,突变体植株对稻瘟病和白叶枯病的抗病性减弱[20];大豆蔗糖转运蛋白基因GmSUT1过表达后,根瘤数增加,而GmSUT1干扰表达后蔗糖的运输受损,表明GmSUT1在蔗糖转运到根瘤及共生固氮中发挥作用[21];番茄SlSUT2能够影响根际丛枝菌根真菌的形成[22-24]。
目前,在马铃薯(Solanum tuberosum L.)中共鉴定到3种蔗糖转运蛋白基因,分别为StSUT1、StSUT2和StSUT4。下调StSUT1的表达会阻碍蔗糖在质外体中的长距离运输,导致植株生长减缓,叶片中可溶性糖和淀粉大量积累,并影响块茎早期形成阶段的鲜质量(数量不变但形态缩小),表明StSUT1对马铃薯的蔗糖吸收和块茎形成具有重要作用[25]。通过RNA干扰技术抑制马铃薯StSUT4的表达,发现StSUT4影响马铃薯茎的伸长、避荫反应、开花时间、结薯以及乙烯的产生等[26-27]。谢海娟等[15]及Gong等[29]克隆了马铃薯StSUT2基因,发现该基因的CDS长度为1818 bp,编码605个氨基酸。Gong等[29]通过RNA干扰技术抑制马铃薯StSUT2的表达发现,StSUT2参与调控马铃薯的生长、开花时间和结薯。笔者采用PCR技术克隆了马铃薯StSUT2基因启动子序列,并分析了StSUT2基因在不同器官和不同光照时间下的表达模式,以期为深入研究马铃薯StSUT2的生理功能提供参考。
1 材料与方法
1.1 材料
试验于2019年3-10月在兰州理工大学生命科学与工程学院实验平台进行。试验材料为马铃薯品种Atlantic组培苗,用于提取马铃薯基因组DNA;马铃薯品种Shepody盆栽苗,用于提取不同器官组织RNA。材料均由兰州理工大学生命科学与工程学院植物逆境生理生态实验室保存。随机取样且至少3盆混样,每个时间点每个器官组织样品设置3个重复。
E.coli DH 5α感受态细胞由兰州理工大学植物逆境生理生态实验团队保存。PrimeSTAR HS(Premix)、DL5000 DNA maker、PrimeScript™ RT Master和MixTB GreenTM Premix Ex TaqTM II试剂盒购自TaKaRa公司;Ezup柱式植物基因组DNA提取试剂盒、SanPrep柱式DNA胶回收试剂盒、RNase A(10 mg·mL-1)、Trizol总RNA提取试剂盒(UNIQ-10柱式)和氯仿购自生工生物工程(上海)股份有限公司,ENTR™/D-TOPO™克隆试剂盒购自Invitrogen公司。
1.2 PCR引物设计
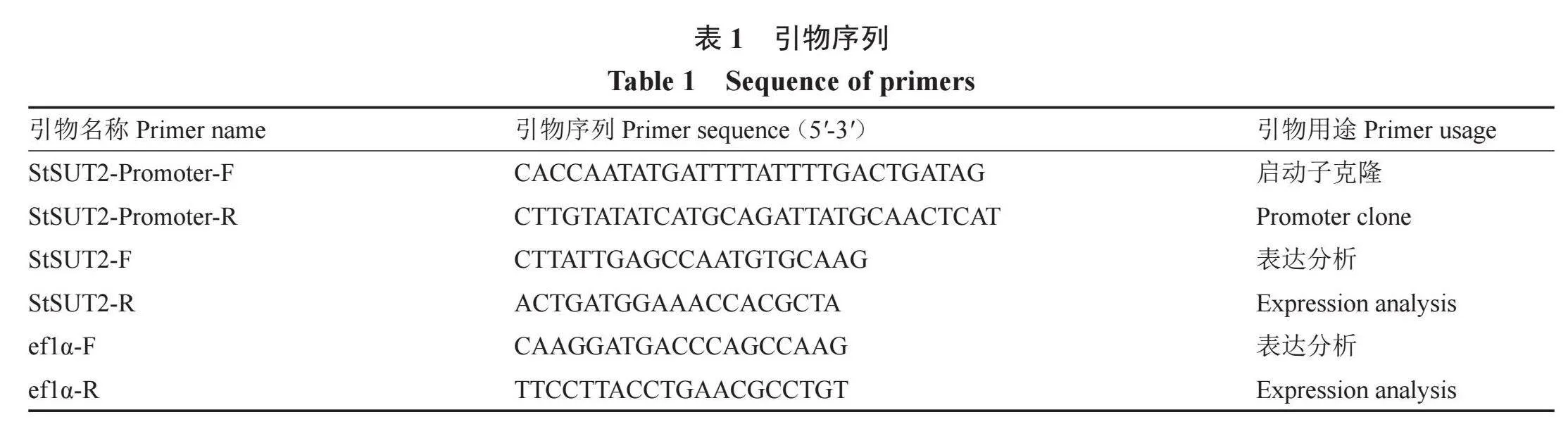
从http://spuddb.uga.edu/数据库中获得马铃薯StSUT2基因上游约2000 bp的序列,以及StSUT2 cDNA序列,使用软件oligo7设计引物(表1)。引物由生工生物工程(上海)股份有限公司合成。
1.3 马铃薯DNA的提取和StSUT2基因启动子片段的克隆
以马铃薯组培苗叶片和根组织为材料,液氮速冻后研磨成粉,依据Ezup DNA抽提试剂盒的使用标准进行DNA规范提取。
以上述提取的DNA为模板,PCR扩增StSUT2基因启动子片段。PCR反应体系:PrimerSTAR HS (Premix) 25 μL,StSUT2-Promoter-F/R各2 μL,DNA 1 μL,ddH2O 20 μL。PCR程序:94 ℃预变性5 min;94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸2 min,设置35个循环;72 ℃延伸10 min。1.2%琼脂糖凝胶电泳观察PCR产物,使用SanPrep柱式DNA胶回收试剂盒回收目的片段。根据定向克隆的方法将目的片段与pENTR-TOPO载体在PCR管中混合冰浴10 min进行连接,连接结束后转化E.coli DH 5α感受态细胞进行抗生素筛选培养。通过菌落PCR筛选出阳性质粒菌株进行测序、比对。
1.4 启动子序列分析
使用在线工具PlantCARE(http://binioformatics.psb.ugent.be/webtools/Plantcare/html/)分析克隆的StSUT2基因启动子片段及其顺式作用元件等信息。
1.5 StSUT2的表达特性分析
按照田泽[28]和梁金永[30]的方法,马铃薯品种Shepody盆栽苗待盛花期时,分别在光照4 h 和16 h时,采集功能叶、幼叶、老叶、茎、花、根、匍匐茎等组织器官以及光照4 h的雄蕊、雌蕊、花萼和花冠,立即液氮速冻,保存于-80 ℃冰箱以备提取总RNA。用UNIQ-10柱式Trizol总RNA抽提试剂盒提取RNA,并反转录合成cDNA;使用TaKaRa TB GreenTM Premix Ex TaqTM Ⅱ试剂盒进行qRT-PCR反应。实时荧光定量PCR仪来自苏州雅睿生物技术有限公司。反应体系为:TB Green Premix Ex Taq II 5 μL,引物各0.4 μL(表1),cDNA模板1.0 μL,RNase-free H2O 3.2 μL。反应程序:95 ℃ 30 sec;95 ℃ 5 sec,60 ℃ 32 sec,循环40次。用2-ΔΔCt法分析基因相对表达量。利用IBM SPSS Statistis 22(版本号22.0.0.0.202)软件对数据进行单因素方差分析,并采用Duncan检验法对显著性差异(plt;0.05)进行多重比较。
2 结果与分析
2.1 马铃薯StSUT2基因启动子片段的克隆
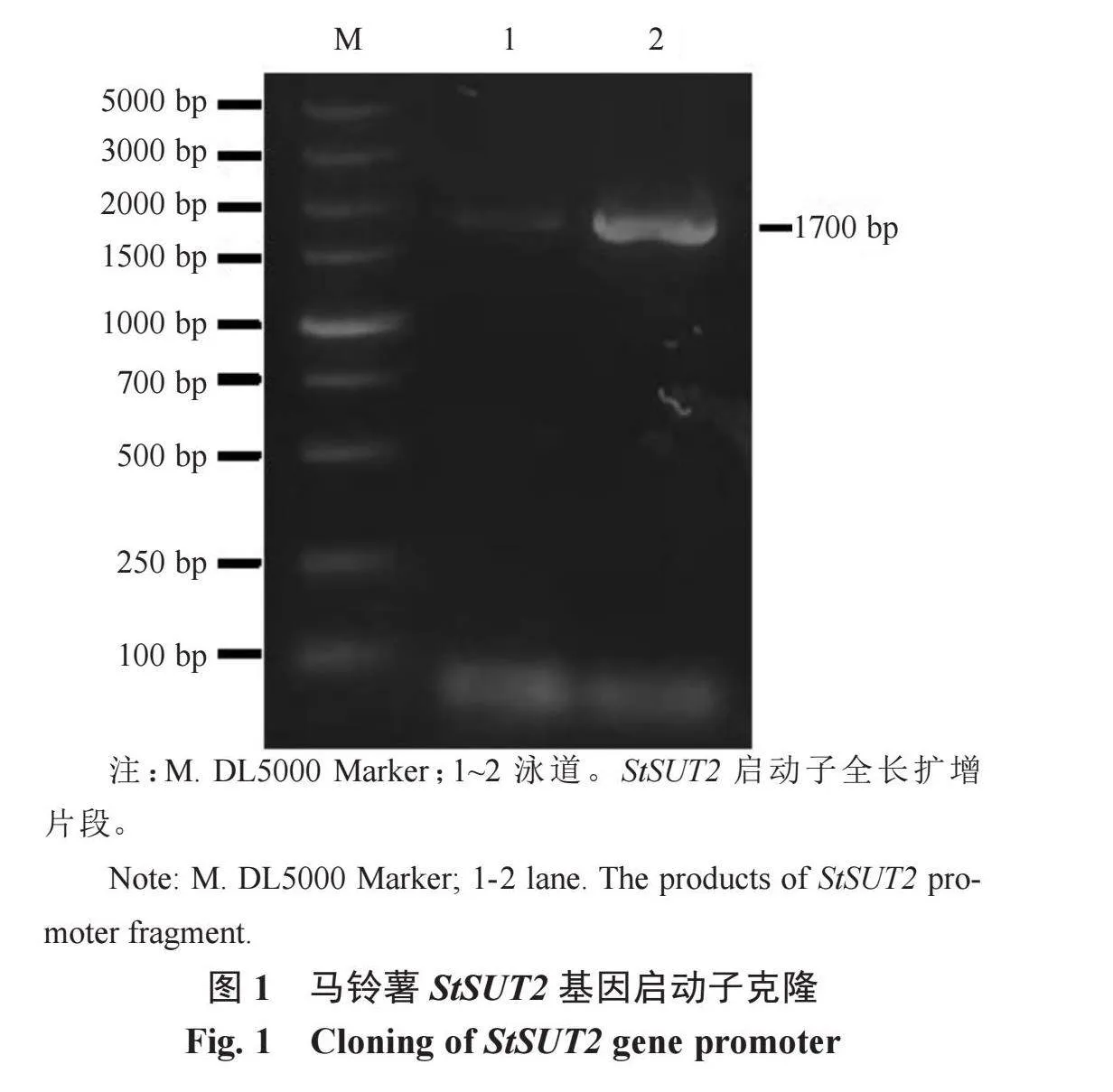
对马铃薯品种Atlantic的基因组DNA进行PCR扩增后,1.2%的琼脂糖凝胶电泳检测产物结果显示,在1500~2000 bp范围内观察到清晰的条带(图1),与预期的理论片段大小一致。测序结果表明,StSUT2基因启动子长度为1700 bp,与马铃薯基因组数据库检索获得的序列基本一致,序列同源性为99.2%,证明成功克隆了StSUT2基因启动子序列。
2.2 马铃薯StSUT2基因启动子的序列分析
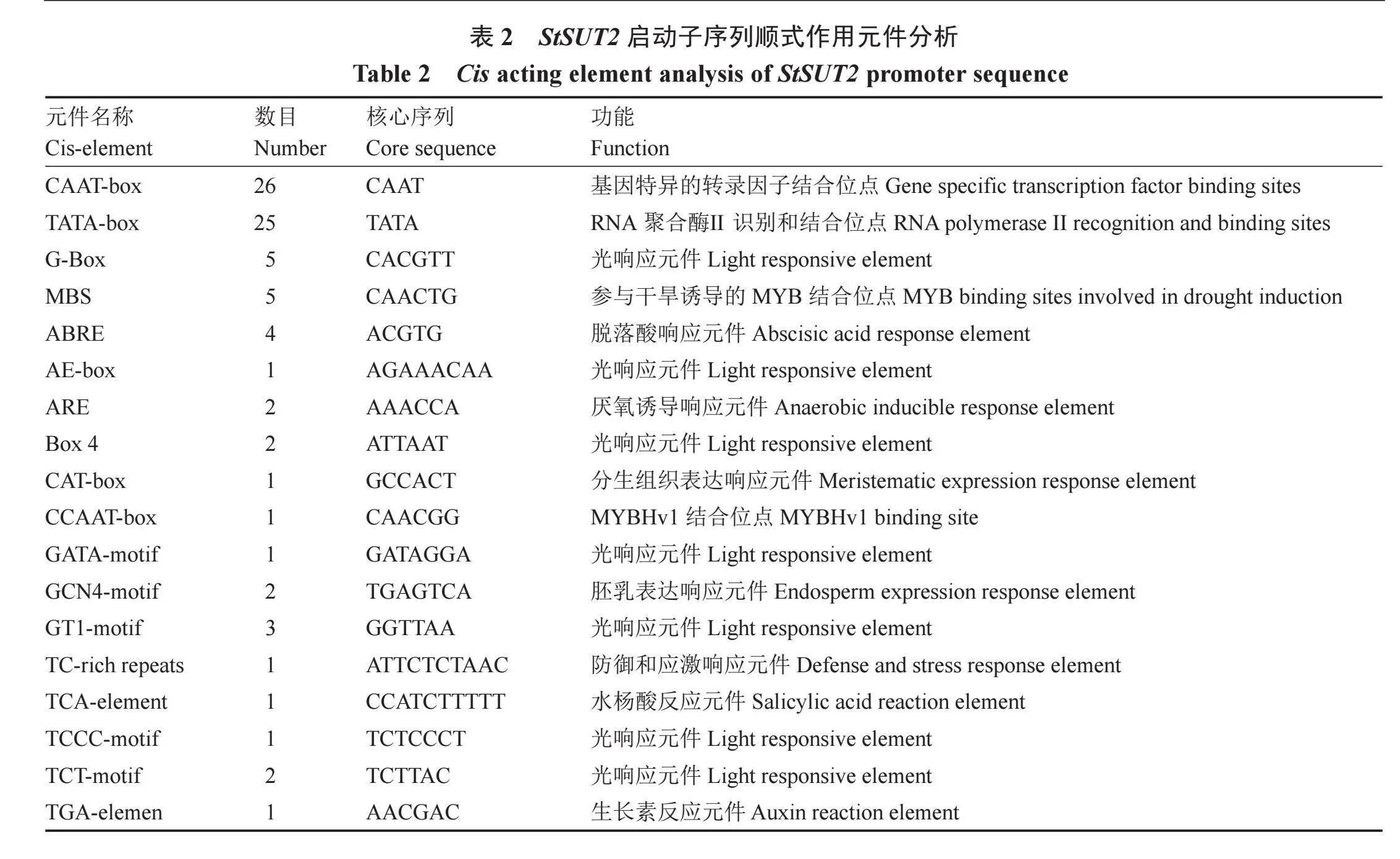
使用PlantCARE在线工具分析克隆的StSUT2启动子序列,结果显示,该启动子区域除了含有TATA-box和CAAT-box等定位转录起始和调控基因转录效率等启动子特征序列元件外,还含有较多光响应元件,如AE-box、Box4、G-Box、GATA-motif、GT1-motif、TCT-motif和TCCC-motif等,此外,还含有脱落酸、水杨酸、生长素、厌氧诱导、防御和应激反应等激素和胁迫响应元件(表2)。
2.3 马铃薯StSUT2基因在不同组织器官和不同光照时间下的表达分析
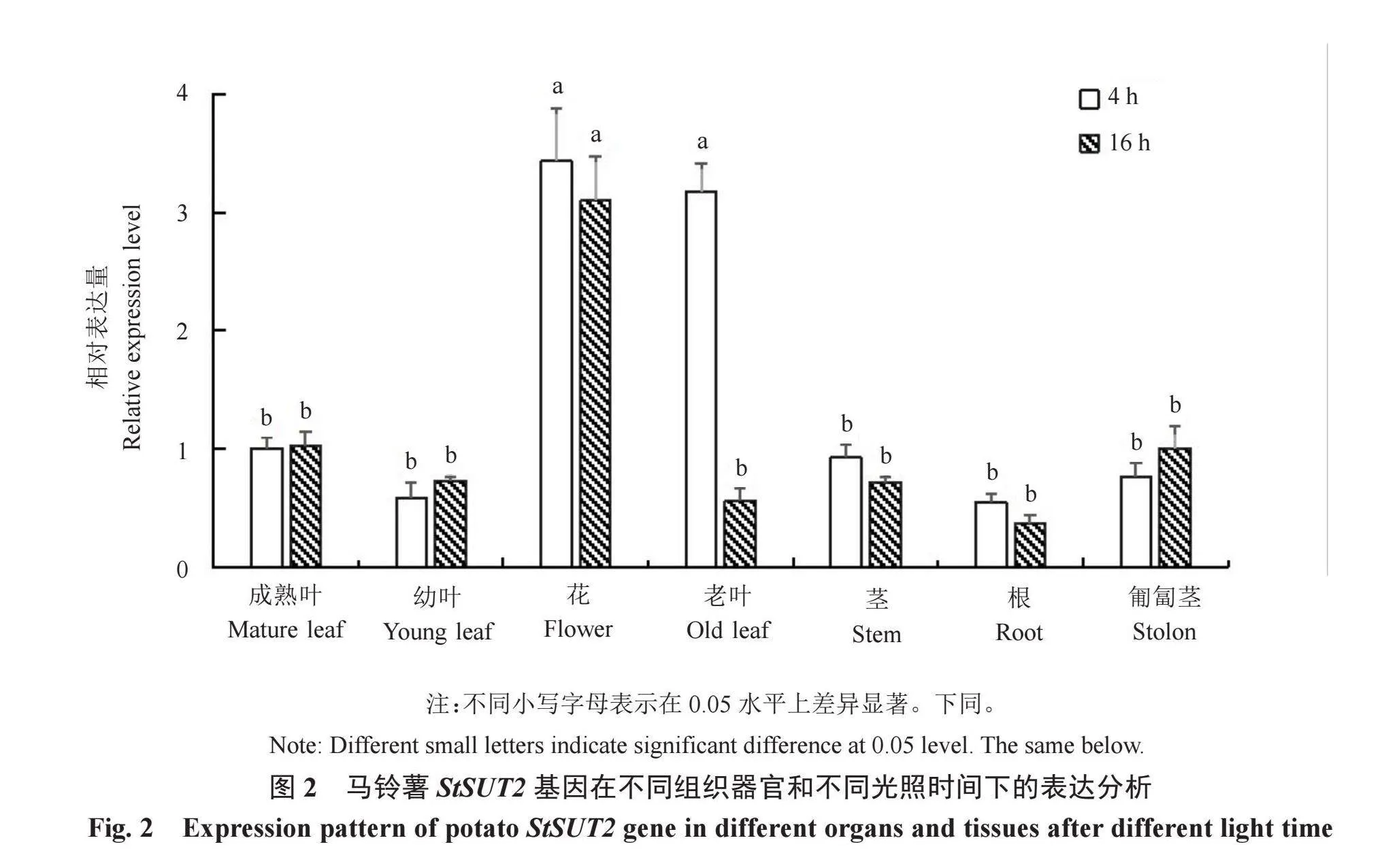
为了探究马铃薯StSUT2基因的表达特性,通过荧光定量PCR方法检测了马铃薯植株在光照4 h和16 h后,StSUT2基因在幼叶、成熟叶、老叶、花、茎、根、匍匐茎等组织器官的相对表达量。结果如图2所示,在光照4 h后,StSUT2在老叶和花中的表达量较高,分别是成熟叶片中表达量的3.2倍和3.4倍,差异显著;光照16 h后,StSUT2在花中表达量仍最高,是成熟叶片中表达量的3.1倍,差异显著;在光照4和16 h后,StSUT2在成熟叶、幼叶、茎、根和匍匐茎等组织器官中均有表达,但差异不显著;除老叶外,StSUT2在各器官组织中的表达量受光照时间的影响差异不显著。
2.4 马铃薯StSUT2基因在花器官不同组织中的表达分析
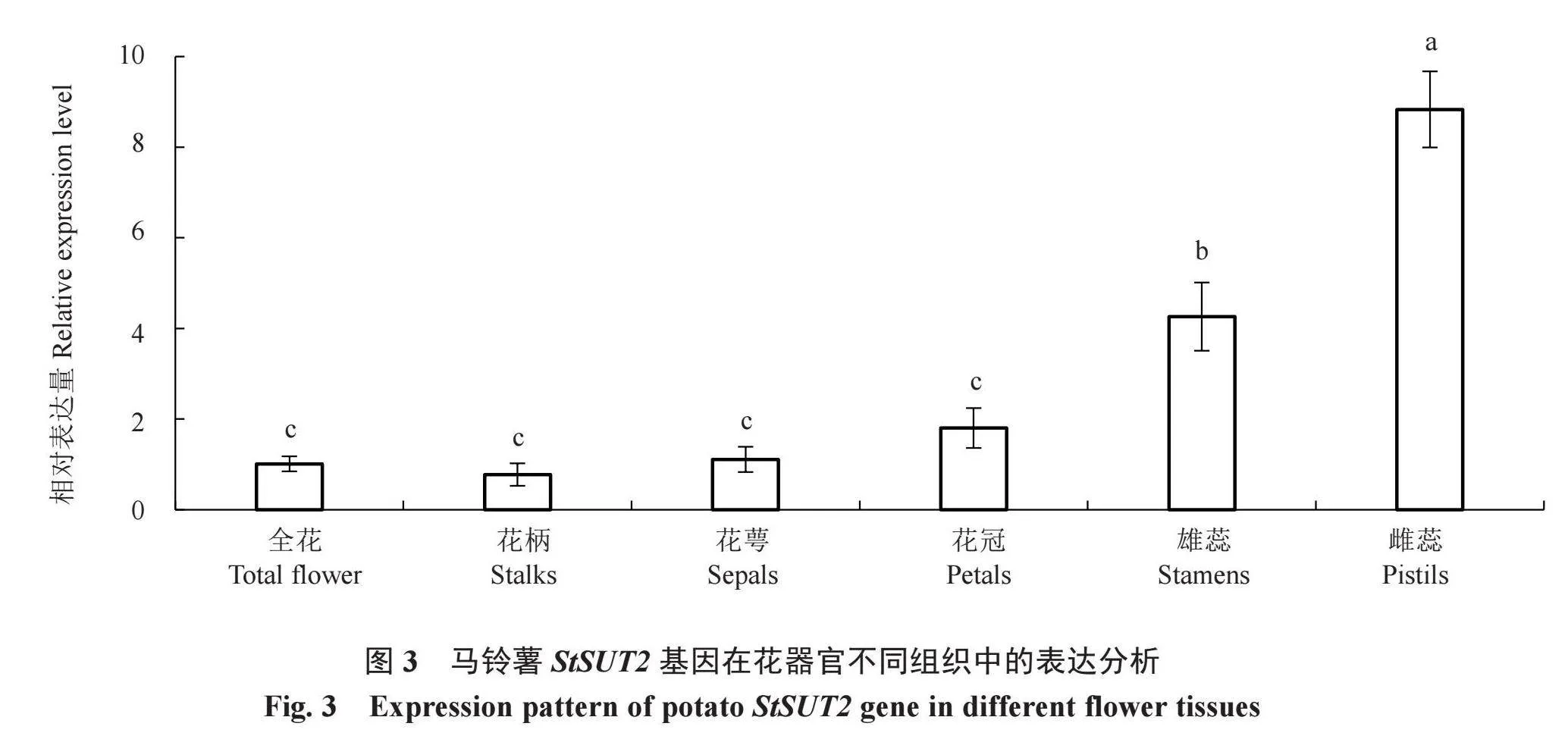
为了分析马铃薯StSUT2在花器官不同组织中的表达特性,检测了全花、花柄、花萼、花冠、雄蕊和雌蕊中StSUT2的表达量。结果如图3所示,雄蕊和雌蕊中StSUT2基因表达量显著高于全花,其中雄蕊和雌蕊分别为全花的4.2倍和9.1倍,而花柄、花萼及花冠的表达量与全花无显著差异。以上结果表明,StSUT2基因主要在马铃薯花蕊中表达。
3 讨论与结论
植物蔗糖转运蛋白在蔗糖的转载、运输和卸载等过程中起着不可替代的作用。研究发现,SUTs在植物响应生物胁迫和非生物胁迫中也扮演着重要的角色[1]。笔者成功克隆了马铃薯StSUT2基因的启动子序列,发现该启动子含有脱落酸、水杨酸、生长素、厌氧诱导、防御和应激反应等响应元件,表明马铃薯StSUT2基因在应答生物胁迫和非生物胁迫中可能发挥一定的生理功能。Chincinska等[27]研究表明,马铃薯蔗糖转运蛋白基因在叶片中的表达受光周期的影响而略有波动,其中,StSUT1和StSUT4在光照阶段的中期表达量较高,而StSUT2在光照的初期表达量较高。本研究表明,马铃薯StSUT2基因的启动子序列中含有较多光响应的顺式作用元件,推测StSUT2基因可感受光信号。但笔者在本研究中发现,光照16 h与4 h相比,除了老叶中的StSUT2表达量显著下降外,其他组织中StSUT2的表达量均无显著差异,即未受光照时间的影响,这可能是因为光照4 h后,StSUT2已被光诱导表达,而持续光照并不会继续诱导StSUT2的表达。今后需设计黑暗处理或在光周期的黑暗阶段取样,来检测和验证马铃薯StSUT2是否受光信号的诱导。
双子叶植物包含SUT1、SUT2和SUT4三个蔗糖转运蛋白亚族,不同SUT亚族对蔗糖的亲和力和转运能力各异[5]。SUT2最初被认为是质膜上的蔗糖信号感应器[31],但这一观点缺乏有力证据,更多研究倾向于认为SUT2只是一个低亲和力的蔗糖转运蛋白[5]。Hackel等[32]发现,番茄SlSUT2在韧皮部筛管、花粉和花粉管中有表达,且在茎、幼叶和果实中少量表达。此外,SlSUT2在花药中的表达水平高于花冠、萼片和子房;与野生型相比,SlSUT2表达下调的转基因番茄表现出较低的花粉萌发率和较慢的花粉管生长速度,因此SlSUT2在蔗糖转运过程中对花粉管的生长和授粉至关重要。此外,玉米OsSUT1参与调控花粉的发育[33]。本研究表明,马铃薯StSUT2在花中表达量较高,尤其在雄蕊和雌蕊中表达量最高,而在幼叶、成熟叶、茎、根和匍匐茎、全花、花柄、花萼、花冠等组织器官中也有一定的表达量,这一研究结果与番茄的SlSUT2基因相似。由此表明,StSUT2基因在马铃薯花蕊发育中可能发挥重要的作用。
综上所述,笔者成功克隆了马铃薯StSUT2基因启动子序列,长度为1700 bp,含有多种光响应、激素和逆境响应顺式作用元件。相较于幼叶、成熟叶、茎、根、匍匐茎和全花、花柄、花萼、花冠等组织器官,StSUT2基因在马铃薯花蕊中表达量较高。
参考文献
[1] 涂文睿,蔡昱萌,颜婧,等.植物蔗糖转运蛋白及其生理功能的研究进展[J].生物技术通报,2017,33(4):1-7.
[2] 巩慧玲,田泽,徐进,等.茄科植物蔗糖转运蛋白研究进展[J].植物生理学报,2017,53(10):1819-1823.
[3] 王筠竹,吕萍,陈跃,等.植物蔗糖转运蛋白SUTs的生理功能及其调控研究进展[J].分子植物育种,2020,18(17):5708-5715.
[4] JULIUS B T,LEACH K A,TRAN T M,et al.Sugar transporters in plants:New insights and discoveries[J],Plant and Cell Physiology,2017,58(9):1442-1460.
[5] KÜHN C,GROF C P L.Sucrose transporters of higher plants[J].Current Opinion in Plant Biology,2010,13(3):288-298.
[6] 李宁,尹延旭,王畅,等.辣椒蔗糖转运蛋白基因生物信息学及表达模式分析[J].辣椒杂志,2024,22(2):13-21.
[7] 罗微,张佳琪,杨妮,等.茶树蔗糖转运蛋白(SUTs)基因家族鉴定及组织表达分析[J].茶叶科学,2024,44(4):585-597.
[8] FROST C J,NYAMDARI B,TSAI C J,et al.The tonoplast-localized sucrose transporter in Populus (PtaSUT4) regulates whole-plant water relations,responses to water stress,and photosynthesis[J].PLoS One,2012,7(8):e44467.
[9] 黄东梅,肖海涛,张志国,等.萱草糖转运蛋白HfSWEET2a的克隆及低温胁迫下的表达分析[J].应用技术学报,2020,20(4):367-374.
[10] LI Y H,GUO T,CUI Y,et al.Cloning and expression of the sucrose transporter gene PsSUT1 from tree peony leaf[J].Genetics and Molecular Research,2015,14(4):12406-12415.
[11] 李国辉,崔克辉.水稻蔗糖转运及其与产量形成的关系[J].植物生理学报,2014,50(6):735-740.
[12] 刘怡然,吴正丹,吴维泰,等.甘薯蔗糖转运蛋白的功能分析[J].生物工程学报,2023,39(7):2772-2793.
[13] 弓雪,姜敏,齐欣,等.玉米蔗糖转运蛋白基因ZmSUT4克隆及其低温胁迫下的表达模式[J].南方农业学报,2019,50(6):1165-1172.
[14] DU Y L,ZHAO Q,CHEN L R,et al.Effect of drought stress on sugar metabolism in leaves and roots of soybean seedlings[J].Plant Physiology and Biochemistry,2020,146:1-12.
[15] 谢海娟,叶广继,王舰,等.马铃薯StSUT2基因在烟草中过表达提高其耐盐性[J].西南农业学报,2020,33(4):696-703.
[16] 吴霞,聂靖芝,陈灿妮,等.大豆蔗糖转运蛋白基因GmSUT4.2基因表达和功能分析[J/OL].分子植物育种,[2024-04-28].https://kns.cnki.net/kcms/detail/46.1068.S.20230427.1143.002.html.
[17] 寿伟松,王铎,沈佳,等.西瓜蔗糖转运蛋白SUT家族的鉴定及其在果实发育和逆境响应中的表达分析[J].浙江农业学报,2024,36(1):94-102.
[18] 胡梦芸,李辉,庞建周,等.过量表达蔗糖转运蛋白基因增强转基因小麦的耐旱性[J].中国农业科学,2015,48(8):1473-1483.
[19] DOIDY J,GRAECE E,KUEHN C,et al.Sugar transporters in plants and in their interactions with fungi[J].Trends in Plant Science,2012,17(7):413-422.
[20] 陈雅琪,肖贵,刘剑镔,等.蔗糖转运蛋白OsSUT2对水稻抗病性的功能分析[J].分子植物育种,2022,20(22):7432-7438.
[21] DENG L L,ZHAO S P,YANG G L,et al.Soybean GmSUT1 transporter participates in sucrose transport to nodules during rhizobial symbiosis[J].Plant Growth Regulation,2022,96(12):1-11.
[22] BITTERLICH M,KRÜGEL U,BOLDT-BURISCH K,et al.The sucrose transporter SlSUT2 from tomato interacts with brassinosteroid functioning and affects Arbuscular mycorrhiza formation[J].Plant Journal,2014,78(5):877-889.
[23] BITTERLICH M,KRÜGEL U,BOLDT-BURISCH K,et al.Interaction of brassinosteroid functions and sucrose transporter SlSUT2 regulate the formation of Arbuscular mycorrhiza[J].Plant Signaling Behavior,2014,9(10):e970426.
[24] HANSCH F,JASPAR H,SIVERS L V,et al.Brassinosteroids and sucrose transport in mycorrhizal tomato plants[J].Plant Signaling and Behavior,2020,15(2):1714292.
[25] KÜHN C,HAJIREZAE M R,FERNIE A R,et al.The sucrose transporter StSUT1 localizes to sieve elements in potato tuber phloem and influences tuber physiology and development[J].Plant Physiology,2003,131(1):102-113.
[26] CHINCINSKA I A,LIESVHE J,KRÜGRL U,et al.Sucrose transporter StSUT4 from potato affects flowering,tuberization,and shade avoidance response[J].Plant Physiology,2008,146(2):515-528.
[27] CHINCINSKA I,GTER K,KRÜGRL U,et al.Photoperiodic regulation of the sucrose transporter StSUT4 affects the expression of circadian-regulated genes and ethylene production[J].Frontiers in Plant Science,2013,4:26.
[28] 田泽.马铃薯StSUT基因的表达分析及StSUT2基因表达载体的构建[D].兰州:兰州理工大学,2019.
[29] GONG H L,LIU J B,IGIRANEZA C,et al.Sucrose transporter StSUT2 affects potato plants growth,flowering time,and tuber yield[J].Current Issues in Molecular Biology,2023,45(3):2629-2643.
[30] 梁金永.马铃薯StSUT2的启动子克隆及其对花器官发育的调控作用[D].兰州:兰州理工大学,2021.
[31] BARKER L,KÜHN C,WEISE A,et al.SUT2,a putative sucrose sensor in sieve elements[J].Plant Cell,2000,12(7):1153-1164.
[32] HACKEL A,SCHAUER N,CARRARI F,et al.Sucrose transporter LeSUT1 and LeSUT2 inhibition affects tomato fruit development in different ways[J].Plant Journal,2006,45(2):180-192.
[33] HIROSE T,ZHANG Z J,MIYAO A,et al.Disruption of a gene for rice sucrose transporter,OsSUT1,impairs pollen function but pollen maturation is unaffected[J].Journal of Experimental Botany,2010,61(13):3639-3646.

