微型月季‘玲之妖精’的离体培养研究

摘要" 为促进微型月季‘玲之妖精’的种苗规模化生产以及后续利用细胞工程方法进行种质改良,以微型月季‘玲之妖精’为试验材料,利用组织培养方法进行离体培养研究,主要包括不同外植体消毒灭菌处理、愈伤组织诱导、愈伤组织增殖、腋芽萌发诱导、腋芽继代增殖以及生根诱导等。结果表明,叶片外植体合适的灭菌方式为75%乙醇消毒30 s+0.1%升汞灭菌5 min,适合的愈伤组织诱导培养基为MS+6-苄基腺嘌呤(6-BA) 0.5 mg/L+2,4-二氯苯氧乙酸(2,4-D) 2.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L,愈伤组织增殖培养基为MS+6-BA 2.0 mg/L+萘乙酸(NAA) 0.2 mg/L+蔗糖30 g/L+琼脂6.5 g/L;茎段外植体合适的灭菌方式为75%乙醇消毒30 s+0.1%升汞灭菌8 min,适合腋芽萌发的培养基为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L,腋芽继代增殖的培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L;生根适宜的培养基为1/2MS+NAA 0.1 mg/L+蔗糖 30 g/L+琼脂 6.5 g/L。本研究为微型月季品系改良和遗传转化提供参考。
关键词" 微型月季;离体培养;愈伤组织诱导;继代增殖
中图分类号" Q813.1" " " "文献标识码" A" " " "文章编号" 1007-7731(2025)02-0040-06
DOI号" 10.16377/j.cnki.issn1007-7731.2025.02.008
Research on in vitro culture of miniature Chinese rose ‘Lingzhi Yaojing’
FANG Hefang" " ZHOU Xinping" " KANG Xudong" " PENG Xiaolong" " LI Tongjian" " JIA Mingliang
(Jiujiang University, Jiujiang 332000, China)
Abstract" In order to promote the large-scale seedling production and subsequent germplasm improvement by cell engineering methods, the goblins of miniature Chinese rose ‘Lingzhi Yaojing’ were used as experimental materials to study in vitro culture, including different explants disinfection and sterilization, callus induction, callus proliferation, axillary bud germination induction, axillary bud subculture proliferation, and rooting induction. The results showed that the suitable sterilization method for leaf explants was 75% ethanol disinfection for 30 s+0.1% mercury chloride sterilization for 5 min, and the suitable callus induction medium was MS+6-BA 0.5 mg/L+2,4-D 2.0 mg/L+sucrose 30 g/L+agar 6.5 g/L. Callus proliferation medium was MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+sucrose 30 g/L+agar 6.5 g/L. The appropriate sterilization method for stem explants was 75% ethanol disinfection for 30 s+0.1% mercury chloride sterilization for 8 min. The medium suitable for axile germination was MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+sucrose 30 g/L+agar 6.5 g/L. The subculture proliferation medium for axillary bud was MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+sucrose 30 g/L+agar 6.5 g/L. The suitable medium for rooting was 1/2MS+NAA 0.1 mg /L+sucrose 30 g/L+agar 6.5 g/L. This study provides a reference for the improvement and genetic transformation of microrose strains.
Keywords" miniature Chinese rose; in vitro culture; callus induction; subculture proliferation
月季为蔷薇科蔷薇属多年生观赏植物,观赏价值极高。月季品种繁多,其中微型月季是一类适合盆栽及地被栽培的品种,具有较高的市场价值[1]。现已有诸多关于微型月季的研究,如马俊丽等[2]通过研究68种微型月季种质资源发现,其表型性状间存在差异,品种间变异系数较高;彭华等[3]对江西地区引种的微型月季品种进行了鉴定评估,认为北京红和紫色美地兰综合表现较好;付存念等[4]研究表明,温州地区引种的微型月季品种中,人间天堂、羽毛等品种综合评价较高。此外,关于盆栽微型月季生产的装备化[5]和自动化[6]方面也有相关研究。微型月季种苗的主要生产方式为扦插,对此有诸多报道,如周丹燕[7]研究发现,微型月季白柯斯特适合扦插的基质配比为草炭∶珍珠岩=2∶3;瞿辉等[8]研究表明,萘乙酸(NAA)和吲哚丁酸(IBA)处理对微型月季扦插生根有明显的促进作用;王燕等[9]对华南地区冬季温室微型月季扦插母株进行补光处理,提高了其插穗品质。由于微型月季株型矮小、茎节数量较少,因此扦插方式繁殖系数较低,难以满足市场需求,因此对其离体培养的研究主要集中在不同的微型月季品种的外植体灭菌、腋芽萌发诱导以及增殖和生根等方面[10-12]。‘玲之妖精’是微型月季的典型代表之一,具有植株矮小、花朵大、重瓣和抗病等特点,花朵具有玫瑰香气,深受人们喜爱。瞿素萍等[13]、彭奎莉等[14]研究表明,不同品种微型月季对培养条件的响应既有同一性,又有一定的特异性,因此对其进行离体培养具有重要意义,可为‘玲之妖精’种质资源的进一步开发和品系改良提供参考。
本文以‘玲之妖精’幼嫩叶片为外植体,进行愈伤组织诱导和增殖研究,同时利用带芽茎段进行了腋芽萌发、增殖及生根诱导成苗的研究,完善了微型月季‘玲之妖精’的离体培养体系,为其品系改良和遗传转化提供参考。
1 材料与方法
1.1 供试材料
供试材料为微型月季‘玲之妖精’植株,外植体选择无病虫害且生长状态良好的当年生半木质化中段枝条。将当天采摘枝条剪成带1~2个芽的茎段,将从枝条上剥离的叶片作为叶片外植体,去掉叶片后暴露腋芽的枝条作为茎段外植体,流水冲洗去除其表面污渍,吸去表面残留水分后,分别置于培养瓶中备用。
1.2 试验方法
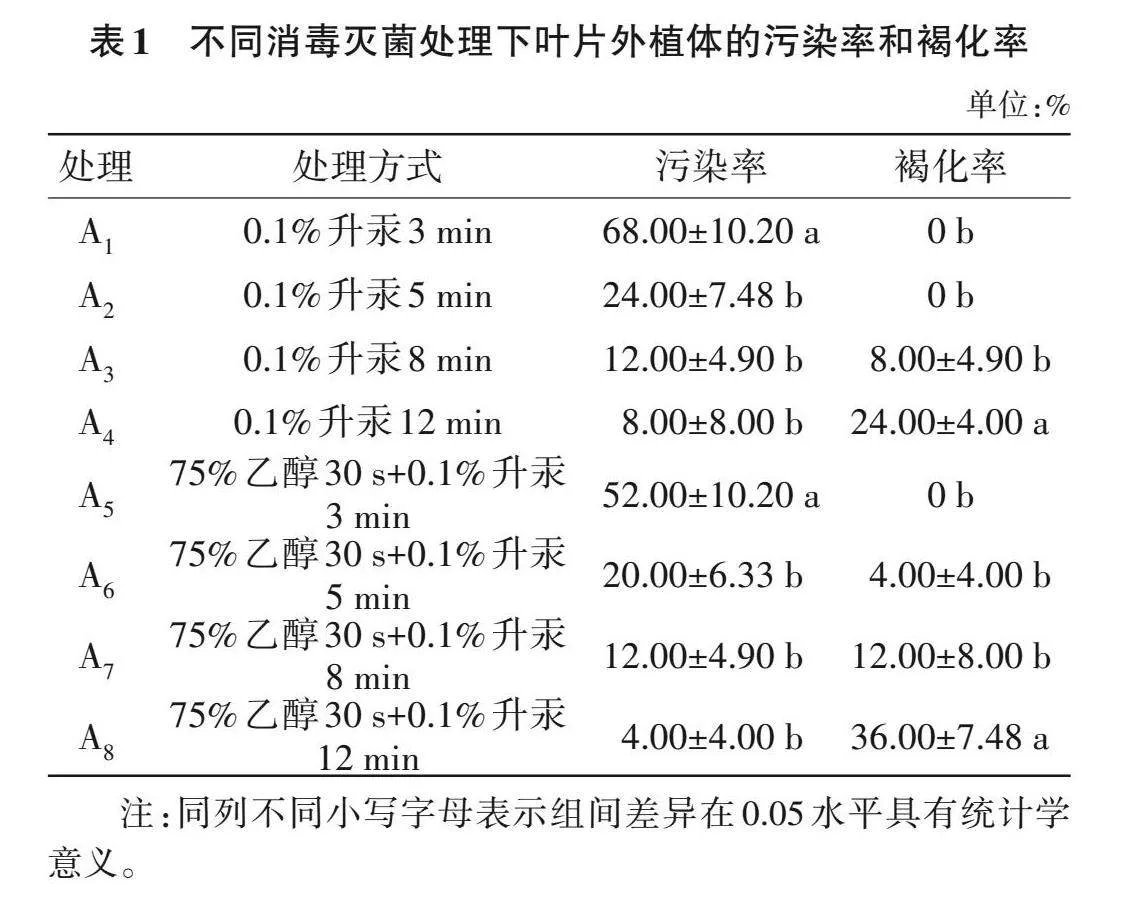
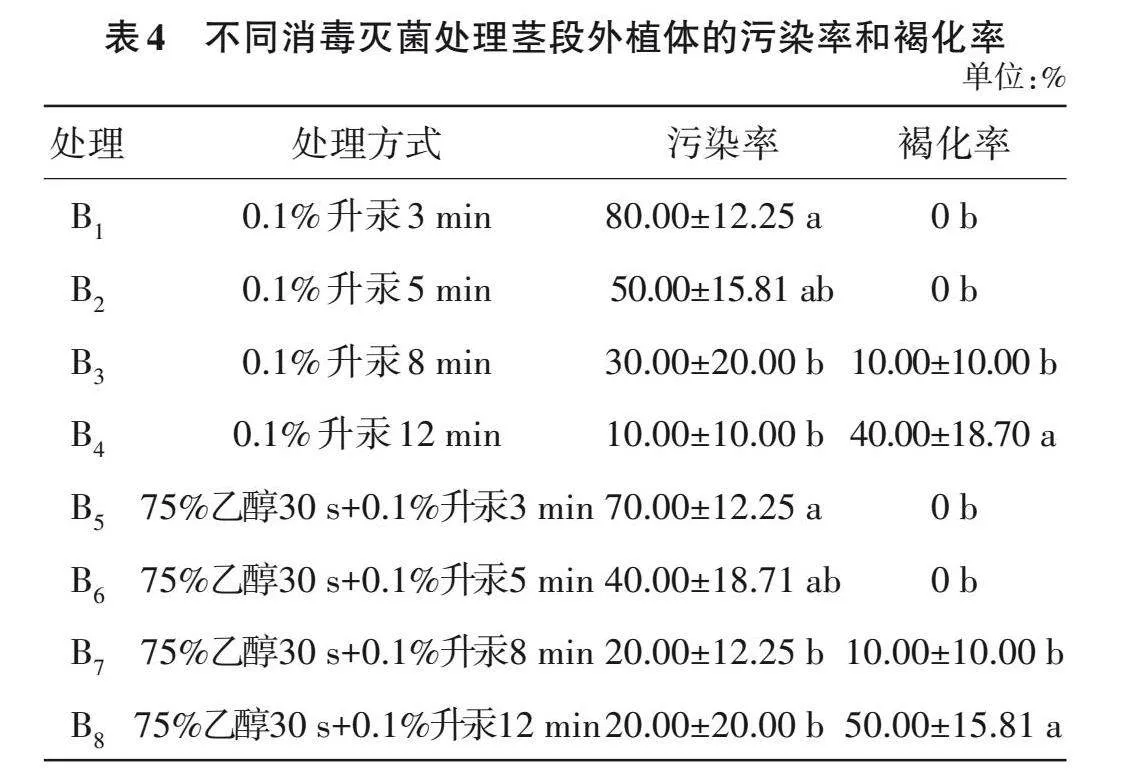
1.2.1 外植体灭菌条件筛选 将清洗好的叶片外植体直接用升汞(0.1% HgCl2水溶液)浸泡灭菌(浸泡时间梯度设置为3、5、8和12 min),无菌水冲洗6次,得到灭菌后的叶片外植体(编号A1~A4);将清洗好的叶片外植体采用75%乙醇浸泡30 s消毒,后用无菌水冲洗3次,再用升汞浸泡灭菌(浸泡时间梯度设置为3、5、8和12 min),最后用无菌水冲洗6次,以洗净残留的升汞为准,得到无菌叶片外植体(编号A5~A8)。茎段外植体采用与叶片外植体相同的灭菌方式,编号B1~B8。灭菌后的外植体接种至培养基[MS+6-苄氨基腺嘌呤(6-BA)1.0 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂6.5 g/L,pH 5.8]中培养观察。14 d后统计污染率和褐化率,并记录污染和生长情况,计算如式(1)~(2)。
污染率(%)=出现污染的组织块数/接种的外植体总数×100 (1)
褐化率(%)=出现褐化的组织块数/接种的外植体总数×100 (2)
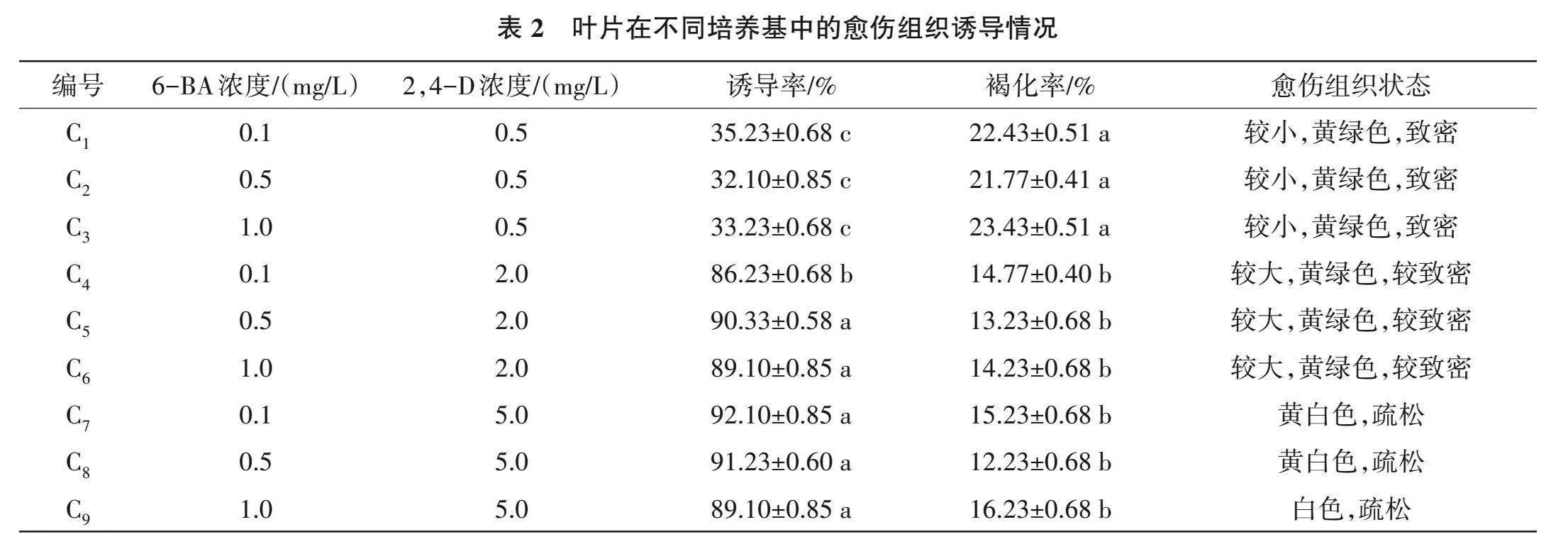
1.2.2 叶片愈伤组织诱导 利用1.2.1中筛选得到的合适灭菌条件进行叶片灭菌,用无菌滤纸将叶片表面水分吸干后,将其剪成1 cm×1 cm的碎片,而后将碎叶片接种至含有不同浓度2,4-二氯苯氧乙酸(2,4-D)和6-BA的MS培养基中,进行愈伤组织诱导试验(培养基为MS+激素组合+蔗糖30 g/L+琼脂6.5 g/L,pH 5.8)。激素浓度组合分别为C1:2,4-D 0.5 mg/L+6-BA 0.1 mg/L;C2:2,4-D 0.5 mg/L+6-BA 0.5 mg/L;C3:2,4-D 0.5 mg/L+6-BA 1.0 mg/L;C4:2,4-D 2.0 mg/L+6-BA 0.1 mg/L;C5:2,4-D 2.0 mg/L+6-BA 0.5 mg/L;C6:2,4-D 2.0 mg/L+6-BA 1.0 mg/L;C7:2,4-D 5.0 mg/L+6-BA 0.5 mg/L;C8:2,4-D 5.0 mg/L+6-BA 0.5 mg/L;C9:2,4-D 5.0 mg/L+6-BA 1.0 mg/L。接种30 d后统计愈伤组织诱导率、褐化率,并观察愈伤状态,计算如式(3)。
愈伤组织诱导率(%)=愈伤组织的诱导个数/叶柄外植体总数×100 (3)
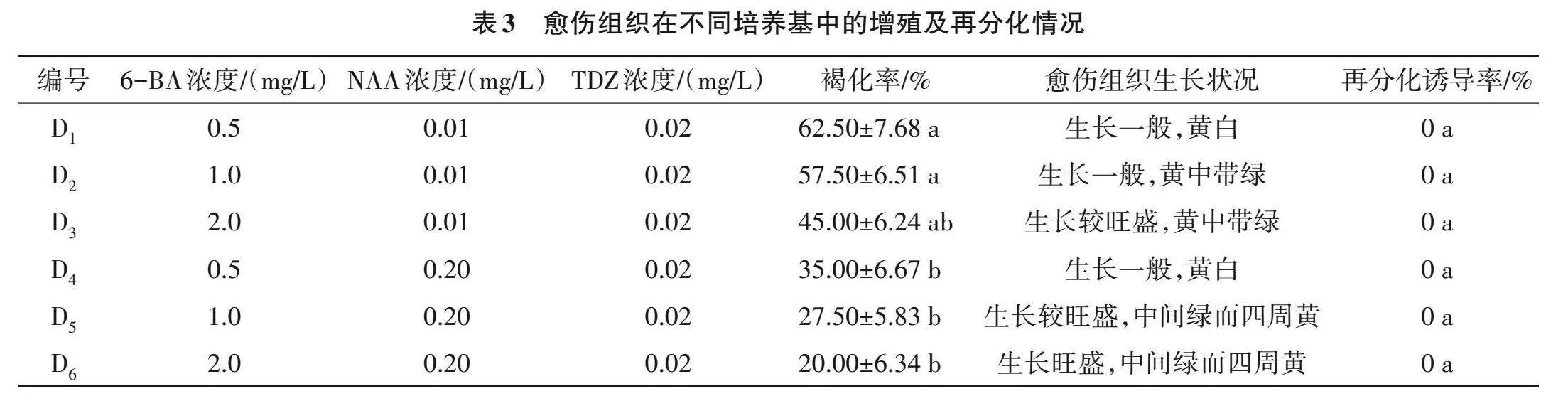
1.2.3 愈伤组织增殖及再分化诱导 将1.2.2诱导的愈伤组织与叶片分离,切割后转入愈伤增殖及再分化培养基中进行愈伤组织增殖及再分化诱导(培养基为MS+激素组合+蔗糖30 g/L +琼脂6.5 g/L,pH 5.8)。激素浓度组合分别为D1:NAA 0.01 mg/L+6-BA 0.5 mg/L+噻苯达唑(TDZ)0.02 mg/L;D2:NAA 0.01 mg/L+6-BA 1.0 mg/L+TDZ 0.02 mg/L;D3:MS+NAA 0.01 mg/L+6-BA 2.0 mg/L+TDZ 0.02 mg/L;D4:NAA 0.2 mg/L+6-BA 0.5 mg/L+TDZ 0.02 mg/L;D5:NAA 0.2 mg/L+6-BA 1.0 mg/L+TDZ 0.02 mg/L;D6:NAA 0.2 mg/L+6-BA 2.0 mg/L+TDZ 0.02 mg/L。接种30 d后统计再分化诱导率、褐化率,并观察愈伤增殖情况,计算如式(4)。
再分化诱导率(%)=诱导出芽的组织块数/接种的愈伤组织块数×100 (4)
1.2.4 腋芽萌发诱导 利用1.2.1中筛选得到的合适灭菌条件进行茎段灭菌,用无菌滤纸将茎段表面水分吸干后,将形态学上端向上接种至含有不同浓度6-BA和NAA的MS培养基中,进行腋芽萌发诱导试验(培养基设定为MS+激素组合+蔗糖30 g/L+琼脂6.5 g/L,pH 5.8)。激素浓度组合分别为E1:6-BA 0.5 mg/L;E2:6-BA 1.0 mg/L;E3:6-BA 2.0 mg/L;E4:6-BA 0.5 mg/L+NAA 0.1 mg/L;E5:6-BA 1.0 mg/L+NAA 0.1 mg/L;E6:6-BA 2.0 mg/L+NAA 0.1 mg/L。接种21 d后统计腋芽萌发率,并观察生长情况,计算如式(5)。
腋芽萌发率(%)=萌发出腋芽的外植体数/接种的外植体总数×100 (5)
1.2.5 腋芽继代增殖诱导 将萌发的腋芽与茎段切开,取腋芽接种于丛生芽继代增殖培养基中进行腋芽继代增殖诱导(培养基设定为MS+激素组合+蔗糖30 g/L +琼脂6.5 g/L,pH 5.8)。激素浓度组合分别为F1:6-BA 1.0 mg/L+NAA 0.1 mg/L;F2:6-BA 1.0 mg/L+NAA 0.5 mg/L;F3:6-BA 1.0 mg/L+NAA 1.0 mg/L;F4:6-BA 2.0 mg/L+NAA 0.1 mg/L;F5:6-BA 2.0 mg/L+NAA 0.5 mg/L;F6:6-BA 2.0 mg/L+NAA 1.0 mg/L;F7:6-BA 3.0 mg/L+NAA 0.1 mg/L;F8:6-BA 3.0 mg/L+NAA 0.5 mg/L;F9:6-BA 3.0 mg/L+NAA 1.0 mg/L。接种30 d后统计增殖倍数,并观察生长情况,计算如式(6)。
增殖倍数(倍)=增殖后的丛生芽数/接种的组织块数 (6)
1.2.6 生根诱导 待苗长到2 cm左右,将其切割接种到不同生根培养基上进行生根诱导(培养基设定为基本培养基+激素组合+蔗糖30 g/L +琼脂6.5 g/L,pH 5.8)。基本培养基+激素组合编号为G1:MS+NAA 0.1 mg/L;G2:MS+NAA 1.0 mg/L;G3:1/2MS+NAA 0.1 mg/L;G4:1/2MS+NAA 1.0 mg/L;G5:1/4MS+NAA 0.1 mg/L;G6:1/4MS+NAA 1.0 mg/L。接种30 d后统计生根诱导率,并观察种苗生长状态,计算如式(7)。
生根诱导率(%)=诱导出根丛生芽个数/接种丛生芽总数×100 (7)
1.3 数据处理
所有试验均重复3次,所得数据用Excel及SPSS软件进行统计分析,数据为平均值±标准差。
2 结果与分析
2.1 叶片外植体离体培养
2.1.1 灭菌条件筛选 由表1可知,随着升汞灭菌时间的延长,叶片外植体污染率逐渐降低,但升汞灭菌8 min及以上的外植体褐化率有所升高。与A1~A4相比,在使用升汞灭菌的基础上添加75%乙醇浸泡30 s后,污染率整体降低。A6的污染率略高于A7和A8(Pgt;0.05),但其褐化率明显低于A8(Plt;0.05)。综合来看,最佳的消毒灭菌处理为A6,即75%乙醇30 s+0.1%升汞5 min。
2.1.2 叶片愈伤组织诱导 由表2可知,6-BA浓度对叶片愈伤组织诱导率和褐化率的影响均较小,以6-BA浓度为0.5 mg/L时,叶片褐化率较低。当2,4-D浓度为0.5 mg/L时,愈伤组织诱导率较低;随着2,4-D浓度的增加,愈伤组织的诱导率呈上升趋势。2,4-D浓度为2.0 mg/L和5.0 mg/L情况下,叶片愈伤组织褐化率差异均无统计学意义(Pgt;0.05)。从愈伤组织状态来看,当2,4-D浓度为0.5 mg/L时,愈伤组织较小且致密,为黄绿色,褐化率较高;当2,4-D浓度为2.0 mg/L时,愈伤组织变大,致密程度降低,褐化率也降低;当2,4-D浓度为5.0 mg/L时,愈伤组织为黄白色或白色,状态较疏松,褐化率较低。遵循当诱导效果无显著差异时,选取激素浓度低的组合原则,选取C5(MS+6-BA 0.5 mg/L+2,4-D 2.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L)为合适的叶片愈伤组织诱导培养基组合。
2.1.3 愈伤组织增殖及再分化诱导 由表3可知,本试验原计划促成愈伤组织的再分化,但在实际诱导时各培养基均未诱导出芽或根等器官,再分化诱导率均为0。对褐化率和愈伤组织生长状况进行综合评判,发现NAA浓度为0.20 mg/L时,褐化率均较低,同时6-BA浓度为2.0 mg/L时,愈伤组织生长旺盛。综合来看,愈伤组织增殖的合适培养基为D6(MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+TDZ 0.02 mg/L+蔗糖30 g/L+琼脂6.5 g/L)。
2.2 茎段外植体离体培养
2.2.1 灭菌条件筛选 由表4可知,不同消毒灭菌处理茎段外植体的污染率和褐化率趋势与叶片外植体相似。B7、B8的污染率基本相同,但B7的褐化率明显低于B8,差异具有统计学意义(Plt;0.05)。综合来看,茎段外植体的最佳消毒灭菌处理为B7,即75%乙醇30 s+0.1%升汞8 min。
2.2.2 腋芽萌发诱导 由表5可知,各种激素组合下腋芽萌发率均较高,可见月季茎段进行腋芽萌发诱导较容易,以E5的腋芽萌发率较高,为90.00%,与除E2、E6外的其余组合差异均具有统计学意义(Plt;0.05)。生长状况方面,E2和E5腋芽萌发成苗生长健壮。综合萌发率和生长状况,腋芽萌发诱导的合适培养基为E5(MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L)。
2.2.3 腋芽继代增殖 由表6可知,NAA浓度对腋芽增殖倍数的影响较小,主要取决于6-BA浓度。当6-BA浓度为1.0 mg/L时,增殖倍数低于其他处理,差异具有统计学意义(Plt;0.05);当6-BA浓度为2.0 mg/L时,增殖倍数较F1~F3显著提高(Plt;0.05),但当6-BA浓度继续提高时增殖倍数未出现明显增长。结合生长状态可看出,各组合除芽数量差异外,均生长健壮,选取合适的腋芽继代增殖培养基为F4(MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L)。
2.2.4 生根诱导培养 由表7可知,当基本培养基为1/2MS时,生根诱导率优于其他组合,差异具有统计学意义(Plt;0.05)。NAA浓度较低时,种苗生长状态较好。当基本培养基为1/2MS、NAA浓度为1.0 mg/L时,生根诱导率较高,但种苗状态较差。总体而言,适合生根诱导的培养基为G3(1/2MS+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L)。
3 结论与讨论
本文研究了灭菌条件对微型月季外植体污染率和褐化率的影响,确定叶片外植体采用75%乙醇消毒30 s+0.1%升汞灭菌5 min、茎段外植体采用75%乙醇消毒30 s+0.1%升汞灭菌8 min灭菌效果较好。相关研究表明,不同来源的外植体由于污染情况不一,所用的灭菌时间存在差异,如吕金浮[15]研究表明,利用升汞对微型月季茎段外植体灭菌3 min效果较好;谢晓静等[16]研究发现,月季茎段消毒以0.1%升汞溶液消毒10 min较为适宜。
‘玲之妖精’叶片愈伤组织诱导最适培养基为MS+6-BA 0.5 mg/L+2,4-D 2.0 mg/L+蔗糖30 g/L+琼脂6.5 g/L,愈伤组织增殖最适培养基为MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+TDZ 0.02 mg/L+蔗糖30 g/L+琼脂6.5 g/L。在以上培养条件下可进行叶片愈伤组织的增殖,但进行再分化诱导时,发现并无芽或根等器官产生,与冯欢等[17]、苗卫东等[18]研究结果不一致,可能与植物基因型、生理状态和培养基成分等不同有关[19]。
胡军荣[20]研究表明,低温处理有利于月季腋芽萌发诱导;刘洋等[21]研究发现,6-BA、NAA和赤霉素(GA3)的组合对于促进月季腋芽萌发有良好的效果。本试验为常温状态下对腋芽萌发进行研究,确定适合腋芽萌发的培养基为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L,其中未添加GA3,后续可利用低温以及GA3对于微型月季‘玲之妖精’的腋芽萌发诱导进行进一步研究。
腋芽继代增殖的培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L,在此条件下丛生芽增殖5倍以上,具有较好的诱导效果。彭奎莉等[22]添加IBA作为生根激素得到的生根率为83.33%;冯欢等[17]研究表明,在1/4MS+NAA 0.1 mg/L激素条件下可获得100%的生根率,但相同的条件下,本试验仅得到5.16%的生根率。本试验生根诱导效果较好的培养基为1/2MS+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.5 g/L,生根诱导率总体较低,且在茎段基部容易产生愈伤组织,影响生根效果,后续研究可选择合适的基本培养基以及激素配比条件等进行生根诱导。
参考文献
[1] 牟会斌,陆红梅. 盆栽和地被好材料:微型月季[J]. 园林,2000,17(12):38-39.
[2] 马俊丽,罗楠. 大花微型月季种质资源筛选[J]. 南方农业,2023,17(7):7-12,17.
[3] 彭华,管帮富,彭火辉,等. 江西南昌引种丰花及微型月季品种的鉴定评估[J]. 江西农业学报,2012,24(4):34-37.
[4] 付存念,张昌轮,苏世闻,等. 温州丰花和微型月季品种筛选与综合评价[J]. 浙江农业科学,2022,63(7):1508-1513,1529.
[5] 刘健斌,雷利锋,张黎. 盆栽微型月季装备化作业生产模式应用[J]. 农业科学研究,2023,44(2):78-80,85.
[6] YU W J,RYO K,KATSUHIKO K,et al. A computer program for automatic watering based on potential evapotranspiration by penman method and predicted leaf area in miniature pot rose production[J]. Agricultural sciences in China,2010,9(3):370-377.
[7] 周丹燕. 不同基质配比对6个月季品种扦插繁殖效果的影响[J]. 植物学研究,2023,12(1):18-25.
[8] 瞿辉,邵和平,叶晓青,等. 不同生长素处理对2个微型月季品种扦插生根的影响[J]. 江苏农业科学,2018,46(19):159-162.
[9] 王燕,王亚平,赖永超,等. 华南地区冬季温室补光对微型月季扦插及生长发育的影响[J]. 广东农业科学,2019,46(6):37-45.
[10] 韩秀慧,满都拉,王华芳. 微型月季离体快速繁殖技术的研究[J]. 内蒙古师范大学学报(自然科学汉文版),2003,32(3):262-265.
[11] 牟会斌. 微型月季微繁体系的构建及组培生根机理研究[D]. 南京:南京农业大学,2001.
[12] 陈兰芬. 7个微型月季组织培养研究[J]. 北京农业职业学院学报,2015,29(2):35-39.
[13] 瞿素萍,王继华,唐开学,等. 5个切花月季品种的叶片离体培养和再生能力的基因型效应[J]. 西南大学学报(自然科学版),2007,29(12):108-112.
[14] 彭奎莉,孟繁博,周志达,等. 不同基因型丰花月季快繁体系差异的研究[C]//中国观赏园艺研究进展2018. 哈尔滨,2018:480-486.
[15] 吕金浮. 微型月季不定芽诱导及植株再生初探[C]//第二届中华农圣文化国际研讨会论文集. 潍坊,2011:264-271.
[16] 谢晓静,毕晓颖,雷家军. 月季品种‘博’茎段离体培养的研究[J]. 辽宁林业科技,2009(1):47-49.
[17] 冯欢,易姝利,谢佳恒,等. 微型月季愈伤组织诱导及植株再生[J]. 植物学报,2014,49(5):595-602.
[18] 苗卫东,高换超,李俊涛,等. 月季无菌材料的获得及不定芽的诱导[J]. 江苏农业科学,2021,49(18):48-53.
[19] 李立香,毛秀红,张演义,等. 月季叶片组织培养的研究进展[J]. 山东林业科技,2009,39(3):159-161.
[20] 胡军荣. 低温预处理对‘红色龙沙宝石’月季离体培养芽诱导的影响[J]. 现代园艺,2023(21):3-4.
[21] 刘洋,陈万鹏,刘祥君. 切花月季‘雪山’的离体快繁体系的建立[J]. 现代园艺,2017(11):18-19.
[22] 彭奎莉,张重叶,王雨薇,等. 微型月季小仙女茎段快繁体系建立的研究[J]. 种子科技,2017,35(8):121-122.
(责任编辑:吴思文)

