改变世界从一条小线虫开始
揭开基因调控之谜
2024年诺贝尔生理学或医学奖花落美国科学家维克托·安布罗斯和加里·鲁夫坎。他们发现了微小RNA及其转录后在基因调控中的作用,让人们对基因调控有了全新的认识。
要理解这项发现的重要性,让我们先来了解一下基因表达的基本过程。
在生物体内,除了众所周知的脱氧核糖核酸(DNA),还存在核糖核酸(RNA)。在细胞生成过程中,DNA如同一份详细的“使用说明书”,扮演着至关重要的角色。不过,“使用说明书”首先得经过“转录”,把信息传递给信使核糖核酸(mRNA),然后才能被细胞内的“工厂”“翻译”成实际的蛋白质。mRNA就像是一位传送指令的“传令员”,确保细胞能准确获取DNA中的遗传信息,并按部就班地进行蛋白质生产。
生物体内的RNA通常分为两种:一种是参与编码蛋白质的RNA,如指导合成蛋白质的mRNA;另一种是不能编码蛋白质的RNA,即非编码RNA。作为非编码RNA的一种,微小RNA是一类很短的RNA分子,通常只有20~24个核苷酸。
微小RNA不产生蛋白质,而是通过影响其他RNA分子来调节基因的活动。如果把微小RNA当作一个精密的“调节器”,那么它能够精确地调节基因表达的强度和时间。微小RNA通过降解mRNA或抑制翻译来控制蛋白质的表达,相当于给生产流程加上了“阀门”。
安布罗斯和鲁夫坎的发现从根本上改变了人们对转录后基因调控的认知。在此之前,人们一直认为DNA是人类基因的关键编码,而安布罗斯和鲁夫坎的发现或许能证明,在生命的最初阶段,RNA比DNA更为重要,是生命形成的初始编码。
隐藏的生命“开关”
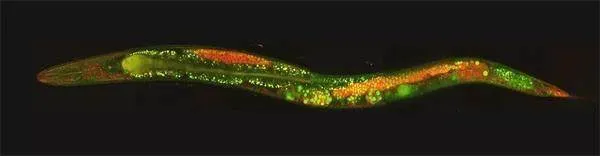
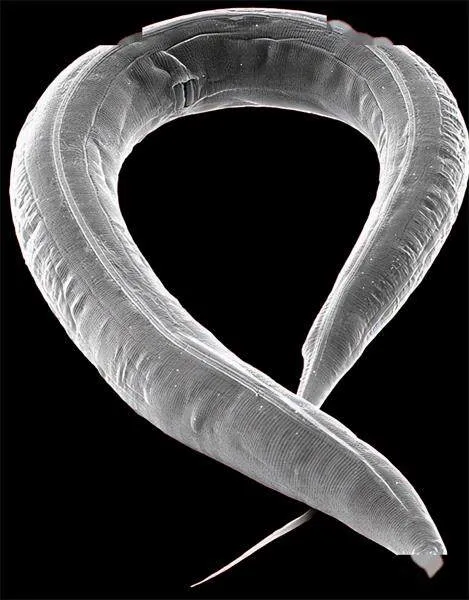
20世纪80年代末,安布罗斯和鲁夫坎对不同类型的细胞如何发育产生了浓厚兴趣。他们在实验室从事博士后研究工作时,研究一种不起眼的约1毫米长的线虫——秀丽隐杆线虫。尽管秀丽隐杆线虫体形很小,却拥有许多特殊的细胞类型,例如神经细胞和肌肉细胞。因为这些细胞在更大、更复杂的动物体内也存在,所以这种小线虫成为研究多细胞生物组织发育和成熟的有用参照物。
安布罗斯和鲁夫坎在探讨秀丽隐杆线虫与生长相关的生理学机制时,偶然发现了一个奇怪的“指挥官”——lin-4基因。基因的工作原理通常是指导细胞制造蛋白质,这就好似工厂里的设计图纸。但是lin-4基因不一样,这个“指挥官”并不指导细胞制造蛋白质,而是产生了一个微小RNA分子。更有趣的是,这个微小RNA分子似乎能够影响另一个基因lin-14的工作。这就好比在一个“大工厂”里,发现了一个小小的“开关”,居然能控制整条“生产线”的运转。
1993年,安布罗斯和鲁夫坎在《细胞》杂志上发表论文,解释了这个神奇的控制过程。他们发现lin-4微小RNA就像一把“钥匙”,能够与lin-14基因产生的mRNA的某些部分完美匹配。当这把“钥匙”插入“锁孔”后,就会阻止lin-14基因产生蛋白质。微小RNA的发现就像是揭示了生命中的一个隐藏“开关”,为我们理解生命如何精确调控细胞开启了一扇崭新的大门。
尽管这是前所未有的发现,但是并未引起强烈的反响。科学家起初认为,安布罗斯和鲁夫坎所发现的新的基因调控机制可能是秀丽隐杆线虫的特殊之处,与其他结构更复杂的动物和人类并无什么关系。这种看法在2000年发生了改变,因为鲁夫坎的研究小组发现了另一种基因let-7。与lin-4基因不同,let-7基因存在于整个动物界。这引起了人们的极大兴趣,从而出现了“寻宝热潮”。
如今,关于微小RNA的研究成果可谓进入“井喷”阶段。科学家已经发现,人类有超过1000种不同的微小RNA。在多细胞生物中,微小RNA的基因调控是普遍存在的。
探索宇宙的“传送门”
2024年诺贝尔生理学或医学奖的颁发,在肯定安布罗斯和鲁夫坎个人成就的同时,也认可了微小RNA的重要作用。微小RNA参与调控生物体发育和生理过程的方方面面,帮助控制各个发育阶段的精确时间。例如,在秀丽隐杆线虫从幼虫到成虫的转变过程中,lin-4基因和let-7基因起着关键作用。它们可以稳定特定细胞的类型特征,同时抑制其他细胞的类型基因表达,这对于维持组织的稳定状态和正常功能至关重要。
在成年生物体内,微小RNA就像一个精密的“平衡器”,确保细胞内各种基因的表达水平保持在适当的范围内。当生物遇到环境压力时,某些微小RNA还能帮助细胞作出适当的反应。它可以迅速调整基因表达,使细胞能够应对外部变化。在科学研究领域,微小RNA的上调或下调已被用于鉴定特定基因功能。因此,只要能够改变基因的功能,或者对基因进行调控,就可能潜在地影响个体稳态与疾病,而微小RNA可以通过对关键基因的调控参与其中,是一个非常“广谱”的现象。
在生命科学研究中,微小RNA如同探索宇宙的“传送门”。这种比喻不仅形象地表达了微小RNA在生命科学研究中的重要性和突破性,还暗示了其在揭示生命本质过程中的关键作用。
在微小RNA被发现参与基因调控之前,人们在进行药物研发时,主要是对蛋白质进行调控。而研究发现,微小RNA与癌症、神经退行性疾病等有着密切关联。在发病过程中,微小RNA的表达水平会发生显著变化。比如癌症,某些微小RNA分子可能过度活跃,抑制了抑癌基因的表达,导致肿瘤的产生。而在其他情况下,某些微小RNA分子可能失去活性,使得原癌基因(指存在于生物正常细胞基因组中的癌基因)得以恣意表达。通过对患者血液或组织中微小RNA的检测,科学家可以捕捉到疾病的早期信号,为精准医疗提供重要线索。微小RNA开创了精准靶向治疗的先河,让人们拥有了精确调控mRNA的能力。
微小RNA还在发育、衰老、免疫反应、神经功能等多个生物学过程中发挥关键作用。例如,在胚胎发育过程中,由于微小RNA精确调控了基因表达的时空模式,因此确保各组织器官的正常形成。再如,1993年,美国科学家辛西娅·凯尼恩及同事发现,秀丽隐杆线虫中DAF-2基因的突变可以将其寿命延长超过2倍,这一发现为理解人类衰老提供了重要的线索,推进了对衰老分子机制的研究。
随着研究的深入,微小RNA领域必将继续为生命科学和医学带来更多惊喜和突破。迄今有关微小RNA的科学文献已超过10万篇,其中有很多篇来自我国科学家的重要研究。例如,中国科技大学生命科学学院研究团队在肿瘤干细胞研究中,发现微小RNA-100可以抑制乳腺肿瘤干细胞的更新和增殖,从而遏制乳腺癌的生长和转移。
卓越的模式生物
1900年,秀丽隐杆线虫在阿尔及利亚的土壤中首次被发现,其拉丁种名elegans意为“优雅”“秀丽”。秀丽隐杆线虫通常生活在土壤和腐烂的植物中,以细菌为食,可以独立生存。这种线虫身体构造简单,只有302个神经元,却能够展示出复杂的行为,提供丰富的生物学信息。秀丽隐杆线虫拥有适度的生物复杂性,便于科学家在细胞和神经网络的层面上进行深入研究。
秀丽隐杆线虫被用作实验对象已有60多年,是全球科学家喜爱的研究工具之一。1998年,秀丽隐杆线虫成为第一种完成全基因组测序的动物,这是分子生物学研究的另一个重要里程碑。此项工作不仅提供了有关个别基因和基因间关系的宝贵信息,也为后续的基因组研究提供了重要的方法指导。虽然“人虫有别”,但是线虫研究中所发现的一些生物学机制,也被证实存在于人类身上。

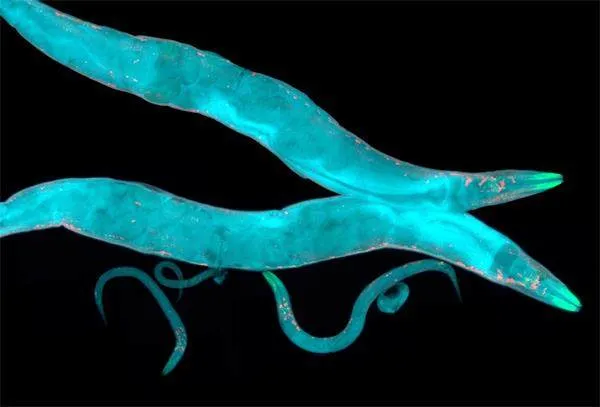
作为一种卓越的模式生物,秀丽隐杆线虫通体透明,提供了独特的实验视角。生物学家能够在显微镜下实时观察其内部结构,以及细胞分裂、发育等生物过程。大多数秀丽隐杆线虫在自然条件下是雌雄同体,每个个体都能够自体受精并产生约300个后代。这种特性使得研究人员能够轻松操控遗传特性,便于进行遗传实验和研究基因的功能。
秀丽隐杆线虫以大肠杆菌为食,可在实验室中大量培养,且从受精卵发育到成熟个体的周期仅约3天。这种快速的生命周期使得科学家能够在短时间内进行多代实验,从而观察其遗传变化和进化过程。此外,它还可以冷冻,解冻之后仍能继续研究,适合长时间保存。科学家从西伯利亚的永久冻土层中采集的一小簇线虫在被解冻后“起死回生”,存活了近一个月。
秀丽隐杆线虫具备易于搭载、培养成本低、生命周期短、后代数量多和耐辐射,以及便于遗传操作等优点,是空间生命科学研究中重要的模式生物,可用于探索太空环境对机体的生长、发育、生殖、运动、衰老等方面的影响与作用。早在1975年,秀丽隐杆线虫就开始了太空之旅,是第一种进入太空的多细胞生物,也是第一种在太空中繁殖的多细胞生物。
我国“神舟十六号”载人飞船携带的秀丽隐杆线虫,被用于中国空间站首次开展舱外辐射生物学暴露实验,返回的实验样品用于研发新型抗辐射药物。所谓“暴露实验”,就是把实验装置和样品从空间站内转移到宇宙空间中去,让其暴露在太空辐射中。经过五个半月在太空环境中的持续暴露,这些线虫随着“神舟十六号”返回地球时仍然活着,不过体内的DNA遭受了明显损伤,影响了它们的生长和繁殖。
三次诺贝尔奖的“功臣”
虽然安布罗斯和鲁夫坎都是首次获得诺贝尔奖,但其研究对象——秀丽隐杆线虫已经是诺贝尔奖的常客了。其他三届诺贝尔奖都与这种不起眼的小线虫有关,不仅让人们增进了对这一模式生物本身的理解,也推动了人类对自身生物学的认知。
“程序性细胞死亡”机制的发现
20世纪60年代之后,南非生物学家西德尼·布伦纳将秀丽隐杆线虫引入实验室研究,强调其作为分子生物学研究模式动物的潜力,为这种线虫的广泛应用奠定了基础。布伦纳的研究团队绘制了完整的线虫细胞谱系图,记录了从受精卵到成虫的每一个细胞分裂。这一图谱不仅帮助生物学家理解了细胞如何分化,也为研究细胞发育过程中的关键因素提供了基础。他们还完整描绘了秀丽隐杆线虫302个神经元的连接图谱,即连接组,这是世界上首个也是迄今唯一完整的动物神经连接组。这一突破性的工作使得研究者能够深入探讨神经系统的结构和功能,理解动物如何感知和响应环境刺激。
布伦纳及其学生约翰·苏尔斯顿、罗伯特·霍维茨,因在秀丽隐杆线虫中发现“程序性细胞死亡”机制而获得2002年诺贝尔生理学或医学奖。“程序性细胞死亡”是一种由基因决定的细胞主动的有序的死亡方式,涉及一系列基因的激活、表达以及调控等作用,具有生理性和选择性。它是生物体在漫长进化过程中逐步建立的细胞“自杀”机制,旨在维持机体内环境的稳定。“程序性细胞死亡”是细胞主动的死亡过程,能够被细胞信号转导的抑制剂阻断。而非程序性细胞死亡是细胞被动的死亡过程,不能被阻断。
“RNA干扰”机制的发现
1998年,美国科学家安德鲁·法尔和克雷格·梅洛利用秀丽隐杆线虫发现了“RNA干扰”机制,从而荣获2006年诺贝尔生理学或医学奖。“RNA干扰”指通过双链RNA诱导具有相同碱基序列的靶标RNA降解,从而促使特定基因表达“沉默”。“RNA干扰”机制在生物学中的应用非常广泛,不仅可以用于基础研究方面,继续研究在生物体内存在的RNA基因的功能、调控机制以及与蛋白质(编码基因)的关系,还能够用于剔除某个基因的影响,以此观察生物体的反应。此外,通过利用“核糖核酸干扰”,科学家能够设计特定的RNA片段来促使导致疾病的基因“沉默”,为开发新的治疗方法提供可能。
“蛋白质标记”技术的发展
以秀丽隐杆线虫为载体,美国科学家马丁·查尔菲首次展示了如何将绿色荧光蛋白的基因作为标签添加到感兴趣的基因上,使其在特定波段下发光。“蛋白质标记”为生物学研究者提供了一种强大的视觉标记技术,广泛应用于不同物种和细胞类型的实验中。查尔菲因在发现和研究绿色荧光蛋白方面的重大贡献,与华裔科学家钱永健,以及绿色荧光蛋白的发现者下村修共享了2008年诺贝尔化学奖。
为了便于理解,科学家将绿色荧光蛋白形象地比喻成一个装有色素的“油漆桶”,装在里面的发光基团对蓝色光照特别敏感。当它受到蓝光照射时,会吸收蓝光的部分能量,然后发射出绿色的荧光。利用这一性质,生物学家可以用绿色荧光蛋白来标记几乎任何生物分子或细胞,然后在蓝光照射下进行显微观察。