基于多变量综合分析多效唑对甜瓜幼苗抗逆生理的影响




摘 要 采用多变量统计方法,解析多效唑对甜瓜幼苗抗性生理效应及其相互关系。结果表明,多效唑显著增加可溶性糖(TSS)、可溶性蛋白质(sPRO)、抗坏血酸(AsA)、脯氨酸(Proline)、总叶绿素(Chl)和叶绿素a(Chla)等物质含量,显著提高谷胱甘肽还原酶(GR)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)等酶活性;丙二醛(MDA)与全钾(TK,R=-0.78)、全氮(TN,R=-0.57)、谷胱甘肽(GSH,R=-0.89)、超氧化物歧化酶(SOD,R=-0.92)、过氧化氢酶(CAT,R=-0.86)等显著负相关。观测指标可聚成2个类群,分别占70.59%和29.41%,同类指标间彼此呈正相关;17个生理指标可提取出3个主成分,分别命名为:功能性物质代谢、营养物质代谢、光合作用,各占总信息量74.91%、10.75%、6.53%,对应关键指标为:可溶性糖、磷、叶绿素b。综上,多效唑可提高甜瓜幼苗抗逆性,50~150 mg/L为最佳处理浓度,主要集中表现为功能性物质代谢、营养代谢、光合作用等三方面功能效应,可溶性糖可作为衡量多效唑处理甜瓜幼苗抗逆性强弱的决定性指标。
关键词 多效唑;甜瓜;多变量分析;抗逆生理
中国海南省南繁区气候条件独特,是“天然温室”和“育种天堂”。1995年,吴明珠院士采用大棚生态型无土栽培方式,在海南省三亚市种植新疆哈密瓜获得成功,有力推动甜瓜在海南省大面积种植[1]。据不完全统计,目前海南省乐东县每年种植冬季反季节甜瓜累计面积超2万hm2,现已成为海南热带高效农业新亮点。但是,海南常年处于高温、多雨、高湿、昼夜温差小和设施光照不足等环境,甜瓜幼苗生长极易发生徒长和热害等问题,对甜瓜苗期生长发育极其不利,导致后期花期推迟、座果率下降、品质不良、产量下降等现象。因此,鉴于海南省南繁区高温、多雨等不利条件,甜瓜主要生产仅限冬季反季节种植,严重影响本地区甜瓜设施栽培产业可持续发展。
多效唑(Paclobutrazol,简称PP333或PBZ),又称为氯丁唑,是英国帝国化学公司于20世纪70年代末推出的一种三唑类化合物,它通过抑制赤霉素(GA)生物合成,影响植物生长发育和生理生化的过程,使植株变矮,茎杆变粗,提高植株抗逆性[2]。多效唑作为一种高效低毒植物生长延缓剂和广谱性杀菌剂,具有成本低、见效快、效益高、节省劳力等优势,现已成为现代农业重要措施之一[3]。目前,有大量研究表明多效唑能够提高作物抗逆性,它已在黄瓜、西瓜、山药等作物得到广泛应用。
但是它们会因不同作物种类、不同生理指标、不同生长时期等所使用浓度不同,并且变幅比较大,甚至存在争议;其次,测定反映多效唑抗逆性生理指标的报道尽管很多,但都相对集中于单一效应分析,很少关注关联性分析和挖掘关键因子,这些结果可能给生产者造成一定的选择性困惑。例如,李创珍等[4]推荐用氯吡脲和400mg/L多效唑配施可增强山药植株抗性,但叶绿素、可溶性蛋白质、可溶性糖、脯氨酸、MDA、POD等物质在不同时期含量变化不一致,叶片可溶性糖含量变化与可溶性蛋白的相反,MDA含量表现先升高后降低再升高的趋势,其关联性没有分析,最佳浓度不好确定;覃芳等[5]认为,多效唑处理金槐不同生理指标有不同最佳使用浓度,叶绿素含量、过氧化物酶活性、过氧化氢酶等酶活性最佳浓度分别为375 mg/L、500 mg/L、750 mg/L时,浓度超过最佳浓度酶活性受抑制,没有确定关键因子,其综合推荐750 mg/L可能过于牵强;殷文涛等[6]研究表明,在西瓜子叶微展期用10 mg/L多效唑喷施,西瓜幼苗植株高度显著降低,茎粗度增加,叶片叶绿素含量显著提高,与上述推荐浓度相差很大。
综上所述,由于园艺作物对多效唑比较敏感,会因处理方法、处理浓度、发育时期、作物种类、管理措施和环境因子等影响因素不同而不同[3],各个生理指标彼此之间,既相对独立,又相互影响,生产上急需进行科学精准研究和综合分析。因此,本试验结合中国海南省南繁区气候特点,以当地主栽甜瓜耀珑品种为材料,采用多变量统计分析方法,综合解析多效唑作用对甜瓜幼苗抗性生理效应机制及其相互关系,旨在为南繁区解决热害问题提供理论参考。
1 材料与方法
1.1 供试材料
以‘耀珑’甜瓜品种为材料,它是当地主栽品种之一,由海南富友种苗股份有限公司提供,属中晚熟品种,叶色墨绿,果皮有网纹,瓜型中等,品质好,产量高。15%多效唑可湿性粉剂购自四川润尔科技有限公司。
1.2 试验方法
选取饱满、大小整齐一致的种子用3%中生菌素(四川金珠生态农业科技有限公司)1 000倍进行种子表面消毒1.5 h,用蒸馏水冲洗3遍,然后放在蒸馏水浸3" h,再用纱布包好放在30~" 32 ℃催芽。2021年12月6日在广西农业良种海南南繁育种基地大棚内于50孔穴苗盘上点播。在甜瓜幼苗子叶平展期(12月10日),喷施多效唑药液浓度梯度为:0.00(CK)、50.00、100.00、" 150.00、200.00、250.00" mg/L,按一次性喷施" 1 000 mL药液,田间常规管理。试验采用单因素完全随机区组设计,6个处理,每个处理3个重复,每个重复20株。
2022年1月3日,在甜瓜幼苗3叶1心(点播后27" d)采样,每重复随机选3株。采用酶联免疫吸附法(Infinite F50,ELISA检测试剂盒),测定MDA、SOD、谷胱甘肽、GR、CAT、POD、抗坏血酸、可溶性蛋白、APX、脯氨酸等10个生理指标(鲜样),氮素含量(干样)测定釆用奈氏比色法,磷素含量(干样)测定釆用钼锑抗吸光光度法,钾素含量(干样)测定采用原子吸收火焰光度法,叶绿素a、叶绿素b和总叶绿素等指标含量(鲜样)采用比色法,可溶性糖含量(鲜样)采用微量法。
1.3 数据处理
用WPS 2019、SPSS 27、Origin 2022等软件进行数据分析。
2 结果与分析
2.1 多效唑对幼苗形态的直观效应
表型观察表明,多效唑对幼苗植株形态直观影响显著(图1),随着多效唑浓度增加,节间变短,植株越来越矮,根系越变发达和粗壮,叶片肥厚而浓绿。但是,当浓度大于150.00 mg/L时(图1-D),叶片明显发生皱缩,表现药害症状。
2.2 叶绿素含量的变化
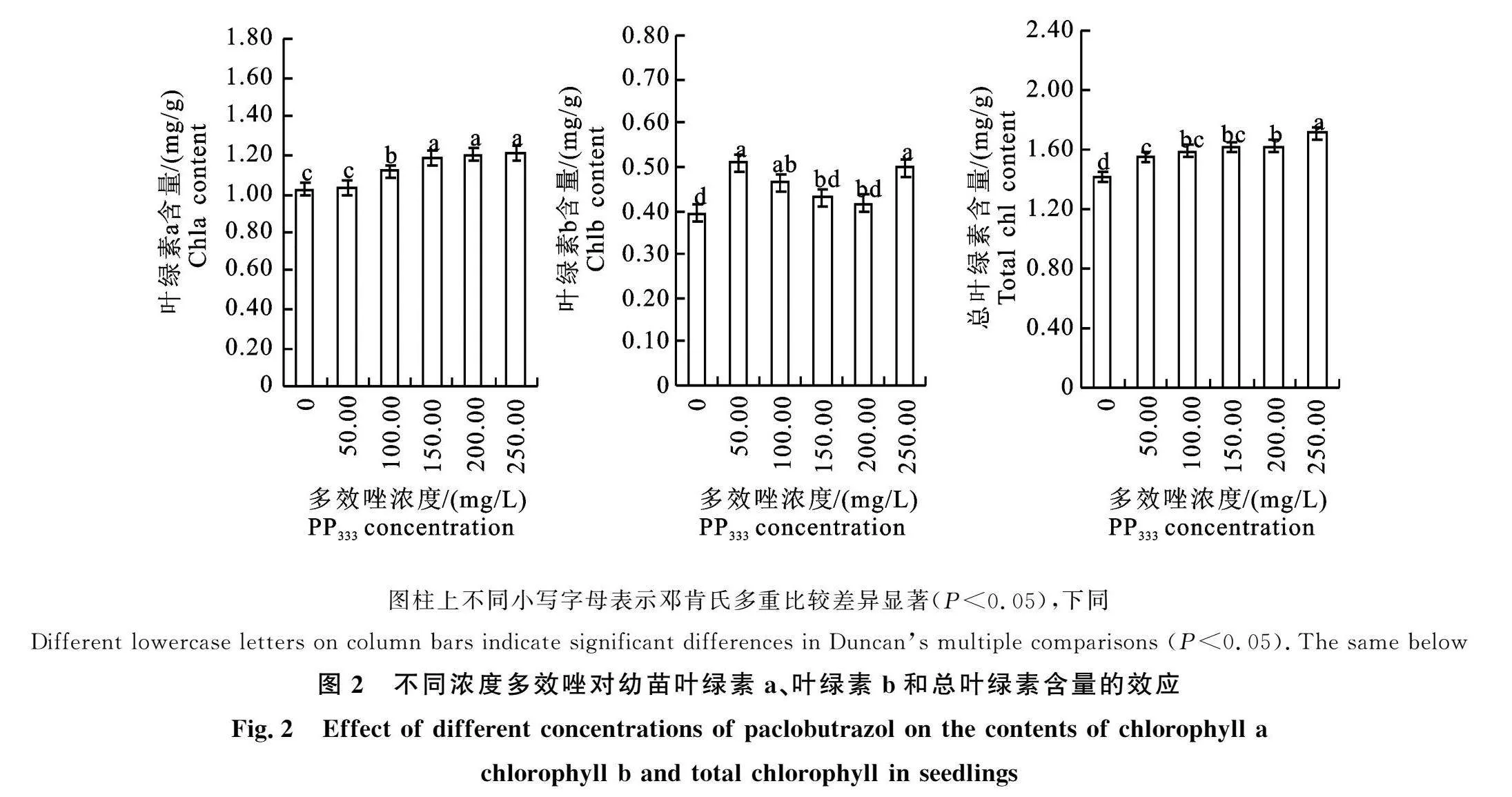
不同处理间叶绿素含量差异显著(图2),总叶绿素和叶绿素a随着多效唑浓度增大而增加,叶绿素b呈“升-峰-降-升”变化,说明三者受多效唑影响规律基本一致,总体呈上升趋势。各处理均比对照组高,叶绿素a和总叶绿素在" 100.00~250.00 mg/L浓度间差异显著,250 mg/L处理增幅最大,分别比对照增加" 18.63%(叶绿素a)、21.28%(总叶绿素);叶绿素b在" 50~100 mg/L及250 mg/L浓度间表现差异显著,50 mg/L处理增幅最大,比对照增加" 30.77%。以上说明,多效唑可提高甜瓜幼苗叶片叶绿素含量,增强光合速率,利于植株提高耐" 热性。
2.3 主要矿质营养物质含量的变化
不同处理组甜瓜幼苗氮、磷、钾等矿质营养物质含量差异显著(图3),随着处理浓度增加,氮、钾等含量呈“降-升-峰-降”变化,磷含量呈“升-峰-降”变化,三者均在低浓度处理区间含量提高,在高浓度区间下降,说明适宜浓度多效唑能够促进营养元素吸收,过高处理浓度影响根系营养吸收。与对照组比较,所有处理均表现差异显著,氮、钾含量比对照组低,磷比对照高,最大变幅分别表现为19.60%(TN)、升17.31%(TP)、降" 27.22%(TK),对应处理为100.00 mg/L、100.00 mg/L、150.00 mg/L,说明多效唑通过调控营养积累比例,协调根冠比关系。
2.4 相关代谢化合物质含量的变化
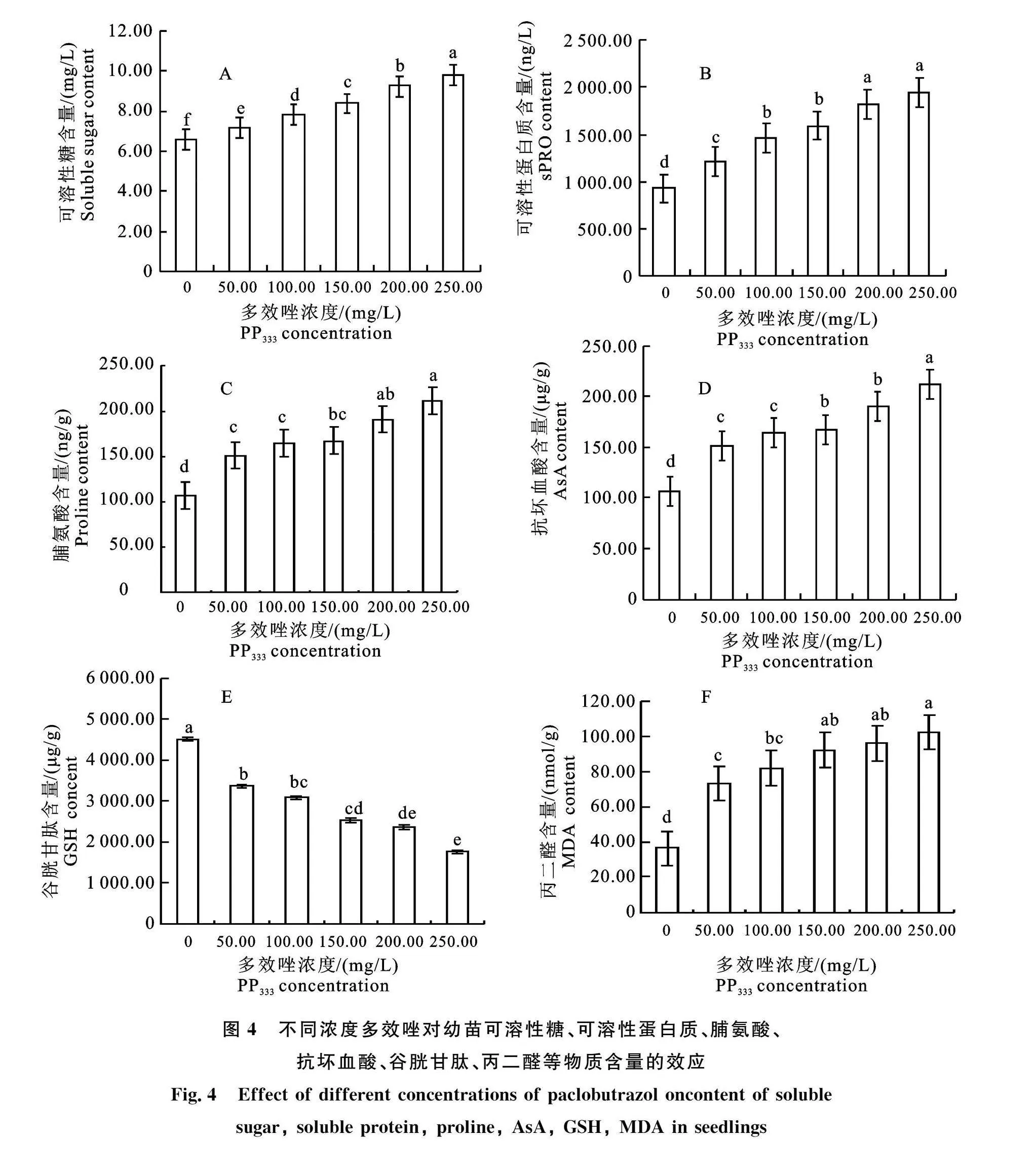
各处理组间相关代谢化合物质含量变化差异显著,可溶性糖、可溶性蛋白质、脯氨酸、AsA等指标随多效唑浓度增加而增加(图4-A~4-D);与对照比较,差异显著,最大增量分别为:33.0%(可溶性糖)、52.4%(可溶性蛋白质)、70.6%(AsA)、49.7%(脯氨酸),对应浓度均为250mg/L,说明多效唑能够增加抗性物质含量,从而提高幼苗" 抗性。
但是有害物质MDA也随多效唑处理浓度增加而增加(图4-F),比对照最大增幅64.5%,而GSH含量下降(图4-E),最大降幅60.1%,说明GSH对多效唑浓度比较敏感,随多效唑浓度增加,幼苗的生长抑制胁迫压力增大,MDA含量增加,保护物质GSH合成可能受阻,含量下降。
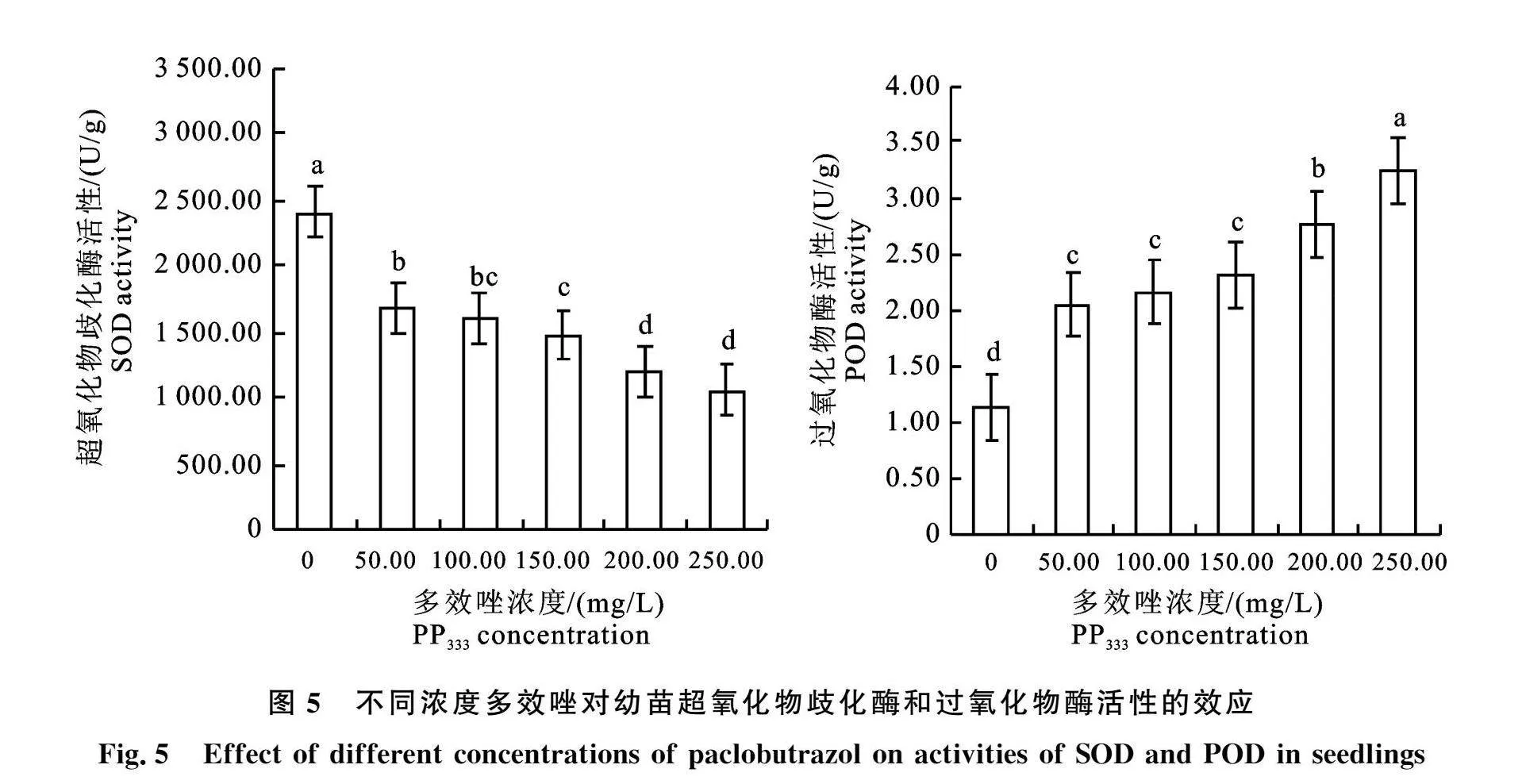
2.5 保护酶活性变化
处理间差异显著(图5,图6),与对照相比,GR、POD、APX最大增幅分别为69.3%、" 185.3%、93.7%,SOD、CAT最大降幅分别为56.1%、" 53.9%,它们最大变幅对应的浓度均为250mg/L。
保护酶活性变化分两类,一类为GR、POD、APX,活性随着多效唑处理浓度增加而增加,利于提高幼苗抗性;另一类为SOD、CAT,它们活性随着处理浓度增加而降低,酶活性受抑制,可能与多效唑抑制压力增大或发挥作用延后有关。
2.6 各生理指标的相关性分析
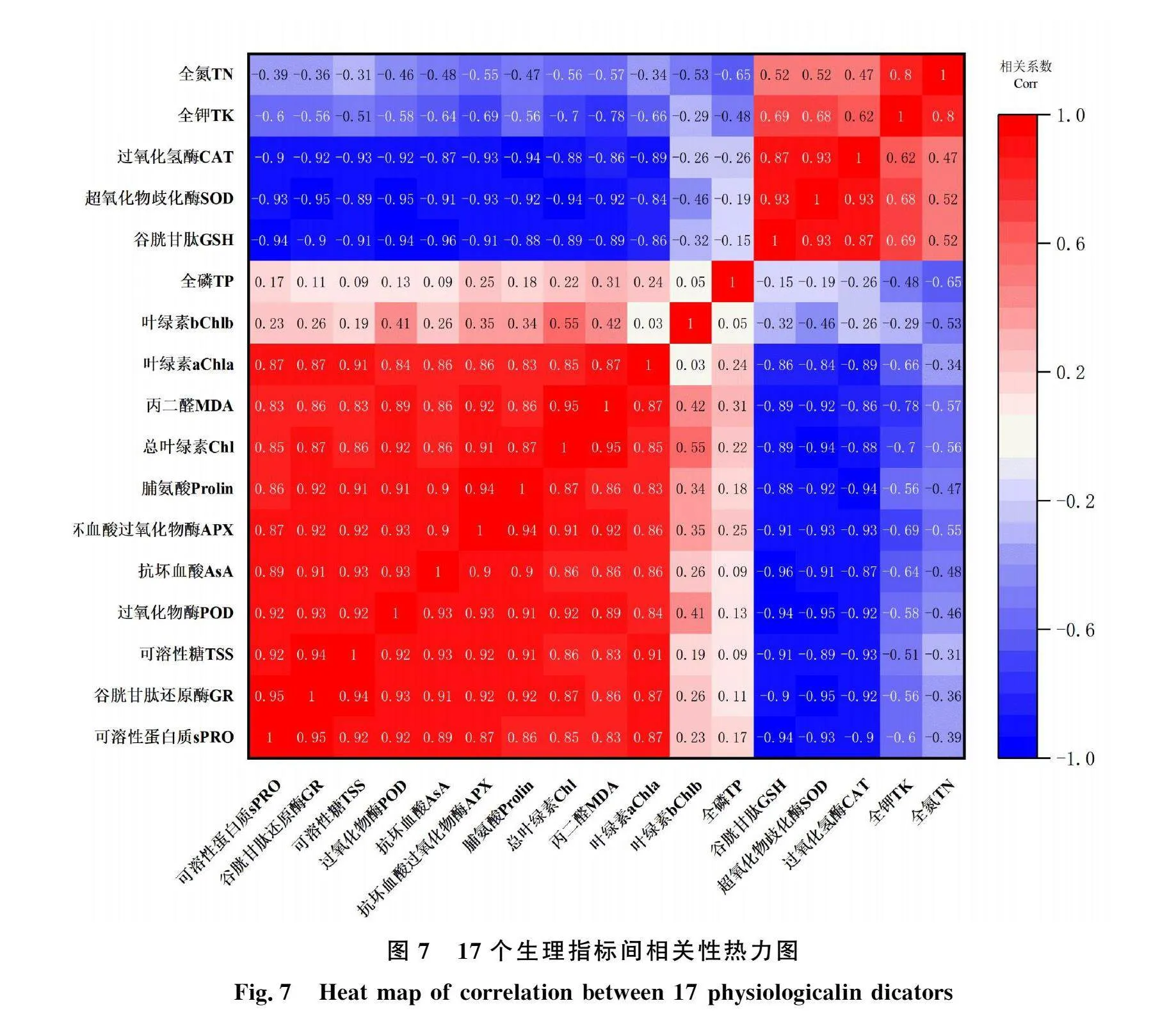
采用SPSS 27软件进行相关分析,再用Origin 2022软件作热图,结果表明(图7),红色区域(Corr:0.0~1.0)占面积最大,说明在多效唑作用下,各抗性指标间多数为正相关。其中,可溶性糖与可溶性蛋白质、GR、POD、AsA、APX、脯氨酸、总叶绿素、MDA、叶绿素a等10个指标为显著正相关,可溶性糖与它们之间可能存在协同作用;MDA与全钾、全氮、GSH、SOD、CAT等为显著负相关,它们对活性氧可能具有清除作用。
2.7 各生理指标的聚类分析
采用Origin 2022软件对生理指标进行R型聚类分析表明,在殴式距离1.3~1.5处对应有两条谱线(图8),将指标聚类成2个类型,说明同类指标间存在一定的协同互作性或遗传相似性,同类间彼此呈正相关(图7)。其中,可溶性糖与可溶性蛋白质、GR、POD、AsA、APX、脯氨酸、总叶绿素、MDA、叶绿素a、叶绿素b、全磷等12个指标聚成一类,占70.59%,它们随着多效唑增加而增加,说明多效唑对抗性生理效应以正向效应为主;GSH、SOD、CAT、全钾、全氮等5个指标聚成一类,占29.41%。
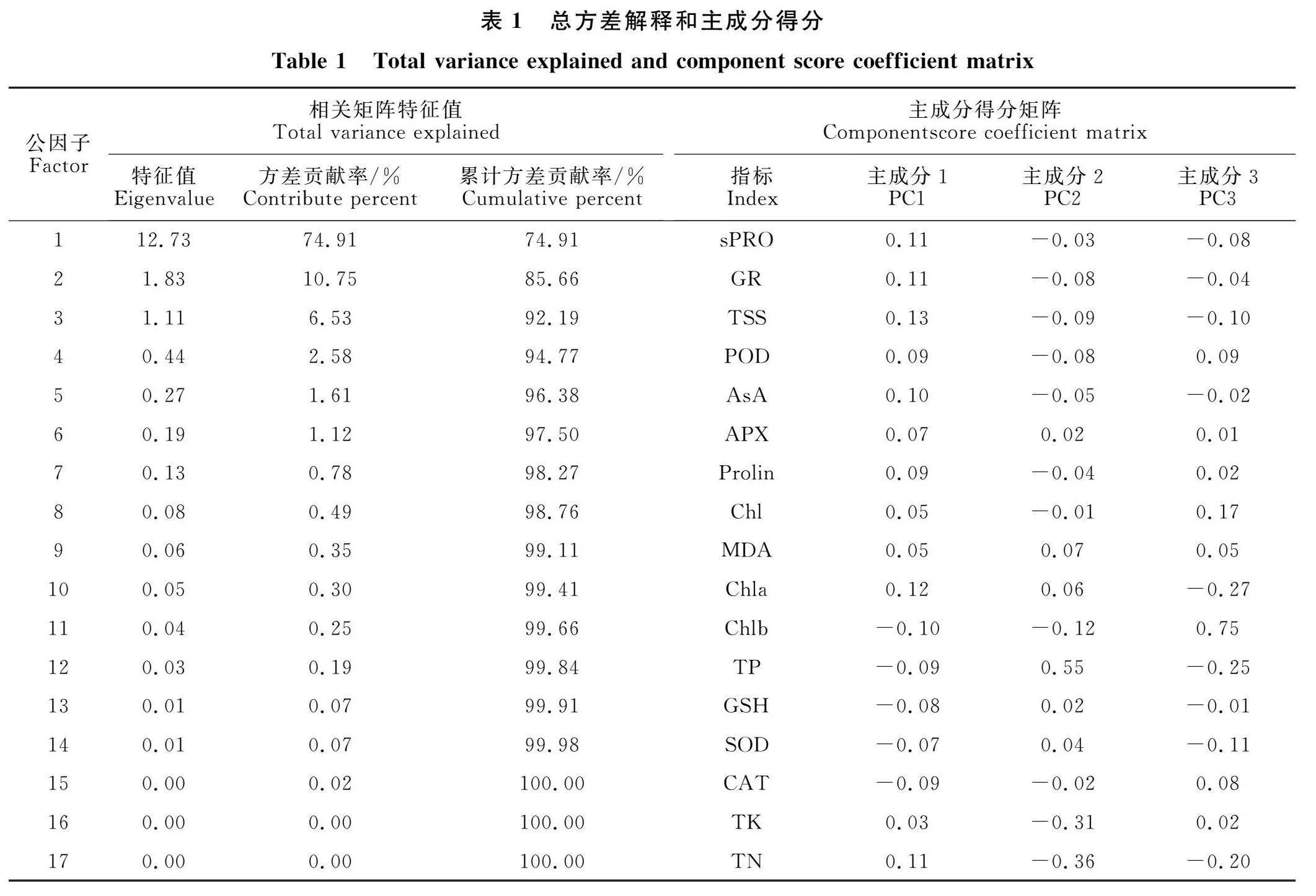
2.8 各生理指标的主成分分析
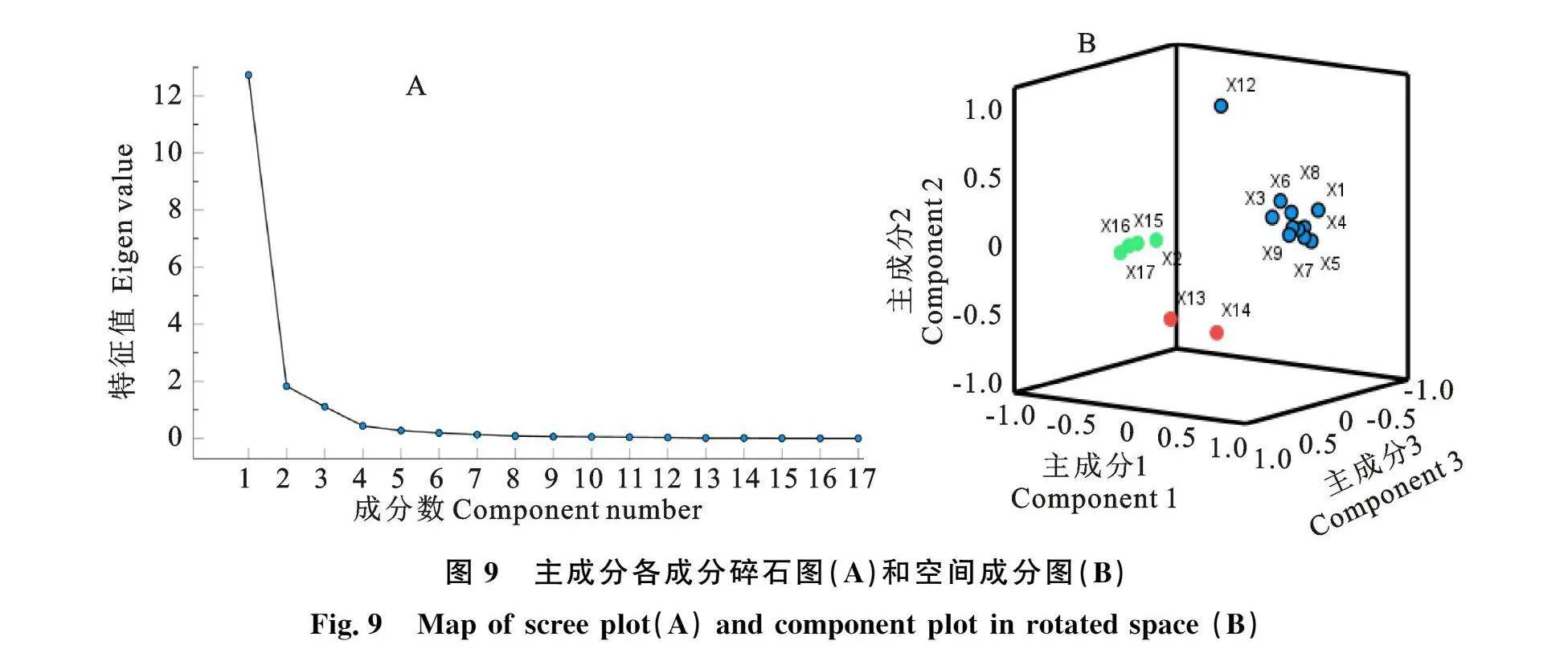
为充分了解不同生理指标间的主次关系,揭示多效唑提高甜瓜幼苗的决定因子。主成分分析表明(表1),依特征值大于1、碎石图坡度平缓度(图9-A)及包含信息量大于70%等提取原则,原来测定17个抗性生理指标反映的信息,可由3个主成分(15.6个变量)反映92.16%信息。从空间成分图(图9-B)可知,可溶性蛋白质、GR、可溶性糖、POD、AsA、APX、脯氨酸、总叶绿素、MDA、叶绿素a等10个指标距离较近。同理,磷单独为一组,叶绿素b、GSH、SOD、CAT、钾、氮为一组。
从表1变量载荷分值可知,第1主成分中,可溶性糖载荷分值最大(0.13),其次可溶性蛋白质、GR、抗坏血酸、脯氨酸等代谢物得分也较大,命名为功能性物质代谢,占总信息量74.91%,说明多效唑对甜瓜幼苗生理的影响以增强幼苗功能性生理代谢为主,其中可溶性糖在抗性中起主效作用,作为判断抗性大小的关键指标;第2主成分中,氮、磷、钾得分较大,均为营养元素,命名为营养物质代谢,占总变量信息量10.75%,当中以磷分值最大(0.55),说明多效唑调节营养吸收以磷为主导;同理,第3主成分叶绿素a、叶绿素b、总叶绿素等得分较大,与植株光合作用有关,命名光合作用,占总变量信息量6.53%,关键因子为叶绿素b。可见,多效唑对幼苗甜瓜产生一系列复杂生理影响,多指标相互作用,共同提高幼苗抗逆性,但主要集中于功能性物质代谢、营养物质代谢、光合作用等三方面功能效应,它们分别以可溶性糖、磷、叶绿素b为决定因子。
3 结论与讨论
植物经多效唑处理后,除了发生形态结构直接变化和植株变矮外,还会引起植物体内一系列复杂的生理生化变化。本研究发现,尽管不同浓度多效唑对甜瓜幼苗17个生理指标影响均表现显著差异,但通过主成分分析可提取出功能性物质代谢、营养物质代谢、光合作用等三个公因子,分别占17个指标信息量的74.91%、10.75%、" 6.53%,物质代谢占权重较大,并且代谢中可溶性糖载荷分值最大(0.13),说明多效唑对甜瓜幼苗代谢生理效应是复杂多样的,但以可溶性糖为主效应,推测它可能是多效唑提高甜瓜幼苗抗逆性的决定因子,可作为判断甜瓜幼苗抗逆性强弱关键性指标。这与黄宝华等[7]采用转录组研究结果相一致,它认为朱顶红经多效唑处理后,在KEGG功能分类中代谢占比最大,达60%以上,代谢中前2位的为全局和总览图、碳水化合物代谢,进一步从分子水平上验证了本研究的推测。这可能是由于糖代谢是高等植物的主要代谢之一,可溶性糖不仅是高等植物主要光合产物,也是碳水化合物代谢和暂时贮藏的主要形式,在植物代谢中占有重要位置[8]。骆桂芬等[9]研究表明,黄瓜等作物中可溶性糖的含量与抗逆性呈正相关,植株体内含糖量越高,抗逆性越强,它们是诱导抗性机制的一部分,也与本研究推测一致。
多效唑诱导作物获得抗性是多生理相互作用共同结果。大量研究表明[2-3,10-14],多效唑处理作物后,可增加植物体内可溶性蛋白、可溶性糖、抗坏血酸、脯氨酸、GSH、叶绿素等物质含量,提高POD、APX、GR等酶活性,与本研究结果一致,说明多效唑确实能够改善植物一系列的生理生化环境,利于提高植株对外界高温、干旱等不良环境的抵御能力。但是,多效唑提高甜瓜幼苗抗逆性不是单一指标孤立作用。本研究通过相关分析和聚类分析发现,可溶性糖与可溶性蛋白质、GR、POD、AsA、APX、脯氨酸、总叶绿、MDA、叶绿a等10个指标之间为显著正相关,可溶性糖与可溶性蛋白质、GR、POD、AsA、APX、脯氨酸、总叶绿、MDA、叶绿a、叶绿b、全磷等12个指标聚成一类,进一步说明多效唑提高甜瓜幼苗抗逆性,主要以可溶性糖为主导的多个生理指标共同协作所致,在生产上应加以协调,综合利用。
本研究发现,随着多效唑浓度增加,SOD和CAT活性降低,MDA含量增加,浓度超过150 mg/L时,甜瓜幼苗外观表现药害症状,说明浓度超过一定界限,一些酶活性就会受到抑制,这与李创珍等[4]、覃芳等[5]研究结果基本一致。因为保护酶对膜系统的保护作用是有一定限度,如果植物体内活性氧代谢系统平衡被打破,就会破坏或降低活性氧清除剂的活性,细胞膜受损[15],而且多效唑与缩节胺(DPC)相似,它们作为一种植物生长延缓剂,处理浓度越大,对作物机体的胁迫程度越大,机体本身的损害越大[15]。同时,高温、强光、紫外辐射等环境胁迫可能引起植物体内ROS的大量增加[16],这种胁迫可能会引起SOD、CAT等酶蛋白变性失活或生物合成受阻[17]。但有趣的是,过去人们往往认为ROS总是有害的,而现在一致的观点认为植株体内维持适量活性氧浓度对于植物生长发育的维持又必不可少,许多研究发现植物很多生理过程需要ROS参与,它在植物生长发育、代谢调节、胁迫信号传递、防御反应等许多方面发挥重要的积极作用[16,18]。一方面,它不但对病原菌有毒杀、提高寄主细胞壁木质化、生长发育、成花诱导、细胞程序性死亡(programmed cell death,PCD)、种子萌发、生物与非生物胁迫(环境胁迫)等有重要作用[18-19];另一方面也可作为信号分子,调节细胞内病程相关蛋白基因和耐热性关键" MBF1c基因的表达,诱导植株抗病性和耐热性[19-20]。因此,推测多效唑作用下维持植物体内较高MDA水平,对植株提高抗病、耐热性等有益。
氮、磷、钾元素是作物生长过程中必不可少的矿质营养元素,有关多效唑影响植株氮、磷、钾含量变化报道较少,且结果不一致。多效唑可以增加水稻、芒果等作物叶片中的氮、钾和磷等营养元素含量[3,21];但也有人认为多效唑对植株的氮、钾同化有一定的抑制作用,降低小麦、桃树等作物叶片中的氮和钾元素含量[22-23]。本研究表明,随着使用浓度增加,氮、磷、钾元素变化整体呈“降-升-降”变化,低浓度多效唑利于营养元素吸收,以及调节营养元素积累配比,促进植株地下根系生长,协调根冠比,增强植株生理活性[3]。反之,随着多效唑浓度增加,抑制GA合成增强[2],植株生长过度受阻,不利于氮、钾营养元素吸收。前人通过补充氮肥、钾肥,可以恢复被高浓度多效唑矮化后植株的高度[2 24-25],进一步证实高浓度多效唑抑制氮、钾的吸收。由此说明多效唑对氮、磷、钾等营养元素吸收的影响,与使用浓度有关。
综上,多效唑提高甜瓜幼苗抗逆性是多个生理变化共同调控的结果,主要表现在功能性物质代谢、营养代谢、光合作用等三方面效应,可溶性糖可作为判断甜瓜幼苗抗逆性强弱决定性指标。但是,多效唑作为一种植物生长延缓剂,它提高抗性是以牺牲植株正常生长为代价,浓度超过150 mg/L表现药害,建议以50~150 mg/L浓度处理为佳。
本研究仅从生理层面作了推测分析,有待今后从基因组、蛋白组、代谢组等更深层次去验证,以进一步明确多效唑提高植株抗性的分子机制。
参考文献 Reference:
[1] 杨小锋,范 荣,王学林.2014-2015年海南三亚厚皮甜瓜品种比较试验[J].中国瓜菜,2016,29(3):32-35.
[2]韩德复.多效唑的生理作用及作用机理[J].长春师院学报(自然科版),1996(2):37-39.
[3]隋艳晖,张 剑.多效唑及其在花卉上的应用[J].北京农业职业学院学报,2006,20(2):22-26.
[4]李创珍,王军民,徐 晶,等.氯吡脲和多效唑配施对山药叶片一些生理特性的影响[J].南方农业学报,2012,43(12):1952-1957.
[5]覃 芳,张俊杰,史艳财,等.叶面喷施多效唑对金槐生长及生理的影响[J].湖北农业科学,202 60(15):96-100,106.
[6]殷文涛,陈海文,黄 远,等.不同浓度多效唑处理对西瓜幼苗生长和生理的影响[J].中国瓜菜,2016,29(11):41-45.
[7]黄宝华,许小琼,陈晓慧,等.多效唑影响朱顶红植株生长的转录组分析[J].热带作物学报,2022,43(1):185-195.
[8]宋成钰.多效唑对蓖麻干物质积累与籽粒灌浆的影响[D].江苏扬州:扬州大学,2019.
[9]骆桂芬,崔俊涛,张 莉,等.黄瓜叶片中糖和木质素含量与霜霉病诱导抗性的关系[J].植物病理学报,1997,27(1):65-69.
[10] MORENO D,BERLIF F J,PICCOOLI P N,et al.Gibberellins and abscisic acid promote carbon allocation in roots and berries of grapevines[J].Journal of Plant Growth Regulation,201 30(2):220-228.
[11]SHARMA D K,DUBERY A K,SRVASTAV M,et al.Effect of putrescine and paclobutrazol on growth,physiochemical parameters,and nutrient acquisition of salt-sensitive citrus rootstock kama khatta(Citrus kama Raf.)under NaCl" stress[J].Journal of Plant Growth Regulation,201 30(3):301-311.
[12]ZHOU Z,MA H,LIANG K,et al.Improved tolerance of teak(Tectona grandis L.f.)seedlings to low-temperature stress by the combined effect of arbuscular mycorrhiza and paclobutrazol[J].Journal of Plant Growth Regulation,2012,31(3):427-435.
[13]SRIVA M,KISHOR A,DAHUJA A,et al.Effect of paclobutrazol and salinity on ion leakage,prolrne content and activities of antioxidant enzymes in mango(Mangifera indica L.)[J].Scientia Horticulturae,2010,125(4):785-788.
[14]魏 莹.苦瓜砧木嫁接缓解高温胁迫下幼苗光抑制和氧化胁迫的机理[D].南京:南京农业大学,2019.
[15]周运刚,王俊刚,马天文,等.不同DPC(缩节胺)处理对棉花生理生化特性的影响[J].新疆农业科学,2010,47(6):1142-1146.
[16]束德峰.温度胁迫下番茄叶绿体谷胱甘肽还原酶基因的克隆、表达和功能分析[D].山东泰安:山东农业大学,2011.
[17]潘瑞炽,豆志杰,叶庆生.茉莉酸甲脂对水分胁迫下花生幼苗SOD活性和膜脂过氧化作用的影响[J].植物生理学报,1995,21(3):221 -228.
[18]杨雪琴.莴苣活性氧代谢相关基因在种子萌发中的功能分析[D].广州:华南农业大学,2020.
[19]郑家瑞,李云洲.植物诱导抗性研究进展[J].山地农业生物学报,2022,41(2):51-58.
[20]邹丽芳.芥蓝" MBF1c调控的耐热性分子生物学基础[D].广州:华南农业大学,2019.
[21]KISHOR A,SRTSTAV M,DUBEY A K,et al.Paclobutrazol minimises the effects of salt stress in mango(Mangifera indica L.)[J].Journal of Horticultural Science amp; Biotechnology,2009,84(4):459-465.
[22]邵庆勤.叶面喷施多效唑提高小麦抗倒伏能力的生理机理研究[D].南京:南京农业大学,2017.
[23]赵宗方,凌裕平,吴小骏,等.多效唑对桃树生长发育和叶片矿质元素含量的影响[J].江苏农学院学报,1998," 19(1):28,40.
[24]孙梦瑄.多效唑、比久、烯效唑、矮壮素对甜瓜幼苗的影响[D].乌鲁木齐:新疆农业大学,2015.
[25]吴光南,张金渝,汤日圣.多效唑对作物的生理效应和应用[J].作物杂志,1991(1):25-27.
Effect of" Paclobutrazol on Stress Resistance Physiology of Melon Seedlings Based on Multivariate Analysis
LIANG Renfan,FU Zhixin,ZHOU Peng,LIN Xu and SU Yicheng
(Guangxi Academy of Agricultural Sciences,Nanning 530007,China)
Abstract This study analyzed thephysiological resistance effects of paclobutrazol (PP333) on the melon seedlings and their interrelationships using multivariate statistical methods.The results indicate that paclobutrazol treatment significantly increased the content of soluble sugar(TSS), soluble protein(sPRO), ascorbic acid (AsA), proline, total chlorophyll(Chl) and chlorophyll a(Chla). It also significantly increased the activities of glutathione reductase(GR),peroxidase(POD) and ascorbic acid peroxidase(APX) etc. Malondialdehyde (MDA) was negatively correlated with total potassium (TK,R=-0.78),total nitrogen (TN,R=-0.57),glutathione (GSH,R=-0.89), superoxide dismutase (SOD, R=-0.92),catalase (CAT, R=-0.86),etc. All resistance indexes could be clustered into 2 groups, accounting for 70.59% and 29.41% respectively.There was a positive correlation between indicators of the same kind;three common factors could be extracted from 17 physiological indicators, and were respectively named: functional substance metabolism,nutrient metabolism,photosynthesis. They accounted for 74.91%,10.75% and 6.53% of the total information.The corresponding key indicators were soluble sugar, phosphorus, chlorophyll b.Thus it can be seen that paclobutrazol can improve the stress resistance of melon seedlings. A concentration of 50-150 mg/L is the best treatment, which is mainly manifested in the functional effects of functional substance metabolism,nutrient metabolism and photosynthesis. Soluble sugar is a decisive indicator for measuring the stress resistance of melon seedlings treated with paclobutrazol.
Key words Paclobutrazol;Melon;Multivariable analysis;Resistance physiology
Received" 2023-06-15 Returned 2023-10-02
Foundation item Guangxi Science and Technology Plan(No.Gk-AD1828195); Special Projects for Basic Research of Guangxi Academy of Agricultural Sciences (No.GNK-2021YT169,No.GNK-2018YT35,No.GNK-2016YM10, No.GNK-2017JZ35).
First author LIANG Renfan, male,Ph.D, associate research fellow. Research area:on-site transformation of science and technology achievements. E-mail:348006717@qq.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

