结缕草属种质资源EST-SSR遗传多样性分析






摘要:本研究以43份不同来源的结缕草属种质为材料,利用表达序列标签-简单重复序列(Expressed Sequence Tag-Simple sequence repeat,EST-SSR)引物对其进行遗传多样性分析。结果表明:从125对EST-SSR引物中筛选出30对能稳定扩增、条带清晰的引物;共检测到124个标记,平均每对引物检测到4个,多态性标记有108个,多态性位点百分率为88.60%;种质间遗传相似性系数为0.530~0.864,平均为0.711;共检测到104个观察等位基因,平均每对引物检测到3个;有效等位基因数范围为0~5,平均为3;Shannon信息指数变化范围为0~1.593,平均为0.940。Nei’s基因多样性指数范围为0~0.793,平均为0.541;在遗传相似性系数为0.800时,利用非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)法将43份种质划分为4个类群,聚类结果与种质地理位置有一定的关联,但联系不紧密。本研究结果表明43份种质的遗传多样性处于上等水平,EST-SSR标记能有效地评价结缕草属种质的遗传差异,为结缕草属种质资源的鉴定评价及分子标记辅助育种提供参考依据。
关键词:结缕草属;EST-SSR;分子标记;遗传多样性;群体结构
中图分类号:S543""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2386-08
Genetic Diversity Analysis of Zoysia willd. Accessions by EST-SSR Markers
HUANG Chun-qiong1, HE Xiao1,2, LUO Li-juan2*, DONG Rong-shu1, LIU Guo-dao1
(1. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Crop
Gene Resources and Germplasm Enhancement in Southern China, Ministry of Agriculture and Rural Affairs, Haikouu,
Hainan Province 571101, China; 2. College of Tropical Crops Hainan University, Haikou, Hainan Province 570228, China)
Abstract:In the present study,43 Zoysia willd. accessions from different sources were used to detect the genetic diversity using Expressed sequence tag-simple sequence repeat(EST-SSR)primers. The results showed that 30 pairs of primer from the original 125 pairs of primer were selected based on the polymorphic,clear and reproducible bands amplified by them. A total of 124 bands were amplified by 30 primer pairs from 43 accessions with 4 bands per primer pairs,and 108 (88.60%) out of them were polymorphic. The genetic similarity coeffcients (GSC) among the 43 accessions ranged from 0.530 to 0.864 with an average of 0.711. A total of 104 observing alleles were amplified by 30 pairs of primer from 43 accessions with 3 observed alleles per pairs of primer. The range of effective number of alleles was 0 to 5 with an average of 3. The range of shannon information index was 0~1.593 with an average of 0.940. The Nei’s genetic diversity index was 0~0.793 with an average of 0.541. Cluster analysis conducted by the unweighted pair-group method with arithmetic averages (UPGMA) separated the 43 accessions into 4 groups when the genetics similarity coefficient was 0.800. The clustering results were somewhat correlated with the geographical location of the accessions,but not closely related. The results indicated that the genetic diversity of Zoysia willd. accessions was rich,which laid a foundation for the identification and evaluation of Zoysia willd. accessions and molecular marker-assisted breeding.
Key words:Zoysia willd;EST-SSR;Molecular makers;Geneic diversity;Population structure
结缕草属(Zoysia Willd.)系禾本科(Gramineae)画眉草亚科(Chloridoideae)的多年生草本,有匍匐根茎,是一种优良的暖季型草坪草,部分种还可以作为牧草[1-2];能适应各种类型的土壤,有较强的抗逆性,耐粗放管理,广泛应用于小区及公园绿化、各种类型的运动场草坪、休憩草坪及保土草坪等的建植[3-4]。结缕草属植物通常可分为16个种,多个变种以及变型。中国分布着5个种,2个变种以及1个变型[5-8]。中国拥有丰富的缕草属种质资源,分布地域广泛,对其进行遗传多样性研究,有助于探究其起源与进化关系,同时为良种选育、资源保护等提供基础材料。
植物种质资源遗传多样性的评价可以利用表型性状或分子标记技术等手段。表型性状一般具有不稳定性,容易受到外界环境的干扰,从而导致评价结果不准确;而分子标记技术是从分子水平上研究种质资源的遗传差异情况,受外界环境的干扰较小,分析结果稳定[9]。分子标记技术在草坪植物种质资源评价研究中有比较广泛的应用,也被应用在结缕草属植物种质资源亲缘关系鉴定、遗传多样研究、指纹图谱构建等研究中。Yaneshita等[10] 利用限制片段长度多态性(Restriction fragment length polymorphism,RFLP)技术分析了来自日本的17份结缕草种质的遗传变异情况。Choi等[11]和Weng等[12]利用随机扩增多态性DNA(Random amplified polymorphic DNA,RAPD)标记分别对来自韩国西南沿海地区的68份和来自台湾的131份结缕草属植物种质资源进行了遗传多样性研究。Cai等[13]利用扩增片段长度多态性(Amplified restriction fragment polymorphism,AFLP)标记构建了78份结缕草种质资源的遗传连锁图谱。Cai等[14]开发了结缕草属种质资源的1044个简单序列重复(Simple sequence repeats,SSR)标记。
表达序列标签-简单重复序列(Expressed sequence tag-Simple sequence repeat,EST-SSR)是基于表达序列标签开发的一种微卫星分子标记,与基因组SSR标记相比具有突出的优越性[15-19]。EST-SSR标记是一类功能标记,在同科不同属或同属不同种间具有良好的通用性。Yan等[20]利用EST-SSR标记的18对引物对75份鸭茅(Dactylis glomerata L.)种质资源进行了遗传多样性评价。赵岩等[21]利用58对来自小麦(Triticum aestivum L.)、大麦(Hordeum vulgare L.)、玉米(Zea mays L.)、高粱[Sorghum bicolor (L.) Moench]、水稻(Oryza sativa L.)的EST-SSR引物对结缕草属植物种质资源进行了分子系统发育分析。基于EST-SSR标记的许多优良特性,为了解不同地理来源的结缕草属不同种间及同种不同种质间的遗传多样性及亲缘关系,本研究利用EST-SSR标记对43份结缕草属植物种质的遗传多样性和群体结构进行了系统分析,通过遗传相似系数进行聚类分析,以期对43份种质的遗传差异进行研究,为结缕草属种质评价及新品种选育工作提供参考。
1 材料与方法
1.1 试验材料
试验材料种植于海南省儋州市中国热带农业科学院热带作物品种资源研究所草业研究中心草坪草种质资源圃,43份结缕草属种质包括沟叶结缕草15份(海南11份,广东1份,福建2份,斯里兰卡1份)、细叶结缕草1份(广东深圳)、结缕草27份(海南4份、山东14份、广东1份、福建1份、江苏3份、浙江2份、上海1份、安徽1份)。具体来源见表1。
1.2 试验方法
1.2.1 基因组DNA的提取及检测 以43份结缕草属种质为材料,选取健康幼嫩叶片提取DNA。具体提取方法参照Huang等[22]的试验方法进行,将提取的DNA浓度稀释到约50 ng·μL-1,置于-20℃冰箱中保存备用。
1.2.2 EST-SSR标记分析 引物参考Zhang等[23]、Brian等[24]、Terry等[25]的研究结果,选取EST-SSR引物共125对,由金斯瑞生物科技公司合成。选择来源不同的6份结缕草属种质(海南乐东的4号、山东青岛的9号、山东青岛31号、福建同安的37号、浙江仙居的40号、上海金山的42号),对125对引物进行筛选,筛选出重复性较好、条带清晰的引物,用于后续评价43份结缕草属种质资源的遗传多样性。
EST-SSR PCR反应体系总体积为20 μL,包括10 μL 2×Easy Taq PCR Supermix(北京全式金生物),0.5 μmol·L-1正向引物、0.5 μmol·L-1反向引物、2 μL样品DNA、6 μL无菌水。扩增程序参考崔蓉菁[26]的试验方法进行。PCR扩增产物用8%聚丙烯酰胺凝胶电泳检测,电泳完成后,利用AgNO3染色、NaOH和甲醛显色,最后拍照记录。
1.3 数据统计与分析
统计清晰稳定的电泳条带,同一位置有扩增条带的记为1,无扩增条带记为0,建立分子数据库,用于条带多态性分析和聚类分析。利用Popgen 32计算每对引物的观察等位基因(Na)、有效等位基因(Ne)、Shannon信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、Nei基因多样性指数(H)等遗传多样性参数。采用NTSYS-pc2.1计算遗传相似性系数,并进行UPGMA聚类分析。利用Sturcture 2.3.4软件进行遗传结构分析,综合结果作出群体结构分析图。
2 结果与分析
2.1 结缕草属种质EST-SSR引物的筛选
选取地理位置相隔较远的6份结缕草属种质,包括4号(海南乐东)、9号(山东青岛)、31号(山东青岛)、37号(福建同安)、40号(浙江仙居)、42号(上海金山)对125对引物进行筛选,最终筛选出了30对条带清晰、多态性好、主带明显的EST-SSR引物。
2.2 结缕草属种质EST-SSR扩增多态性分析
利用筛选出来的30对EST-SSR引物对43份结缕草属种质DNA进行扩增,共获得124条条带,其中多态性条带108条,多态性条带比例为88.60%(表2),引物扩增条带范围为1~8条,平均为4条。其中,编号ES-091引物扩增的条带最多,为8条,多态性条带比例最高的引物有17对(ES-001,ES-003,ES-007,ES-009,ES-013,ES-034,ES-043,ES-047,ES-049,ES-056,ES-057,ES-058,ES-066,ES-089,ES-092,ES-097,ES-100)均为100%,多态性条带比例最低的引物有2对(ES-021,ES-080),均为50%。
2.3 结缕草属种质EST-SSR群体遗传多样性分析
利用筛选出的30对EST-SSR引物对43份结缕草属种质的DNA进行EST-SSR的PCR扩增(表3),30对引物共扩增出了104个观察等位基因,观察等位基因数变化范围为1~6个,平均为3个,其中引物ES-012扩增出的观察等位基因数最多,为6个;引物ES-013及ES-043扩增出的观察等位基因最少,均为1个。有效等位基因数变化范围为0~5个,平均为3个,其中引物ES-034扩增出的有效等位基因数最多,为5个;引物ES-007,ES-013,ES-043,ES-006扩增出的有效等位基因数最少,均为1个。Shannon信息指数变化范围为0~1.593,平均为0.940,其中Shannon信息指数最大的是引物是ES-034,这说明ES-034具有很高的多态性检测效率;Shannon信息指数最小的引物是ES-013,ES-043。观测杂合度的变化范围在0~1,平均为0.201,其中引物ES-006,ES-009,ES-012,ES-047,ES-079,ES-080,ES-091,ES-013的观测杂合度最小,为0;引物ES-013,ES-043的观测杂合度最大,为1。期望杂合度的变化范围为0~0.804,平均为0.547,其中ES-034的期望杂合度最大,为0.804;ES-013,ES-043的期望杂合度最小,为0。Nei’s基因多样性指数范围为0~0.793,平均为0.541,Nei’s基因多样性指数最大的引物为ES-034,为0.793;Nei’s基因多样性指数最小的引物为ES-043,为0。
2.4 遗传相似性系数分析
根据30对EST-SSR引物的多态性条带,通过NTSYS-pc2.1 软件计算出43份结缕草属种质间的遗传相似性系数,得到遗传相似性系数矩阵。从遗传相似性系数矩阵可以计算出种质间的遗传相似系数范围为0.530~0.864,平均为0.711。19号(山东临忻)结缕草和的20号(江苏南京)结缕草的遗传相似系数最大(0.864),表明这两份种质间的亲缘关系最近;而4号(海南乐东)结缕草和36号(广东梅州)结缕草遗传相似系数最小(0.530),表明这两份种质间的亲缘关系最远。
2.5 聚类分析
对43份结缕草属种质的EST-SSR分子标记结果进行统计,并进行UPGMA聚类分析(图1),在遗传相似性系数为0.800时,分为4个类群。其中第Ⅰ类群包括28份种质,有结缕草18份(9份来自山东,1份来自安徽,3份来自江苏,4份来自海南,1份来自福建)和沟叶结缕草10份(8份来自海南,1份来自广东,1份来自斯里兰卡),来自山东临沂的19号结缕草和来自江苏南京的20号结缕草亲缘关系最近,来自福建泉州的3号结缕草与其他27份种质亲缘关系较远。第Ⅱ类包括13份种质,其中结缕草7份(山东5份,广东1份,浙江1份),沟叶结缕草5份(海南3份,福建2份),细叶结缕草1份(广东),来自海南万宁的41号沟叶结缕草与其他12份种质亲缘关系较远,来自山东青岛的32号结缕草种质与来自海南琼中的沟叶结缕草33号种质亲缘关系较近。第Ⅲ类包括来自浙江开化的24号结缕草1份种质,第Ⅳ类群只有来自上海金山的42号结缕草1份种质。
2.6 群体结构分析
为了进一步了解供试材料的遗传组成,以EST-SSR标记数据为基础,使用Structure 2.3.4软件分析43份结缕草属种质的遗传结构,设置K值为1~10,引入ΔK值来确定最佳K值,绘制ΔK值随着K值增大的变化曲线图(图2)。如图2所示,当K=2时,ΔK值最大,所以将43份材料划分为2个类群。43份结缕草属材料群体结构分析如图3所示,43份材料明显分为2大类群。
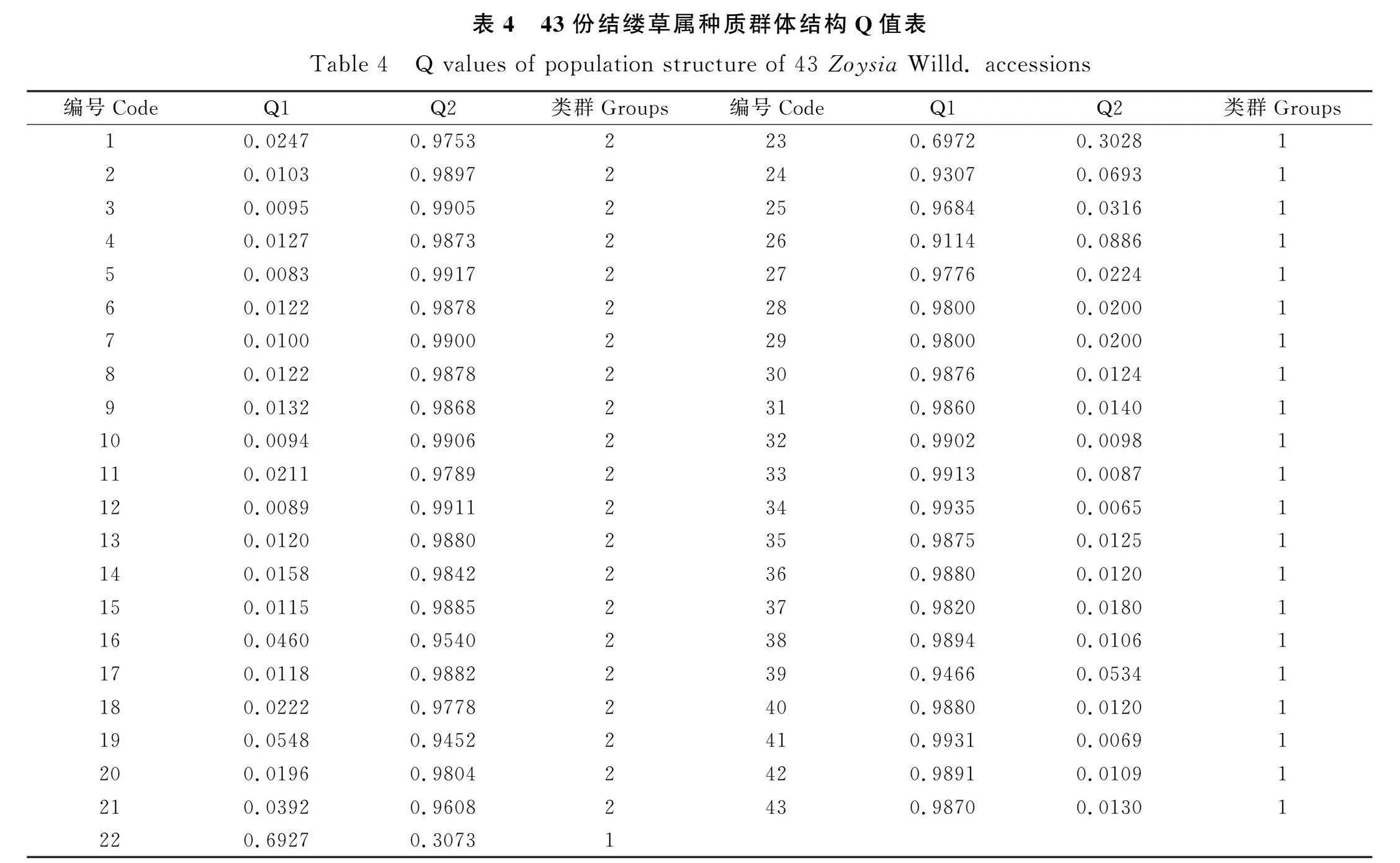
由表4结缕草属种质Q值表可知,类群1中共包含22份材料,Q值在0.693~0.993之间,其中22号、23号种质Q值小于0.7,类群2中包含21份种质,Q值在0.945~0.992之间。
3 讨论
3.1 结缕草属种质资源的多态性及遗传差异
EST-SSR标记是一种研究植物种质资源遗传多样性和群体结构分析的重要工具,本研究选取地理位置相隔较远的6份结缕草属种质对125对引物进行筛选,最终筛选出了30对条带清晰、主带明显、重复性好的EST-SSR标记,利用这30对引物对43份结缕草属种质进行遗传多样性分析,共扩增出108条多态性条带,多态性比率(PPB)为88.60%。Weng等[27-28]和郭海林[29]的研究结果均表明结缕草属植物种质资源的遗传变异情况与不同种的植物学分类相关性不高,而与其长期对生长环境的适应性相关性更高。本研究的遗传相似性变异范围为0.530~0.864,这与Cai等[13]利用基因组SSR的研究结果一致。本研究利用EST-SSR标记共扩增出104个观察等位基因,平均每对EST-SSR标记可检测到3个观察等位基因,这与Odeny等[30]对木豆[Cajanus cajan (L.) Millsp]的SSR标记研究结果一致,但显著低于Dutta等[31]的研究结果,这可能是因为选取的种质和引物不同所导致。本研究评估43份结缕草属种质资源遗传差异发现Shannon信息指数变化范围为0~1.593,平均为0.940,高于郭海林等[32](0.3504)和郭海林等[33]等(0.3746)结果,这与选取试验种质差异有关。
3.2 结缕草属种质资源的聚类分析及遗传结构
聚类分析以及群体结构分析是种质资源遗传多样性评价常用的分析方法[34]。本研究通过聚类分析发现,来自山东临沂的19号结缕草和来自江苏南京的20号结缕草亲缘关系最近聚在一起;而来自同一地区的结缕草属种质并没有聚集在同一类群中,比如来自山东的结缕草属材料在第Ⅰ类群、第Ⅱ类群中均有分布,这说明聚类结果与地理来源关系不紧密。伊然等[35]利用EST-SSR标记对60份苇状羊茅遗传多样性研究、陈志祥等[34]利用SSR标记对72份木豆种质资源的研究以及陈斐等[36]利用SSR标记对82份苜蓿(Medicago sativa L.)种质资源的研究时均发现种质资源的聚类分析结果与地理来源不存在紧密联系关系。另外,本研究还发现来自浙江开化的24号结缕草种质和来自上海金山的42号结缕草种质分别单独聚为1类,与其他种质遗传距离较远,这2份种质在形态上并没有明显的区别特征,但可能在遗传物质上存在一定差异。这一现象与郭海林等[33]利用SRAP标记对结缕草属种质资源的遗传多样性研究结果一致。此外,本研究发现聚类分析没能将结缕草属的3个种(沟叶结缕草、细叶结缕草和结缕草)从种间区分开。郭海林等[32-33]对结缕草属种质资源的聚类分析时也发现了类似结果。导致这一现象的原因可能与种质数量及所用引物及引物数量有关。
曾美娟等[37]利用EST-SSR标记对茄子(Solanumm elongena L.)进行亲缘关系分析,将29份不同的茄子材料划分为2个类群,这说明EST-SSR分析结果可以较好地反映作物种质资源间的亲缘关系,并对其群体结构进行有效划分,但聚类分析的结果和遗传多样性与标记的种类数量及试验材料的地理来源、数量及亲缘关系都有一定的关系。每个群体中测试材料的Q值的分布可以表示每种材料之间的关系,群体结构的Q值越大,亚群分类的可能性就越大,本研究中43份材料中有41份材料的Q值大于0.9,说明本研究的结缕草群体结构相对简单,适合连锁不平衡分析,这与董乐等[38]对45份浙江红花油茶(Camellia chekiangoleosa Hu)经济性状与SSR分子标记的关联分析的结果一致。
4 结论
利用EST-SSR标记对43份结缕草属种质资源的遗传多样性研究发现聚类结果与种质地理位置有一定的关联,但联系不紧密,43份种质的遗传多样性处于上等水平,EST-SSR标记能有效地评价结缕草属种质的遗传差异,本研究结果为结缕草属分子标记辅助育种提供参考依据。
参考文献
[1] 黄春琼,刘国道,白昌军,等. 结缕草属植物种质资源遗传变异研究[J]. 热带作物学报,2018,39(7):1259-1265
[2] 宣继萍. 结缕草属(Zoysia Willd.)植物种质资源多样性研究[D]. 南京:南京农业大学,2008:44
[3] 李亚,谢晓金,宣继萍.中国结缕草属(Zoysia spp.)植物抗寒性评价[J]. 草地学报,2003,11(3):240-245
[4] 李亚,耿蕾,刘建秀. 中国结缕草属植物抗盐性评价[J]. 草地学报,2004,12(1):8-11
[5] KIM J H. A taxonomic study of genus Zoysia Willd. in Korea[J]. Korean Journal of Plant Taxonom,1983,13(1):41-53
[6] ZOTOV V D. Zoysia Willd. (Gramineae) in New Zealand[J]. New Zealand Journal of Botany,1971,9(4):634-644
[7] 高雪. 三种草坪草EST-SSR分子标记开发及利用[D]. 济南:山东农业大学,2015:7
[8] 郑荣佳,孔维一,冯嘉欣,等. 结缕草属植物表型多样性分析及优异种质筛选[J]. 草地学报,2022,30(9):2325-2335
[9] GROVER A,SHARMA P C. Development and use of molecular markers:past and present[J]. Critical Reviews in Biotechnology,2016,36:290-302
[10]YANESHITA M,NAGASAWA R,ENGELKE M C,et al. Genetic variation and interspecific hybridization among natural populations of zoysia grasses detected by RFLP analyses of chloroplast and nuclear DNA[J]. Genes and Genetic Systems,1997,72(4):173-179
[11]CHOI J S,AHN B J,YANG G M. Classification of zoysia grasses (Zoysia spp.) native to the southwest coastal regions of Korea using RAPDs[J]. Journal Korean Society Horticultural Science,1997,38(6):789-795
[12]WENG J H,FAN M J,LIN C Y,et al. Genetic variation of Zoysia as revealed by random amplified polymorphic DNA(RAPD) and Isozyme pattern[J]. Plant Production Science,2007,10(1):80-85
[13]CAI H W,INOUE M,YUYAMA N,et al. An AFLP based linkage map of zoysiagrass (Zoysia japonica)[J]. Plant Breeding,2004,123(6):543-548
[14]CAI H W,INOUE M,YUYAMA N,et al. Isolation,characterization and mapping of simple sequence repeat markers in zoysia grass (Zoysia spp.)[J]. Theoretical and Applied Genetics,2005,112:158-166
[15]CHEN H M,LI L Z,WEI X Y,et al. Development,chromosome location genetic mapping of EST-SSR markers in wheat[J]. Chinese Science Bulletin,2005,50:2328-2336
[16]HOLTON T A,CHRISTOPHER J T,MCCLURE L,et al. Identification and mapping of polymorphic SSR markers expressed gene sequences of barley and wheat[J]. Molecular Breeding,2002,9:63-71
[17]SAHA M C,ROUF MIAN M A,EUJAYL I,et al. Tall fescue EST-SSR markers with transferability across several grass species[J]. Theoretical and Applied Genetics,2004,109:783-791
[18]ZHANG L Y,BERNARD M,LEROY P,et al. High transferability of bread wheat EST-derived SSRs to other cereals[J]. Theoretical and Applied Genetics,2005,111:677-687
[19]ZHANG L Y,RAVEL C,BERNARD M,et al. Transferable bread wheat EST-SSRs can be useful for phylogenetic,studies among the triticeae species[J]. Theoretical and Applied Genetics,2006,113:407-418
[20]YAN H,ZHANG Y,ZENG B,et al. Genetic diversity and association of EST-SSR and SCoT markers with rust traits in Orchardgrass (Dactylis glomerata L.)[J]. Molecules,2016,21(1),66
[21]赵岩,丁承强,孔凡美,等. EST-SSR标记在结缕草中的通用性[J]. 中国草地学报,2008,30(3):69-73
[22]HUANG C Q,HUANG D Y,ZHANG Y F,et al. Genetic analysis for 57 accessions of Cynodon dactylon from 17 countries in 6 continents by SRAP markers[J]. Tropical grasslands,2010,44:274-281
[23]ZHANG J X,WANG M L,GUO Z P,et al. Genetic diversity and population structure of bermudagrass [Cynodon dactylon (L.) Pers.] along latitudinal gradients and the relationship with polyploidy level[J]. Diversity,2019,11(8):135
[24]BRIAN M S,JEFF A B,KAREN R,et al. Development,linkage mapping,and use of microsatellites in bermudagrass[J]. Journal of the American Society for Horticultural Science,2010,135(6):511-520
[25]TERRY L K,NEIL R W,VICTOR M O,et al. DNA polymorphisms at bermudagrass microsatellite loci and their use in genotype fingerprinting[J]. Crop Science,2011,51(3):1122-1131
[26]崔蓉菁. 狗牙根耐铝种质的筛选及耐铝性状与标记的关联分析[D]. 南京:南京农业大学,2020:46
[27]WENG J H. Genetic variation of Zoysia in Taiwan as analyzed by isozyme patterns and salinity tolerance[J]. Plant Production Science,2002,5(3):236-241
[28]WENG J H,FAN M J,LIN C Y,et al. Genetic variation of Zoysia as revealed by random amplified polymorphic DNA(RAPD)and isozyme pattern[J]. Plant Production Science,2007,10(1):80-85
[29]郭海林. 结缕草属植物种质资源多样性及重要性状的遗传分析与分子标记[D]. 南京:南京农业大学,2008:42-43
[30]ODENY D A,JAYASHREE B,GEBHARDT C,et al. New microsatellite markers for pigeonpea (Cajanus cajan (L.) millsp.)[J]. BMC Research Notes,2009,2(1):1-5
[31]DUTTA S,KUMAWAT,G,SINGH,B P,et al. Development of genic-SSR markers by deep transcriptome sequencing in pigeonpea [Cajanus cajan (L.) Millspaugh][J]. BMC Plant Biology,2011,11(1):17
[32]郭海林,刘建秀,周志芳,等. 结缕草属植物种间关系和遗传多样性的SSR标记分析[J]. 草地学报,2008,16(6):552-558
[33]郭海林,郑轶琦,陈宣,等. 结缕草属植物种间关系和遗传多样性的SRAP标记分析[J]. 草业学报,2009,18(5):201-210
[34]陈志祥,罗小燕,李拴林,等. 基于SSR标记的木豆种质资源遗传多样性与群体结构分析[J].草地学报,2021,29(5):904-91
[35]伊然,王子玥,刘凌云,等. 基于EST-SSR标记的60份苇状羊茅遗传多样性分析[J]. 草地学报,2023,31(7):2041-2048
[36]陈斐,魏臻武,李伟民,等. 基于SSR标记的苜蓿种质资源遗传多样性与群体结构分析[J]. 草地学报,2013,21(4):759-768
[37]曾美娟,刘建汀,卓玲玲,等. 茄子EST-SSR分子标记的鉴定及多态性分析[J]. 中国细胞生物学学报,2020,42(8):1366-1373
[38]董乐,田仟仟,黄彬,等. 浙江红花油茶经济性状与SSR分子标记的关联分析[J]. 分子植物育种,2022,20(14):4710-4722
(责任编辑 闵芝智)

