饲草型小黑麦品种(系)的抗寒生理生化指标评价





摘 要 为筛选适应低温环境的抗寒饲用型小黑麦新品种(系),以‘石大1号’小黑麦(CK1)和‘中饲1048’小黑麦(CK2)为对照,研究‘甘农4号’‘甘农7号’‘藏饲1号’小黑麦品种,以及C5、C23和C25小黑麦品系在不同低温胁迫(0 ℃,-10 ℃,-20 ℃,-30 ℃)下的抗寒生理反应。结果表明:随着低温胁迫加剧,6 个小黑麦品种(系)叶片的平均相对含水量(RWC)和叶绿素(Chl)含量逐渐降低,脯氨酸(Pro)、可溶性糖(SS)、可溶性蛋白(SP)、丙二醛(MDA)含量,以及过氧化物酶(POD)活性均表现为先增高后降低,并在-20 ℃达到最大;超氧化物歧化酶(SOD)活性先降低后升高,但过氧化氢酶(CAT)活性逐渐升高。从品种(系)间的差异看,不同低温胁迫下‘甘农7号’叶片的RWC平均值最高,C25的Pro含量平均值最高,C5的SS含量平均值最高,‘甘农4号’的MDA含量平均值最低。灰色关联度综合评价结果表明,8个小黑麦品种(系)抗寒性强弱为C25 gt;‘甘农4号’gt;CK1 gt;CK2 gt;C5 gt;‘甘农7号’gt;C23 gt;‘藏饲1号’。
关键词 小黑麦品种(系);低温胁迫;抗寒性;灰色关联度
随着中国畜牧业的快速发展,饲草供应的季节不平衡及种植面积受限等问题日益突出[1]。在保证优质农田全部发展粮食作物的前提下,青藏高原等高寒地区及随国家经济结构调整而增多的冬闲田,为饲草种植地的选择提供了新方案。作为冬闲田种植的饲草,要求其抗寒性强,以适应低温胁迫。研究表明,低温会引起植物细胞脱水,使其水势降低,进而导致叶片相对含水量(relative water content,RWC)降低[2];叶绿体及多种细胞内膜系统结构易受低温影响而受损,导致叶绿素(chlorophyll,Chl)含量减少,植物光合作用受阻[3-4];此外,低温作用下植物体内产生大量活性氧自由基,诱导膜脂过氧化产生丙二醛(malondialdehyde,MDA)[5]。为降低低温伤害,保证自身正常生长,植物会增强体内的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)的活性以清除细胞内多余活性氧[6];同时,植物体内脯氨酸(proline,Pro)、可溶性糖(soluble sugar,SS)和可溶性蛋白(soluble protein,SP)的含量迅速上升,以维持植物体内的渗透压平衡,防止细胞质过度脱水,从而提高植物抵抗冻害的能力[7-8]。因此,要筛选适宜冬闲田种植的饲草品种,就有必要研究其抗寒机理。
小黑麦(×Triticosecale Wittmack)是以小麦属(Triticum)和黑麦属(Secale)作亲本,经属间杂交和染色体加倍人工育成的新物种[9],结合了小麦的高产优质和黑麦的耐性强、适应性广等优势,可作为正季作物的填闲作物,在冬闲田种植[10-11]。但由于遗传特性的差异,不同品种的抗寒性差异较大[12-13]。刘杰[14]研究发现单一低温胁迫下‘中饲1048’的POD、CAT活性的降幅和MDA、SP含量的增幅均小于‘中饲3241’,综合评价认为,‘中饲1048’对低温环境的耐受能力强于‘中饲3241’。宋谦等[15]通过研究小黑麦新品系在甘肃省高寒牧区的生产性能,发现小黑麦新品系P2(‘甘农2号’)的抗寒性较强,适宜在高寒地区推广种植。马文馨等[16]通过综合评价不同小黑麦品种的SS、Pro和MDA含量等生理指标在低温环境下的变化趋势,发现‘甘农2号’小黑麦抗寒性较强。但目前国内抗寒性强的小黑麦品种较少,无法满足北方农牧交错区和青藏高寒牧区冬闲田种植需求。因此,本研究以甘肃农业大学培育的小黑麦品种‘甘农4号’‘甘农7号’‘藏饲1号’,及小黑麦品系C5、C23、C25为试验材料,以国家审定的‘石大1号’(CK1)和‘中饲1048’(CK2)为对照,研究各参试材料在不同低温胁迫下生理生化指标的变化,探讨小黑麦抗寒机理,并筛选出抗寒性强的小黑麦品种(系),以满足北方农牧交错区和青藏高寒牧区冬闲田种植需求。
1 材料与方法
1.1 试验材料
小黑麦品种‘甘农4号’‘甘农7号’‘藏饲1号’,小黑麦品系C5、C23、C25,以‘石大1号’(CK1)、‘中饲1048’(CK2)为对照。以上参试小黑麦均由甘肃农业大学草业学院提供。
1.2 试验设计及方法
二因素随机区组设计,A因素为8个小黑麦品种(系):‘甘农4号’‘甘农7号’‘藏饲1号’、C5、C23、C25、CK1、CK2;B因素为低温处理,设4个水平(0" ℃,-10" ℃,-20" ℃,-30" ℃)。试验采用盆栽法,将8个小黑麦品种(系)种植于含 0.5 kg混合基质(农田土∶砂∶羊粪=7∶1∶1体积比)的花盆(直径20 cm,深10 cm)内,每盆定植10株,重复3次,采用常规管护措施,保证幼苗正常生长。待分蘖期时,将试验材料连花盆一起置于人工培养箱进行低温胁迫处理。低温处理时,首先将供试材料在0" ℃培养箱中冷适应24 h(16 h/8 h,光/暗),然后分别置于4个低温水平下处理8 h,最后在0" ℃培养箱中缓苗2 h[17]。低温处理结束后立即采集同一处理、长势良好的叶片20 g左右,利用蒸馏水冲洗干净,并吸干水分后,剪碎、混匀、称量,锡纸包裹。液氮迅速冷冻后于-80" ℃低温冰箱保存,以备测定叶片的各项生理指标。
1.3 测定项目与方法
小黑麦幼苗生理生化指标的测定方法参照《植物生理学实验指导》[18],具体见表1。
1.4 数据统计
1.4.1 数据处理 [HT]利用Excel 2019整理数据及作图,SPSS 25.0进行方差分析,Duncan氏法进行多重比较,试验结果均以“平均值±标准误”的形式表示。
1.4.2 灰色关联度分析 [HT]记各小黑麦品种(系)的生理生化指标组成的数列为(Xi(k)),其中i为各小黑麦品种(系),k为各生理生化指标。筛选各指标最优值构建小黑麦标准抗寒材料(X0),并对所有数据初值进行归一化处理,记为Xi(k)′。先通过计算差值矩阵(ρ=0.5),求取各指标关联度及权重系数,再利用各指标关联度及权重系数计算各品种(系)的加权关联度,并根据各品种(系)加权关联度的大小进行小黑麦抗寒性的评价。各计算公式如下:
归一化处理:Xi(k)′=Xi(k)X0(k)[FL)]
关联系数:ζi(k)=miniminkX0(k)′-Xi(k)′+ρ×maximaxkX0(k)′-Xi(k)′X0(k)′-Xi(k)′+ρ×maximaxkX0(k)′-Xi(k)′
指标关联度:r(k)=∑mk=1ζi(k)
指标权重系数:w(k)=r(k)∑mk=1r(k)
加权关联度:ri=∑mk=1w(k)ζi(k)
公式中i=1,2,3,…,m;k=1,2,3,…,n。
2 结果与分析
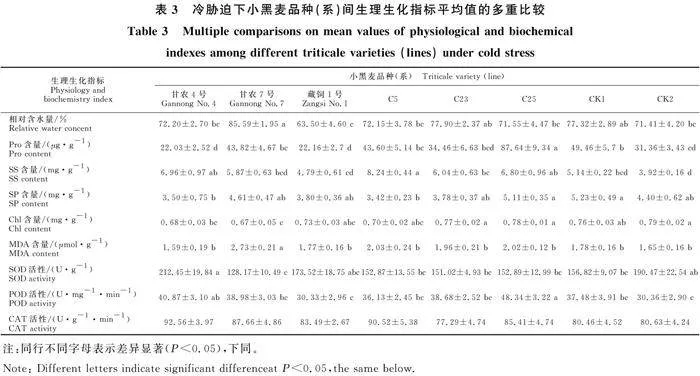
表2表明,小黑麦品种(系)间除SP含量存在显著性差异(Plt;0.05),CAT活性无显著差异(Pgt;0.05)外,其他指标均存在极显著差异(Plt;0.01);低温胁迫间及不同小黑麦品种(系)与低温胁迫互作间的各指标均存在极显著差异(Plt; 0.01),表明不同品种对低温胁迫响应的生理指标间差异显著。
2.1 低温胁迫下小黑麦品种(系)间生理生化指标的差异
如表3所示,‘甘农4号’MDA含量的平均值最低且显著低于‘甘农7号’,SOD活性的平均值显著高于除‘藏饲1号’和CK2外的其余品种(系),CAT活性平均值高于其他参试品种(系);‘甘农7号’叶片的相对含水量的平均值最高,且显著高于除C23和CK1外的其他品种(系)(Plt;0.05),MDA含量平均值显著高于其余各品种(系)(Plt;0.05);‘藏饲1号’的相对含水量和POD活性的平均值最低,且各生理指标与其他品种(系)间差异显著;C5的SS含量的平均值最高,
显著高于除‘甘农4号’和C25外的其他品种(系)(Plt;0.05);C23的各项生理指标的平均值与CK1和CK2均无显著性差异(Pgt; 0.05);C25的Pro含量的平均值显著高于其他品种(系),POD活性的平均值显著高于除‘甘农4号’外的其他品种(系)(Plt;0.05)。
2.2 不同低温胁迫下小黑麦品种(系)生理生化指标的变化
如表4所示,随低温胁迫加剧,8 个小黑麦品种(系)叶片相对含水量的平均值显著降低(Plt; 0.05);Pro、SS、SP和MDA含量的平均值均表现为先增高后降低的趋势,且均在温度为-20" ℃时达到最大值;Chl含量平均值逐渐降低,且0" ℃和-10" ℃处理下的Chl含量平均值显著高于其他处理;SOD活性平均值先降低后逐渐升高;POD活性平均值表现为先增高后降低的趋势,在 -20" ℃时达到最高活性并显著高于其他低温处理 (Plt;0.05);CAT活性平均值逐渐升高。
2.3 不同低温胁迫下小黑麦品种(系)间生理生化指标的比较分析
由图1可知,0 ℃~-30 ℃时,‘甘农7号‘的相对含水量均最高。0 ℃时,‘甘农7号’ (95.20%)显著高于‘藏饲1号’、‘甘农4号’和CK2 (P< 0.05),其中‘藏饲1号’(76.20%)最低; -10 ℃时,‘甘农7号’(86.19%)显著高于‘藏饲1号’(68.83%)(P<0.05),与其他品种(系)间差异不显著;-20 ℃时,‘甘农7号’" (82.40%)显著高于C25、C5、‘藏饲1号’(P< 0.05),其中C25(62.00%)最低;-30 ℃时,‘甘[CM(21]农7号’ (78.57%)显著高于除CK1和C25外的其他品种(系)(P<0.05),且‘藏饲1号’ (42.12%)最低。
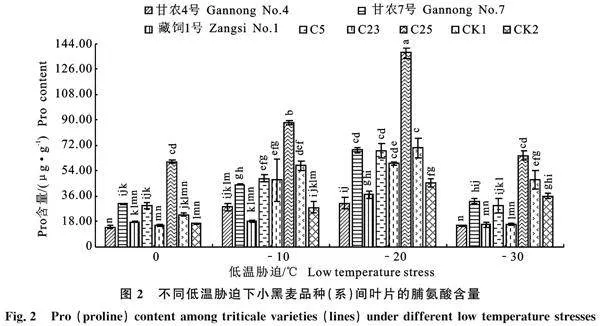
0 ℃~-30 ℃,C25的Pro含量均为最高(60.34 μg·g-1、88.15 μg·g-1、137.62" μg·g-1、64.45 μg·g-1),且显著高于其他品种(系)(P< 0.05);‘甘农4号’的Pro含量均为最低(14.02" μg·g-1、28.12" μg·g-1、31.11" μg·g-1、14.88" μg·g-1)(图2)。
由图3可知,除-20 ℃,其余3种温度处理下,C5的SS含量均最高(0 ℃、-10 ℃、-30 ℃依次为6.72 mg·g-1、7.92 mg·g-1、8.05 " mg·g-1)。0 ℃时,C5的SS含量显著高于另外7个小黑麦品种(系),‘藏饲1号’的SS含量 (2.03 mg·g-1)显著低于除‘甘农7号’外的其他品种(系)(P< 0.05);-10 ℃时, C5的SS含量显著高于除‘甘农4号’外的其他品种(系),CK2的SS含量(3.84 mg·g-1)最低且显著低于除‘藏饲1号’和C25外的其他品种(系)(P< 0.05);-20 ℃时,参试小黑麦品种(系)的SS含量均显著高于CK1(5.59 mg·g-1)和CK2(4.65 mg·g-1)(P< 0.05),其中C25和‘甘农4号’的SS含量最高(均为12.18 mg·g-1),品系C23和C5次之(9.25 mg·g-1、10.28 mg·g-1); -30 ℃时,C5的SS含量显著高于除‘甘农7号’外的其他品种(系)(P< 0.05),其中CK2的SS含量(3.68 mg·g-1)最低,且除‘甘农7号’、C5和CK2外,其余5种小黑麦品种(系)间的SS含量差异不显著。
由图4可知,0 ℃时, C25的SP含量(4.62 mg·g-1)最高,显著高于‘甘农4号’、C5和CK2(P< 0.05),其中CK2的最低(1.47 mg·g-1),并与其他品种(系)间差异不显著;-10 ℃时, C25的SP含量(5.80 mg·g-1)略低于CK1 (6.34 mg·g-1),并显著高于‘甘农4号’‘藏饲1号’和C5(P< 0.05),‘甘农4号’的SP含量 (3.14 mg·g-1)最低;-20 ℃时,‘甘农4号’的SP含量(7.48 mg·g-1)最高且显著高于‘藏饲1号’、C5和C23(P< 0.05),与其他品种(系)间无显著性差异,其中C5和C23的SP含量(4.52" mg·g-1、4.51 mg·g-1)最低;-30 ℃时,CK2的SP含量(5.51 mg·g-1)显著高于除CK1外的其余参试小黑麦品种(系),‘甘农4号’的SP含量(1.01 mg·g-1)最低并显著低于除C23的其余参试小黑麦品种(系)(P< 0.05)。
如图5所示,0 ℃和-10 ℃时,所有参试品种(系)间的Chl含量差异不显著(Pgt;0.05);" -20 ℃时,C23的Chl含量(0.79 mg·g-1)最高,且显著高于‘甘农4号’‘甘农7号’‘藏饲1号’和C5;-30 ℃时,C23的Chl含量(0.74" mg·g-1)最高,显著高于除‘藏饲1号’、C25和CK2外的其他品种(系),其中‘甘农7号’的Chl含量(0.41 mg·g-1)最低,且显著低于其他品种(系)(P< 0.05)。
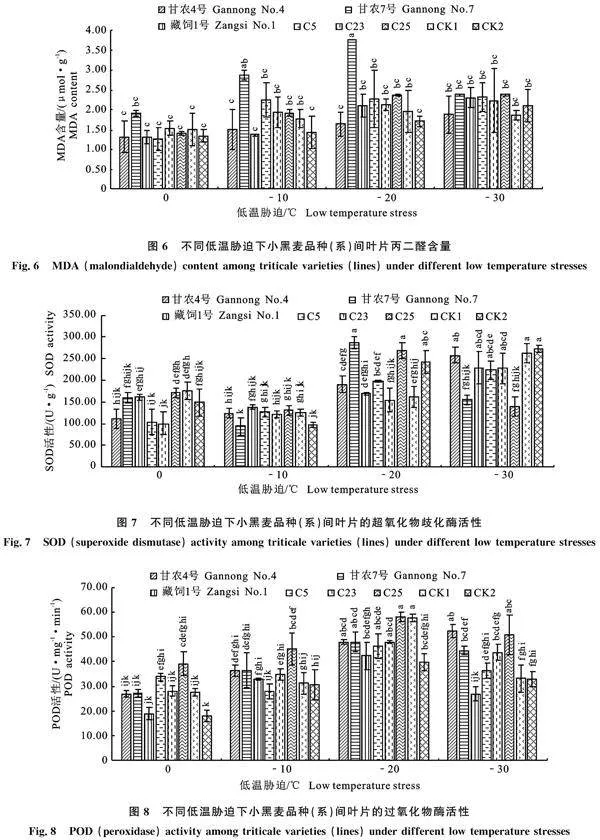
如图6所示,除-10 ℃时,‘甘农7号’的MDA含量(2.87 μmol·g-1)显著高于‘甘农4号’、‘藏饲1号’和CK2;-20 ℃时,甘农7号 (3.76 μmol·g-1)显著高于其他材料(Plt; 0.05);其余小黑麦品种(系)间的MDA含量均无显著差异。
由图7可知,0 ℃时,C23的SOD活性 (138.04 U·g-1)最高,且显著高于CK2(Plt; 0.05),与其他品种(系)无显著性差异;-10 ℃时,CK1的SOD活性(176.55 U·g-1)最高,‘甘农4号’(170.66 U·g-1)和C23(161.01" U·g-1)次之,三者显著高于‘甘农7号’和C5 (Plt;0.05);-20 ℃时,除‘甘农4号’和‘藏饲1号’外,其余参试品种(系)的SOD活性均显著低于CK2(286.44 U·g-1)(Plt;0.05),其中‘甘农7号’的SOD活性(153.74 U·g-1)最低; -30 ℃时,‘甘农4号’的SOD活性(279.12" U·g-1)显著高于所有品种(系)(Plt;0.05),C23的SOD活性(135.84 U·g-1)最低。
由图8可知,C25的POD活性在0 ℃、" -10 ℃、-20℃时均为最高(依次为:39.17" [CM(21] U·mg-1·min-1、45.18[KG*3]U·mg-1·min-1、" 58.21 U·mg-1·min-1),且均显著高于CK2 (Plt;0.05);-30 ℃时,‘甘农4号’和C25的POD活性显著高于除‘甘农7号’和C23外的其余品种(系)(Plt;0.05),其中‘藏饲1号’的POD活性 (27.03 U·mg-1·min-1)最低。
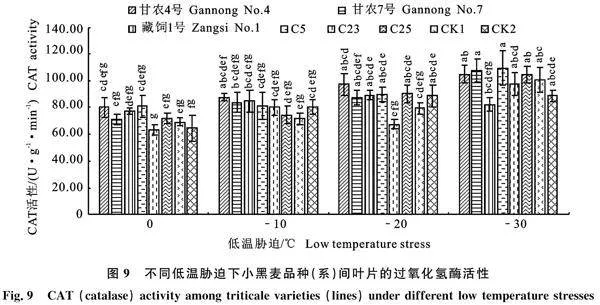
由图9可知,0" ℃和-10" ℃时,所有参试小黑麦品种(系)的CAT活性间均无显著差异(Pgt; 0.05);-20" ℃时,‘甘农4号’的CAT活性 (97.50 U·g-1·min-1)最高,C23的CAT活性(67.78 U·g-1·min-1)最低,除两者存在显著性差异(Plt;0.05)外,其余小黑麦品种(系)间均差异不显著;-30" ℃时,除‘甘农7号’ (108.03" U·g-1·min-1)显著高于‘藏饲1号’ (82.33"" U·g-1·min-1)(P< 0.05)外,其他品种(系)间差异不显著。
2.4 小黑麦品种(系)抗寒性综合评价
根据植物抗寒性机理,得出参试小黑麦品种(系)各生理生化指标中除MDA含量为负向指标,其余均为正向指标,因此以MDA含量的最小值,其余指标的最大值构建小黑麦标准抗寒材料(X0)(表5)。通过对各指标数据进行初值化,计算得到其关联度及权重值,各指标权重占比依次为Chlgt;CATgt;RWCgt;SSgt;MDAgt;PODgt; SODgt;SPgt;Pro(表6)。依据灰色系统中,加权关联度值越大越接近标准材料,对小黑麦各品种(系)的抗寒性进行综合评价,结果表明:C25 gt;‘甘农4号’gt;CK1 gt;CK2 gt;C5 gt;‘甘农7号’gt;C23gt;‘藏饲1号’(表7)。
3 讨" 论
3.1 不同小黑麦品种(系)在低温胁迫下生理生化指标的变化
通常RWC较高的植物具有较高的渗透调节功能和较强的抗逆性[19-20]。本试验中,不同低温处理后,‘甘农7号’叶片的RWC的平均值最高。说明‘甘农7号’是通过维持较高的RWC以适应低温迫害,与黄相玲等[21]的研究结果一致。植物在低温环境中,体内的Pro会大量积累,以降低细胞水势,同时增强细胞的代谢作用,抵御冻害、冷害的能力增强[22-23]。本研究中,C25的Pro含量的平均值显著高于其他品种(系),表明C25体内Pro含量的增加是其抗寒性强的重要原因。SS的积累有利于提高植物保水能力,并保护生物膜使其避免受损,以此缓解低温逆境对其造成的危害[24],C5的SS含量的平均值最高且显著高于对照,表明C5可以通过积累更多的SS来降低低温危害。SP可以保护植物原生质,避免其因低温影响造成脱水[25]。本试验中,C25的SP含量平均值较高,说明低温环境下C25可以通过提高SP含量来增强细胞保水能力,使其在低温环境下能够更好存活。受低温作用,植物光合作用受阻,Chl含量下降,因此Chl含量的下降幅度成为衡量植物抗寒性的重要指标[26]。品系C23和C25的Chl含量的平均值较高,说明低温对其Chl合成影响较小。低温胁迫下,植物各器官经膜脂过氧化产生MDA,MDA含量越高,对生物膜的破坏越大,植物的抗寒性越差[27]。‘甘农7号’的MDA含量的平均值最高,且显著高于其他品种(系),说明低温环境对‘甘农7号’的危害更大。李呈呈[28]对彩叶桂的研究表明,抗寒性较好的植物叶片内SOD、POD、CAT等抗氧化物酶活性较大。本试验中C25的POD活性的平均值表现最好,‘甘农4号’的SOD和CAT活性的平均值最高,说明‘甘农4号’和C25在低温环境下更容易激活抗氧化酶的活性。
3.2 不同低温胁迫对小黑麦生理生化指标的 影响
抗寒性是指植物通过自身遗传和变异以适应和抵抗长期的低温环境,并健康生长的能力,是牧草种质资源评价的重要指标[29]。本试验中,随着低温胁迫的加剧,参试小黑麦品种(系)的RWC和Chl含量的平均值均表现为逐渐降低。这与王伟强等[22]的研究结果一致,说明低温环境下,小黑麦会降低RWC以提高细胞液浓度,维持植物生长,同时也会使得Chl的分解加快,吸收转运速率下降,造成小黑麦Chl合成受阻,Chl含量随之降低[30]。在本研究中,随低温胁迫的加剧,小黑麦叶片的Pro、SS、SP、MDA含量平均值和POD活性的平均值均表现为先增高后降低,并在 -20 ℃时达到最大值。出现此现象的原因是一定程度的低温胁迫有利于小黑麦通过提高Pro、SS和SP含量来调节渗透平衡,然而随着胁迫程度加剧,小黑麦组织细胞受损,Pro、SS和SP含量开始下降,这与张基德等[31]的研究结果一致,表明植物有一定的耐受域值。其次,低温环境容易造成植物细胞内的过氧化自由基代谢失衡,引起膜脂过氧化,细胞膜渗透性变大,MDA含量上升[32]。而本研究中小黑麦体内的平均MDA含量在-20" ℃后开始降低,与李菡等[33]的研究结果相似,其原因是过度低温引起细胞内氧化压力持续增加,造成细胞膜质过氧化加重,小黑麦的生长也严重受损。此外,植物细胞内的POD可以通过增强其活性来清除体内的有害物质,使细胞免于低温伤害,但长期重度低温胁迫也会使POD活性降低,甚至失活[34],这与本试验所得结论一致。低温处理下小黑麦叶片的SOD活性的平均值在-10 ℃降为最低值,后随温度降低逐渐升高,说明-10 ℃是小黑麦叶片SOD活性的临界值,即温度低于-10 ℃时,小黑麦叶片SOD活性增强以清除体内的有害物质,这与谢婉莹等[35]的研究结果相似。低温处理下,植物叶片的CAT活性会持续上升以降低逆境伤害[36]。本研究也得出同样结论,即随低温胁迫的加剧,小黑麦品种(系)的CAT活性的平均值呈上升趋势。
3.3 低温胁迫×品种(系)间小黑麦生理生化指标的变化
通过低温胁迫×小黑麦品种(系)间相关抗寒性生理生化指标可知,0 ℃~-30 ℃时,‘甘农7号’的RWC均为最高。说明低温胁迫下,‘甘农7号’的保水能力强,能更好适应低温环境。各参试小黑麦品种(系)的Pro含量在0" ℃~-30" ℃时,均为 C25表现最好,说明C25在低温环境下的Pro含量较多,可供其维持细胞平衡,以避免细胞受损[22]。C5的SS含量在0 ℃~-30 ℃时均显著高于CK2,说明C5更容易在低温逆境中通过积累SS含量来提高细胞的渗透调节能力,以增强原生质体与环境间的渗透平衡。0" ℃~ -30" ℃时,各参试小黑麦品种(系)的SP含量表现不稳定,其原因一方面是不同的低温处理诱导小黑麦体内产生不同的SP(如冷响应蛋白),且各小黑麦品种(系)对不同的低温处理适应程度不同,SP增加量也不同,另一方面,低温环境会迫使小黑麦产生自溶水解酶或溶酶体,使得体内的蛋白质分解速度加快,导致SP含量降低[37]。0" ℃和-10" ℃时,所有参试品种(系)间的Chl差异不显著,说明各品种(系)的Chl对低程度的低温胁迫反应不突出。-20 ℃和-30" ℃时,C23的Chl含量最高,表明低温胁迫下其Chl的合成受阻程度较低。‘甘农7号’的MDA含量在-10" ℃和-20" ℃时较高,说明‘甘农7号’因低温胁迫产生的活性氧自由基更多,受损程度更大。SOD、POD、CAT可以保护植株免受低温产生的活性氧对膜脂的伤害[38]。本试验中,C25的POD活性在各低温阶段均显著高于对照,原因可能是低温环境激活了其抗氧化酶基因,使得POD活性升高。各品种(系)在不同低温阶段的SOD和CAT活性表现不稳定,可能与其体内的SOD和CAT酶含量及对温度的适应范围有关。由于本研究中不同品种(系)的小黑麦在不同低温处理下对同一生理生化指标的反应各不相同,即单一指标不能评价某一品种(系)的抗寒性强弱。因此通过灰色关联度分析法对各参试品种(系)进行综合性评价,结果表明:Chl含量、CAT活性和RWC含量是小黑麦抗寒系统中的主要影响因子,即Chl含量、CAT活性和RWC含量越高,小黑麦抗寒性越强。其中C25和‘甘农4号’的加权关联度大于CK1,在参试小黑麦品种(系)中抗寒性较强。
4 结" 论
参试小黑麦品种(系)抗寒性强弱排名: C25 gt;‘甘农4号’gt;CK1 gt;CK2 gt;C5 gt;‘甘农7号’gt;C23gt;‘藏饲1号’,C25和‘甘农4号’的抗寒性较强,适宜在高海拔温度较低地区推广种植,并为小黑麦抗寒分子育种提供基础材料。
参考文献 Reference:
[1] 何鹏亮,揭红东,谭燕群,等.湖南冬闲田高产优质饲用小黑麦新品系筛选研究[J].中国草地学报,2022,44(11):56-65.
HE P L,JIE H D,TAN Y Q,et al.Evaluation of new high-yield and high-quality forage triticale lines in winter fallow fields in Hunan province[J].Chinese Journal of Grassland,2022,44 (11):56-65.
[2]陈玖红,王 沛,王 平,等.6份披碱草属牧草种质材料抗寒性的比较[J].草业科学,2019,36(6):1591-1599.
CHEN J H,WANG P,WANG P,et al.Comparison of chilling resistance of sixElymus germplasms[J].Pratacultural Sciences,2019,36(6):1591-1599.
[3]郑友峰,陈家兰,肖 昉,等.不同温度对苋菜光合特性及光合作用相关基因表达的影响[J].植物资源与环境学报,2022,31(5):50-57.
ZHENG Y F,CHEN J L,XIAO F,et al.Effects of different temperatures on photosynthetic characteristics and expression of photosynthesis-related genes in Amaranthus tricolor[J].Journal of Plant Resources and Environment,2022,31(5):50-57.
[4]DING Y L,SHI Y T,YANG S H.Advances and challenges in uncovering cold tolerance regulatory mechanisms in plants[J].New Phytologist,2019,222:1690-1704.
[5]项洪涛,郑殿峰,何 宁,等.植物对低温胁迫的生理响应及外源脱落酸缓解胁迫效应的研究进展[J].草业学报,2021,30(1):208-219.
XIANG H T,ZHENG D F,HE N,et al.Research progress on the physiological response of plants to low temperature and the amelioration effcectiveness of exogenous ABA[J].Acta Prataculturae Sinica,2021,30(1):208-219.
[6]黄丽芳,龙宇宙,李金芹,等.低温胁迫对小粒种咖啡幼苗生理特性的影响[J].中国农业科技导报,2023,25(2):60-67.
HUANG L F,LONG Y ZH,LI J Q,et al.Physiological and biochemical characteristics of coffee arabicas seedling under low temperature stress[J].Journal of Agricultural Science and Technology,2023,25(2):60-67.
[7]韦霞霞,李玉梅,李彦彪,等.葡萄抗寒性与韧皮部糖分及内源激素积累的相关性[J].西北农业学报,2021,30(3):386-394.
WEI X X,LI Y M,LI" Y" B,et al.Correlation on grape cold tolerance,ddissoluble sugar and accumulation of endogenous hormones in phloem[J].Acta Agriculturae Boreali-occidentails Sinica,2021,30(3):386-394.
[8]杨航宇,刘长仲.低温胁迫对4种卫矛属植物抗寒生理指标的影响[J].草原与草坪,2020,40(2):92-98.
YANG H Y,LIU CH ZH.Effects of low temperature stress on physiological indexes of cold resistance of four species in the genusEuonymus[J].Grassland and Turf,2020,40(2):92-98.
[9]刘 晶,赵明月,郭宏玉,等.高寒牧区小黑麦研究进展[J].青海科技,2021,28(4):23-26.
LIU J,ZHAO M Y,GUO H Y,et al.Advances in triticale research in alpine pastoral areas[J].Qinghai Science and Technology,2021,28(4):23-26.[ZK)]
[10] 游永亮,李 源,赵海明,等.饲用小黑麦在海河平原区的生产性能及适应性评价[J].草原与草坪,2015,35(3):32-38.
YOU Y L,LI Y,ZHAO H M,et al.Evaluation of production performance and adapt ability of forage triticale in Haihe plain area[J].Grassland and Turf,2015,35(3):32-38.
[11]王 敏,宋 谦,杜文华.陇东旱塬区饲用小黑麦品系形态特征和草产量对干旱的响应[J].西北农业学报,2024,33(8):1424-1435.
WANG M,SONG Q,DU W H.Morphological characteristics and yields of forage triticale lines in response to drought in the Longdong rainfed plateau area[J].Acta Agriculturae Boreali-occidentails Sinica,2024,33(8):1424-1435.
[12]孙 敏,苗果园,杨珍平,等.小黑麦、黑麦与普通小麦粮用和饲用价值的差异[J].麦类作物学报,2008,28(4):644-648.
SUN M,MIAO G Y,YANG ZH P,et al.Differences in food and fodder value among triticale,Secale andTriticum[J].Journal of Triticeae Crops,2008,28(4):644-648.
[13]黄一波,汪结明,李瑞雪,等.7种木莲属植物抗寒性评价及其生理机制[J].热带亚热带植物学报,2021,29(5):519-529.
HUANG Y B,WANG J M,LI R X,et al.Evaluation of cold resistance and physiological mechanism of seven species of Manglietia species[J].Journal of Tropical and Subtropical Botany,2021,29(5):519-529.
[14]刘 杰.低温干旱复合胁迫对黑麦、小黑麦、短芒披碱草幼苗的抗逆性研究[D].拉萨:西藏大学,2017.
LIU J.Study on the stress resistance of rye,triticale and Elymus breviaristatus seedlings under combined stress of low temperature and drought[D].Lhasa: Tibet University,2017.
[15]宋 谦,田新会,杜文华.甘肃省高寒牧区小黑麦新品系的生产性能[J].草业科学,2016,33(7):1367-1374.
SONG Q,TIAN X H,DU W H.Studies on production performanceof new triticale lines in alpine pastoral areas of Gansu[J].Pratacultural Science,2016,33(7):1367-1374.
[16]马文馨,宋 谦,田新会,等.小黑麦不同材料的抗寒性评价[J].草原与草坪,2019,39(3):85-91.
MA W X,SONG Q,TIAN X H,et al.Evaluation of cold resistance of different triticale materials[J].Grassland and Turf,2019,39(3):85-91.
[17]尹玉林,马文馨,李亚娟,等.甘肃省中部地区猫尾草新品系的抗寒性研究[J].草地学报,2021,29(03):625-630.
YIN Y L,MA W X,LI Y J,et al.Study on the cold resistance of new strains of timothy grass from in the central part of Gansu province[J].Acta Agrestia Sinica,2021, 29(3):625-630.
[18]邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2003:18-165.
ZOU Q.Experimental Instruction of Plant Physiology[M].Beijing:China Agricultural Publishing House,2003:18-165.
[19]谢 楠,赵海明,李 源,等.饲用黑麦、小黑麦品种苗期耐盐性评价及盐胁迫下的生理响应[J].草地学报,2016, 24(1):84-92.
XIE N,ZHAO H M,LI Y,et al.Salt tolerance evaluation and physiological response of forage rye and triticale at seedling stage[J].Acta Agrestia Sinica,2016,24(1):84-92.
[20]王 涛,王晓楠,王明芳,等.低温下冬小麦水分含量的变化与抗寒性鉴定[J].作物杂志,2015,164(1):61-66.
WANG T,WANG X N,WANG M F,et al.Moisture content changes and cold resistance identification by winter wheat varieties at low temperature[J].Crops,2015, 164(1):61-66.
[21]黄相玲,张仁志.植物抗逆生理机制研究进展[J].南方农业,2021,15(34):96-99,103.
HUANG X L,ZHANG R ZH.Study progress in resistance to adverse physiological mechanism of plants[J].South China Agriculture,2021,15(34):96-99,103.
[22]王伟强,田新会,杜文华.‘甘农4号’小黑麦苗期抗寒性评价[J].甘肃农业大学学报,2023,58(1):46-54.
WANG W Q,TIAN X H,DU W H.Evaluation on cold resistance of Triticosecale variety ‘Gannong No.4’" at seedling stage[J].Journal of Gansu Agricultural University,2023,58(1):46-54.
[23]王明莹.不同品种苜蓿对低温胁迫的生理响应及抗寒性评价[J].呼伦贝尔学院学报,2022,30(3):84-88,128.
WANG M Y.Research on the cold resistance of differentalfalfa varieties to low temperature stress[J].Journal of Hulunbuir University,2022,30(3):84-88,128.
[24]张 瑜,严琳玲,虞道耿,等.柱花草种质抗寒性评价与筛选[J].热带作物学报,2018,39(10):1887-1892.
ZHANG Y,YAN L L,YU D G,et al.Evaluation and selection of cold resistance of Stylosanthes germplasm[J].Chinese Journal of Tropical Crops,2018,39(10):1887-1892.
[25]苏李维,李 胜,马绍英,等.葡萄抗寒性综合评价方法的建立[J].草业学报,2015,24(3):70-79.
SU L W,LI SH,MA SH Y,et al.A comprehensive assessment method for cold resistance of grape vines[J]. Acta" Prataculturae Sinica,2015,24(3):70-79.
[26]刘松虎,任毛飞,李 蒙,等.不同黄心菜品种的抗寒生理比较研究[J].安徽农学通报,2019,25(4):18-19,53.
LIU S H,REN M F,LI M,et al.Comparative analysis on cold resistance of different varieties of Brassica pekinensis (Lour.)Rupr.[J].Anhui Agricultural Science Bulletin,2019,25(4):18-19,53.
[27]李艳芳,包国章,刘晓婷,等.冻融及碱性盐胁迫下紫花苜蓿幼苗的生理响应[J].江苏农业科学,2016,44(7):278-281.
LI Y F,BAO G ZH,LIU X T,et al.Physiological response of alfalfa seedlings under freeze-thaw and alkaline salt stress[J].Jiangsu Agricultural Sciences,2016,44(7):278-281.
[28]李呈呈.彩叶桂抗寒及光合特性研究[D].山东青岛:山东农业大学,2021.
LI CH CH.Study on cold resistance and photosynthetic characteristics ofOsmanthus fragrans colour-leaved group cultivars[D].Qingdao Shandong:Shandong Agricultural University,2021.
[29]唐子兴.不同小麦品种抗寒性评价[J].安徽农学通报,2021,27(2):24-26.
TANG Z X.Evaluation of cold resistance of different wheat varieties[J].Anhui Agricultural Science Bulletin,2021,27(2):24-26.
[30]王 宁,徐 杰,吴 军,等.喷施不同外源物质对低温胁迫下的光蜡树苗部分抗寒生理指标的影响[J].西部林业科学,2010,39(1):31-35.
WANG N,XU J,WU J,et al.The effects spraying exogenous chemicals on some indexes in low temperature resistance of seedlings of Fraxinus griffithii under low temperature stress[J].Journal of West China Forestry Science,2010,39(1):31-35.
[31]张基德,李玉梅,陈艳秋,等.梨品种枝条可溶性糖、脯氨酸含量变化规律与抗寒性的关系[J].延边大学农学学报,2004,11(4):281-285.
ZHANG J D,LI Y M,CHEN Y Q,et al.Relationship between soluble sugar content,proline content and the hardiness of pear cultivars[J].Agricultural Science Journal of Yanbian University,2004,11(4):281-285.
[32]宋晓芳.干旱、盐胁迫下低温处理对多年生黑麦草种子萌发的影响[D].陕西杨凌:西北农林科技大学,2013.
SONG X F.Effects of pre-chilling on germination of perennial ryegrass seeds under drought and salt stress[D].Yangling Shaanxi:Northwest Aamp;F University,2013.
[33]李 菡,李 云,任学军,等.模拟海水胁迫下小麦幼苗的质量及生理响应机制[J].核农学报,2023,37(6):1270-1278.
LI H,LI Y,REN X J,et al.Quality and physiological response mechanism of wheat seedlings under simulated seawater stress[J].Journal of Nuclear Agricultural Sciences,2023,37(6):1270-1278.
[34]杨 丹,田新会,杜文华.红三叶新品系生理生化指标对低温的响应机理[J].草地学报,2019,27(1):163-169.
YANG D,TIAN X H,DU W H.Physiological and biochemical parameters of red clover line responses to low the temperature[J].Acta Agrestia Sinica,2019,27(1):163-169.
[35]谢婉莹,温 琳,祁银燕.4种引种核桃品种的抗寒性研究[J].青海大学学报,2023,41(3):30-35,64.
XIE W Y,WEN L,QI Y Y.Study on the cold resistance of four varieties of introducedJuglans regia L.[J].Journal of Qinghai University,2023,41(3):30-35,64.
[36]李翠红,张永茂,冯毓琴,等.苹果矮化砧木抗寒性的评价与比较[J].西南农业学报,2017,30(5):1183-1188.
LI C H,ZHANG Y M,FENG Y Q,et al.Screening and contrast of different apple dwarfed rootstocks hardiness[J].Southwest China Journal of Agricultural Sciences ,2017,30(5):1183-1188.
[37]娄晓鸣.枇杷(Eriobotrya japonica Lindl.)抗寒种质鉴定及其抗寒机制[D].南京:南京农业大学,2018.
LOU X M.Identification of cold tolerance germplasm and cold tolerance mechanism in loquat[D].Nanjing:Nanjing Agricultural University,2018.
[38]王晓龙.苜蓿抗寒性鉴定及耐寒种质筛选[D].呼和浩特:内蒙古农业大学,2021.
WANG X L.Identification of cold tolerance and screening of and cold tolerant germplasm of alfalfa[D].Hohhot:Inner Mongolia Agricultural University,2021.Evaluation of Physiological and Biochemical Indexes of Cold Resistancein Forage Triticale Varieties(lines)
ZHANG Yinxia,CHU Hongli,ZHAO" Fangyuan" and" DU Wenhua
(Pratacultural College,Gansu Agricultural University/Key Laboratory of Grassland Ecosystem of Ministry of"Education/Pratacultural Engineering Laboratory of" Gansu" Province/Sino-U.S.Centers for Grazing" Land Ecosystem" Sustainability,Lanzhou 730070,China)
Abstract To screen triticale varieties (lines) that are well-suited to the cold environment,triticale varieties ‘Shida No.1’ and ‘Zhongsi 1048’ were used as controls,we" investigated the physiological responses to cold resistance of triticale varieties ‘Gannong No.4’ ‘Gannong No.7’" and ‘Zangsi No.1’,as well as lines C5,C23,and C25,under different low temperature stresses (0" ℃,-10" ℃,-20" ℃, -30" ℃).The results showed that with the intensification of low temperature stresses,the average contents of relative water content (RWC) and chlorophyll (Chl) in leaves of six triticale varieties (lines) decreased gradually,meanwhile,the average contents of proline (Pro),soluble sugar (SS),soluble protein (SP),malondialdehyde (MDA),and peroxidase (POD) increased first,then decreased,reaching their peak at the temperature of -20 ℃; The average activity of superoxide dismutase (SOD) decreased first and then increased,while the average activity of catalase (CAT) increased gradually.Based on the variations among triticale varieties (lines),‘Gannong No.7’" exhibited the highest average" RWC" under different low-temperature stresses.Variety C25 had the highest average" Pro" content,C5 showed the highest average" SS" content,and ‘Gannong No.4’" demonstrated the lowest average" MDA" content.The comprehensive evaluation results of grey correlation degree showed that the cold resistance ranking among eight triticale varieties ( lines ) is as follows: C25 gt;‘Gannong No.4’ gt;CK1 gt;CK2 gt;C5 gt;‘Gannong No.7’ gt;C23 gt;‘Zangsi No.1’.
Key words Triticale varieties (lines); Low temperature stress; Cold resistance; Grey correlation degree
Received" 2023-07-01""" Returned 2023-10-13
Foundation item The National Natural Science Foundation of China (No.32260339); Industrial Support Program of Colleges and Universities in Gansu Province (No.2022CYZC-49); Major Project of Gansu Province (No.21ZD4NA012); Major Project of Xizang (No.XZ202101ZD003N).
First author ZHANG Yinxia,female,master student.Research area:grass germplasm resources and breeding cultivation.E-mail:199087296@qq.com
Corresponding"" author DU Wenhua,female,professor,doctoral supervisor.Research area:grass germplasm resources and breeding cultivation.E-mail:duwh@gsau.edu.cn
(责任编辑:顾玉兰 Responsible editor:GU Yulan)

