施用生物菌肥对地黄重茬土壤的影响



摘要:以地黄(Rehmannia glutinosa)的重茬土壤为研究对象,分析生物菌肥对地黄重茬土壤的微生物群落构成及土壤内根系残留化合物的影响。通过施用不同浓度的生物菌肥,结合土壤微生物计数法和超高效液相色谱-四极杆飞行时间质谱法(UPLC-QTOF/MS)对施有生物菌肥的重茬土壤分别进行微生物种群计数和根系残留化合物分析。结果表明,不同处理下土壤微生物群落结构存在明显差异,其中,0.05%生物菌肥施用60 d后的地黄重茬土壤中细菌、放线菌之和最高,而真菌数量相对较少。筛选出9种地黄重茬土壤中特有的根系残留化合物,其中,在生物菌肥浓度为0.05%时,化合物2的含量最低;化合物5和化合物6含量在生物菌肥浓度为0.10%、施用60 d的条件下最低。可见,外施生物菌肥可有效改变地黄重茬土壤微生物数量和降解重茬土壤中根系残留的某些化合物,有效缓解地黄的连作障碍。
关键词:生物菌肥; 地黄(Rehmannia glutinosa); 重茬土壤; UPLC-QTOF/MS
中图分类号:S567.234;S154" " " " "文献标识码:A
文章编号:0439-8114(2024)12-0099-06
DOI:10.14088/j.cnki.issn0439-8114.2024.12.018 开放科学(资源服务)标识码(OSID):
Effect of applying bacterial manure on the continuous cropping soil of Rehmannia glutinosa
YU Yan-ge, DAI Dan-dan, LA Gui-xiao, LI Xiang-yang, GUO Xiao-yang, WANG Yan-hong, YANG Tie-gang
(Institute of Traditional Chinese Medicine, Henan Academy of Agricultural Sciences, Zhengzhou" 450002, China)
Abstract: Taking the continuous cropping soil of Rehmannia glutinosa as the research object, the effect of applying bacterial manure on microbial community composition and root residual compounds in the soil of Rehmannia glutinosa was analyzed. The soil microbial count method was used to detect the number of microorganisms. Ultra high-performance liquid chromatography coupled to quadrupole time-of-flight mass spectrometry (UPLC-QTOF/MS) was used to profile the root residual compounds in the soil of Rehmannia glutinosa. The results showed that soil microbial community structure had significant differences under different treatments. The total number of bacteria and actinomycetes in Rehmannia glutinosa soil after 60 d of applying 0.05% bacterial manure was the highest, while the number of fungi was less. Nine unique residue compounds were screened out in the soil of Rehmannia glutinosa. The content of Compound 2 was the lowest when the concentration of bacterial manure was 0.05%. At the same time, the contents of Compound 5 and Compound 6 were the lowest when the concentration of bacterial manure was 0.10% and applied for 60 days. It was found that the application of bacterial manure could effectively change the soil microbial populations and reduce some residual compounds of continuous cropping soil. It was also beneficial to alleviate the continuous cropping obstacle of Rehmannia glutinosa.
Key words: bacterial manure; Rehmannia glutinosa; continuous cropping soil; UPLC-QTOF/MS
收稿日期:2024-03-27
基金项目:国家现代农业产业技术体系资助项目(CARS-21);河南省中药材体系项目(HARS-22-11-G2);河南省农业科学院新兴学科发展专项(2024XK04)
作者简介:余彦鸽(1990-),女,河南洛阳人,助理研究员,硕士,主要从事中药材栽培生理研究,(电话)15890116124(电子信箱)yyg604208@163.com;通信作者,杨铁钢(1967-),男,河南长垣人,研究员,博士,主要从事中药材栽培生理研究,(电子信箱)tiegangyang@126.com。
地黄(Rehmannia glutinosa)是玄参科地黄属多年生草本植物,是中国常用药材[1]。然而,地黄在栽培过程中存在明显的连作障碍,需间隔8~10年才可再次种植,严重影响地黄产业的发展[2,3]。地黄产生连作障碍的原因比较复杂[4]。地黄土壤微生物种群平衡的失调是造成地黄连作障碍的主要原因[5]。土壤微生物群落的数量和活性影响着土壤的肥力,通过添加生物菌肥,可改良和优化土壤微生物区系,减缓连作障碍的发生[6,7]。因此,探寻有效的生物菌肥来缓解地黄土壤连作障碍,是科研人员关注的焦点。作物连作障碍的形成及加重的原因是多重的。长期连作时,作物对土壤微生物的选择压力增大,土壤中细菌数目减少、真菌数目上升,导致土壤微生物区系紊乱,进而影响植物对营养物质的吸收利用,最终导致减产、降质[8,9]。同时,重茬土壤的微生物群落构成、功能的改变也是连作作物病害加剧的重要诱因[10-12]。连作的地黄长势较差与其根际土壤总微生物量下降、细菌与真菌的比例降低有相关性[13]。生物菌肥通过特定有益的微生物菌群改善土壤质量[14-16]。有效的抗重茬生物菌肥可通过调节根部土壤微生物种类、结构修复失衡的土壤微生态,减少重茬障碍的发生[17]。卢明忠等[18]通过外施专用生物菌肥栽培重茬太子参,太子参的产量与太子参多糖含量均有明显提升,这说明生物菌肥对提高土壤微生物多样性及改善土壤生态结构均具有一定影响。杜真辉等[19]的研究表明,施用菌肥可提高地黄产量与品质,降低成本。目前生物菌肥的研究主要是对宿主植物的增产和品质的改善[20,21],而有关运用超高效液相色谱-四极杆飞行时间质谱法(UPLC-QTOF/MS)研究其对土壤中根系残留化合物影响的报道较少。本研究采用微生物计数法和UPLC-QTOF/MS法,分析施用不同浓度生物菌肥的地黄重茬土壤,考察该生物菌肥对地黄重茬土壤的微生物群落及土壤内根系残留化合物的影响,以期为缓解地黄连作障碍探索有效的解决途径。
1 材料与方法
1.1 材料
试验于2019年10月在河南省焦作市温县鑫合农庄试验地取样,分别对地黄重茬土和非重茬土多点取样。样地按S形选取5个样点,每个样点按随机多点混合取样法将土样混合均匀。混匀的土样一部分于4 ℃保存鲜样,测定微生物数量;一部分风干保存,测定土壤中的化学成分[22]。供施生物菌肥为山东神圣生物肥料有限公司研制生产的固体颗粒菌肥,其有效活菌数≥10亿CFU/g,有机质含量≥20%。
1.2 试验设计
试验设计5个不同浓度的生物菌肥,菌肥用量分别为土壤鲜重的0%(B0)、0.01%(B1)、0.05%(B2)、0.10%(B3)、0.20%(B4)。将拌有不同浓度生物菌肥的土壤置于相对湿度55%~60%的盒子中,每个处理3次重复,随机排列。每3 d喷水1次,喷水量要求一致,室内放置。每30 d取样1次,连续取样3个月,即取样时间分别为30 d(C1)、60 d(C2)、90 d(C3)。取样后及时置于4 ℃冰箱避光冷藏。
1.3 方法
1.3.1 土壤微生物数量分析法 土壤细菌、真菌、放线菌数量分析采用稀释平板计数法。细菌培养采用牛肉膏蛋白胨培养基,选择10-3、10-4、10-5稀释度的菌悬液涂平板,在25 ℃条件下培养3 d后计数;真菌培养采用马丁氏培养基,在使用前加入1%的链霉素0.5 mL,选择10-2、 10-3、10-4稀释度的菌悬液涂平板,于30 ℃条件下培养5 d后计数;放线菌培养采用高氏Ⅰ号培养基,在培养基灭菌后加入150 mg/mL重铬酸钾溶液0.5 mL,选择10-2、10-3、10-4 稀释度的菌悬液涂平板,于30 ℃条件下培养7 d后计数。细菌、真菌、放线菌培养时,每个稀释度均3次重复[23]。
1.3.2 土壤根系残留化合物的测定 运用UPLC-QTOF/MS法测定土壤样品中的根系残留化合物。
1)溶液提取。称取土样2.0 g于具塞量筒中,加入20 mL乙腈,超声振荡30 min,静置过夜。在10 ℃、5 000 r/min条件下离心20 min。取离心管上清液1.0 mL,加入1.0 mL甲醇-水混合液(V/V,1∶1),过滤,上机待测。
2)色谱分离条件。色谱柱:BEH C18柱;流动相为0.1%甲酸水溶液(A)和乙腈溶液(C)。洗脱梯度:0~1 min,5%~15% C;1~8 min,15%~85% C;8~10 min,85%~100% C;10~12 min,100% C;12.0~12.1 min,100%~5% C;12.1~15.0 min,5% C。流速为0.4 mL/min;柱温35 ℃;进样量为5 μL。
3)质谱检测条件。离子源:电喷雾(ESI);离子源温度为120 ℃;毛细管温度为350 ℃;毛细管电压为2 000 V;锥孔电压为17 V;电喷雾电压为1 600 V;扫描时间为0.1 s;扫描间隔0.02 s;脱溶剂流速为450 L/h;雾化气、吹脱气、辅助加热气、碰撞气均为高纯氮气;离子监测质荷比(m/z)为100~1 000。
1.4 数据分析
将采集到的质谱数据运用UNIFY软件进行未知化合物成分鉴定,同时运用QI分析软件分析不同处理下土壤代谢物,并找寻特异性Maker。
2 结果与分析
2.1 生物菌肥对地黄重茬土壤微生物群落构成的影响
2.1.1 地黄非重茬土壤、重茬土壤和生物菌肥土壤中微生物数量比较 从表1可以看出,在重茬土壤、非重茬土壤和生物菌肥土壤中细菌数量最多,放线菌次之,真菌最少。生物菌肥土壤中的细菌、放线菌、真菌数量均高于重茬和非重茬土壤。与非重茬土壤相比,重茬土壤中真菌数量较高,而细菌、放线菌数量较低。
2.1.2 不同取样时间施不同浓度生物菌肥的地黄重茬土壤中微生物数量分析 不同处理条件下的地黄重茬土壤中微生物数量不同,差别较大(图1)。细菌的数量最多,放线菌次之,真菌最少。
在不同培养时间施不同浓度生物菌肥的地黄重茬土壤中细菌数量如图1A所示。从生物菌肥浓度来看,细菌的数量随生物菌肥浓度的升高呈先增高后降低的趋势。细菌数量在生物菌肥浓度B2条件下最高,B3次之,B0最低。从不同取样时间来看,取样时间C2的土壤中细菌数量较取样时间C1、C3的土壤中细菌数量多。因此,施0.05%生物菌肥培养60 d取样的地黄重茬土壤中细菌数量最多,而不施生物菌肥培养30 d的地黄土壤中细菌数量最少。
在不同培养时间施不同浓度生物菌肥的地黄重茬土壤中放线菌数量如图1B所示。不同处理条件下的重茬土壤放线菌数量的变化趋势与细菌相似。在不同取样时间下,放线菌的数量随生物菌肥浓度的升高呈先增高后降低的趋势。放线菌数量在生物菌肥浓度B2条件下最高,B3、B4次之,B0最低。因此,在生物菌肥浓度0.05%的地黄重茬土壤中放线菌数量最多。
在不同培养时间施不同浓度生物菌肥的地黄重茬土壤中的真菌数量如图1C所示。从生物菌肥浓度来看,重茬土壤中的真菌数量先降低再稍微升高最后基本不变,浓度B2土壤中的真菌数量达到最低,B3次之,B0最高,其中生物菌肥浓度为0.05%、施用60 d后的土壤中真菌数量最少。
通过比较不同培养时间和施不同浓度生物菌肥的重茬土壤中细菌、真菌、放线菌数量,地黄重茬土壤中细菌和放线菌数量在生物菌肥浓度0.05%时达到最高,在生物菌肥浓度0.10%时次之,而不施生物菌肥最低。地黄重茬土壤中的真菌数量则与之相反。在生物菌肥浓度为0.05%、施用60 d后,地黄重茬土壤中细菌、放线菌数量最高,真菌数量最少。
2.2 基于UPLC-QTOF/MS的生物菌肥施用后对地黄重茬土壤根系残留化合物的影响
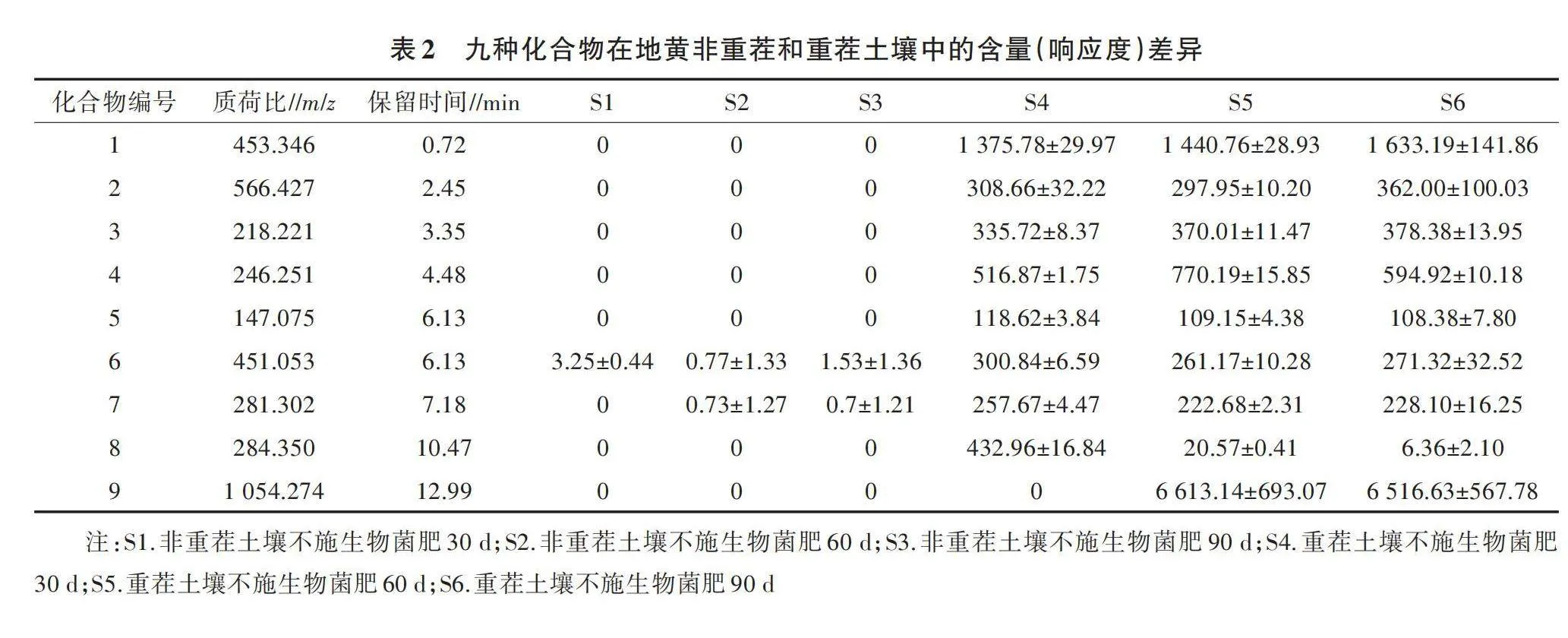
2.2.1 地黄重茬土壤中特有的根系残留化合物筛选 UPLC-QTOF/MS数据预处理包括滤噪、峰识别、重叠峰分析、峰对齐、峰补齐、标准化、归一化等。通过对不同处理条件下地黄重茬土壤的UPLC-QTOF/MS数据处理,获得2 745种化合物。根据某一化合物在地黄重茬土壤不施生物菌肥(培养30、60、90 d)的响应度大于地黄非重茬土壤不施生物菌肥(培养30、60、90 d) 的响应度筛选出9种化合物。在地黄非重茬土壤不施生物菌肥(培养30、60、90 d)的土壤中,化合物1至化合物9几乎不存在,其含量几乎为0。相反,在地黄重茬土壤不施生物菌肥(培养30、60、90 d)的土壤中,化合物1至化合物9的含量较高(表2)。因此,这9种化合物是地黄重茬土壤内特有的根系残留化合物。
2.2.2 生物菌肥施用后地黄重茬土壤中特有的根系残留化合物含量变化 通过比较化合物1至化合物9在施用不同生物菌肥浓度和不同取样时间的地黄重茬土壤中的含量,发现化合物2、化合物5、化合物6、化合物8的含量变化明显(图2)。
化合物2的含量随取样时间的增加整体呈降低趋势,在施菌剂后90 d含量最低。从生物菌肥浓度来看,化合物2的含量在生物菌肥浓度为B2条件下最低。化合物5、化合物6的含量变化趋势基本一致,在施生物菌肥后60 d最低。从生物菌肥浓度来看,化合物5和化合物6的含量在B3时最低,低于B0。从取样时间来看,化合物5、化合物6的含量在施生物菌肥后60 d最低。不施生物菌肥时,化合物8的含量最高,且不同的取样时间差别不大。随着生物菌肥浓度的增加,化合物8的含量急剧降低。在生物菌肥浓度0.05%时,化合物8含量几乎为0。
由此表明,施生物菌肥后,可有效降解地黄重茬土壤内特定的根系残留化合物2、化合物5、化合物6、化合物8。在生物菌肥浓度0.05%条件下,化合物2的含量最低,降解最多。化合物5和化合物6含量在生物菌肥浓度0.10%、施用60 d时最低。
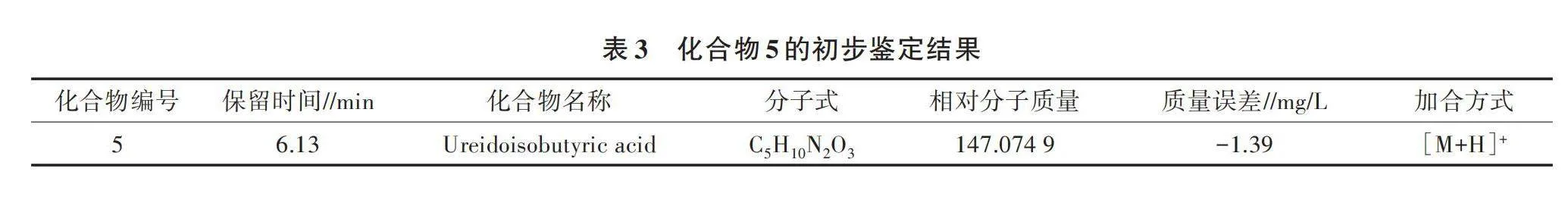
2.2.3 未知化合物的初步鉴定 根据“2.2.1”和“2.2.2”的结果,初步得出施用生物菌肥后对地黄重茬土壤根系残留化合物影响比较大的是化合物2、化合物5、化合物6、化合物8。结合QI、UNIFI软件,综合考虑相对分子质量、分子不饱和度以及同位素丰度等因素推算未知物的分子元素组成。通过各峰的一级质谱信息、二级质谱结果,在这4种影响重茬土壤根系残留化合物的差异未知物中,仅初步鉴定出化合物5为Ureidoisobutyric acid,其分子式为C5H10N2O3,相对分子质量为147.074 9(表3),但该化合物的相关功能还需进一步探讨。
3 小结与讨论
同一作物或近缘作物在同一块土壤上连续种植,出现发育不良、严重减产的现象称为连作障碍[24]。引起连作障碍的原因较为复杂,是作物和土壤两个系统综合作用结果的外观表现[25,26]。作物通过根系分泌某些化合物来吸引土壤中某些特定微生物类群,也能选择性抑制某些微生物类群[27]。土壤微生物区系对土壤质量有很大的影响,一般认为细菌型土壤是土壤肥力提高的生物学标志之一,真菌型土壤是地力衰退的标志之一[28]。随着地黄连续种植年限的增加,地黄土壤中微生物的多样性降低,优势种群数量发生改变,土壤微生物类型由细菌型向真菌型过渡,导致地力衰竭[29]。在本研究中,与地黄的非重茬土壤相比,重茬土壤中真菌的数量高于非重茬土壤,而细菌、放线菌的数量恰好相反,这与吴林坤等[13]的研究结果相似。同时,对地黄重茬土壤施用不同浓度的生物菌肥、不同时间取样分析发现,在生物菌肥浓度0.05%、取样时间60 d时,土壤中细菌、放线菌数量之和最高,而真菌数量相对较少。可见,外施生物菌肥可有效改变地黄重茬土壤微生物数量和微生物群落构成,该结果与卢明忠等 [18]的研究一致。
本研究筛选出9种地黄重茬土壤中特有的根系残留化合物。施用生物菌肥后,化合物2、化合物5、化合物6、化合物8是变化较大的土壤根系残留化合物。根据吴宗伟等[30]的研究,推测这4种化合物抑制机理可能与酚酸作用机理类似,主要通过对根的抑制阻碍地黄生长。虽然外施生物菌肥能够在一定程度上降解重茬土壤中根系残留的某些化合物,但这是多种微生物和土壤因素共同作用的结果,单一因素有一定的局限性。因此,重茬土壤中根系残留化合物的降解机制有待进一步研究。
参考文献:
[1] 田云鹤,王丰青,李明杰,等.不同地黄种质连作障碍效应分析[J].河南农业科学,2015,44(8):98-103.
[2] 张重义,林文雄.药用植物的化感自毒作用与连作障碍[J].中国生态农业学报,2009,17(1):189-196.
[3] 张重义,尹文佳,李 娟,等.地黄连作的生理生态特性[J].植物生态学报,2010,34(5):547-554.
[4] 黄锦鹏,刘 洪,魏晋贤.地黄连作障碍机制研究进展[J].南方农业,2016,10(6):29-30.
[5] 陈 慧,郝慧荣,熊 君,等.地黄连作对根际微生物区系及土壤酶活性的影响[J].应用生态学报,2007,18(12):2755-2759.
[6] ENWALL K,NYBERG K,BERTILSSON S,et al. Long-term impact of fertilization on activity and composition of bacterial communities and metabolic guilds in agricultural soil[J].Soil biology amp; biochemistry,2007,39(1):106-115.
[7] JANVIER C,VILLENEUVE F,ALABOUVETTE C,et al. Soil health through soil disease suppression: Which strategy from descriptors to indicators?[J].Soil biology amp; biochemistry,2007," " " "39(1):1-23.
[8] 薛 超,黄启为,凌 宁,等.连作土壤微生物区系分析、调控及高通量研究方法[J].土壤学报,2011(3):612-618.
[9] 孙凯宁,杨 宁,王克安,等.山药连作对土壤微生物群落及土壤酶活性的影响[J].水土保持研究,2015,22(6): 95-98.
[10] EISENHAUER N, SCHEU S, JOUSSET A. Bacterial diversity stabilizes community productivity[J].Plos one,2012,7(3):e34517.
[11] CHEN T,LI J,WU L K,et al. Effects of continuous monoculture of Achyranthes bidentata on microbial community structure and functional diversity in soil[J].Allelopathy journal,2015,36(2):197-211.
[12] HUANG L F,SONG L X,XIA X J,et al. Plant-soil feedbacks and soil sickness: From mechanisms to application in agriculture[J].Journal of chemical ecology,2013,39(2):232-242.
[13] 吴林坤,黄伟民,王娟英,等.不同连作年限野生地黄根际土壤微生物群落多样性分析[J].作物学报,2015, 41(2):308-317.
[14] LOON L C,BAKKER P A,PIETERSE C M. Systemic resistance induced by rhizosphere bacteria[J].Annual review of phytopathology,1998,36(1):453-483.
[15] 姬延伟,焦汇民,李 灿,等.微生物菌肥对梨树根系土壤微生物的影响[J].农业科学,2018,8(12):1454-1460.
[16] 葛均青,于贤昌,王竹红.微生物肥料效应及其应用展望[J].中国生态农业学报,2003,11(3):87-88.
[17] 肖 蓉,孙海峰,聂园军,等.复合微生物菌剂对重茬苹果园土壤细菌群落的影响[J].微生物学通报,2016, 43(2):301-309.
[18] 卢明忠,曾茂贵,张 宽,等.不同菌肥处理对重茬太子参产量和品质的影响[J].海峡药学,2016,28(10):42-44.
[19] 杜真辉,董诚明,熊玉萍,等.菌肥与复合肥组合对地黄产量及品质的影响[J].作物杂志,2016,32(4):146-149.
[20] 段淇斌,赵冬青,姚 拓,等.施用生物菌肥对饲用玉米生长和土壤微生物数量的影响[J].草原与草坪,2015, 35(2):54-58.
[21] 马玉琴,魏 偲,茆振川,等.生防型菌肥对黄瓜生长及根结线虫病的影响[J].中国农业科学,2016,49(15): 2945-2954.
[22] 周吉祥,张 贺,杨 静,等.连续施用土壤改良剂对沙质潮土肥力及活性有机碳组分的影响[J].中国农业科学,2020," " " " 53(16):3307-3318.
[23] 陈 冲,刘 伟,吴岳泰.4种微生物肥对再植苹果生长及土壤微生物群落结构的影响[J].山西果树,2017(1):3-5.
[24] 位小丫,林 煜,陈 婷,等.田间条件下植物促生细菌缓解太子参连作障碍的效果评价[J].生态学杂志,2018, 37(2):399-408.
[25] KAI M,EFFMERT U,PIECHULLA B. Bacterial-plant-interactions: Approaches to unravel the biological function of bacterial volatiles in the rhizosphere[J].Frontiers in microbiology,2016(7):1-14.
[26] MEINERS S J,PHIPPS K K, PENDERGAST T H,et al. Soil microbial communities alter leaf chemistry and influence allelopathic potential among coexisting plant species[J].Oecologia,2017," " 183(4):1155-1165.
[27] DOORNBOS R F,LOON L C,BAKKER P A H M. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere. A review[J].Agronomy for sustainable development,2012,32(1):227-243.
[28] 韩 哲,徐丽红,刘 聪,等.小麦残茬对连作西瓜生长及根际土壤微生物的影响[J].中国农业科学,2016,49(5):952-960.
[29] 李振方,杨燕秋,谢冬凤,等.连作条件下地黄药用品质及土壤微生态特性分析[J].中国生态农业学报,2012,20(2):217-224.
[30] 吴宗伟,王明道,刘新育,等.重茬地黄土壤酚酸的动态积累及其对地黄生长的影响[J].生态学杂志,2009,28(4):660-664.

