自然状态下黄连与土壤环境主要因子的相互作用




摘要:采集自然状态下生长的黄连(Coptis chinensis Franch)根周围的3个土壤样本,以其附近空白区域土壤作为对照,对土壤样本理化性质、可培养微生物数量、微生物类群与群落结构进行分析。结果表明,与对照土壤相比,黄连根周围土壤pH、有机质含量、有效磷含量、有效钾含量、可培养真菌数量极显著提高;土壤全氮含量、可培养细菌总量整体上显著提高;硝态氮水平极显著降低;可培养放线菌数量整体上变化不显著;土壤原核微生物数量下降,病原真菌数量增加。
关键词:黄连(Coptis chinensis Franch); 理化因子; 微生物类群; 自然状态; 土壤环境; 相关性分析
中图分类号:S567.5+2" " " " "文献标识码:A
文章编号:0439-8114(2024)12-0094-05
DOI:10.14088/j.cnki.issn0439-8114.2024.12.017 开放科学(资源服务)标识码(OSID):
The interaction between Coptis chinensis and major soil environmental factors
in natural state
WANG Qian1, FANG Zhi-wei 2, LI Shang-ren3, WANG Wen-juan4, WU Gao-ling1, WANG Zhi-yong1
(1.College of Biotechnology/Hubei Province South Characteristic Agricultural Industry Technology Research Institute, Xianning Vocational Technical College, Xianning" 437100,Hubei,China;2.Institute of Systems Biology/College of Life Science, Jianghan University,Wuhan" 430056, China;
3.Xianning Public Testing Center, Xianning" 437100, Hubei, China;4.College of Public Health and Health Professions, Hubei University of Science and Technology, Xianning" 437100, Hubei,China)
Abstract: Three soil samples around the roots of Coptis chinensis in the natural state were collected, and the surrounding blank areas were also collected as the control. The physical and chemical properties, cultivable microbial quantity, microbial groups, and community structure of these soil samples were analyzed. The results showed that, compared to the control soil, the pH, organic matter content, available phosphorus content, available potassium content, and the number of cultivable fungi in the soil around Coptis chinensis roots were significantly increased. The total nitrogen content and total cultivable bacteria in the soil were significantly increased compared to the control soil on the whole. The nitrate nitrogen level significantly decreased compared to the control soil. The number of cultivable actinomycetes did not show significant changes on the whole. The number of soil prokaryotic microorganisms decreased, while the number of pathogenic fungi increased.
Key words: Coptis chinensis Franch; physicochemical factors; microbial group; natural state; soil environment; correlation analysis
收稿日期:2024-08-27
基金项目:中央引导地方科技发展基金项目(Z135050009017-429);咸宁职业技术学院校级课题(2022Y038)
作者简介:王 潜(1994-),男,湖北咸宁人,主要从事园艺园林技术研究,(电话)18672330646(电子信箱)919700025@qq.com;并列第一作者,方治伟(1984-),男,河南开封人,实验师,硕士,主要从事生物信息学研究,(电话)13554678690(电子信箱)304734978@qq.com;李尚仁(1982-),男,湖北阳新人,医药工程师,主要从事药品检查研究,(电话)18972810653(电子信箱)229057897@qq.com;通信作者,王志勇(1967-),男,湖北咸宁人,教授,硕士,主要从事应用生物技术研究,(电话)13508649407(电子信箱)472027278@qq.com。
黄连(Coptis chinensis Franch)是毛茛科黄连属多年生植物,属于《野生药材资源保护管理条例》中的三级保护药材,别名味连,始载于《神农本草经》,后各朝代重要医药典籍均有记载,认为其性寒、味苦,归心、脾、胃、肝、胆、大肠经,有清热、燥湿、解毒、泻火等功效。用于湿热痞满、呕吐吞酸、泻痢、黄疸、高热神昏、心火亢盛、心烦不寐、心悸不宁、血热吐衄、目赤、牙痛、消渴、痈肿疔疮;外治湿疹、湿疮、耳道流脓。历版《中华人民共和国药典》所述黄连分别称“味连”“雅连”“云连”,均为多年生草本植物,以干燥根茎入药。据不完全统计,宋代以前古方书中有312万多方剂,约5%的方剂中有黄连。据《全国中成药品种目录》统计,以黄连作原料的中成药品种有108种[1]。
目前国内黄连人工栽培已有一定规模,如重庆市石柱土家族自治县已建GAP示范基地,是国内最大的黄连生产、销售基地。但黄连育苗移栽后需5~7年成熟,其产量也受诸多因素制约,而且黄连与其他中药材一样存在连作障碍[2],因此严重制约了黄连的人工栽培。
通过研究自然条件下黄连与土壤理化因子及微生物间的相互作用,能更好地反映黄连的真实生长需求,并更好地指导黄连人工栽培,从而减少对野生黄连的消耗,进而更好地保护野生黄连资源。
1 材料与方法
1.1 材料
1.1.1 样品的采集与处理 采样时间为2022年5月。采样地点为湖北省咸宁九宫山国家级自然保护区,具体地点为东经114°36′3″,北纬29°23′1″,海拔1 085 m。采样区属亚热带季风性湿润气候,四季分明;昼夜温差较大,盛夏多风;年均气温11.7 ℃,降雨量大,年降雨量约1 681 mm,相对湿度较大。
由于野生黄连数量有限,在采样区选择3个约100 m2的区域进行土壤样品的采集,每个区域约生长80株野生黄连,采样时沿南北方向按“S”形路线,每个点随机选择生长4年以上、大小规格相近的黄连根周围土壤作为研究对象(直径约10 cm,分别编号为1-1、2-1、3-1),以采样区中无黄连着生处相应的土壤为对照(分别编号为1-0、2-0、3-0),采集土样,采样深度为0~15 cm。采集黄连根周围土样后,随即用周围土壤将采样坑还原,并对黄连浇足定根水,尽量保证对黄连生长影响最小。土样充分混合后立即风干至湿度为20%~30%,过2 mm筛,尽量在短时间内进行测定分析[3]。
1.1.2 培养基
1)牛肉膏蛋白胨琼脂培养基。牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15~20 g,无菌水1 000 mL,pH 7.4~7.6。
2)改良马丁琼脂培养基。蛋白胨5.0 g,酵母浸出粉2.0 g,硫酸镁0.5 g,磷酸氢二钾1.0 g,葡萄糖20.0 g,琼脂15~20 g,无菌水1 000 mL,pH 7.4~7.6。
3)高氏一号培养基。可溶性淀粉20 g,NaCl 0.5 g,硝酸钾1 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,硫酸亚铁0.01 g,琼脂15~20 g,无菌水1 000 mL,pH 7.4~7.6。
1.1.3 试剂及仪器设备
1)主要试剂。重铬酸钾、硫酸亚铁、硝酸钾、氯化钠、硼酸均为分析纯,硫酸(优级纯),均由国药集团化学试剂有限公司生产;二硝基酚指示剂、氯化钾(分析纯),天津市光复精细化工研究所;MP bio土壤基因组DNA提取试剂盒(Fast DNA® Spin Kit for soil,116560,MP Biomedicals,USA);普通琼脂糖凝胶DNA回收试剂盒(DP209,天根生化科技有限公司);2×SG Green qPCR Mix (with ROX,Q1002,SinoGene Scientific Co.,Ltd.);DL2000 DNA marker (3427A,TaKaRa Bio Inc.);Qubit® dsDNA Assay Kit in Qubit® 2.0 Flurometer(Life Technologies,CA, USA);NEBNext® UltraTM DNA Library Prep Kit for Illumina® (NEB, USA)。
2)主要仪器设备。pH计(FE20型)、电子分析天平(XS105DU型),METTLER TOLEDO;全自动凯氏定氮仪(K9860型),济南海能仪器有限公司;紫外可见分光光度计(UV-2450型)、原子吸收分光光度计(AA7000型),SHIMADZU;培养箱(GXZ型),宁波东南仪器有限公司;超声波破碎仪(Covaris M220型),江苏肯尔菲实验仪器贸易有限公司;生物分析仪(Agilent 2100型),安捷伦科技(中国)有限公司;NovaSeq高通量测序平台,Illumina Inc.,USA;定量PCR仪(CFX Manager),Bio-Rad Laboratories;电泳仪(DYY-3C型)、凝胶成像仪(WD-9413A型),北京六一生物科技有限公司;台式离心机(MedifugeTM型),赛默飞世尔科技公司。
1.2 方法
1.2.1 土壤理化性质分析 土壤pH的测定采用电极法;土壤有机质(OM)的测定采用重铬酸钾外加热法;土壤全氮(TN)的测定采用凯氏定氮法;土壤硝态氮(NO3-N)的测定采用紫外分光光度法;土壤有效磷(A-P)的测定采用氟化铵-盐酸提取-钼锑抗比色法;土壤速效钾(A-K)的测定采用醋酸铵提取-原子吸收分光光度法;土壤含水量的测定采用常规的烘干称重和风干称重的方法[4]。
1.2.2 土壤可培养微生物数量测定 对各采样点的混合土样,参照《微生物学实验》[5],以稀释平板计数法利用“1.1.2”项的培养基分别测定土壤可培养细菌、真菌和放线菌的数量。
1.2.3 土壤微生物类群及多样性分析 考虑到各样品在同一片区域微生物类群及多样性存在相似性,本研究选择1-0、1-1这一组样品,先采用CTAB法提取总DNA[6],然后送北京诺禾致源科技股份有限公司测序,采用NCBI-nt库构建物种分类特征数据库,后采用Kraken2软件估算物种丰度,并计算Shannon-Wiener多样性指数[3]。
1.2.4 数据的统计分析 采用SPSS 16.0统计软件、Excel软件进行各数据的方差分析、单因素分析、相关性分析,利用Excel软件作图。
2 结果与分析
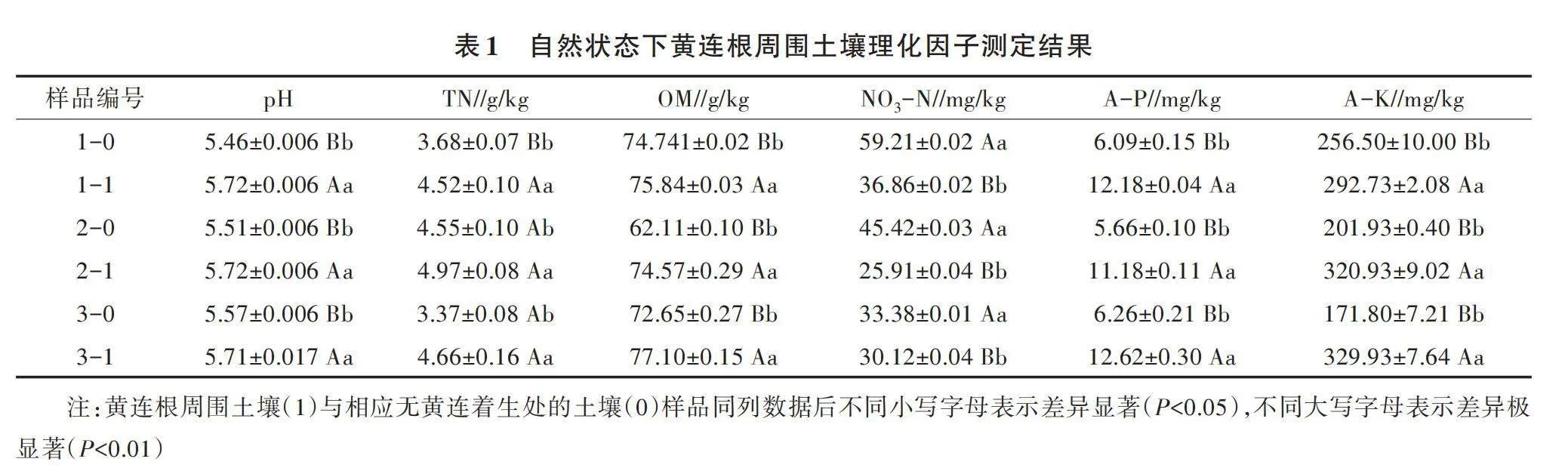
2.1 自然状态下黄连根周围土壤理化因子的变化
从表1可以看出,黄连根周围土壤pH、有机质含量、有效磷含量、有效钾含量比对照土壤极显著提高,土壤全氮含量比对照土壤显著或极显著提高;但是黄连根周围土壤硝态氮含量比对照土壤极显著降低。
自然条件下土壤有效磷和有效钾的来源主要是土壤难以利用磷和钾的分解。在黄连生长的条件下,黄连会通过根部分泌部分有机物质,这些有机物质能与土壤难溶性磷钾矿物质发生作用,促进其有效成分的释放,进而提高了土壤中有效磷、有效钾的含量。黄连根周围因黄连生长产生的枯枝落叶及根系分泌物的产生,使得土壤有机质含量与总氮含量均比对照高。研究表明,黄连在生长过程中通过多种途径向土壤中释放小檗碱、黄连碱等多种生物碱[7],因此黄连根周围的土壤pH提高。
2.2 可培养微生物计数结果
由图1可以看出,可培养细菌数量均显著增加,可培养真菌数量均极显著增加,可培养放线菌数量变化除样品2-0与2-1外均不显著。
微生物的活动通常与土壤有机质含量呈正相关,由于黄连生长使其根周围土壤有机质含量增加显著,因此细菌和真菌数量增加也显著,放线菌数量变化虽多数样品不显著,但均呈增加趋势。
2.3 各检测数据间相关性分析
相关性分析结果(表2)显示,pH与有机质、养分含量呈负相关,与微生物数量呈正相关。不同类型土壤pH与有机质、养分含量之间相关性不同。郭明全等[8]对攀枝花烟区750个土壤样本的pH与土壤养分间的关系研究表明,土壤pH与速效磷、速效钾存在显著的负相关,与有机质、碱解氮呈显著正相关。赵艺等[9]对内江市白马镇的土壤研究显示,土壤pH与土壤速效磷含量呈极显著负相关,与土壤缓效钾含量呈显著正相关,与水解性氮含量相关性不明显。这可能是不同土壤及其生境特点所致。本研究中采样点海拔较高,气候、土壤湿润,因此呈现出特有的结果。采样点酸碱度不高,因此微生物的活动利于酸碱度的稳定。有机质含量与pH、全氮、硝态氮、有效磷含量呈负相关,与有效钾含量及微生物数量呈正相关,原因也大体如此。
一般植物对土壤养分的吸收呈一定的相对比例,因此全氮含量与速效养分的含量呈正相关,速效养分含量之间均呈正相关。全氮、硝态氮含量与有机质含量、微生物数量呈负相关,这可能是因为自然状态下微生物比较活跃的活动消耗了土壤中的氧气,导致通气变差,反硝化作用上升,引起氮素损失。该结果与黄连的生长环境一致,表明黄连喜欢湿润环境,土壤含水量需在50%以上才可以保证黄连生长良好[10]。自然条件下,有机质来源少,有机质含量低时微生物的活动相对较弱,反硝化作用弱,氮素含量以及硝态氮反而会增加。
不同土壤有效磷含量与微生物量的相关性有一些差别。土壤有效磷含量高促进了微生物的生长繁殖,导致微生物总量增加。程伟[11]的研究显示,黑钙土土壤有效磷含量与微生物量呈现出负相关的特性,这是因为微生物的大量繁殖消耗了土壤中有限的速效磷,本研究结果与之一致。
2.4 微生物类群与多样性分析
测序结果仅保留相对丰度大于0.02%的类群用于后续分析,分析结果见表3。
由表3可以看出,1号采样区对照土壤与根际土壤检测到的原核微生物从门到科的数量差别不大,但检测到的属和种数量均多于黄连根际土壤。对照土壤与根际土壤检测到的真菌从门到种的数量差别不大,种的数量较属、科、目少,其原因可能是检测到的真菌类群数量较大,许多真菌种的相对丰度较小,但1个属多个丰度较小的真菌加和起来导致属、科、目的相对丰度反而较大。根周围土壤与对照区原核微生物与真菌Shannon-Wiener多样性指数均差别不大。
黄连主要病害包括黄连白粉病、根腐病、白绢病和炭疽病[12]。从宏基因组数据库中可以搜索到引起白粉病[布氏白粉菌(Blumeria graminis)]、根腐病[金黄尖镰孢(Fusarium oxysporum)]的2种病原菌,且根际土壤中的相对丰度较大;未发现白绢病和炭疽病的病原菌,可能是自然状态下因海拔较高,这些病原菌的传播受到一定影响,未能到达该区域。另有研究表明,食酸菌属的细菌数量在发病根际土壤增加,很可能与黄连病害发生有关[13]。宏基因组分析中也检测到食酸菌属的多个种,但根际土壤与对照土壤食酸菌类丰度差别不大(表4)。
主要反硝化细菌,如铜绿假单胞菌(Pseudomonas aeruginosa)、荧光假单胞菌(Pseudomonas fluorescens)、施氏假单胞菌(Pseudomonas stutzeri)、门多萨假单胞菌(Pseudomonas mendocina)、绿针假单胞菌(Pseudomonas chlororaphis)、脱氮硫杆菌(Thiobacillus denitrificans)均可见,且丰度均较高,根际土壤与对照土壤相对丰度差别不大。
3 讨论与小结
3.1 自然条件下黄连生长与土壤理化因素的相互作用及其对人工栽培的启示
土壤理化性质与植物发育、营养吸收、土壤微生物群落组成等密切相关。其中pH、有机质含量、主要营养元素含量等直接影响植物生态平衡,间接改变环境微生物的活性及群落多样性。根系分泌物堆积会直接改变土壤多种理化性质,如酚酸、生物碱等物质的分泌会改变土壤酸碱度,改变土壤有效营养物质的含量,导致植物根系微生物数量、类群及多样性的变化。许多陆生植物生长过程中土壤硝态氮的变化与土壤全氮、有机质、速效磷、速效钾含量变化相似,都比对照高[14]。本研究中由于自然条件下黄连生长环境湿度较大,土壤含水量较高,黄连生长环境中存在较多的反硝化细菌(与宏基因组分析结果一致),另外黄连在生长过程中会向环境释放生物碱,且自然条件下没有人为施用速效氮肥,即使在土壤全氮含量、有机质含量均增加时,土壤硝态氮含量依然显著下降。因此黄连人工栽培时要特别注意这个特殊现象,既要保持黄连生长对土壤水分与空气湿度的需求,又要注意控制水分,避免水分过多引起反硝化作用,使黄连生长所需速效氮不足,引起黄连生长缓慢。栽培实践中要少量多次施用速效的硝态氮,同时注意配合其他速效营养的施用。
3.2 自然条件下黄连生长与土壤微生物间的相互作用及其对人工栽培的启示
在生长过程中,植物与土壤微生物之间相互作用,有益和有害微生物通常处于动态平衡。一些植物特别是外来入侵植物在其生长过程中与土壤微生物间存在比较显著的相互促进关系[15]。本研究结果显示,在自然条件下,黄连连作时会导致病原真菌丰度增加,有益菌在竞争中往往表现出弱势,进而严重影响后茬植物的生长发育,形成连作障碍。
土壤环境中既存在对植物生长有益的微生物,也存在对植物生长有害的微生物。因此,从人工栽培的角度出发,分离筛选有益的对黄连生长具有促进与保护作用的微生物并应用到黄连栽培中具有重要意义。
参考文献:
[1] 陈馥馨,高晓山.含黄连方剂及黄连配伍药的文献统计[J].中成药,1997,19(8):40-41.
[2] 张 丹.基于黄连化感物质与微生物群落结构变化的连作障碍机制研究[D].成都:成都中医药大学,2015.
[3] 章家恩.生态学常用实验研究方法与技术[M].北京:化学工业出版社,2007.
[4] 全国农业技术推广服务中心.土壤分析技术规范[M].第二版.北京:中国农业出版社,2000.
[5] 赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2007.
[6] 张 婧,刘广娜,左蔚琳.土壤微生物基因组DNA不同提取方法的比较及PCR扩增体系的建立[J].吉林农业,2018(16):55-56.
[7] 李雪改,杨立国,陈丽霞,等.黄连水提液化学成分的分离与鉴定[J].沈阳药科大学学报,2012,29(3):193-198,226.
[8] 郭明全,胡建新,张宗锦.攀枝花烟区土壤pH分布特点及其与土壤有效养分的关系[J].西南农业学报,2012,25(4):1338-1342.
[9] 赵 艺,施泽明,师刚强.土壤pH值与土壤养分有效态关系探讨——以内江市白马镇为例[J].四川环境,2009,28(6):81-83.
[10] 刘 丹,吴田泽,孟祥霄,等.无公害黄连栽培技术体系探讨[J].中国现代中药,2018,20(11):1396-1403,1410.
[11] 程 伟.土壤有效磷含量对土壤微生物量及代谢活性的影响[D].长春:吉林农业大学,2013.
[12] 唐立高.黄连主要病虫害诊断与防治方法[J].现代园艺,2013(11):103-104.
[13] 谭 渊,陈 强,刘汉军,等.不同种植年限黄连根系土壤细菌PCR-DGGE分析[J].中国中药杂志,2015,40(16):3147-3151.
[14] 周群英,高廷耀.环境工程微生物学[M].北京:高等教育出版社,2000.
[15] 王志勇,江雪飞,郑 慧,等.空心莲子草入侵对土壤细菌群落结构及其多样性的影响[J].化学与生物工程 2011,28(11):17-21.

