红花龙胆的组织培养研究


摘 要:为建立红花龙胆的组培快繁体系,对外植体的选择、消毒方法、无菌系的建立、继代培养、生根培养、组培苗的壮苗及移栽等进行研究。结果显示:红花龙胆的组织培养最合适的外植体是茎尖,初代培养选择75%的酒精和0.1% HgCl2消毒,污染率最低,效果最佳;诱导培养基选择MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+蔗糖30 g/L+琼脂0.5%;继代培养基MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+IBA 0.2 mg/L+蔗糖30 g/L+琼脂0.5%+活性炭0.2%~0.3%;生根培养基为1/2MS+NAA 0.5 mg/L
+IBA 0.2 mg/L+蔗糖30 g/L+琼脂0.5%+活性炭0.2%~0.3%;珍珠岩∶蛭石∶腐殖土为1∶1∶1作为移栽基质,其移栽成活率达90%以上。
关键词:红花龙胆;组织培养;外植体
中图分类号:S435.672 文献标志码:B 文章编号:2095–3305(2024)10–00-03
红花龙胆又叫龙胆草、土白莲、九月花、星秀花、冷风吹和雪里梅,属于龙胆科[1]。红花龙胆味苦、性寒,属于寒性中药。全草入药,具有清热除湿、解毒、止咳的功效,能治湿热黄疸、肺热咳嗽、小便不利等症。
当前关于红花龙胆的研究很多,在红花龙胆血清药物化学、红花龙胆的栽培、化学成分、资源调查、显微鉴别、生药学鉴定等方面均有研究,在组织培养方面有红花龙胆愈伤组织诱导研究、红花龙胆组培快繁体系研究[2-10]。野生红花龙胆由于受自然环境和生长条件的限制,产量较低,加之民间人为采挖比较严重,导致资源不断减少[11-16]。对此,为进行种源保护,对红花龙胆的组织培养进行研究具有重要意义。
1 材料来源
红花龙胆外植体是从贵州省兴义丰都和白碗窑、兴仁大山、安龙笃山等地采集。采集点远离公路和村寨,采集到的外植体受污染程度较小。
2 外植体的采集
2.1 外植体的采集时间
红花龙胆的外植体在3—8月均可进行采集,最佳采集时间为4—5月。这期间采集的红花龙胆幼嫩,生理机能旺盛,容易消毒灭菌和培养,分化率高。8月后采集的红花龙胆,已进入生长末期,对诱导培养的反应迟钝,诱导时间过长,或者不分化。值得注意的是,采集红花龙胆的外植体尽量不要在雨天取材,这样灭菌比较困难,污染率高,采集应在雨后晴天的早晨进行。
2.2 外植体的采集部位
取红花龙胆带侧芽的幼嫩茎段、茎尖作外植体,茎尖的生长速度快,培养5~10 d后开始生长,幼嫩茎段的侧芽容易萌发,且有稳定的遗传性状。
3 培养基的选择和培养条件
诱导培养基:MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+
30 g/L蔗糖+0.5%琼脂;MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂。
继代培养基:MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+
IBA 0.2 mg/L+30 g/L蔗糖+0.5%琼脂+0.2%~0.3%活性炭;
生根培养基:1/2MS+NAA 0.5 mg/L+IBA 0.2 mg/L
+30 g/L蔗糖+0.5%琼脂+0.2%~0.3%活性炭。
诱导、继代、生根培养都选择MS培养基,细胞分裂素用6-BA,浓度为1.5 mg/L,生长素选择NAA和IBA,蔗糖提供碳源和调节培养基的渗透压,琼脂作为支持物,活性炭吸附有毒副作用的物质。
配制好的培养基在121 ℃条件下灭菌20~30 min,
接种后置于培养室中,光照强度为1 000~2 000 Ix,培养温度为(25±1)℃,空气湿度保持在80%以上进行培养。
4 培养方法
4.1 外植体的消毒灭菌及无菌系的建立
外植体的消毒灭菌主要采用以下两种方法:一种是将受污染程度较小的红花龙胆幼嫩茎段、茎尖用矿泉水浸泡30 min~2 h,用70%~75%的酒精消毒15~18 s,
再用无菌水洗涤3~4次,0.1%的氯化汞(HgCl2)消毒15~18 min,继续用无菌水洗涤3~5次;另一种是用5%的次氯酸钠取代0.1% HgCl2消毒灭菌15~20 min,无菌水洗涤3~4次。
将消毒灭菌后的茎切成0.5~1 cm的小段,每段至少有1个侧芽,茎尖切成0.5 cm的小段接种到诱导培养基MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂和MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂上进行培养,使用MS+6-BA 1.5 mg/L+
NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂作为诱导培养基,茎尖作为外植体,5~10 d后侧芽和顶芽开始生长。待35 d后长出1~4个侧芽,茎长为3~5 cm,2个月后转接到继代培养基上进行继代培养。使用MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂作为诱导培养基,茎尖作为外植体,15 d后侧芽和顶芽开始生长。待45 d后长出1~2个侧芽,茎长长至2~4 cm,2个半月后转接到继代培养基上进行继代培养。
4.1.1 初代培养的污染率
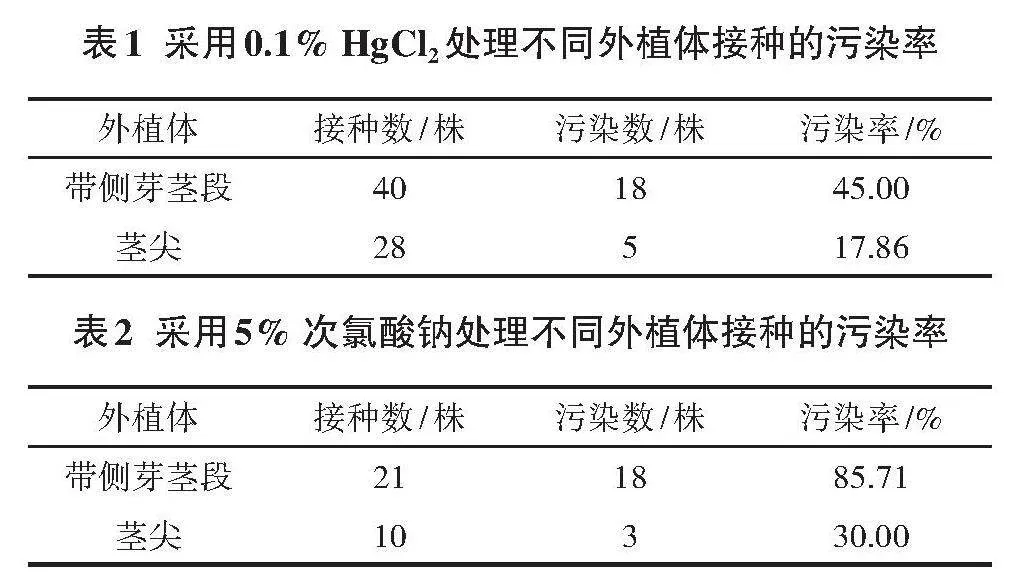
两种方式处理不同外植体的污染率的具体情况见表1、表2。
初代培养的消毒灭菌处理分析:由表1和表2中的数据可以看出,采用0.1% HgCl2处理不同外植体接种的污染率明显低于采用5% 次氯酸钠处理不同外植体接种的污染率,因此采用0.1% HgCl2处理的效果较好。但其缺点是汞离子不易去除,必须多次用无菌水冲洗,并且剧毒的HgCl2在自然中和在人体内都不会降解,使用时要小心谨慎,使用后的消毒剂废液及洗涤外植体的废水要做回收处理,避免对环境造成污染[17]。
表1" 采用0.1% HgCl2处理不同外植体接种的污染率
外植体 接种数/株 污染数/株 污染率/%
带侧芽茎段 40 18 45.00
茎尖 28 5 17.86
表2" 采用5% 次氯酸钠处理不同外植体接种的污染率
外植体 接种数/株 污染数/株 污染率/%
带侧芽茎段 21 18 85.71
茎尖 10 3 30.00
4.1.2 初代培养的分化率
在采用0.1% HgCl2处理情况下,两种培养基接种外植体分化率的具体情况见表3、4。
由表3和表4可以看出,采用茎尖作为外植体时,
在培养基MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+
0.5%琼脂中的分化率为71.43%,在培养基MS+6-BA
2.0 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂中的分化率为60.00%,使用MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+
30 g/L蔗糖+0.5%琼脂作为初代培养基效果较好。采用
带侧芽茎段作为外植体时,在培养基MS+6-BA 1.5 mg/L+
NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂中的分化率为5.00%,
在培养基MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+
0.5%琼脂中的分化率为14.29%,使用MS+6-BA 2.0 mg/L+
NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂作为初代培养基效果较好。此外,无论是采用MS+6-BA 1.5 mg/L+NAA
0.5 mg/L+30 g/L蔗糖+0.5%琼脂培养基,还是MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+0.5%琼脂培养基,茎尖的分化率都比带侧芽茎段的分化率高,因此在红花龙胆的组织培养中,茎尖是最佳的外植体。
表3" 培养基MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+
30 g/L蔗糖+0.5%琼脂的分化率
外植体 接种数/株 分化数/株 分化率/%
带侧芽茎段 40 2 5.00
茎尖 28 20 71.43
表4" 培养基MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+
30 g/L蔗糖+0.5%琼脂的分化率
外植体 接种数/株 分化数/株 分化率/%
带侧芽茎段 21 3 14.29
茎尖 10 6 60.00
4.1.3 初代培养消毒灭菌处理时间的控制
根据表5和表6中的数据对比发现,应严格控制对红花龙胆外植体的消毒灭菌时间。消毒时间过短,初代培养容易造成污染,污染率高;消毒时间过长,消毒剂容易使红花龙胆的组织造成损伤,甚至死亡,死亡率高。从表5和表6中可知,75% 酒精对红花龙胆消毒的最佳时间为15~18 s,0.1% HgCl2对红花龙胆消毒的最佳时间为15~18 min。
表5" 采用75% 酒精和0.1% HgCl2处理茎尖,不同消毒灭菌时间的死亡率
75%酒精消毒时间/s 0.1% HgCl2消毒时/min 接种数/株 死亡数/株 死亡率/%
10~12 12 37 0 0.00
15~18 15 28 3 10.71
15~18 18 32 4 12.50
20 20 60 20 33.33
表6" 采用75% 酒精和0.1% HgCl2处理茎尖,不同消毒灭菌时间的污染率
75%酒精消毒时间/s 0.1% HgCl2消毒时间/min 接种数/株 污染数/株 污染率/%
10~12 12 37 23 63.16
15~18 15 28 5 17.86
15~18 18 32 3 9.38
20 20 60 2 3.33
4.2 继代培养
待初代培养中侧芽和顶芽长至3~5 cm时,转接到继代培养基MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+IBA 0.2 mg/L+30 g/L蔗糖+0.5%琼脂+0.2%~0.3%活性炭上,进行继代培养,45 d为一个周期转接一次。
在红花龙胆的继代培养过程中,会出现褐变现象。而茎尖和幼嫩茎段褐变程度较低,因此在继代培养中应选择茎尖和幼嫩茎段继续培养。此外,在培养基中添加0.2%~0.3%的活性炭可以有效避免酚类物质被氧化产生醌类物质的毒害作用,防止褐化。
在红花龙胆的继代培养中,仍然会出现乳白色的细菌污染,菌斑呈黏液状,接种2~3 d开始出现,因此要进行防治。对培养基要进行彻底灭菌,先排净高压锅里面的冷空气,然后升温至121 ℃,灭菌20~30 min;接种操作器械也要进行彻底灭菌,镊子、接种环等接种工具每使用一次都要在酒精灯上进行灼烧灭菌;操作人员在接种过程中禁止讲话、打喷嚏,要注意呼吸,操作要规范熟练;培养瓶和盖要定期检查,瓶和盖有损坏要立即更换;被细菌污染的培养基,对培养基进行高压灭菌后再进行清洗,防止交叉污染。
4.3 生根培养
待继代培养中苗长到5~8 cm时,将生长健壮的苗从继代培养基中转接生根培养基1/2MS+NAA 0.5 mg/L+IBA 0.2 mg/L+30 g/L蔗糖+0.5%琼脂+0.2%~0.3%活性炭中进行生根,生长不健壮的苗继续转接到继代培养基中进行继代培养,生根培养的温度为25~27 ℃,
光照强度为1 000 lx,光照时间8~10 h/d,培养15 d后,
待根长为1~2 cm时,取出茎苗,洗净基部的培养基,进行移栽。
5 炼苗移栽和田间管理
生根培养15~30 d后,组培苗根长到1~2 cm时,打开瓶盖,在培养基上加薄层水,移至大棚中培养5~7 d,取出组培苗移栽到珍珠岩∶蛭石∶腐殖土为1∶1∶1的基质中,在基质中可以适当加入一些农家肥。取苗时要用镊子小心操作,切勿将根系损坏,清洗黏附在根系上的琼脂,动作要轻,减少或避免伤根伤苗。移栽时用小铲或粗的竹签在基质中开穴,然后再种植红花龙胆组培苗,使根舒展开。移栽后3~5 d浇1次水,移栽初期保持空气湿度为90%以上,温度保持20~25 ℃。移栽后要注意防治红花龙胆的根腐病,在移栽前使用甲霜恶霉灵稀释成1 500~2 000倍液浸泡或者移栽后使用甲霜恶霉灵稀释成1 500~2 000倍液喷施叶面可以进行有效防治。
6 结论
在红花龙胆的组织培养中,初代培养的培养基选择MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+30 g/L蔗糖+
0.5%琼脂效果较好,外植体采用茎尖,外植体的消毒灭菌采用的方法是用矿泉水浸泡30 min~2 h,70%~75%的酒
精消毒15~18 s,再用无菌水洗涤3~4次,0.1% HgCl2消毒15~18 min,继续用无菌水洗涤3~5次,污染率最低。
继代培养选择培养基MS+6-BA 1.5 mg/L+NAA 0.5 mg/L+IBA 0.2 mg/L+30 g/L蔗糖+0.5%琼脂+0.2%~
0.3%活性炭,继代效果较好。
生根培养选择培养基为1/2MS+NAA 0.5mg/L+
IBA 0.2 mg/L+30g/L蔗糖+0.5%琼脂+0.2%~0.3%活性炭,生根效果较好。
移栽后的田间管理要防止红花龙胆的根腐病,移栽前可使用甲霜恶霉灵稀释成1 500~2 000倍液浸泡根部,以防治根腐病。
参考文献
[1] 张松瑶.红花龙胆血清药物化学初步研究[J].中西医结合心血管病电子杂志,2017,5(34):18-19.
[2] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020.
[3] 李海峰,赵志莲,刘光明.红花龙胆草的栽培[J].中国花卉园艺,2006(20):33-34.
[4] 陈云,王国凯,武璨,等.红花龙胆化学成分研究[J].中国中药杂志,2013,38(3):362-365.
[5] 周谣,王苗苗,刘翰飞,等.红花龙胆中萜类化学成分的研究[J].中国药学杂志,2023,58(17):1540-1546.
[6] 沈涛,张霁,杨庆,等.云贵高原红花龙胆生态适宜性区划研究[J].中国药学杂志,2017,52(20):1816-1823.
[7] 徐伟,孙爱群,张镇,等.贵州红花龙胆资源调查及主要形态性状分析[J].六盘水师范学院学报,2014,26(6):1-6.
[8] 周雪林,于振,孙爱群,等.红花龙胆的显微鉴别及硒含量的测定[J].北方园艺,2014(2):156-158.
[9] 王雪萍,许春泉.红花龙胆的生药学鉴定[J].沈阳药学院学报,1992(3):179-184.
[10] 詹亚华,李西林.红花龙胆生药学研究[J].武汉植物学研究,1985(3):237-242.
[11] 晋海军,张嘉,申旭峰,等.红花龙胆愈伤组织诱导及其生理生化特性分析[J].分子植物育种,2021,19(16):5482-5488.
[12] 钟世浚,张碧东,赖世婷,等.红花龙胆组培快繁体系研究[J].植物研究,2021,41(5):753-759.
[13] 胡卫珍,陈晓芳,袁钰.天冬组培快繁技术体系的研究[J].种子科技,2024,42(5):42-44.
[14] 王思思,蔡菊,张涛,等.柳叶马鞭草离体快繁体系建立[J].种子,2024,43(2):135-141,149,157.
[15] 游启孙.林下药用植物风柜斗草茎段组培快繁[J].绿色科技,2021,23(19):147-150.
[16] 席银凯,黄衡宇,曾彪.药用植物白及组培苗瓶内复壮研究[J].中国农学通报,2020,36(22):61-68.
[17] 莫小路,姚军.药用植物组培快繁技术[M].北京:化学工业出版社,2020.
收稿日期:2024-08-15
基金项目:黔西南州科技计划项目“民族药倒提壶总生物碱提取工艺优化及安全性评价”(2023-1-18)。
作者简介:曾镇广(1971—),男,贵州兴义人,副教授,研究方向为分析化学、药物分析、药用植物组织培养。

