PEG的分散性及结构对PEG化胶束在BSA溶液中稳定性的影响



摘 要: 聚乙二醇(Polyethylene glycol, PEG)化胶束在体外的稳定性是其作为纳米药物载体的重要参考指标。将不同分散性和结构的PEG,与十八烷酸、十四烷酸、1,2-二硬脂酸-3-磷脂酰乙醇、胆固醇、维生素E琥珀酸酯、N,N-双十四烷基胺和抗癌药物紫杉醇等合成一系列两亲性聚合物;分析在相同疏水段的条件下,PEG的分散性和结构对其胶束临界胶束浓度(Critical micelle concentration, CMC)、粒径以及在牛血清白蛋白(BSA)溶液中的稳定性的影响。结果显示:PEG的分散性对线形PEG化胶束的CMC和粒径影响不明显,分支结构的PEG化胶束在CMC和粒径上均显著小于线形PEG化胶束;在BSA溶液中,分支结构的PEG化胶束的稳定性显著优于线形单分散的,多分散PEG化胶束的稳定性最差,PEG结构和分散性影响胶束的体外稳定性。该文结果为开发单分散PEG化胶束的药物递送系统提供了重要的理论依据。
关键词: 单分散PEG;胶束;分支结构;牛血清白蛋白;体外稳定性
中图分类号: TQ432.2
文献标志码: A
文章编号: 1673-3851 (2024)11-0743-10
引文格式:林超,袁于民. PEG的分散性及结构对PEG化胶束在BSA溶液中稳定性的影响[J]. 浙江理工大学学报(自然科学),2024,51(6):743-752.
Reference Format:" LIN" Chao,YUAN" Yumin. Effect of PEG dispersity and structure on the stability of PEG micelles in BSA solutions[J]. Journal of Zhejiang Sci-Tech University,2024,51(6):743-752.
Effect of PEG dispersity and structure on the stability of PEG micelles in BSA solutions
LIN Chao1,2, YUAN Yumin2
(1a.School of Materials Science amp; Engineering; 1b.Institute of Smart Biomedical Materials, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2.Biomatrik Inc., Jiaxing 314001, China)
Abstract: The in vitro stability of polyethylene glycol (PEG)-modified micelles is a crucial factor for their application as nanocarriers for drug delivery. A series of amphiphilic polymers were synthesized by using PEGs with different dispersities and structures, combined with octadecanoic acid, tetradecanoic acid, 1, 2-distearoyl-sn-glycero-3-phosphoethanolamine, cholesterol, vitamin E succinate, N, N-ditetradecylamine, and the anticancer drug paclitaxel. The study investigated the effects of PEG′s dispersity and structure on the critical micelle concentration (CMC), particle size, and stability in bovine serum albumin (BSA) solutions under the same hydrophobic segment conditions. The results show that the dispersion of PEG has little effect on the CMC and particle size of linear PEGylated micelles, while the branched PEGylated micelles are significantly smaller in CMC and particle size than linear PEGylated micelles; the stability of branched PEGylated micelles in BSA solutions is superior to that of their linear monodisperse counterparts, while the stability of polydisperse PEGylated micelles is unsatisfactory. PEG structure and dispersity affect the in vitro stability of micelles. The results of this paper provide important reference for the development of drug delivery systems with monodisperse PEG micelles.
Key words: monodisperse PEG; micelles; branch structure; bovine serum albumin; in vitro stability
0 引 言
利用两亲性分子在水溶液中自组装以形成由疏水核和亲水冠组成的胶束,是药物递送中的常用载体。疏水核通常为可生物降解的聚合物或小分子药物,如聚丙交酯(PLA)[1]、小分子脂肪酸[2-3]、胆固醇(Chol)[4]、维生素E(VE)[5-6]、N,N-双十四烷基胺[7]和抗癌药物紫杉醇(PTX)[8]等,并通过亲水基团与疏水基团的相互作用来稳定胶束结构、促进疏水性药物的溶解,且亲水链段在外层形成电晕,提供水环境中的稳定性。聚乙二醇(Polyethylene glycol, PEG)作为比较常用的亲水性聚合物,在体内具备“隐形”特性,在胶束药物递送系统中占据主导地位。在体内环境中,胶束的PEG冠可以减少血液中的蛋白质吸附[9],从而避免被单核吞噬细胞系统(Mononuclear phagocyte system, MPS)和网状内皮系统(Reticuloendothelial system, RES)快速清除,增加循环时间,并通过增强渗透性和保留效应促进胶束在肿瘤部位的积累[10-11]。因此,PEG化胶束在疏水药物的靶向递送领域被广泛研究,封装疏水性PTX的PEG化胶束(mPEG-PLA)制剂已在亚洲上市[12]。
通过对PEG化胶束的临界胶束浓度(Critical micelle concentration,CMC)和蛋白吸附实验来研究胶束在体外的稳定性,从而为PEG化胶束在体内稳定性研究提供参考依据。CMC是胶束形成能力和保持完整性的主要关键指标,与两亲性分子的结构和亲水亲油平衡值密切相关。一方面随着PEG链长的增加,其亲水亲油平衡值增加,CMC增加,胶束的尺寸也随之增加[13-15];另一方面随着PEG链长的增加,其抵御蛋白吸附的能力增强,使胶束在蛋白溶液中的稳定性增加[12]。目前多分散PEG是纳米药物(脂质纳米颗粒、脂质体、胶束和其他形式的纳米颗粒)中使用最广泛的亲水性材料,它为不同链长的PEG所组成的同系混合物,而单分散则是由相同链长的PEG组成。迄今为止关于PEG的分散性对胶束稳定性影响研究的报道较少。郝祖杭等[13]通过对比多分散与单分散甲氧基聚乙二醇-四苯乙烯(mPEG-TPE)胶束在牛血清白蛋白(BSA)溶液中稳定性发现,单分散mPEG-TPE胶束比多分散胶束具有更好的稳定性。此外,PEG结构的变化也会对其胶束的稳定性产生影响,分支结构的PEG化胶束比线形的PEG化胶束具有更小的胶束粒径和更好的屏蔽非特异性蛋白的吸附[16-18],在体内有更好的“隐身效果”、更长的半衰期和更好的生物利用度[19-21]。
本文选择十八烷酸、十四烷酸、硬脂酸、Chol、VES、N,N-双十四烷基胺和抗癌药物PTX疏水性化合物,研究其与线形PEG键合后的具有相同疏水核但分散性不同的衍生物,测定PEG化胶束粒径在BSA溶液中的变化来判断胶束的稳定性;并合成以赖氨酸为节点的分支PEG,分别与N,N-双十四烷基胺和PTX合成分支结构的PEG衍生物,将其与对应的线形PEG化胶束进行比较。本文结果为开发单分散PEG胶束在药物递送领域应用提供了重要的参考意义。
1 实验部分
1.1 实验材料与仪器
1.1.1 材 料
线形多分散(MW=2000 Da)与单分散(n=45)的甲氧基聚乙二醇-双琥珀酰亚胺戊二酸酯(mPEG-DSG)、甲氧基聚乙二醇-二肉豆蔻酰基-外消旋-甘油(mPEG-DMG)、甲氧基聚乙二醇-二硬脂酰磷脂酰乙醇胺(mPEG-DSPE)、甲氧基聚乙二醇-胆固醇(mPEG-Chol)、甲氧基聚乙二醇-维生素E琥珀酸酯(TPGS)、甲氧基聚乙二醇-双十四烷基乙酰胺(ALC-0159)、甲氧基聚乙二醇-紫杉醇(mPEG-PTX)以及分支(mPEG23)2-Lys-COOH和(mPEG23)2-Lys-COONHS由浙江博美生物技术有限公司提供,N,N-双十四烷基胺、PTX、磷酸盐缓冲液(PBS)、4-二甲氨基吡啶(DMAP)和二环己基碳二亚胺(DCC)购自上海阿拉丁生化技术有限公司,二氯甲烷(DCM)、乙酸乙酯(EA)、盐酸(HCl)、四氢呋喃(THF)、氘代氯仿(CDCl3)、乙腈(ACN)、无水硫酸镁(MgSO4)和氢氧化钠(NaOH)购自湖州双林化学科技有限公司,BSA购自北京索莱宝科技有限公司。
1.1.2 仪 器
纳米粒度电位分析仪(BeNano 180 Zeta Pro,丹东百特);透射电子显微镜(TEM,Hitachi ht7800,日本);基质辅助激光解析飞行时间质谱仪(MALDI-TOF/TOF,德国布鲁克);核磁共振氢谱仪(1H NMR,600 MHz,德国布鲁克);表面张力仪(OT-60,宁波新边界);高效液相色谱-电喷雾检测器(HPLC,UltiMate3000,美国赛默飞世尔)。
1.2 样品的制备
1.2.1 两亲性化合物的合成
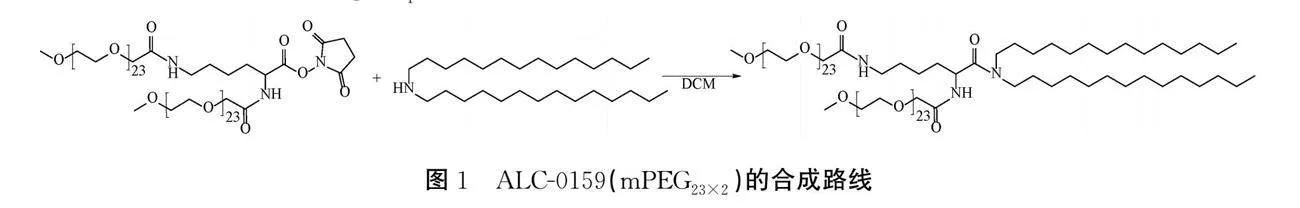
a)分支ALC-0159的合成。分支ALC-0159的合成路线如图1所示,具体如下:将(mPEG23)2-Lys-COONHS(1.00 g,0.414 mmol)、N,N-双十四烷基胺(0.34 g,0.829 mmol)加入到DCM(20 mL)溶液中,常温状态下搅拌6 h,通过层析硅胶板监测反应液中原料反应完后,使用清水(20 mL)对反应进行淬灭。对有机相用0.1 mol/L的HCl溶液(25 mL×3)萃洗杂质,无水MgSO4干燥有机相,减压蒸干有机溶剂得到ALC-0159(mPEG23×2)的粗产物,再经柱层析纯化,最后用EA(10 mL)重结晶,减压蒸干有机溶剂得白色粉末状ALC-0159(mPEG23×2)(0.86 g,产率77%,HPLC:94.17%)。1H NMR (600 MHz, Chloroform-d) δ 7.36 (d, J=8.7 Hz, 1H), 6.92 (t, J=6.0 Hz, 1H), 4.89 (td, J=8.5, 4.8 Hz, 1H), 4.07-3.94 (m, 4H), 3.64 (s, 180H), 3.55 (t, J=4.7 Hz, 4H), 3.38 (s, 6H), 3.33-3.19 (m, 4H), 3.05 (dt, J=14.0, 7.6 Hz, 1H), 1.76-1.69 (m, 1H), 1.59 (m, J=29.4, 15.0, 7.2 Hz, 4H), 1.50 (p, J=7.4 Hz, 3H), 1.36 (q, J=8.1 Hz, 2H), 1.32-1.22 (m, 44H), 0.88 (t, J=6.9 Hz, 6H)。
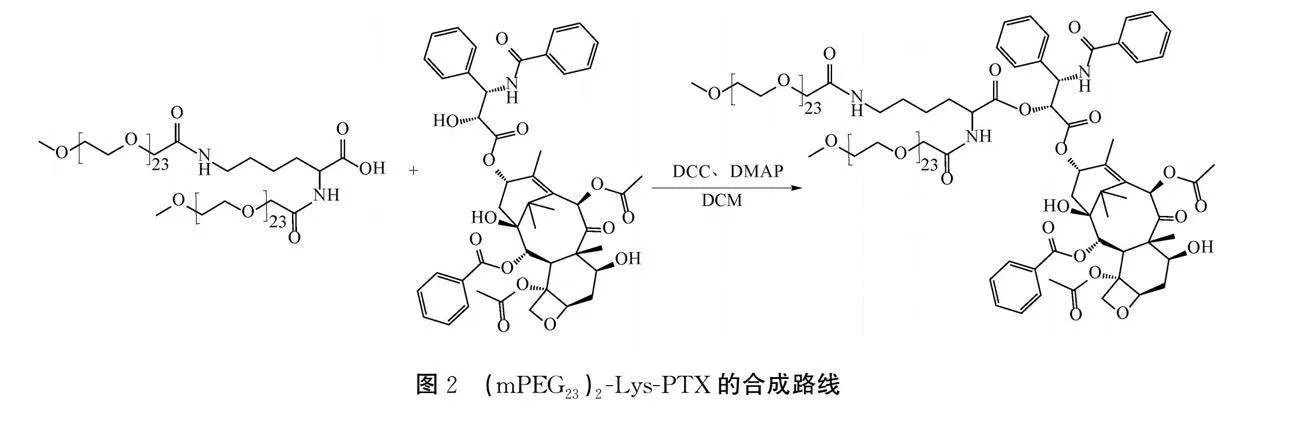
b)分支mPEG-PTX的合成。分支mPEG-PTX的制备方法如图2所示,具体如下:将(mPEG23)2-Lys-COOH(1.00 g,0.432 mmol)、PTX(0.55 g,0.647 mmol)、DCC(0.25 g,1.197 mmol)和DMAP(3.00 mg,0.025 mmol)加入DCM(20 mL)的溶液中,常温状态下搅拌6 h,层析硅胶板监测反应液中原料反应完后,使用清水(20 mL)对反应进行淬灭。对有机相用0.1 mol/L的NaOH水溶液(25 mL×3)萃洗杂质,无水MgSO4干燥有机相,减压蒸干有机溶剂得到(mPEG23)2-Lys-PTX的粗产物,再经柱层析纯化,最后用EA(10 mL)重结晶,减压蒸干有机溶剂得白色粉末状(1.13 g,产率83%,HPLC:93.51%)。1H NMR (600 MHz, Chloroform-d) δ 8.17-8.12 (m, 2H), 7.90-7.82 (m, 2H), 7.65-7.60 (m, 1H), 7.53 (t, J=7.6 Hz, 2H), 7.49-7.45 (m, 3H), 7.40 (td, J=7.5, 5.8 Hz, 3H), 7.30 (d, J=7.4 Hz, 1H), 7.05 (t, J=6.2 Hz, 1H), 6.30 (d, J=9.8 Hz, 1H), 6.18 (t, J=9.1 Hz, 1H), 5.98 (dd, J=9.0, 4.4 Hz, 1H), 5.67 (d, J=7.1 Hz, 1H), 5.47 (d, J=4.4 Hz, 1H), 5.00-4.96 (m, 1H), 4.68 (td, J=8.1, 5.5 Hz, 1H), 4.44 (m, J=10.9, 6.5, 4.1 Hz, 1H), 4.31 (d, J=8.5 Hz, 1H), 4.20 (d, J=8.6 Hz, 1H), 3.95 (d, J=15.7 Hz, 2H), 3.87 (d, J=15.5 Hz, 1H), 3.82-3.73 (m, 3H), 3.64 (d, J=3.5 Hz, 180H), 3.56-3.54 (m, 4H), 3.38 (s, 6H), 3.14 (dt, J=11.5, 5.4 Hz, 2H), 2.61-2.52 (m, 2H), 2.49 (s, 3H), 2.23 (s, 3H), 1.91 (d, J=1.5 Hz, 4H), 1.83 (d, J=5.0 Hz, 6H), 1.78 (s, 1H), 1.69 (s, 3H), 1.62-1.54 (m, 1H), 1.43 (t, J=7.5 Hz, 2H), 1.28-1.24 (m, 1H), 1.22 (d, J=11.0 Hz, 3H), 1.13 (d, J=9.2 Hz, 3H)。
1.2.2 胶束溶液的制备
对于mPEG-DSG、mPEG-DMG、mPEG-DSPE、mPEG-Chol、TPGS和ALC-0159两亲性聚合物采用直接水溶法制备胶束溶液;对于mPEG-PTX两亲性聚合物,由于其通过直接水溶法制备的胶束粒径分布为双峰,为了保证胶束粒径分布为单峰,采用溶剂旋干法制备胶束溶液。
直接水溶法:将3 mg样品加入到1.5 mL的PBS溶液中,通过超声波处理20 min,使之在PBS缓冲中形成均匀的胶束溶液。
溶剂旋干法:将3 mg样品溶解在300 μL的THF中,再将其缓慢滴入1.5 mL的PBS溶液中,磁力搅拌1 h,减压浓缩去除溶液中的THF,获得聚合物样品的胶束溶液。
1.3 测试与表征
1.3.1 两亲性聚合物MALDI-TOF和1H NMR的表征
采用MALDI-TOF 对单分散分支ALC-0159(mPEG23×2)和(mPEG23)2-Lys-PTX进行表征。以ACN作为流动相,反式-2-[3-(4-叔丁基苯基)-2-甲基-2-丙烯]丙二腈为检测基质,扫描的范围为m/z=1000~3000。分支ALC-0159和mPEG-PTX的1H NMR使用溶剂均采用CDCl3。
1.3.2 高效液相色谱测试
分别称取ALC-0159(mPEG23×2)和(mPEG23)2-Lys-PTX样品10 mg,加入1 mL的色谱级ACN,摇晃使其充分溶解,用孔径为0.45 μm有机系滤膜过滤灰尘,用高效液相色谱仪自动吸取10 μL进行HPLC分析。
1.3.3 两亲性聚合物的CMC测试
两亲性聚合物的CMC是通过聚合物溶液的表面张力-浓度对数图确定,超纯水配制一系列该聚合物不同浓度的溶液(1000.0、500.0、100.0、50.0、10.0、5.0、2.5、1.0 μmol/L和0.5 μmol/L),使用表面张力仪测量聚合物在不同浓度下对应的表面张力。制作表面张力与浓度对数的曲线图,将曲线图转折点两侧的线段部分进行延长,延长线的交点浓度即为此聚合物的CMC。
1.3.4 两亲性聚合物的粒径分布和TEM测试
胶束粒径和粒径分布指数(Polymer dispersity index,PDI)由纳米粒度电位分析仪测定,纳米粒度电位仪采用173°光路,测试温度为25 ℃,激光的波长长度为671 nm。样品测试前进行超声处理20 min,用水系0.45 μm的滤头对胶束溶液进行过滤去除杂质,每个样品平衡时间为120 s,单次测试的子测试时间为2.1 s,子测试数量为60次,重复测试3次。配制各种两亲性聚合物水溶液(1 mmol/L),超声波处理5 min使样品充分溶解,吸取样品10 μL滴加于铜网上,放于37 ℃恒温箱中干燥6 h,吸取磷钨酸染色液10 μL滴加于铜网上,干燥6 h,于80 kV下进行透射电镜成像。
1.3.5 两亲性聚合物胶束在BSA溶液中稳定性测试
配制质量浓度为4 mg/mL的两亲性聚合物胶束溶液,配制BSA溶液(4、20 mg/mL和40 mg/mL),超声波处理5 min混合均匀;取等体积的胶束溶液与BSA溶液混合(mPEG-DSG、mPEG-DMG、mPEG-DSPE和mPEG-Chol的BSA质量浓度为40 mg/mL;TPGS和ALC-0159的BSA质量浓度为20 mg/mL;mPEG-PTX的BSA质量浓度为4 mg/mL),通过0.45 μm的滤头对胶束溶液进行过滤去除杂质,每个样品制备3组,放入37 ℃的恒温培养箱中,在不同时间段测试其粒径,并绘制粒径-时间曲线图。
2 结果与讨论
2.1 分支ALC-0159(mPEG23×2)和(mPEG23)2-Lys-PTX的质谱
赖氨酸(Lys)具有3个官能团,常用来构建分支结构的PEG衍生物[21],多分散PEG2000相当于45个PEG重复单元,因此,选用mPEG23-CH2COOH与赖氨酸的2个氨基反应来构建分支状(mPEG23)2-Lys-COOH以消除分子量不同带来的影响。利用(mPEG23)2-Lys-COOH或其活化酯分别与N,N-双十四烷基胺和PTX反应得到分支状的ALC-0159(mPEG23×2)和(mPEG23)2-Lys-PTX,并对其分子量进行表征,结果如图3所示。图3显示:分支结构ALC-0159(mPEG23×2)和(mPEG23)2-Lys-PTX分子离子峰[M+Na]+的质荷比分别为2730.6和3174.6,与理论[M+Na]+分子质量2729.9和3174.7相一致,表明成功制备目标化合物ALC-0159(mPEG23×2)和(mPEG23)2-Lys-PTX,且都为单一分子量分布。
2.2 临界胶束浓度、粒径和TEM
具有较小CMC和粒径的胶束,其疏水内核通过相互作用使胶束更加稳定[22],而较小的粒径有利于通过 EPR效应增加药物在肿瘤组织的积累[23]。为此,通过表面张力仪、动态光散射法(Dynamic light scattering, DLS)和TEM考察了PEG的分散性与结构对PEG化胶束的CMC和粒径影响。
2.2.1 线形单分散与多分散mPEG-DSG、mPEG-DMG、mPEG-DSPE、mPEG-Chol和TPGS胶束的CMC、粒径与TEM的分析
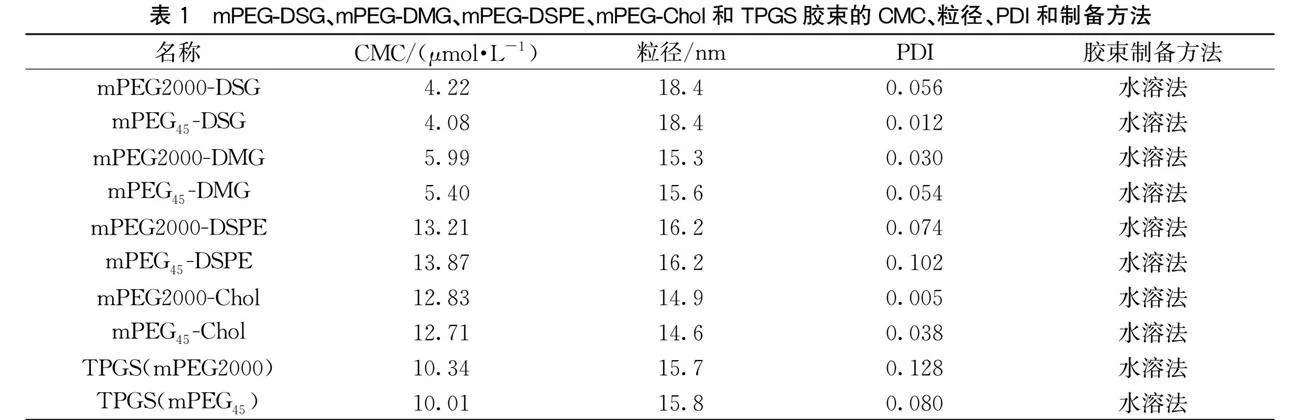
线形mPEG-DSG、mPEG-DMG、mPEG-DSPE、mPEG-Chol和TPGS胶束的CMC与粒径数值见表1。表1显示:mPEG2000-DSPE和mPEG2000-Chol胶束的CMC值与文献报道值[15,24-25]接近,对各自单分散与多分散PEG化胶束的CMC进行对比,两者之间相差不明显,但大部分单分散PEG化胶束的CMC要小于多分散的,单分散与多分散PEG化胶束的粒径与PDI也相差甚小。因此,PEG的分散性对其CMC、粒径及PDI影响较小。
图4为mPEG-DSG、mPEG-DMG、mPEG-DSPE、mPEG-Chol和TPGS胶束的TEM图。由图4可知:聚合物胶束大小较均匀,分散性较好,胶束颗粒之间基本无黏连,平均粒径约为10 nm;同时也可以看出,胶束疏水基团相同时,单分散胶束粒径与多分散胶束大小无太大差异。
2.2.2 线形及分支状ALC-0159和mPEG-PTX胶束的CMC、粒径与TEM的分析
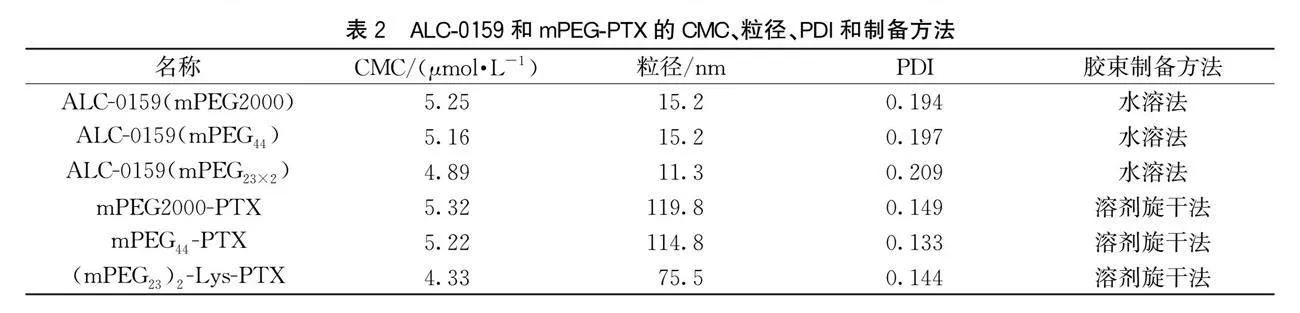
线形及分支状ALC-0159和mPEG-PTX胶束的CMC与粒径数值见表2。由表2可知:线形单分散ALC-0159的CMC比多分散的略小,粒径均为15.2 nm;分支状ALC-0159(mPEG23×2)的CMC与胶束粒径则明显小于线形状;在mPEG-PTX胶束的CMC与粒径数据中观察到,分支状(mPEG23)2-Lys-PTX胶束的CMC与粒径也明显小于线形的,主要是由于PEG的分支结构可通过PEG链的相互缠结[26],使得胶束的稳定性增强,所以胶束的CMC和粒径都比线形胶束明显要小,与Hsu等[18]所报道的两组树突分支状PEG化胶束的CMC与粒径均小于对应线形胶束的结果相一致。
图5为ALC-0159和mPEG-PTX胶束的TEM图。图5(a)—(c)显示:ALC-0159胶束大小较均匀,分散性较好,胶束颗粒之间基本无黏连,平均粒径约为10 nm。由图5(d)—(f)可知:胶束大小较均匀,分散性较好,颗粒之间无黏连,其中mPEG2000-PTX和mPEG44-PTX粒径大小约为100 nm,(mPEG23)2-Lys-PTX粒径大小约为70 nm,分支状胶束大的粒径小于线形胶束粒径,与通过DLS法测定的结论相一致。
2.3 PEG化胶束在BSA溶液中的稳定性研究分析
PEG化胶束在体内稳定性还受到血液中蛋白质的影响[22,27-28],蛋白质吸附在胶束的表面时,导致胶束的粒径增大,而吸附了蛋白质的胶束之间还会融合,致使其粒径进一步的增大,以至于被免疫细胞识别而遭清除[29]。对上述7种线形和2种分支状PEG化胶束分别在BSA的PBS缓冲溶液进行混合孵育,利用DLS法监测胶束粒径的变化情况,通过胶束粒径随时间的变化来评估PEG的分散性和结构对胶束体外稳定性的影响。
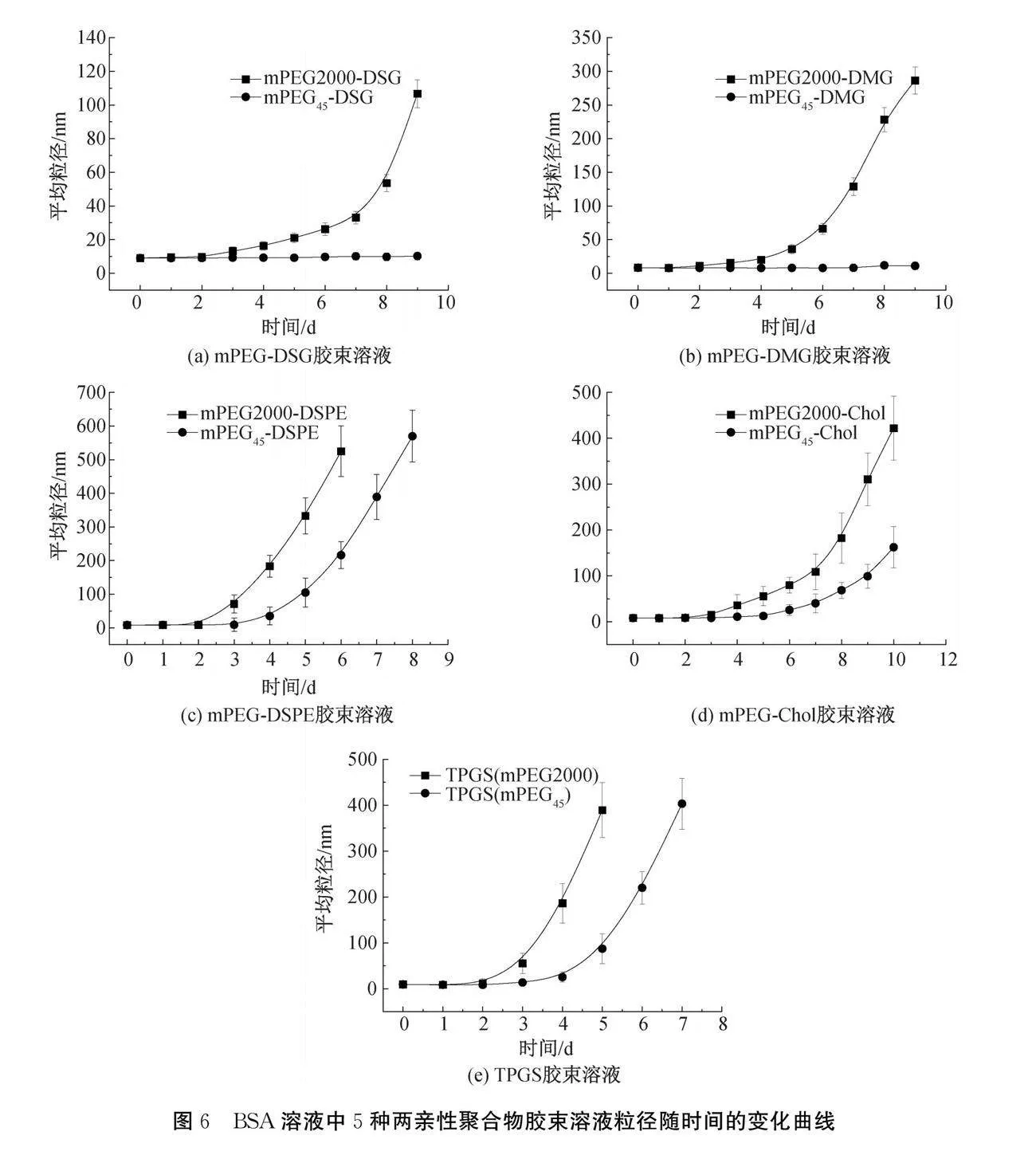
2.3.1 线形单分散与多分散mPEG-DSG、mPEG-DMG、mPEG-DSPE、mPEG-Chol和TPGS胶束在BSA溶液中稳定性
在BSA溶液中,线形单分散与多分散mPEG- ""DSG、mPEG-DMG、mPEG-DSPE、mPEG-Chol和TPGS的5种胶束粒径随时间变化结果如图6所示。由图6(a)可知:mPEG2000-DSG粒径在第3天的时候略微变大,第9天时,mPEG2000-DSG的粒径增加到~100 nm,与初始对比变化较大,而对于mPEG45-DSG,从开始至第9天,其粒径基本不变。图6(b)的mPEG-DMG胶束粒径变化趋势与mPEG-DSG相类似。图6(c)的mPEG2000-DSPE和mPEG45-DSPE胶束溶液的粒径的变化分别由第3天和第4天开始逐渐增加,mPEG45-DSPE初始稳定时间较长,mPEG45-DSPE的粒径变化幅度明显小于mPEG2000-DSPE。图6(d)的mPEG2000-Chol和mPEG45-Chol胶束溶液的粒径的变化分别由第4天和第6天开始逐渐增加,mPEG45-Chol初始稳定时间较长,且粒径变化幅度小于mPEG2000-Chol。从图6(e)观察TPGS与mPEG-DSPE胶束粒径变化有相同趋势,TPGS(mPEG45)的胶束稳定性优于TPGS(mPEG2000)。以上结果表明:在BSA溶液中,当PEG链长相同时,单分散的胶束的稳定性优于多分散胶束,是由于多分散PEG的胶束表面的PEG分布不均,短链PEG抵御BSA吸附的能力较差,对胶束表面不能起到足够的保护作用,是BSA吸附的薄弱环节;单分散胶束的PEG长度都是均一的,稳定性较好,与Teramura等[8]研究的PEG5000聚合物比PEG1000聚合物有更好的抵抗蛋白质吸附结论相一致。
2.3.2 线形及分支状ALC-0159和mPEG-PTX胶束在BSA溶液中稳定性
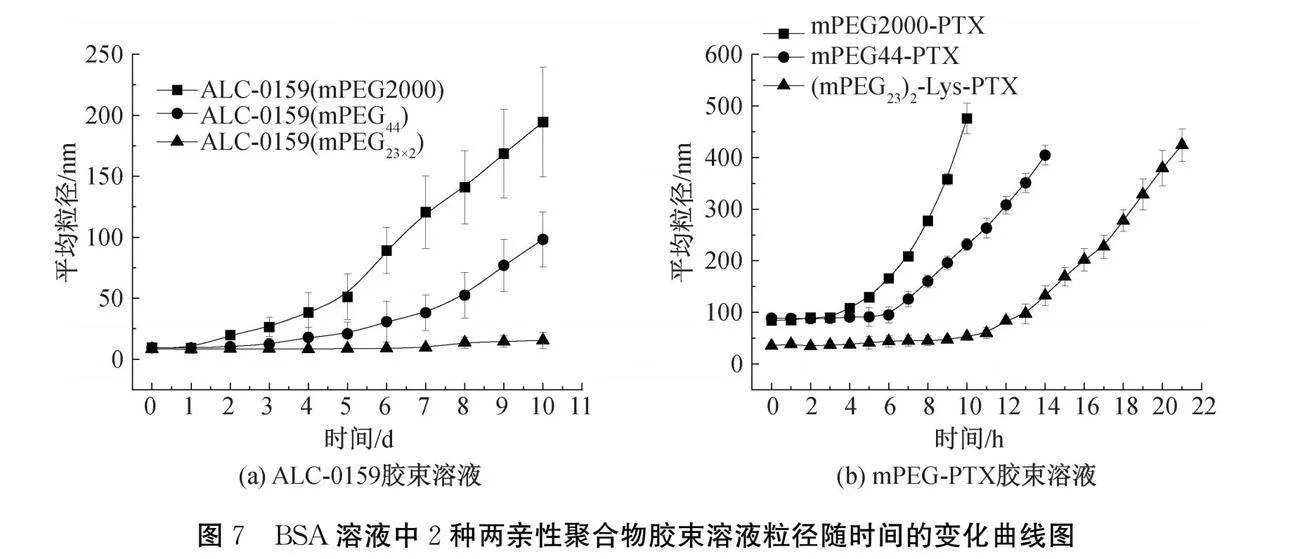
在BSA溶液中,线形单分散、多分散及分支状的ALC-0159和mPEG-PTX胶束粒径随时间变化结果如图7所示。图7(a)显示:线形多分散ALC-0159(mPEG2000)的粒径在第2天就开始显著增大,线形单分散ALC-0159(mPEG44)的胶束粒径则在第3天起开始缓慢增加,而分支状单分散ALC-0159(mPEG23×2)在测试的第10天内粒径几乎没有变化,稳定性好。图7(b)表明:线形多分散mPEG2000-PTX在BSA溶液中,4 h出现胶束粒径增大的现象,10 h后粒径急剧增大到~450 nm,线形单分散mPEG44-PTX在6 h后粒径开始缓慢增加,这种缓慢增加的趋势延续到14 h;(mPEG23)2-Lys-PTX在10 h内胶束粒径几乎没有变化,之后其粒径则随时间缓慢增加。ALC-0159的稳定性远远好于mPEG-PTX,这是由于mPEG-PTX在BSA的PBS缓冲液中,其酯基可快速水解,导致胶束解离。分支状的胶束在BSA溶液中的稳定性远远大于线形单分散的,线形单分散胶束的稳定性又大于其线形多分散的,这主要是由于分支状的PEG在胶束表面具有更高的PEG密度,且相互缠结[28],抵御BSA吸附的能力增强,从而分支状的PEG化胶束在BSA溶液中有更好的稳定性。因此,使用单分散PEG化胶束尤其是分支结构PEG化胶束作为药物纳米载体时,具有更好的体外稳定性。这有利于提高胶束在体内的稳定性并延长药物的体内循环半衰期,以获得更好的治疗效果。
3 结 论
本文通过7种不同疏水基团的两亲性PEG化胶束,研究了PEG分散性和结构对PEG化胶束的理化特性的影响,主要结论如下:
a)线形单分散和多分散PEG化胶束的CMC及粒径之间的差异可忽略,但线形单分散PEG化胶束在BSA溶液中展现出更好的稳定性。
b)对于分子量相近但结构不同的ALC-0159和mPEG-PTX,分支状的PEG化胶束比对应的线形胶束均具有更低的CMC和更小的粒径,并且在BSA溶液中展现出更强的稳定性。
目前,纳米医学领域中的研究均采用多分散PEG化胶束,依据本文研究显示,线形及分支单分散PEG化胶束在BSA溶液中稳定性更好,为开发单分散PEG化胶束药物递送系统提供重要的指导意义。
参考文献:
[1]Mundel R, Thakur T, Chatterjee M. Emerging uses of PLA-PEG copolymer in cancer drug delivery[J]. 3 Biotech, 2022, 12(2):41-52.
[2]Feng Y, Wang J, Zhang S, et al. Preparation of amentoflavone-loaded DSPE-PEG2000 micelles with improved bioavailability and in vitro antitumor efficacy[J]. Biomedical Chromatography: BMC, 2023, 37(9): 5690-5699.
[3]Hattori Y, Tamaki K, Sakasai S, et al. Effects of PEG anchors in PEGylated siRNA lipoplexes on in vitro gene-silencing effects and siRNA biodistribution in mice[J]. Molecular Medicine Reports, 2020, 22(5): 4183-4196.
[4]Sugiyama I, Sonobe T, Sadzuka Y. Effect of hybridized liposome by novel modification with some polyethyleneglycol-lipids[J]. International Journal of Pharmaceutics, 2009, 372(1): 177-183.
[5]Mu L, Feng S S. A novel controlled release formulation for the anticancer drug paclitaxel (Taxol): PLGA nanoparticles containing vitamin E TPGS[J]. Journal of Controlled Release, 2003, 86(1): 33-48.
[6]Zhao Y, Neuzil J, Wu K. Vitamin E analogues as mitochondria-targeting compounds: from the bench to the bedside?[J]. Molecular Nutrition amp; Food Research, 2009, 53(1): 129-139.
[7]Fortner A, Schumacher D. First COVID-19 vaccines receiving the US FDA and EMA emergency use authorization[J]. Discoveries (Craiova, Romania), 2021, 9(1): 122-130.
[8]Lu J, Chuan X, Zhang H, et al. Free paclitaxel loaded PEGylated-paclitaxel nanoparticles: Preparation and comparison with other paclitaxel systems in vitro and in vivo[J]. International Journal of Pharmaceutics, 2014, 471(1): 525-535.
[9]Teramura Y, Kuroyama K, Takai M. Influence of molecular weight of PEG chain on interaction between streptavidin and biotin-PEG-conjugated phospholipids studied with QCM-D[J]. Acta Biomaterialia, 2016, 30: 135-143.
[10]Chaudhari K R, Ukawala M, Manjappa A S, et al. Opsonization, biodistribution, cellular uptake and apoptosis study of PEGylated PBCA nanoparticle as potential drug delivery carrier[J]. Pharmaceutical Research, 2012, 29(1): 53-68.
[11]Caprifico A E, Foot P J S, Polycarpou E, et al. Overcoming the protein corona in chitosan-based nanoparticles[J]. Drug Discovery Today, 2021, 26(8): 1825-1840.
[12]Sofias A M, Dunne M, Storm G, et al. The battle of \"nano\" paclitaxel[J]. Advanced Drug Delivery Reviews, 2017, 122: 20-30.
[13]郝祖杭, 袁于民. mPEG链长及分散性对mPEG-TPE胶束行为影响[J]. 浙江理工大学学报(自然科学), 2023, 49(3): 365-373.
[14]戴江东, 李会鹏, 孙敏捷. 不同链长聚乙二醇修饰的香豆素6脂质纳米粒对口服吸收的影响[J]. 中国药科大学学报, 2021, 52(3): 293-300.
[15]Su Y, Liu M, Xiong Y, et al. Effects of stability of PEGylated micelles on the accelerated blood clearance phenomenon[J]. Drug Delivery Translational Research, 2019, 9(1): 66-75.
[16]Xu Z, Li Q, Huang Y, et al. Blocking nonspecific interactions using Y-shape poly(ethylene glycol)[J]. International Joournal of Molecular Sciences, 2023, 24(15): 12414-12426.
[17]Wang J, Rosario L S, Demirdirek B, et al. Comparison of PEG chain length and density on amphiphilic macromolecular nanocarriers: self-assembled and unimolecular micelles[J]. Acta Biomaterialia, 2009, 5(3): 883-892.
[18]Hsu H J, Han Y, Cheong M, et al. Dendritic PEG outer shells enhance serum stability of polymeric micelles[J]. Nanomedicine, 2018, 14(6): 1879-1889.
[19]Sim S L, He T, Tscheliessnig A, et al. Branched polyethylene glycol for protein precipitation[J]. Biotechnology and Bioengineering, 2012, 109(3): 736-746.
[20]Vugmeyster Y, Entrican C A, Joyce A P, et al. Pharmacokinetic, biodistribution, and biophysical profiles of TNF nanobodies conjugated to linear or branched poly(ethylene glycol)[J]. Bioconjugate Chemistry, 2012, 23(7): 1452-1462.
[21]Li X Q, Lei J D, Su Z G, et al. Comparison of bioactivities of monopegylated rhG-CSF with branched and linear mPEG[J]. Process Biochemistry, 2007, 42(12): 1625-1631.
[22]Garg S M, Vakili M R, Lavasanifar A. Polymeric micelles based on poly(ethylene oxide) and α-carbon substituted poly(?-caprolactone): An in vitro study on the effect of core forming block on polymeric micellar stability, biocompatibility, and immunogenicity[J]. Colloids and Surfaces B-Biointerfaces, 2015, 132: 161-170.
[23]McNelles S A, Knight S D, Janzen N, et al. Synthesis, radiolabeling, and in vivo imaging of PEGylated high-generation polyester dendrimers[J]. Biomacromolecules, 2015, 16(9): 3033-3041.
[24]Lukyanov A N, Torchilin V P. Micelles from lipid derivatives of water-soluble polymers as delivery systems for poorly soluble drugs[J]. Advanced Drug Delivery Reviews, 2004, 56(9): 1273-1289.
[25]He Z Y, Chu B Y, Wei X W, et al. Recent development of poly(ethylene glycol)-cholesterol conjugates as drug delivery systems[J]. International Journal of Pharmaceutics, 2014, 469(1): 168-178.
[26]Orienti I, Zuccari G, Falconi M, et al. Novel micelles based on amphiphilic branched PEG as carriers for fenretinide[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2012, 8(6): 880-890.
[27]Li S, Garreau H, Pauvert B, et al. Enzymatic degradation of block copolymers prepared from epsilon-caprolactone and poly(ethylene glycol)[J]. Biomacromolecules, 2002, 3(3): 525-530.
[28]Chen H, Kim S, He W, et al. Fast release of lipophilic agents from circulating PEG-PDLLA micelles revealed by in vivo forster resonance energy transfer imaging[J]. Langmuir, 2008, 24(10): 5213-5217.
[29]Lin W J, Juang L W, Lin C C. Stability and release performance of a series of pegylated copolymeric micelles[J]. Pharmaceutical Research, 2003, 20(4): 668-673.
(责任编辑:廖乾生)

