花椒籽蛋白的制备工艺优化及组成分析







摘要:以花椒籽蛋白提取率为评价指标,采用单因素试验和响应面试验研究4个因素(料液比、pH值、提取温度和提取时间)对花椒籽蛋白提取率的影响。通过SDS-PAGE凝胶电泳和氨基酸分析,探究花椒籽蛋白的组成。结果表明,花椒籽蛋白的最佳提取工艺条件为料液比1∶35(g/mL)、pH值9.0、提取温度45 ℃、提取时间3.5 h,在该条件下花椒籽蛋白提取率可达46.54%。花椒籽蛋白由6个主要亚基组成:54,31,25,18,10,9 kDa,其中31 kDa的蛋白质含量最丰富。花椒籽蛋白氨基酸种类齐全,其中Glu含量最高,达到16.37 g/100 g。此外,花椒籽蛋白中必需氨基酸、疏水性氨基酸和酸性氨基酸含量较高,分别为36.88,34.75,24.65 g/100 g。由此可知,花椒籽蛋白是一种营养价值较高的优质蛋白质资源,同时可能具备抗氧化功能。
关键词:花椒籽蛋白;提取率;单因素试验;响应面法;氨基酸组成
中图分类号:TS201.1 """""文献标志码:A """"文章编号:1000-9973(2024)09-0101-08
Optimization of Preparation Process of Zanthoxylum bungeanum
Seed Protein and Its Composition Analysis
DONG Si-yu, SUN Xin, LI Ying-qiu*
(College of Food Science and Engineering, Qilu University of Technology
(Shandong Academy of Sciences), Jinan 250353, China)
Abstract: With Zanthoxylum bungeanum seed protein extraction rate as the evaluation index, single factor test and response surface test are used to investigate the effects of solid-liquid ratio, pH value, extraction temperature and extraction time on Zanthoxylum bungeanum seed protein extraction rate. The composition of Zanthoxylum bungeanum seed protein is explored by SDS-PAGE gel electrophoresis and amino acid analysis. The results show that the optimal extraction process conditions are solid-liquid ratio of 1∶35 (g/mL), pH value of 9.0, extraction temperature of 45 ℃ and extraction time of 3.5 h. The extraction rate of Zanthoxylum bungeanum seed protein under these conditions could reach 46.54%. Zanthoxylum bungeanum seed protein consists of six major subunits, namely 54, 31, 25, 18, 10, 9 kDa, among which, the content of 31 kDa protein is the most abundant. Zanthoxylum bungeanum seed protein has a complete variety of amino acids, among which, the content of Glu is the hightest of 16.37 g/100 g. In addition, the content of essential amino acids, hydrophobic amino acids and acidic amino acids in Zanthoxylum bungeanum seed protein is higher, which is 36.88, 34.75, 24.65 g/100 g respectively. In conclusion, Zanthoxylum bungeanum seed protein is a kind of high-quality protein resource with high nutritional value and it may have antioxidant function.
Key words: Zanthoxylum bungeanum seed protein; extraction rate; single factor test; response surface method; amino acid composition
收稿日期:2024-03-20
基金项目:山东省与重庆市科技合作项目(2021LYXZ018);齐鲁工业大学(山东省科学院)科教产融合试点工程重大创新专项项目(2022JBZ01-08);山东省重点研发计划项目(2020CXGC010604)
作者简介:董思雨(1999—),女,硕士,研究方向:食品科学。
*通信作者:李迎秋(1972—),女,教授,博士,研究方向:粮食、油脂及植物蛋白工程。
花椒籽(Zanthoxylum bungeanum seed)呈黑色,有光泽,是花椒生产的主要副产物,占花椒质量的3/5,富含多种营养成分,但实际利用率较低[1-2]。研究发现,脱脂的花椒籽种仁中含有60%以上的蛋白质[3],这些蛋白质具有多种生物活性,因此深入研究花椒籽蛋白对丰富植物蛋白资源、提高农产品副产物资源利用率具有重要意义。
目前关于花椒籽蛋白的研究主要集中在蛋白的理化功能性质和多肽的生物活性方面。刘庆庆等[4]证明了pH偏移可以改变花椒籽蛋白的理化性质和乳化性。原洪[5]制备出具备抗氧化和抗菌活性的花椒籽铁结合肽;姜太玲等[6]从花椒籽蛋白中纯化出抗菌肽,对大肠杆菌的抑制率达100%;吴红洋等[7]从花椒籽蛋白中纯化出降血压肽,具有良好的血管紧张素转换酶抑制效果;张志清等[8]使用Alcalase酶解花椒籽蛋白制得抗氧化肽,对DPPH自由基的清除率为61.00%。另外,张志清等[9]、宋燕[10]分别通过响应面试验优化了盐提法和酶法提取花椒籽蛋白的工艺参数。但有关响应面优化碱溶酸沉法提取花椒籽蛋白工艺条件的研究以及对花椒籽蛋白组成的分析尚无报道。
基于此,本文以碱溶酸沉法提取花椒籽蛋白,拟用单因素试验和响应面试验获得几个关键因素的最佳参数,并通过SDS-PAGE凝胶电泳图谱和氨基酸测定分析花椒籽蛋白组成,从而分析其特征及潜在功能,以期为花椒籽蛋白的工业化生产提供参考,促进花椒籽蛋白的开发利用。
1 材料与方法
1.1 材料与试剂
花椒籽:由山东兴源农产品有限公司提供的山东省济南市莱芜区大红袍花椒籽;碳酸钠、酒石酸钾钠、硫酸铜(均为分析纯):国药集团化学试剂有限公司;福林酚(分析纯):上海麦克林生化科技股份有限公司。
1.2 仪器与设备
DK-98-ⅡA型数显恒温水浴锅 金坛市金南仪器厂;Kjeltec 2300型全自动凯氏定氮仪 广州赛为思仪器设备有限公司;Scientz-18N型真空冷冻干燥机 宁波新芝生物科技股份有限公司;UV-1900紫外可见分光光度计 上海元析仪器有限公司;PowerPac HC型Bio-Rad电泳仪 美国Bio-Rad公司;L-8900氨基酸自动分析仪 日本日立公司。
1.3 试验方法
1.3.1 花椒籽蛋白的提取
脱脂的花椒籽粉末过80目筛,准确称量1.000 g花椒籽粉末,按照一定的料液比加入蒸馏水,混匀。用1.0 mol/L NaOH调节溶液至碱性,置于恒温水浴锅中保温,期间使用搅拌器搅拌。一段时间后,以6 000 r/min的转速在室温下离心15 min。用1.0 mol/L HCl将离心后的上清液调至酸性,再次离心,弃去上清液。所得沉淀用蒸馏水反复洗至中性,经冷冻干燥后即得花椒籽蛋白。
花椒籽蛋白提取率按照下式计算:
花椒籽蛋白提取率(%)=提取液中蛋白质含量(g)总蛋白含量(g)×100%。
式中:提取液中蛋白质含量采用Lowry法[11]测定,总蛋白含量采用凯氏定氮仪测定,蛋白换算系数为6.25。
1.3.2 单因素试验
按照1.3.1中方法制备蛋白质,通过单因素试验探究料液比(1∶20、1∶25、1∶30、1∶35、1∶40、1∶45,g/mL)、pH值(7.0,7.5,8.0,8.5,9.0,9.5)、提取温度(40,45,50,55,60,65 ℃)和提取时间(2.5,3.0,3.5,4.0,4.5,5.0 h)对花椒籽蛋白提取率的影响。
1.3.3 响应面优化试验
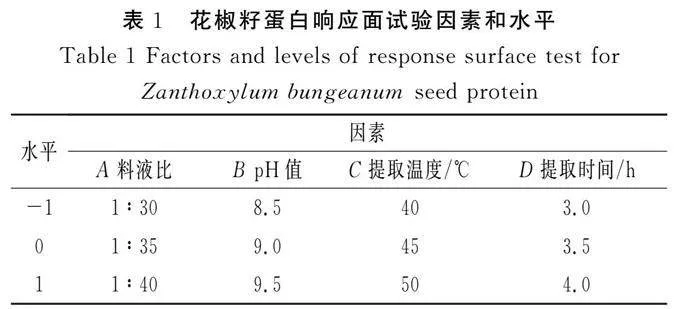
根据单因素试验结果,采用Design-Expert 8.0.6.1软件设计料液比、pH值、提取温度、提取时间四因素三水平的响应面试验,以花椒籽蛋白提取率为响应值。响应面试验因素水平设计见表1。
1.3.4 SDS-PAGE凝胶电泳
将制得的花椒籽蛋白用还原型样品溶解液配制成10 mg/mL的溶液,煮沸3 min后取10 μL上样。首先在浓缩胶(3%)上以80 V电压运行30 min,然后在分离胶(12%)上以120 V电压运行120 min。制得的凝胶经过固定2 h、染色2 h、脱色12 h后显示出清晰条带,即可使用凝胶成像仪拍照分析。
1.3.5 氨基酸组成
称取0.1 g花椒籽蛋白与10 mL 6 mol/L HCl 混合,吹3 min氮气后封口,于110 ℃水解24 h。水解液用双层滤纸过滤,并用超纯水定容至50 mL,适当稀释后过0.22 μm滤膜。随后取20 μL滤液于氨基酸自动分析仪中分析花椒籽蛋白的氨基酸组成。
1.4 数据处理和分析
每个样品做3次平行试验,结果取平均值。采用Origin 8.0软件分析数据并绘图,采用Design-Expert 8.0.6.1软件分析响应面结果。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 料液比对花椒籽蛋白提取率的影响
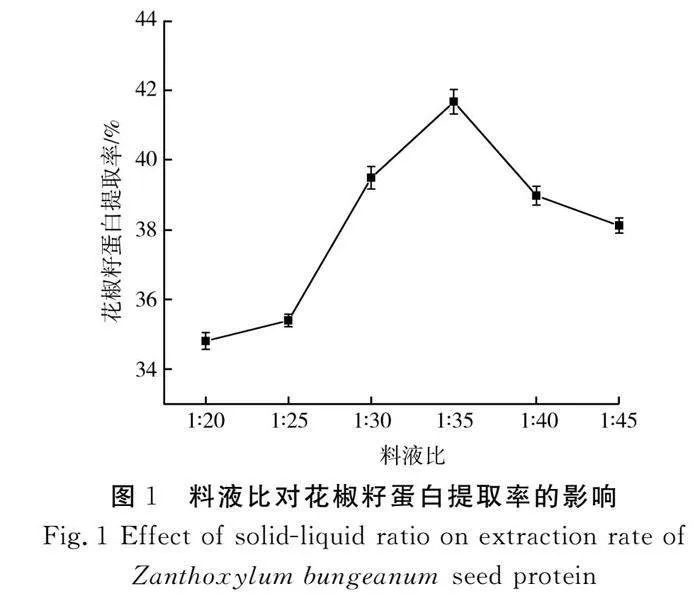
在50 ℃、pH值为9.0的条件下提取4 h,料液比对花椒籽蛋白提取率的影响见图1。
由图1可知,随着花椒籽粉末与蒸馏水比例的增加,花椒籽蛋白的提取率先上升后下降,料液比为1∶35时,提取率达到最高。当料液比小于1∶35时,提取率随着料液比的增大而增加,可能是因为料液比较小时,高黏度的溶液在一定程度上阻碍了蛋白质溶解;较大的料液比使花椒籽粉末分散更均匀,蛋白质之间的作用力减少,有利于蛋白质与水结合,从而增加了蛋白的溶解度[12]。当料液比大于1∶35时,提取率降低,可能是溶液过稀,使蛋白质分子与水结合不紧密,不利于花椒籽蛋白的溶出[13]。因此,选择料液比1∶35作为响应面试验设计的中心值。
2.1.2 溶液pH值对花椒籽蛋白提取率的影响
在50 ℃、料液比1∶35的条件下提取4 h,溶液pH值对花椒籽蛋白提取率的影响见图2。
由图2可知,当pH值为7.0~9.0时,花椒籽蛋白提取率逐渐上升,当pH值为9.0时提取率达到最大,当pH值大于9.0时,提取率随着pH值的增加而降低。当pH值小于9.0时,蛋白质提取率随着溶液pH值的增加而上升,这是因为较高的碱浓度能够促进极性基团的解离,同时也使铵根离子的电离增加,增强了蛋白的溶出效果,因此蛋白提取率较高[14]。当pH值大于9.0时,碱浓度过高使蛋白质结构遭到破坏,提取率下降,可能是蛋白质发生部分变性所致。因此,选择pH值9.0作为响应面试验设计的中心值。
2.1.3 提取温度对花椒籽蛋白提取率的影响
在料液比1∶35、pH值9.0的条件下提取4 h,提取温度对花椒籽蛋白提取率的影响见图3。
由图3可知,花椒籽蛋白提取率随着提取温度的升高呈现先升高后降低的趋势,当提取温度为45 ℃时,花椒籽蛋白的提取率达到最大。当提取温度低于45 ℃时,提取率随着提取温度的升高快速升高,这是因为提取温度升高使分子运动加快,有利于蛋白质分子扩散并与水分子结合,提高了蛋白质的溶解度,从而花椒籽蛋白提取率提高。当提取温度高于45 ℃时,蛋白质容易发生热变性,造成蛋白质流失,从而导致提取率降低。因此,选择提取温度45 ℃作为响应面试验设计的中心值。
2.1.4 提取时间对花椒籽蛋白提取率的影响
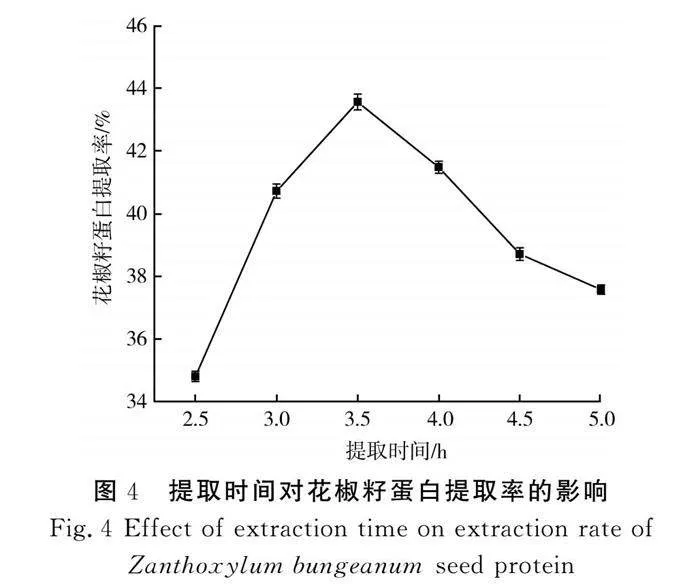
在50 ℃、料液比1∶35、pH值9.0的条件下提取蛋白,提取时间对花椒籽蛋白提取率的影响见图4。
由图4可知,当提取时间从2.5 h增加到3.5 h时,花椒籽蛋白提取率升高,当提取时间为3.5 h时,提取率最大,继续延长提取时间,提取率呈现降低的趋势。当提取时间小于3.5 h时,随着提取时间的延长,更多的蛋白质得以溶出,提取率随之增加。当提取时间为3.5 h时,水溶性蛋白的溶出趋于饱和,继续延长提取时间已不能够提高蛋白提取率。当提取时间高于3.5 h时,提取时间过长导致花椒籽蛋白重新被高含量的纤维素包埋[15],限制了蛋白质溶出,提取率有所降低。因此,选择提取时间3.5 h作为响应面试验设计的中心值。
2.2 响应面试验结果分析
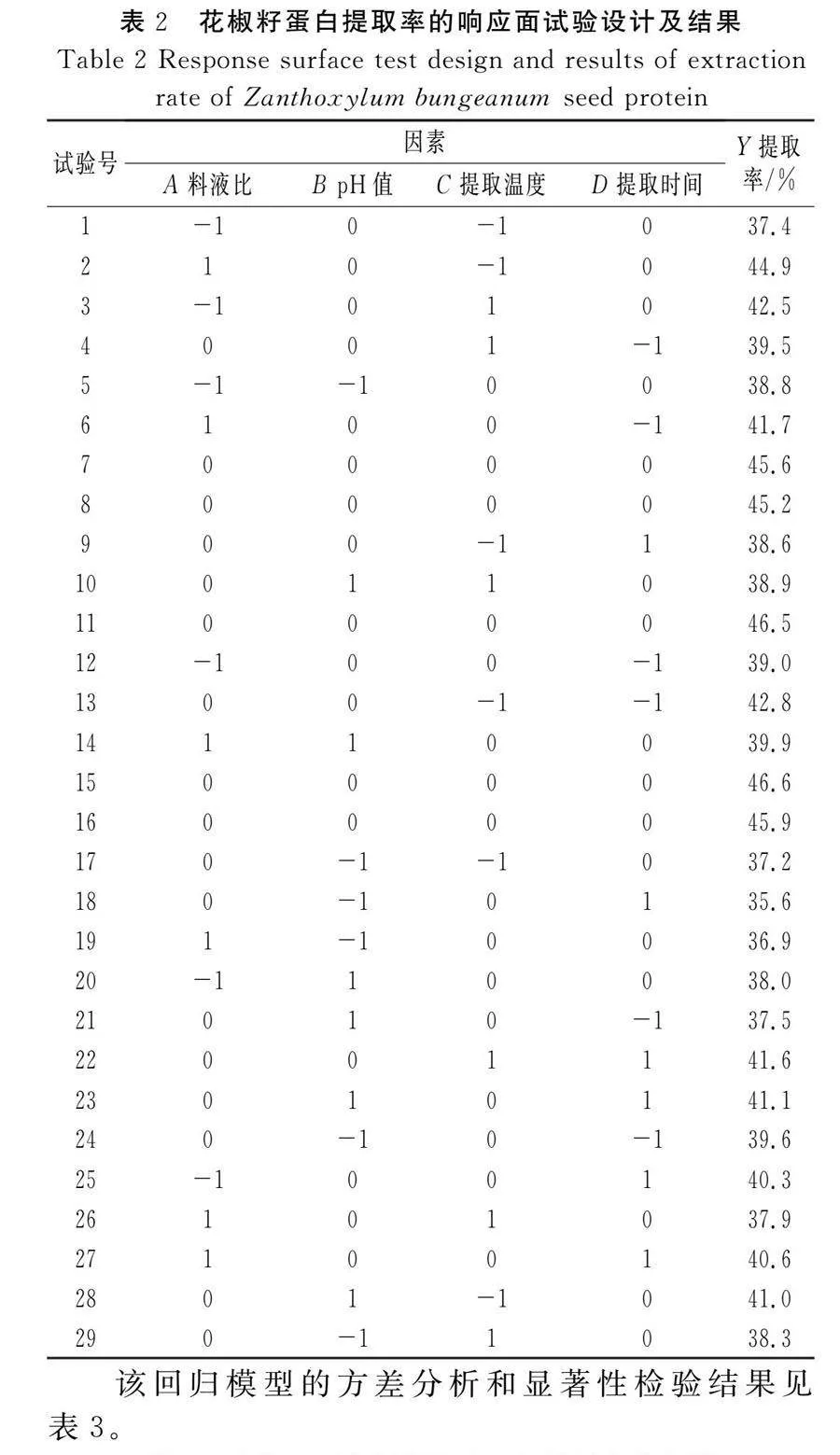
提取花椒籽蛋白的响应面试验设计及结果见表2。
该回归模型的方差分析和显著性检验结果见表3。
以料液比(A)、pH值(B)、提取温度(C)和提取时间(D)4个因素为自变量,以花椒籽蛋白提取率为响应值(Y),通过Design-Expert 8.0.6.1对表2中试验数据进行二次回归模型分析,拟合得到二次回归方程Y=45.96+0.49A+0.83B-0.27C-0.19D+0.95AB-3.03AC-0.60AD-0.80BC+1.90BD+1.57CD-2.81A2-4.70B2-2.47C2-2.81D2。
由表3可知,模型的P值lt;0.001,表示碱溶酸沉法提取花椒籽蛋白的回归模型达到极显著水平;失拟项的P值为0.601 2gt;0.05,失拟项不显著,表明模型的预测值与实测值能较好地拟合。模型的决定系数R2=0.983 7,校正决定系数RAdj2=0.967 4,说明模型的预测值与实测值之间有较好的相关性。以上结果表明该模型可以被用来预测4种提取条件对花椒籽蛋白提取率的影响。与此同时,该回归方程中,一次项A(料液比)显著,B(pH值)极显著,C(提取温度)和D(提取时间)不显著;交互项AB、BC显著,AC、BD、CD极显著,AD不显著;二次项A2、B2、C2、D2均极显著,说明各因素之间的作用对花椒籽蛋白提取率的影响不是简单的加和效应,而是一种复杂的交互影响的关系。由F值可知,4个因素对花椒籽蛋白提取率的影响大小为B(pH值)gt;A(料液比)gt;C(提取温度)gt;D(提取时间)。
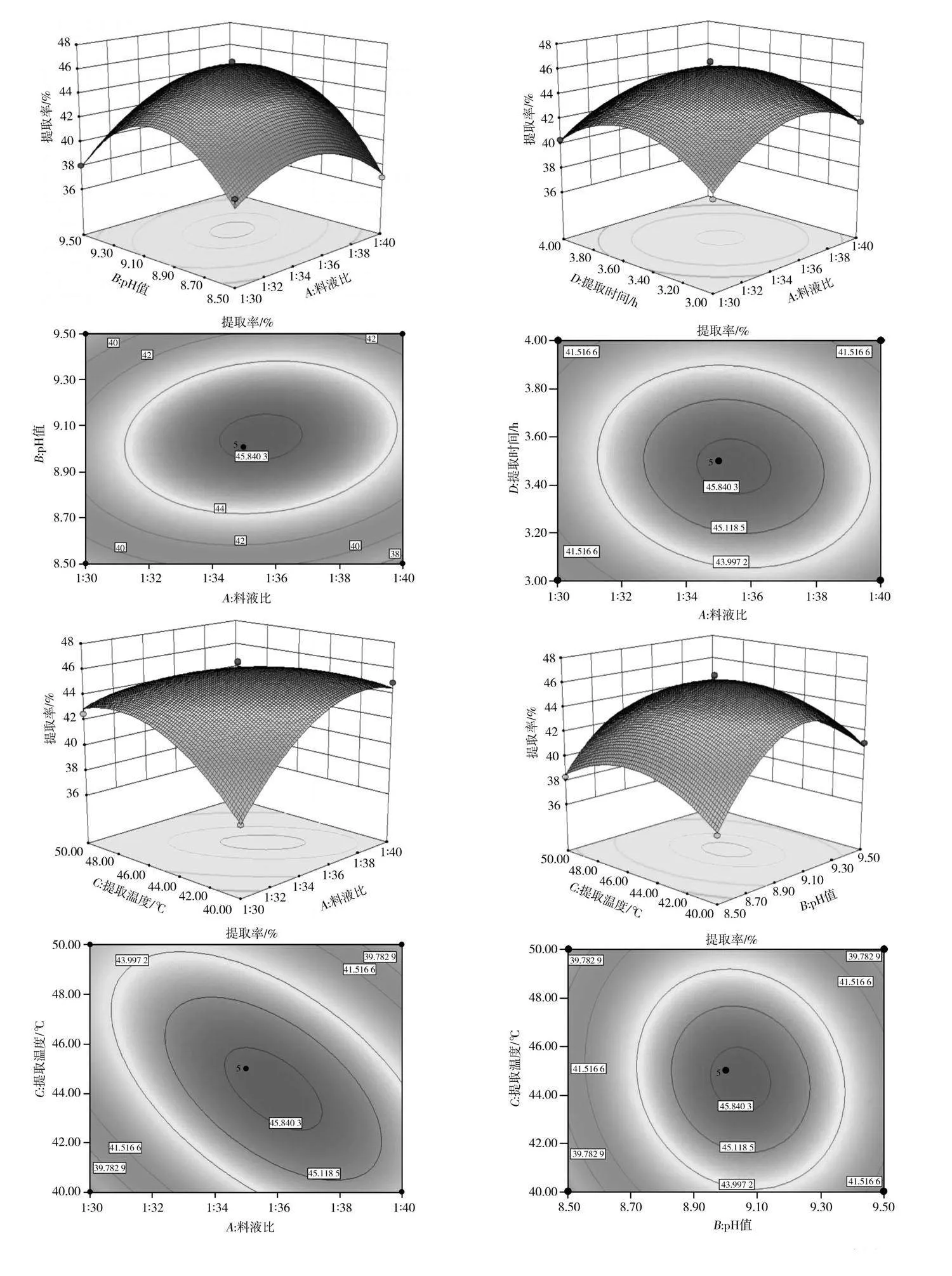
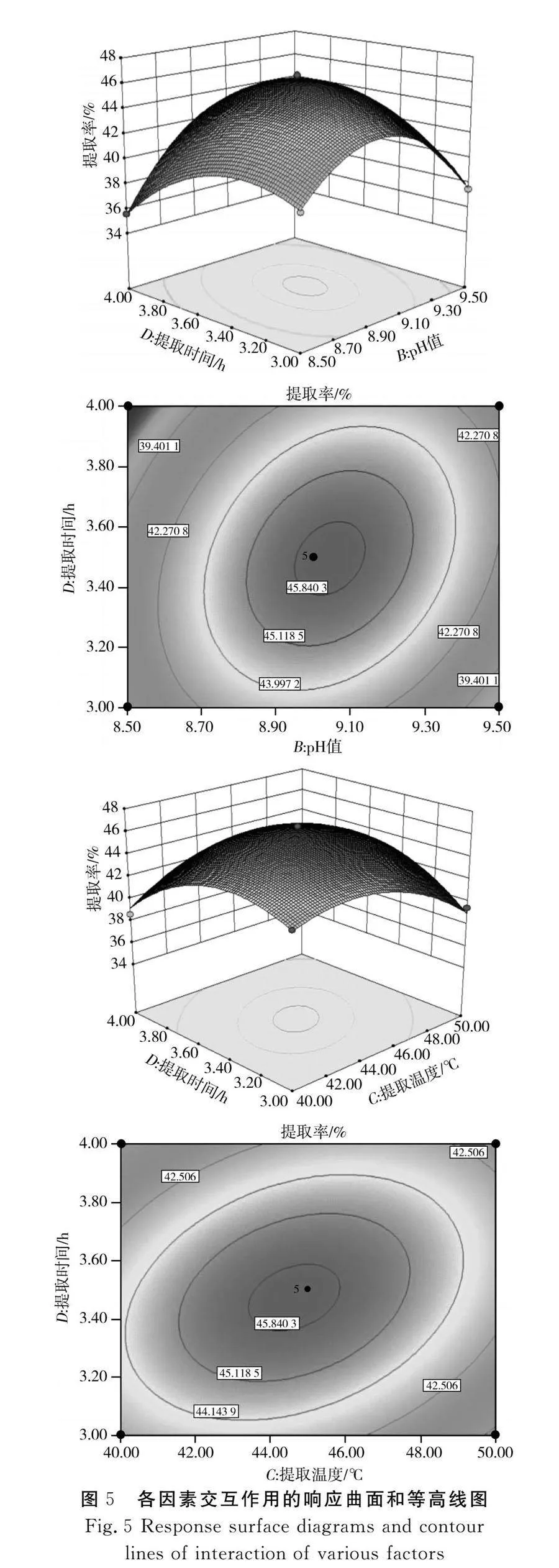
利用Design-Expert 8.0.6.1软件对A(料液比)、B(pH值)、C(提取温度)和D(提取时间)的交互作用进行分析,绘制响应面3D曲面图和等高线图,见图5。曲面越弯曲表示两因素交互作用的影响程度越大,等高线越接近椭圆形表示两因素交互作用效果越明显[16]。
由图5可知,料液比和提取温度、提取温度与提取时间、pH值与提取时间、料液比与pH值的交互作用对花椒籽蛋白提取率具有明显的影响,料液比与提取时间、提取温度与pH值的交互作用对花椒籽蛋白提取率的影响不明显。对该回归模型进行数学分析,得到花椒籽蛋白的最佳提取工艺条件为料液比1∶36.30、pH值9.06、提取温度43.69 ℃、提取时间3.45 h。在该条件下理论上花椒籽蛋白的提取率为46.12%。
2.3 响应面优化模型的验证结果分析
通过分析响应面回归模型,得到了提取花椒籽蛋白的最佳工艺条件,为了方便试验操作,将上述提取工艺条件修正为料液比1∶35、pH值9.0、提取温度45 ℃、提取时间3.5 h。按照修正条件进行3次重复试验检验模型的准确性,得到花椒籽蛋白的实际提取率为46.54%,与模型预测值的差异不大。由此可知,花椒籽蛋白提取条件的响应面回归模型可以准确地预测花椒籽蛋白的提取率。
2.4 SDS-PAGE凝胶电泳结果分析
SDS-PAGE可以分析蛋白质分子量组成的信息,花椒籽蛋白的还原型SDS-PAGE凝胶电泳图谱见图6,泳道M和泳道1分别代表标准分子量蛋白Marker和花椒籽蛋白电泳条带。
由图6可知,花椒籽蛋白包含6个主条带,分子量分别为54,31,25,18,10,9 kDa,其中分子量为31 kDa和18 kDa的蛋白质含量较丰富。
2.5 氨基酸组成结果分析
花椒籽蛋白的氨基酸组成测定结果见表4,由于酸水解过程完全破坏了色氨酸,因此表4中未显示色氨酸的测定值。
由表4可知,花椒籽蛋白中氨基酸种类齐全,共检测出17种氨基酸,其中包括10种必需氨基酸(Thr、Cys、Val、Met、Ile、Leu、Tyr、Phe、Lys、His)和7种非必需氨基酸(Asp、Ser、Glu、Gly、Ala、Arg、Pro)。花椒籽蛋白的总氨基酸含量为84.82 g/100 g,其中必需氨基酸含量为36.88 g/100 g,占总氨基酸含量的0.434 8,必需氨基酸与非必需氨基酸含量的比值为0.769 3,均高于FAO/WHO的推荐值(0.4和0.6),说明花椒籽蛋白是一种营养价值较高的优质蛋白质资源[17]。
氨基酸的组成、含量和序列往往会影响蛋白质的功能性质[18]。谷氨酸(Glu)是一种鲜味氨基酸,在花椒籽蛋白中含量最高,达到16.37 g/100 g,说明花椒籽蛋白可以用于增添鲜味。精氨酸(Arg)、天冬氨酸(Asp)和亮氨酸(Leu)在花椒籽蛋白中的含量也较高,分别为8.54,8.28,7.13 g/100 g。Arg有助于细胞分裂,对于维持婴幼儿生长发育十分重要[19];Asp不仅可以呈鲜味,而且可以消除疲劳,促进肝功能[20];Leu能够刺激肌肉蛋白合成,有助于肌肉代谢[21]。花椒籽蛋白中含有较高含量的Arg、Asp和Leu,说明其可能具备良好的上述功效。另外,花椒籽蛋白中疏水性氨基酸(HAA)和酸性氨基酸(NCAA)含量较高,分别为34.75,24.65 g/100 g。多数研究表明HAA可以提供电子,因而赋予蛋白质清除自由基的能力;NCAA侧链的氨基和羧基一般具有金属螯合能力[22]。因此,花椒籽蛋白可能具有较好的抗氧化活性,可以用于制备抗氧化产品。此外,支链氨基酸与芳香族氨基酸的比值(BCAA/AAA)高往往有利于肌肉代谢、维持蛋白质稳态,花椒籽蛋白的BCAA/AAA比值(1.95)高于大麻籽(1.83),说明花椒籽蛋白的上述功效优于大麻籽[23]。赖氨酸与精氨酸的比值(Lys/Arg)低有利于降低血液中胆固醇含量,花椒籽蛋白的Lys/Arg比值(0.35)低于绿豆蛋白(0.98),说明花椒籽蛋白降低胆固醇的功效可能优于绿豆蛋白[24]。
3 结论
通过响应面试验得出各因素对花椒籽蛋白提取率的影响大小为pH值gt;料液比gt;提取温度gt;提取时间,并且检验验证响应面模型拟合良好,可以用于预测4个因素对提取率的影响。由上述试验得到花椒籽蛋白的最佳提取条件为料液比1∶35、pH值9.0、提取温度45 ℃、提取时间3.5 h,此条件下花椒籽蛋白的提取率可达46.54%。SDS-PAGE凝胶电泳结果显示花椒籽蛋白主要包含低分子量亚基,其中31 kDa的蛋白质含量最丰富。花椒籽蛋白氨基酸组成齐全,必需氨基酸含量高于FAO/WHO的推荐值,且含有较高含量的与抗氧化功能相关的疏水性氨基酸与酸性氨基酸,表明花椒籽蛋白是一种优质的蛋白质资源。本研究为花椒籽蛋白的进一步加工和利用提供了参考,对提高花椒籽的附加值有一定的促进作用。
参考文献:
[1]LUO Q Y, LI X M, ZHANG Z Q, et al.Extraction of Zanthoxylum seed protein and identification of its simulated digestion products[J].LWT-Food Science and Technology,2022,161(9):113412.
[2]胡晴文,彭郁,李茉,等.花椒油和花椒籽油提取技术研究进展[J].中国油脂,2024,49(1):16-21.
[3]杨令叶,田呈瑞,权麻玉.大红袍花椒籽种仁蛋白的分类研究[J].中国油脂,2008(9):16-18.
[4]刘庆庆,黄河,罗宇柯,等.pH偏移对花椒籽蛋白理化指标及乳化性能的影响[J].西华大学学报(自然科学版),2020,39(6):81-86.
[5]原洪.花椒籽铁结合肽的提取、纯化及肽铁螯合物性质研究[D].西安:陕西师范大学,2019.
[6]姜太玲,吴红洋,董小华,等.花椒籽蛋白抗菌肽的分离纯化研究[J].中国油脂,2015,40(10):20-24.
[7]吴红洋,姜太玲,杨承志,等.花椒籽蛋白降血压肽的分离纯化[J].核农学报,2014,28(11):2058-2064.
[8]张志清,宋燕,姜太玲,等.Alcalase蛋白酶水解花椒籽蛋白制备抗氧化肽的条件优化[J].食品工业科技,2014,35(11):179-183,187.
[9]张志清,宋燕,刘翔.响应面法优化提取花椒籽蛋白质工艺研究[J].核农学报,2013,27(7):988-995.
[10]宋燕.花椒籽膳食纤维、蛋白质的分离提取及抗氧化肽的制备研究[D].雅安:四川农业大学,2013.
[11]PETERSON G L. A simplification of the protein assay method of Lowry et al. which is more generally applicable[J].Analytical Biochemistry,1977,83(2):346-356.
[12]郎田田,雷姝敏,陈红.超声波辅助盐溶法提取杏鲍菇蛋白的工艺优化[J].中国调味品,2018,43(6):19-23.
[13]孟桥,那治国,王鑫,等.响应面法优化黑木耳蛋白质的提取工艺[J].食品工业,2021,42(2):129-134.
[14]姜伊悦,张小勇,崔泰花,等.元蘑蛋白的超声辅助提取及结构分析[J].食品科技,2019,44(8):228-234.
[15]张宇.汉源花椒籽油提取及其调节血脂功能的研究[D].雅安:四川农业大学,2020.
[16]叶娜,陈诚,冯莉.基于正交试验和响应面法优化甜面酱加工工艺[J].中国调味品,2023,48(8):150-154.
[17]FAO/WHO.Energy and protein requirements[R].FAO Nutrition Meeting Report Series,Roma:FAO,1973:52-63.
[18]ZHU Y, FU S Y, WU C L, et al. The investigation of protein flexibility of various soybean cultivars in relation to physicochemical and conformational properties[J].Food Hydrocolloids,2020,103(3):105709.
[19]WU G, JAEGER L A, BAZER F W, et al. Arginine deficiency in preterm infants: biochemical mechanisms and nutritional implications[J].The Journal of Nutritional Biochemistry,2004,15(8):442-451.
[20]赵玲,王善宇,刘淇,等.野生与养殖许氏平鲉肌肉营养和风味对比分析[J].轻工学报,2022,37(5):32-40.
[21]MOHANTY B, MAHANTY A, GANGULY S, et al. Amino acid compositions of 27 food fishes and their importance in clinical nutrition[J].Journal of Amino Acids,2014,2014(3):269797.
[22]王颖颖,李迎秋.酶解牡丹籽蛋白抗氧化特性的研究[J].中国调味品,2020,45(12):159-164.
[23]MALOMO S A, ALUKO R E. Conversion of a low protein hemp seed meal into a functional protein concentrate through enzymatic digestion of fibre coupled with membrane ultrafiltration[J].Innovative Food Science amp; Emerging Technologies,2015,31:151-159.
[24]LIU F F, LI Y Q, WANG C Y, et al. Impact of pH on the physicochemical and rheological properties of mung bean (Vigna radiata L.) protein[J].Process Biochemistry,2021,111(2):274-284.

