酒精含量对快速发酵醉椒风味物质及微生物群落组成的影响研究











摘要:醉椒是以高酒精度白酒(30%以上)和辣椒为主要原料,低盐慢速发酵的西南特色鲜辣、低刺激调味品。其发酵周期长,且发酵原理、风味特征和微生物群落组成不明,制约品质和安全性控制。文章研究发现15%以上白酒(60%)显著抑制醉椒发酵过程,6%白酒发酵过快,酸味明显,质构变软;9%和12%为最适白酒添加范围,发酵30 d后pH稳定在3.5,总酸含量为13.93~15.92 g/kg,无酸味,无霉变,有清香味,咀嚼感良好;亚硝酸盐含量低于0.8 mg/kg,大肠菌群未检出。GC-MS结合16S rDNA、ITS高通量测序显示,真菌多样性高于细菌,克鲁维毕赤酵母、膜醭毕赤酵母、皱枝孢霉为优势真菌,黄曲霉、赭曲霉未检出,植物乳杆菌、肠膜明串珠菌为优势细菌;乳酸酯、萜类、糖醇、寡糖和鲜味氨基酸为醉椒特征风味物质。
关键词:醉椒;酒精浓度;快速发酵;细菌群落组成;真菌群落组成;乳酸酯化
中图分类号:TS202.1 """""文献标志码:A """"文章编号:1000-9973(2024)09-0038-09
Study on Effect of Alcohol Content on Flavor Substances and Microbial
Community Composition of Fast Fermented Zuijiao
WEI Jia-jia1,2, FU Zhong-jie1,2, LUO Ya1, MO Xiao-hui1, JIA Li-rong1,2, DUAN Fei-xia1,2*
(1.College of Biomass Science and Engineering, Sichuan University, Chengdu 610065, China;
2.Key Laboratory of Food Science and Technology in Institutions of Higher Education in
Sichuan Province, Sichuan University, Chengdu 610065, China)
Abstract: Zuijiao is a southwest characteristic spicy and low-stimulation condiment with white wine of high alcohol content (more than 30%) and chili as the main raw materials through low-salt and slow fermentation. Its fermentation cycle is long, and the fermentation principle, flavor characteristics and composition of microbial community are unclear, which restricts the quality and safety control. In this paper, it is found that more than 15% white wine (60%) significantly inhibits the fermentation process of Zuijiao, while 6% white wine makes the fermentation too fast, resulting in its obvious sourness and soft texture. 9% and 12% are the most suitable white wine addition range. After 30 d of fermentation, pH stabilizes at 3.5, total acid content is 13.93~15.92 g/kg. Zuijiao has no sourness, no mildew, and it has a refreshing aroma and good chewiness.The nitrite content is less than 0.8 mg/kg, and the coliform is not detected. GC-MS combined with 16S rDNA and ITS high-throughput sequencing shows that fungal diversity is higher than bacterial diversity. Pichia kluyveri, Pichia membranaefaciens and Cladosporium delicatulum are the dominant fungi, Aspergillus flavus and Aspergillus ochraceus are not detected, and Lactobacillus
plantarum and" Leuconostoc mesenteroides are the dominant bacteria. Lactate, terpenes, sugar alcohol, oligosaccharides and umami amino acids are characteristic flavor substances of Zuijiao.
Key words: Zuijiao; alcohol concentration; fast fermentation; composition of bacterial community; composition of fungal community; lactic acid esterification
收稿日期:2024-03-28
基金项目:成都市科技项目-重点研发支撑计划-技术创新研发项目(2021-YF05-02232-SN);国家级大学生创新创业训练计划项目(C2023127323)
作者简介:魏佳佳(2002—),女,硕士研究生,研究方向:食品科学与营养健康。
*通信作者:段飞霞(1981—),女,副教授,研究方向:食品科学。
醉椒是西南地区一种特色辣椒发酵制品,具有悠久的食用历史。醉椒以30%~50%质量占比的高度白酒与辣椒混合,低盐慢速发酵为其工艺特点,以低酸味、高鲜香为风味特点,与四川泡菜、酸菜、豆瓣具有明显的风味差异,是鲜香味型发酵辣酱的代表。醉椒辣味明显,但食用后胃肠刺激感低,现已作为低刺激型复合调味料、火锅底料的生产原料使用,以满足消费者对低胃肠负担辣味调味产品的需求[1],市场前景广阔。
目前,醉椒主要通过与高浓度白酒混合的传统自然发酵法生产,成熟周期较长(6~12个月),生产效率低,难以满足调味产品市场需求。此外,醉椒发酵过程属于高浓度白酒混合发酵,高含量的乙醇等物质对醉椒微生物的繁殖、演替和代谢产物的影响及其介导醉椒特殊风味形成的原因不明是制约醉椒生产、应用过程中风味、安全性等品质控制的关键科学瓶颈问题。
因此,本文主要针对醉椒发酵周期长、发酵过程中理化特性、微生物特性不明等问题,通过气相色谱-质谱联用(GC-MS),以及基于16S rRNA和ITS的二代高通量测序技术,结合感官评定、理化实验、传统微生物学实验等,研究初始酒精含量对醉椒发酵速度、感官性质、风味物质组成及微生物群落结构的影响,揭示醉椒发酵的特征风味物质和微生物种群特点,并在保持醉椒鲜香、酯香风味的基础上优化得到可有效缩短醉椒发酵周期的初始酒精含量范围。
1 材料与方法
1.1 材料与试剂
新鲜二荆条:市售;泡菜盐:四川久大制盐有限责任公司;60%浓香型白酒:泸州永昌隆酒业有限公司;白糖:安琪酵母股份有限公司。酚酞试剂、氢氧化钠、氯化钠、磷酸二氢钾、盐酸(均为分析纯):成都市科隆化学品有限公司;E.Z.N.A.Soil DNA Kit Omega 试剂盒:美国Omega公司;琼脂糖:西班牙Biowest 公司;AxyPrep DNA Gel Extraction Kit试剂盒:美国Axygen公司。
1.2 仪器与设备
pH计 上海浦春计量仪器有限公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器开发有限公司;8890B-5977B气相色谱-质谱联用仪 美国Agilent 公司;FastPfu Polymerase 北京全式金生物技术有限公司;ABI GeneAmp9700型PCR仪 美国ABI公司;DYY-6C电泳仪 北京六一生物科技有限公司。
1.3 醉椒的生产工艺
选取无虫眼、无腐坏的鲜二荆条辣椒,清洗、切段或捣碎成0.6~1 cm的小段;选取干辣椒,清洗、切段或捣碎、去籽;以鲜辣椒∶干辣椒不低于3∶1的比例混合均匀,为辣椒原料。辣椒原料与10%白糖、4%食盐、22%水搅拌均匀,分别加入6%、9%、12%、15%的白酒,酒精含量分别为2.29%、3.36%、4.40%、5.39%。将发酵混合物密封,进行自然发酵,检测指标,获得醉椒成品,醉椒生产工艺流程图见图1。
1.4 实验方法
1.4.1 理化、微生物指标的检测
以发酵起始日期为第0天,于第1,2,3,4,6,8,9,10,11,12,13,17,23,26天测定泡菜的pH值、总酸度,取10 mL发酵液,在14 000 r/min下离心15 min,取上清液用pH计测定pH值[2],总酸度采用电位滴定法测定[3]。称取25 g醉椒,放入盛有225 mL生理盐水的无菌均质杯内,8 000 r/min均质2 min,制成1∶10的样品匀液,采用大肠菌群MPN计数法测定大肠菌群数[4]。亚硝酸盐含量采用盐酸萘乙二胺分光光度法测定[5]。
1.4.2 感官评定
选取20位经过专业培训的评定人员组成感官评定小组进行感官描述检验,对发酵30 d的醉椒的色泽、气味、滋味、质构、有无霉变5个指标进行评分,采用加权平均法,色泽系数0.2,气味系数0.2,滋味系数0.3,质构系数0.2,有无霉变系数0.1,具体赋分方式见表1。醉椒感官综合评分S由各项感官特性的加权平均计算得到,见下式:
S=N1×8+N2×6+N3×210×Xi。
式中:N1为评价“好”,得8分的人数;N2为评价“较好”,得6分的人数;N3为评价“较差”,得2分的人数;Xi为指标系数。
1.4.3 微生物多样性检测
各样品取10 g发酵液、10 g发酵辣椒(距顶5,7.5,10 cm采样),将固液混合物研磨,加入15 mL离心管中,于-80 ℃贮存。DNA抽提和PCR扩增:采用E.Z.N.A. Soil DNA Kit(Omega Bio-Tek,Norcross, GA, USA)试剂盒进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop 2000紫外可见分光光度计测定DNA浓度、纯度;用5′端分别连接样品特异性8碱基barcode的引物对338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),对16S rDNA基因V3~V4可变区进行PCR扩增,扩增程序:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后4 ℃保存。Illumina MiSeq测序:使用2%琼脂糖凝胶电泳回收PCR产物,采用AxyPrep DNA Gel Extraction Kit试剂盒纯化回收产物,用Tris-HCl洗脱,用2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer(Promega,USA)对回收产物进行检测定量,建库并于 Illumina MiSeq平台(Illumina,San Diego,USA)上机测序。数据处理:使用fastp软件原始测序序列进行质控,使用Flash软件进行拼接,overlap需大于10 bp。使用uParse软件,根据97%的相似度对序列进行OTU聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier对每条序列进行物种分类注释,比对Silva 16S rRNA基因数据库(v138),设置比对阈值为70%。
1.4.4 GC-MS测定挥发性有机物组成
加入双(三甲基硅烷基)三氟乙酰胺(BSTFA)(含1%三甲基氯硅烷(TMCS))衍生试剂后,再进行GC/MS分析。
色谱条件:将衍生化后样品用分流模式注入GC-MS系统进行分析,进样量1 μL,分流比10∶1。样品经Agilent 122-5532G DB-5MS毛细管柱(40 mm×0.25 mm×0.25 μm)分离后进入质谱检测。进样口温度300 ℃,载气为高纯氦气,载气流速1 mL/min,隔垫吹扫流速3 mL/min,溶剂延迟5.5 min。升温程序:初始温度60 ℃,平衡0.5 min,然后以8 ℃/min的速度升至310 ℃,维持6 min。
质谱条件:电子轰击离子源(EI),传输线温度310 ℃,离子源温度280 ℃,四极杆温度150 ℃,电子能量70 eV。扫描方式为全扫描模式(Scan),质量扫描范围(m/z):50~500 u,扫描频率为3.2 scan/s。
将质谱信息与代谢数据库进行匹配,根据质谱匹配度鉴定代谢物。主要数据库为 NIST、Fiehn 以及 MS-DIAL 公共库。
1.4.5 风味成分评价方法
1.4.5.1 相对气味活度值
根据刘登勇等[6]的方法,采用气味活度值(odor activity value,OAV)评价各化合物对样品总体风味的贡献,按下式计算:
OAV=CT。
式中:C为物质绝对浓度,T为感觉阈值。
OAVlt;1说明该物质对总体风味无实际作用;OAVgt;1说明该物质可能对总体风味有直接影响;且在一定范围内,OAV越大说明该物质对总体风味的贡献越大。
由于所研究样品往往包含几十甚至上百种挥发性化合物,绝对定量几乎不可能。因此,食品风味研究领域一般用化合物的相对浓度(Cr)代替绝对浓度进行分析,即:
Cr≈C。
各化合物的相对浓度可以通过峰面积归一化法计算得到,各化合物的相对气味活度值(relative odor activity value,ROAV)按下式计算:
ROAVi=100×OAViOAVmax。
OAVmax是OAV最高的物质,由下式得到:
ROAVi≈100×CrCmax×TmaxTi。
显然,所有组分均满足0lt;ROAV≤100,且ROAV越大的组分对样品总体风味的贡献越大。本研究认为ROAV≥1的物质为所分析样品的主体风味成分,但0.1≤ROAVlt;1的物质对样品总体风味也具有比较重要的贡献。
1.4.5.2 滋味活度值
滋味物质的滋味活度值(taste activity value,TAV)的计算公式如下:
TAV=CT。
式中:TAV为味道强度值;C为滋味物质的绝对浓度(mg/100 g);T为滋味物质的阈值(mg/100 g)[7]。
通常认为,TAV大于1时,该物质对该样品的呈味有贡献,且数值越大,贡献越大。相反,当TAV小于1时,说明该物质对呈味贡献不大,呈味作用不显著。
用化合物的相对浓度(Cr)代替绝对浓度进行分析,相对滋味活度值(relative taste activity value,RTAV)按照下式计算:
RTAVi≈100×CrCmax×TmaxTi。
式中:Cr为物质相对浓度,T为感觉阈值。
1.5 数据处理
各实验均重复3次,本文采用平均值±标准差的形式进行数据计算和绘图;采用Origin 2021软件作图,采用SPSS 21.0软件进行显著性分析。
2 结果与讨论
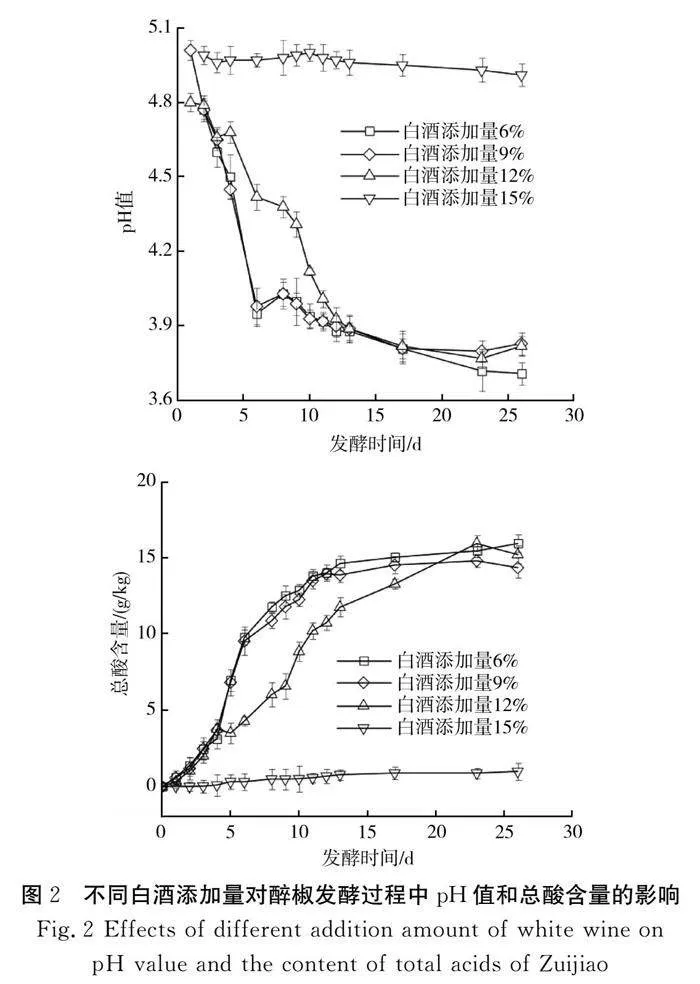
2.1 pH值
由图2可知,当白酒添加量为6%和9%时,醉椒样品的pH值快速下降,第6天时降至4.0后逐渐趋于平缓,维持在3.9左右;第26天时,白酒添加量为6%样品的pH值下降到3.7。当白酒添加量为12%时,样品的pH值下降较慢,第12天后逐渐稳定在3.9。当白酒添加量为15%时,pH值下降极缓慢,到第28天时pH值仍然维持在4.9以上。
发酵食品中,pH值的降低通常由乳酸菌发酵产生的乳酸等有机酸浓度增加导致[8],上述实验结果表明,白酒对乳酸菌生长的抑制作用与初始浓度呈正相关,当白酒添加量低于15%,即酒精总含量低于6.4%时,乳酸菌在体系中较快增长,前期pH值仍快速下降,在第28天左右达到最低值3.8;白酒添加量为15%(酒精含量6.4%)显著抑制醉椒发酵体系中乳酸菌的生长。
2.2 总酸
白酒添加量为6%、9%和12%的样品中,总酸变化趋势包括3个阶段:短暂的延滞期、快速积累期和稳定期。由图2可知,白酒添加量为6%和9%时,总酸在第12 天左右趋于稳定,分别达到13.98,13.93 g/kg;白酒添加量为12%时,总酸含量在第23天后达到峰值15.92 g/kg。在第26天时,在白酒添加量为9%和12%的样品中观察到总酸含量下降的现象。白酒添加量为15%的醉椒样品中总酸含量无显著增加(P>0.05)。上述实验结果与pH值的变化趋势一致,二者均说明15%的白酒添加量显著抑制乳酸菌生长繁殖,导致难以发酵或极长的发酵周期。
2.3 醉椒感官评定
由图3可知,各醉椒样品在色泽上无显著差异,白酒添加量为6%的醉椒样品微酸带异味,质构较软,辣椒皮肉分离;白酒添加量为9%和12%时,醉椒样品无明显酸味,有酒香与清香,无霉变,辣椒有咀嚼感,发酵效果较好;白酒添加量为15%的醉椒样品无明显酸味,滋味平淡,无明显霉变。结果显示,白酒添加量下降到6%时,产生酸味和异味,可能是由于在此酒精含量下,乳酸菌生长被部分抑制,乳酸积累速度和乙醇浓度均不足以抑制腐败菌,导致乳酸菌和耐乙醇腐败菌同时生长,形成不良风味;进一步提高白酒添加量为15%,能有效抑制腐败菌,同时抑制了乳酸菌的生长,导致发酵速度变慢;而白酒添加量为9%和12%时,经过30 d的发酵,可获得具有酯香风味且无明显酸味的较成熟的醉椒产品。上述现象表明,不同含量的酒精度能通过抑制或调控微生物生长速度影响醉椒风味的形成。
2.4 微生物多样性分析
采用基于16S rDNA和ITS的二代高通量测序技术分别研究白酒添加量为6%、9%和12%时醉椒发酵样品的细菌和真菌群落结构。
多样性指数分析见表2。所有实验样品的OTU覆盖率(coverage)均大于99%,表明本次实验建立的文库能够较准确地反映出待测样品的微生物多样性情况[9]。Shannon、Simpson指数用于计算菌群多样性(community diversity),Shannon值越大,说明群落多样性越高,Simpson值越大,说明群落多样性越低[10]。Chao、ACE指数用于计算菌群丰度(community richness),指数越大,说明群落丰富度越高[11]。
由表2可知,白酒添加量为6%的醉椒细菌群落Shannon指数大于其真菌群落,细菌群落Simpson指数小于其真菌群落,而白酒添加量为9%和12%的醉椒细菌群落Shannon指数小于其真菌群落,细菌群落Simpson指数大于其真菌群落,各样品的细菌Chao、ACE指数均大于真菌。上述结果表明,白酒添加量为6%的醉椒细菌群落多样性大于其真菌群落,白酒添加量为9%和12%的醉椒细菌群落多样性小于其真菌群落,各组醉椒细菌群落丰富度比真菌群落高。
白酒添加量为6%的醉椒细菌群落Shannon指数大于白酒添加量为9%和12%的醉椒,Simpson指数小于白酒添加量为9%和12%的醉椒,而Chao、ACE指数均小于白酒添加量为9%和12%的醉椒,说明白酒添加量为6%的醉椒细菌群落多样性更高,丰富度更低。白酒添加量为6%的醉椒真菌群落Shannon指数小于白酒添加量为9%和12%的醉椒,Simpson指数远大于白酒添加量为9%和12%的醉椒,而Chao、ACE指数均小于白酒添加量为9%和12%的醉椒,说明白酒添加量为6%的醉椒中真菌群落的多样性和丰富度小于白酒添加量为9%和12%的醉椒,提示真菌群落结构及代谢产物对醉椒发酵风味物质形成具有重要意义。结合感官、pH、总酸实验结果,认为酒精含量通过差异化干预不同微生物的生长繁殖速度,改变发酵过程中细菌和真菌群落结构,导致不同的代谢产物积累。
2.5 醉椒细菌群落组成分析
各样品的稀释性曲线见图4中A。由图4中A可知,3个样品的细菌测序量基本覆盖了样品中所存在的全部物种,说明本研究中样品丰富度较高,实验结果科学有效。在门水平上的细菌群落组成见图4中B。由图4中B可知,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)是白酒添加量为9%和12%样品中的主要优势菌。厚壁菌门(Firmicutes)在白酒添加量为12%的醉椒样品中占88.39%,在白酒添加量为9%的醉椒样品中占87.63%;变形菌门(Proteobacteria)在白酒添加量为12%的醉椒样品中占10.75%,在白酒添加量为9%的醉椒样品中占11.61%。在白酒添加量为6%的样品中,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)为主要优势菌,占比分别为69.63%和20.34%。
各样品在属水平上的细菌群落组成见图4中C。由图4中C可知,白酒添加量为9%和12%时,乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)为主要优势菌属,随着白酒添加量的增加,乳杆菌属占比变大,而明串珠菌属占比变小。乳杆菌属(Lactobacillus)占比分别为63.95%和73.95%,明串珠菌属(Leuconostoc)占比分别为22.62%和12.55%。乳杆菌属(Lactobacillus)是泡菜、酸奶中常见的菌种,明串珠菌属(Leuconostoc)常见于泡菜、黄酒、发酵乳中,具有较强的产酸能力和耐酸性,是醉椒酸味物质的主要来源。白酒添加量为6%时,假单胞菌属(Pseudomonas)、乳杆菌属(Lactobacillus)和一种未知肠杆菌属为优势菌,其占比分别为37.06%、16.39%、16.97%。低白酒含量无法抑制果胶乳杆菌的生长,会对醉椒的质构等品质产生不良影响。
各样品在种水平上的细菌群落组成见图4中D。由图4中D可知,在白酒添加量9%、12%的样品中,植物乳杆菌(Lactobacillus plantarum)和肠膜明串珠菌(Leuconostoc mesenteroides)是主要优势菌,植物乳杆菌(Lactobacillus plantarum)是两组醉椒中的绝对优势物种。植物乳杆菌在白酒添加量为9%和12%的样品中占比分别为56.26%和72.68%,而肠膜明串珠菌(L. mesenteroides)占比分别为20.17%和11.23%。白酒添加量越大,植物乳杆菌(L. plantarum)在醉椒中占比越高,肠膜明串珠菌(L. mesenteroides)占比越低,这种差异可能与不同菌种对酒精的耐受程度不同有关。植物乳杆菌(L. plantarum)是益生菌,在食品行业中通常用于酸奶、泡菜的制作,产生乳酸、抗菌肽、胞外多糖和其他代谢产物[12],在醉椒发酵中起重要作用。肠膜明串珠菌(L. mesenteroides)是乳酸菌中的明串珠菌属的重要菌种,能发酵糖类产生多种酸类和醇类,具有高产酸能力、抗氧化能力和拮抗致病菌等能力[13]。
在白酒添加量6%的样品中,植物乳杆菌(L. plantarum)、嗜冷假单胞菌(Pseudomonas psychrophila)和一种未分类的欧文氏菌(Erwiniaceae)是主要优势菌,占比分别为14.88%、36.07%和16.97%。欧文氏菌(Erwiniaceae)是一种植物腐败菌[14],可由原料带入,可能是导致白酒添加量6%的醉椒质构、气味等感官品质不良的主要菌种之一。由门、属、种水平的细菌群落组成可以看出,白酒添加量越小,醉椒细菌群落丰富度越高,这与多样性指数结果一致,其原因可能是白酒添加量过低时,无法抑制杂菌生长,导致乳酸菌无法成为绝对优势菌种。
2.6 醉椒真菌群落组成分析
各样品的稀释性曲线见图5中A,3个样品的细菌测序量基本覆盖了样品中所存在的全部物种,说明本研究中样品丰富度较高,实验结果科学有效。各样本门水平上的真菌群落组成见图5中B。由图5中B可知,当白酒添加量为9%和12%时,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)为优势真菌,子囊菌门(Ascomycota)占比达到84.83%和80.89%,担子菌门(Basidiomycota)占比达到15.12%和18.34%。白酒添加量为6%时,子囊菌门(Ascomycota)是唯一优势菌。
在属水平上,各样品真菌群落组成见图5中C。由图5中C可知,当白酒添加量为9%和12%时,毕赤酵母属(Pichia)、枝孢属(Cladosporium)、假丝酵母属(Candida)为主要优势菌,在白酒添加量为9%的样品中占比10.82%、16.83%和9.26%,在白酒添加量为12%的样品中占比10.65%、22.24%和5.73%。毕赤酵母属(Pichia)是白酒中主要微生物之一,具有较强的酯化能力,枝孢属(Cladosporium)广泛分布于土壤、空气及各种有机物中,可由原料带入,可产生多种脂肪酸参与酯化反应,假丝酵母属(Candida)在白酒酒曲、康砖茶[15]、老面酵头中均有发现。在白酒添加量为6%时,毕赤酵母属(Pichia)和一种未知酵母属为优势菌,且白酒添加量为6%的样品在真菌丰富度上远低于白酒添加量9%和12%的样品。
在种水平上,各样品真菌群落组成见图5中D。由图5中D可知,白酒添加量为9%和12%时,克鲁维毕赤酵母(Pichia kluyveri)、膜醭毕赤酵母(Pichia membranaefaciens)、皱枝孢菌(Cladosporium delicatulum)是优势真菌,克鲁维毕赤酵母(P. kluyveri)占比6.18%和4.90%,膜醭毕赤酵母(P. membranaefaciens)占比4.64%和5.74%,皱枝孢菌(C. delicatulum)占比16.31%和21.78%。克鲁维毕赤酵母(P. kluyveri)在葡萄酒中被检出,在葡萄酒品质与风味形成中有良好作用[16-17],有较强的产酸、产酯、产乙醇能力[18];膜醭毕赤酵母(P. membranaefaciens)可提升草莓、柑橘等水果对青绿霉菌的抗病性[19-20],在醉椒发酵过程中可能参与抑制腐败真菌的繁殖。皱枝孢菌(C.delicatulum)在自然发酵的腐乳、贵州酸汤中被检出,与有机酸含量呈负相关[21],且酯化能力较强。当白酒添加量为6%时,真菌群落丰富度和多样性极低,克鲁维毕赤酵母(P. kluyveri)、膜醭毕赤酵母(P. membranaefaciens)和一种未知酵母菌为优势真菌,总占比达90%以上。
由门、属、种水平的细菌和真菌群落组成可以看出,白酒添加量越小,样品细菌群落的丰富度与多样性越高,而真菌群落的丰富度与多样性越低,与多样性指数的趋势一致。白酒添加量低于6%时,乙醇浓度低,无法抑制杂菌生长,腐败菌与乳酸菌同时快速繁殖,发酵末期细菌群落的丰富度与多样性高,尽管乳酸菌不是绝对优势菌种,但快速发酵导致体系pH快速下降,抑制真菌生长,导致发酵后期真菌的丰富度和多样性低。而在适宜的白酒添加量下,在发酵初始腐败菌生长受到乙醇抑制,在发酵过程中可能受到乳酸和抗菌肽抑制,形成以乳酸菌为绝对优势菌的细菌群落特点,此外,由于乳酸积累速度更慢,使酵母等真菌在发酵前期得以增长,为发酵后期的产香和酯化作用奠定了基础,从而呈现出较高的真菌丰富度和多样性。
2.7 生物指标、理化指标
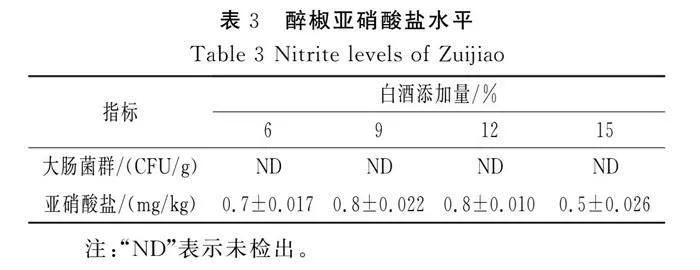
在发酵第28天检测各样品的大肠菌群数量和亚硝酸盐含量,结果见表3。
由表3可知,各样品中均未检出大肠菌群,与微生物多样性的结果一致;在白酒添加量为6%、9%、12%和15%的样品中,亚硝酸盐含量分别为0.7,0.8,0.8,0.5 mg/kg,均显著低于国标相关规定的安全范围。
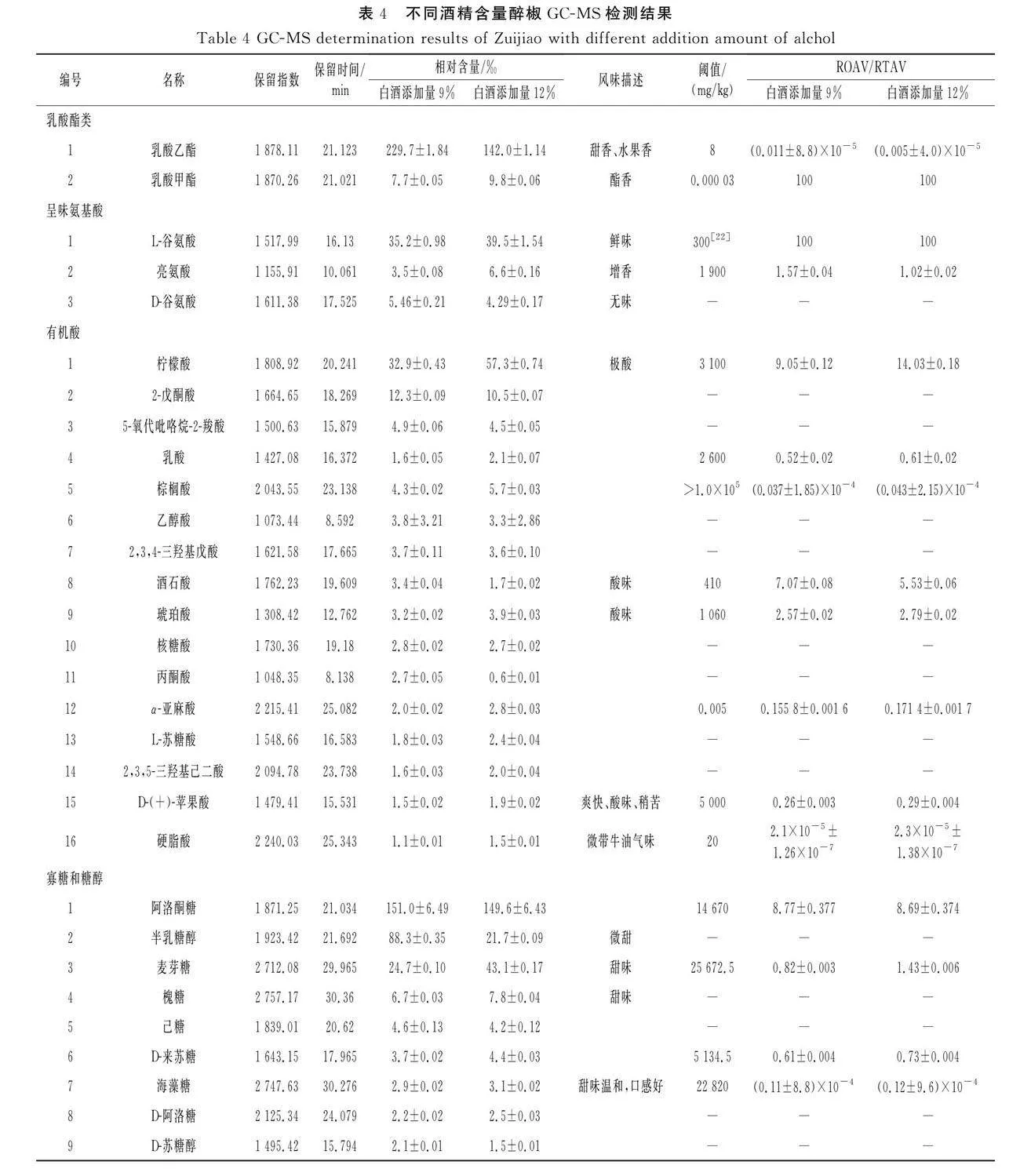
2.8 醉椒风味分析
白酒添加量为9%和12%的醉椒样品衍生化后通过GC-MS检测的风味物质见表4。由表4可知,共检测到37种风味物质,包括2种酯类、2种氨基酸、16种酸类、14种糖类、1种萜类和2种辣椒素类。香气成分以酯类、脂肪酸、氧化芳樟醇和酸类为主。白酒添加量为9%的醉椒中乳酸乙酯占比23.0%、乳酸甲酯占比0.8%,白酒添加量为12%的醉椒中乳酸乙酯占比14.2%、乳酸甲酯占比1.0%。乳酸乙酯呈甜香、水果香,乳酸甲酯呈酯香,乳酸甲酯在两组样品中均为最大挥发性风味贡献物质。白酒添加量为9%的醉椒中α-亚麻酸的ROAV为0.155 8,白酒添加量为12%的醉椒中α-亚麻酸的ROAV为0.171 4,α-亚麻酸对醉椒风味起到重要作用。白酒添加量为9%和12%的醉椒氧化芳樟醇的ROAV均为0.006,对气味的贡献较小。
味觉成分主要为呈味氨基酸、有机酸和寡糖。白酒添加量为9%和12%的醉椒鲜味氨基酸L-谷氨酸的RTAV均为100,白酒添加量为9%和12%的醉椒鲜味增效剂亮氨酸的RTAV分别为1.57,1.02。有机酸检测到柠檬酸、2-戊酮酸、5-氧代吡咯烷-2-羧酸、酒石酸、乳酸、乙醇酸、2,3,4-三羟基戊酸、酒石酸、琥珀酸、L-苏糖酸、2,3,5-三羟基己二酸和D-(+)-苹果酸,其中以柠檬酸具有最大RTAV贡献,白酒添加量为9%和12%的醉椒酸味物质的整体RTAV分别为19.50,31.65。糖类包括阿洛酮糖、半乳糖醇、异麦芽糖、麦芽糖,白酒添加量为9%和12%的醉椒甜味物质的RTAV分别为10.49,11.20,整体风味贡献不大,但寡糖和糖醇作为益生元具有健康益处。
此外,检测到两种辣椒素类物质,包括辣椒素和二氢辣椒素,白酒添加量为9%的醉椒中辣椒素含量为0.56%,二氢辣椒素含量为0.15%;白酒添加量为12%的醉椒中辣椒素含量为0.80%,二氢辣椒素含量为0.25%。
3 结论
文章通过16S rRNA和ITS的二代高通量测序技术、GC-MS等,发现细菌和真菌繁殖、代谢共同推进醉椒的自然发酵成熟过程。乳杆菌属(Lactobacillus)、明串珠菌(Leuconostoc),尤其是植物乳杆菌(L. plantarum)、肠膜明串珠菌(L. mesenteroides)是主要优势细菌,毕赤酵母属(Pichia)、枝孢属(Cladosporium),尤其是克鲁维毕赤酵母(P. kluyveri)、膜醭毕赤酵母(P. membranaefaciens)、皱枝孢霉(C. delicatulum)是主要优势真菌,其发酵过程中产生的大量乳酸酯、萜类、糖醇、寡糖和鲜味氨基酸形成了醉椒的鲜香风味;同时明确了醉椒快速发酵的适宜白酒添加量为9%~12%(酒精度60%),可有效缩短发酵周期到1个月。本研究为逐步揭示醉椒发酵原理、推动醉椒过程中的品质和安全性控制提供了数据和理论支持。
参考文献:
[1]项群然.缓解辣椒素致胃肠损伤的益生菌筛选及其发酵乳制备研究[D].无锡:江南大学,2022.
[2]陈安特,张文娟,张羲,等.酿酒酵母对萝卜泡菜发酵过程的影响[J].食品与发酵工业,2017,43(6):129-133.
[3]国家卫生健康委员会,国家市场监督管理总局.食品安全国家标准 食品中总酸的测定:GB 12456—2021[S].北京:中国标准出版社,2021.
[4]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 大肠菌群计数:GB 4789.3—2016[S].北京:中国标准出版社,2016.
[5]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定:GB 5009.33—2016[S].北京:中国标准出版社,2016.
[6]刘登勇,周光宏,徐幸莲.金华火腿主体风味成分及其确定方法[J].南京农业大学学报,2009,32(2):173-176.
[7]林波,郑凤锦,何洁,等.低醇甘蔗果酒发酵菌种的筛选与呈味特征分析[J].食品科技,2022,47(6):16-23.
[8]侯楠楠,王梅,王倩,等.乳酸菌固态发酵豆粕产酸性能分析[J].中国酿造,2022,41(9):124-129.
[9]马岩石,姜明,李慧,等.基于高通量测序技术分析东北豆酱的微生物多样性[J].食品工业科技,2020,41(12):100-105.
[10]BAI L, CUI J, JIE W, et al. Analysis of the community compositions of rhizosphere fungi in soybeans continuous cropping fields[J].Microbiological Research,2015,180:49-56.
[11]CHAO A, BUNGE J. Estimating the number of species in a stochastic abundance model[J].Biometrics,2002,58(3):531-539.
[12]ROSS P R, MORGAN S, HILL C. Preservation and fermentation:past,present and future[J].International Journal of Food Microbiology,2002,79(1-2):3-16.
[13]李文斌,宋敏丽,高荣琨.肠膜明串珠菌的研究和应用进展[J].食品工程,2006(4):3-4,11.
[14]远方,张松贺,屈淑平,等.大白菜对软腐欧文氏菌防御反应分子基础研究[C]//中国农业生物技术学会.中国农业生物技术学会第三届会员代表大会暨学术交流会论文摘要集,2006:71.
[15]付润华,齐桂年.四川康砖茶的微生物研究[J].江苏农业科学,2008(5):231-234.
[16]ZOTT K, BELY M. The grape must non-Saccharomyces microbial community: impact on volatile thiol release[J].International Journal of Food Microbiology,2011,151(2):210-215.
[17]冯莉,陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.
[18]吴健,何伟,王建成,等.酿酒酵母与产香酵母发酵特性及其相互作用规律[J].食品与发酵工业,2020,46(20):78-87.
[19]张璐,张瑶,刘丽丹,等.膜醭毕赤酵母对草莓采后灰霉病抗病性的诱导[J].食品科学,2013,34(22):286-291.
[20]罗杨.膜醭毕赤酵母对柑橘采后青绿霉病害的生物防治及机理研究[D].重庆:西南大学,2011.
[21]黄韵霖.腐乳风味与后酵微生物的相关性研究[D].广州:华南理工大学,2022.
[22]马建荣,潘腾,王振宇,等.传统炭烤羊肉特征滋味成分解析[J].食品科技,2019,44(4):110-116.

