探讨血清外泌体miRNA-132及SIRT1在2型糖尿病伴轻度认知障碍中的诊断价值



摘 要:目的" 本研究旨在探索血清外泌体miRNA-132及沉默信息调节因子1(SIRT1)在2型糖尿病(T2DM)伴轻度认知障碍(MCI)患者中的表达水平,以及作为诊断T2DM伴MCI的诊断价值。方法" 本实验选取泰州市人民医院内分泌科60例2型糖尿病患者,其中认知正常组(T2DM+NCI)30例,轻度认知障碍组(T2DM+MCI)30例,检测血清外泌体miRNA-132 及SIRT1的表达水平。结果" 与T2DM+NCI组相比,T2DM+MCI组患者中性别、年龄、受教育程度、LPA有差异性,具有统计学意义(Plt;0.05);且血清外泌体miRNA-132、血清SIRT1表达水平降低,亦具有统计学意义(Plt;0.05)。ROC曲线显示血清外泌体miRNA-132在单独检测时,其灵敏度为0.933,特异度为0.5,曲线下面积(AUC)为0.727。血清SIRT1在单独检测时,灵敏度为0.433,特异度为1,曲线下面积(AUC)为0.673。两者联合检测时,灵敏度为0.867,特异度为0.6,曲线下面积(AUC)为0.752。结论" 与T2DM+NCI组相比,T2DM+MCI组患者中miRNA-132、SIRT1表达水平同向降低。血清外泌体miRNA-132及血清SIRT1对诊断T2DM伴轻度认知障碍具有一定的意义,二者联合检测时诊断价值更高。
关键词:2型糖尿病;轻度认知障碍;外泌体miRNA-132;SIRT1
中图分类号:R587.1 " " " " " "文献标志码:A 文章编号:1671-0142(2024)06-0065-05
随着社会的发展,生活方式的改变以及老龄化等各种因素,糖尿病(Diabetes Mellitus,DM)发病率呈逐年上升趋势,同样老龄化的发展也带来了认知障碍人群的增多,数年前鹿特丹研究发现2型糖尿病(Type 2 diabetes mellitus,T2DM)患者发生阿尔茨海默症(Alzheimer's disease,AD)的风险约为正常人的2倍[1],可能与2型糖尿病患者长期处于高血糖状态、神经炎症以及血脑屏障被破坏等因素有关[2]。包括轻度认知障碍(Mild cognitive impairment,MCI)在内的糖尿病并发症直接影响了患者的生存质量及寿命,影响疾病的预后,也增加了家庭及社会经济负担,所以积极开展糖尿病伴认知障碍的研究,开发生物标志物的检测筛查痴呆发病前期,早发现,早诊治,积极采取干预措施,对延缓疾病的不可逆发展进程将具有重要临床意义。近年来科学家们发现外泌体作为生物标志物具有高特异性、强稳定性等特点,且外泌体广泛分布于生物体的各种体液中,较易获取。外泌体(exosomes)是一种大小为40~100纳米的脂质双分子囊泡,这些囊泡广泛分布于生物体的血液、尿液、脑脊液等各种体液中。外泌体其表面具有的多种粘附蛋白已经成为基因治疗的潜在载体,纳米尺寸和柔韧性使它们能够跨越主要的生物屏障[3],如血脑屏障(BBB)等,故提取血液中外泌体标本进行相关生物标志物检测能更好地反映中枢神经系统相关疾病的病理生理机制。目前外泌体在神经系统相关疾病的研究中也越来越多[4]。在生物体液中,miRNAs在细胞间通讯中发挥着重要作用,循环miRNAs的转运可以通过蛋白质转运体或外泌体进行,并且miRNAs可进一步调节其下游靶基因蛋白,进一步影响疾病发病的信号通路。目前发现miRNAs与多种疾病如肿瘤、心血管疾病、神经系统疾病有着密切的联系,尤其是在神经退行性疾病AD 中发挥着重要调控作用。相关研究表明:成年海马中神经元发生缺陷与AD有关,miRNA-132缺失并最终损害成人海马区神经,可以通过恢复miRNA-132水平来修复,miRNA-132具有神经元保护功能[5],miRNAs的水平可能为了解AD大脑中发生的变化提供一个窗口。另有研究表明,外泌体内 miRNAs含量比于外周血总 miRNAs含量更加丰富,因此具有更直接、特异性更高的特点[6]。
1 一般资料
1.1 资料选取 本实验选取在泰州市人民医院内分泌科住院,在2021年8月至2022年8月期间的2型糖尿病患者共60例(男性30例,女性30例),平均年龄为54.98±11.56岁。
1.2 纳入标准 (1)2型糖尿病(符合1999年世界卫生组织关于糖尿病的诊断标准:1)空腹血糖≥7.0mmol/L;2)口服葡萄糖耐量试验(OGTT)2h血糖≥11.1mmol/L;3)三多一少症状加随机血糖≥11.1mmol/L)。(2)入组患者年龄:18岁以上。
1.3 排除标准 (1)伴有糖尿病急性并发症及急性感染病变患者,严重低血糖史。(2)严重肝肾功能不全。(3)伴随其他内分泌疾病如甲亢、甲减等。(4)恶性肿瘤个人史。(5)曾做过减重手术或目前正在接受减肥药物治疗者。(6)伴有慢性消耗性疾病、贫血、严重营养不良者。(7)妊娠期及哺乳期患者。(8)已明确阿尔茨海默病,或伴脑血管病、脑外伤、中毒性脑病、帕金森病、脑垂体瘤及影响认知功能的神经系统疾病。(9)非T2DM患者。(10)听力、视力、精神障碍等无法配合量表评估者。
1.4 评估认知能力 对入组患者进行MoCA量表的评估,若评分gt;25分表明患者认知功能正常,若19分≤评分≤25分则提示患者为MCI;对受教育年限不满12年的患者评分结果可加1分。
2 研究方法
2.1 样品收集 采集入组患者入院第2天清晨空腹静脉血液样本5mL,离心后收集上层血清于冻存管,并保存在-80C°冰箱中,用于后续实验。
2.2 常规检测 入院后常规检测生化指标,收集糖化血红蛋白(HbA1c)、空腹C肽(FC-P)、空腹血糖(FBG)、尿酸(UA)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血肌酐(CREA)、尿白蛋白肌酐比(ACR)、总胆固醇(TC)、甘油三酯(TG)、载脂蛋白E(APOE)、脂蛋白A(LPA)等指标。计算出体重指数(BMI),利用C肽改良的HOMA公式来计算胰岛素抵抗指数(HOMA-IR)、胰岛β细胞功能指数(HOMA-β)。
2.3 血清外泌体miRNA-132的提取及测定
2.3.1 使用exoRNeasy Midi Kit 试剂盒提取外泌体,对提取的外泌体进行透射电镜(TEM)、纳米颗粒追踪分析(NTA)以及蛋白印迹(WB)鉴定。
2.3.2 使用exoRNeasy Midi Kit试剂盒提取外泌体总RNA,用艾科瑞生物的逆转录试剂盒(Code No.AG11716)合成第一链cDNA,进行逆转录,对逆转录得到的产物进行实时荧光定量PCR(qPCR)。具体引物信息,见表1。
2.3.3 采用2^(-△△Ct)法计算两组血清外泌体样本中miRNA-132 相对表达水平。
2.4 血清SIRTI的提取及测定 用酶联免疫吸附实验(ELISA)检测血清中SIRT1的水平。
2.5 统计学方法 应用软件SPSS 27.0对本次实验的结果进行统计学分析;经Shapiro-Wilk检验后,对不符合正态分布的数据用非参数检验的方法,以中位数、四分位数来表示。对符合正态分布的数据使用两独立样本T检验的方法,用均数±标准差来表示。软件Graphpad Prism进行画图;最后使用ROC曲线分析来判断测量指标对T2DM伴MCI的诊断价值。qPCR的实验数值采用2^(-△△Ct)来表示。Plt;0.05具有统计学意义。
3 结果
实验结果发现两组患者在T2DM+MCI组中女性患者更多,年龄更大,受教育程度更低,LPA值更高,且具有统计学意义(Plt;0.05),见表2;在病程、BMI、HbA1c、FC-P、FBG、UA、HDL-C、LDL-C、CREA、ACR、TC、TG、APOE、HOMA-IR-c、HOMA-β-c等方面无明显差异(Pgt;0.05)。
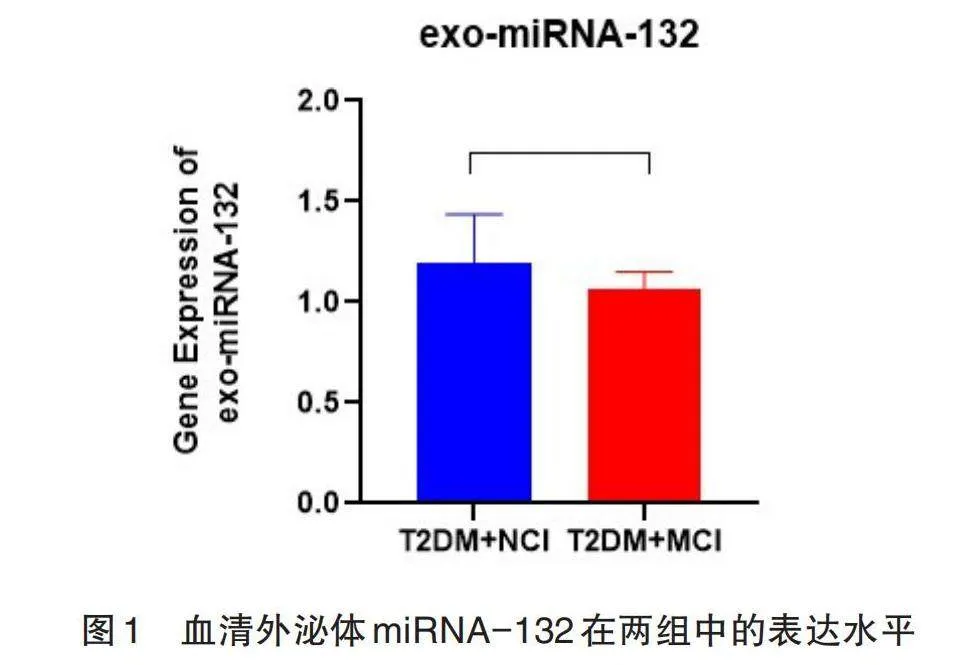
实时荧光定量 PCR(qPCR)实验结果CT值计算得出2^(-△△Ct)进行验证,结果发现血清外泌体miRNA-132在T2DM+MCI组患者中表达下调,与T2DM+NCI组患者相比有显著差异(Plt;0.05),具有统计学意义。血清SIRT1在T2DM+MCI组中表达下调,差异具有统计学意义(Plt;0.05),见图1。
血清SIRT1在T2DM+MCI组中表达下调,差异具有统计学意义(Plt;0.05),见表3。
使用ROC曲线分析血清外泌体miRNA-132、血清SIRT1检测对T2DM伴MCI的诊断价值,以及两者联合检测对T2DM伴MCI的诊断价值。结果显示,血清外泌体miRNA-132单独检测时,曲线下面积(AUC)为0.727,95%置信区间(CI)为0.598~0.855,灵敏度为0.933,特异度为0.5,最佳截断值为1.142。血清SIRT1单独检测时,曲线下面积(AUC)为0.673,95%置信区间(CI)为0.535-0.812,灵敏度为0.433,特异度为1,最佳截断值为 292.01。两者联合检测时,曲线下面积(AUC)为0.752,95%置信区间(CI)为0.629-0.875,灵敏度为0.867,特异度为0.6,最佳截断值为0.568。
4 讨论
随着老龄化社会的到来,糖尿病(Diabetes Mellitus,DM)已然成为威胁老年人身心健康最常见的疾病。预测到2045年,全球20~79岁的成年人糖尿病患病率将上升至12.2%,约7.832亿人[7]。糖尿病并发症给患者带来的危害远超糖尿病本身,如糖尿病合并冠心病及肾病时其患者体内的炎症反应远远高于单纯性冠心病及肾病患者[8]。阿尔茨海默病是一种以进行性认知功能障碍以及行为损害为特征的退行性中枢神经系统病变,主要发生于老年和老年前期。轻度认知障碍为阿尔茨海默前期阶段,可进一步发展为痴呆。研究表明糖尿病是认知功能障碍的危险因素,因此积极开展糖尿病伴认知障碍的研究,开发生物标志物的检测筛查痴呆发病前期,具有重要临床意义。
外泌体是一种脂质双分子囊泡,其独特的结构使其能通过血脑屏障,更加准确地反应中枢神经系统的病理生理过程。miRNAs是一种内源性非编码RNA,在调节基因表达方面发挥着重要作用,但是目前关于外泌体miRNA-132及SIRT1在T2DM中的研究较少。本研究结果表明,女性罹患T2DM伴轻度认知障碍的数量明显多于男性,与既往一项以性别分组的研究结论一致,该研究提示在AD的演化过程中,不同性别之间的脑血流灌注具有显著的差异性[9]。研究证据表明年龄与认知功能紧密相关,并且随着年龄的增长,痴呆的风险越大。本研究结果显示T2DM+MCI组患者年龄高于T2DM+NCI组(Plt;0.05),与既往研究一致,既往大部分对于认知障碍的研究多在老年患者中进行,而本研究入组患者年龄并未局限于老年患者,结果发现在年龄范围扩大后,年龄仍然是T2DM伴MCI的重要影响因素。本研究组设想基于年龄因素,在T2DM患者中评估认知功能可能需提前筛查,有待今后进一步研究。本研究中T2DM+NCI组的患者的受教育程度普遍高于T2DM+MCI组。可能与接受更高水平的教育时,大脑的新陈代谢增快,以及生物神经突触的连接程度发生变化有关。因此本研究组认为,对受教育程度低的T2DM患者更应关注其认知功能。本实验发现在T2DM+MCI组患者中LPA的表达量高于对照组。LPA是一种特殊的脂蛋白,又称脂蛋白(a),LPA由一种类似LDL的颗粒组成,它与载脂蛋白(a)共价结合,在结构上与其他载脂蛋白不同。早在2002年,就有研究表明,较高的 LPA 浓度与阿尔茨海默病 (AD)之间存在联系,其促进心血管疾病和炎症的发生是脑血管疾病和认知能力下降的可能机制[10]。miRNA-132来源于miRNA212/132簇,是一种能参与神经元功能形成、分化及成熟过程的调控因子,与认知功能的发生发展息息相关。miRNA-132对维持大脑神经元的完整性具有十分重要的作用,并能减少海马神经元之间的突触传递。miRNA-132在大脑中的表达下调会加重Aβ蛋白的沉积和tau蛋白的磷酸化[11,12]。本研究发现,血清外泌体miRNA-132在T2DM+NCI组的表达高于T2DM+MCI组,这与国内外学者研究结果一致[13]。SIRT1的减少可能增加 AD 和胰岛素抵抗的风险,血糖浓度升高可下调SIRT1以及增加p53乙酰化而诱导神经元凋亡[14],本研究结果表明血清SIRT1在T2DM+MCI组患者中的表达水平较T2DM+NCI组显著降低,与上述研究结果一致。SIRT1可受其上游靶基因miRNA-132的调控,Sara Giovanna Romeo等学者通过对30例来自开颅手术切除脑肿瘤的不同组织学分级的星形细胞瘤标本研究认为,miRNA-132的过表达降低了SIRT1的表达。可能与miRNA-132能阻滞NF-KBp56去乙酰化,从而导致SIRT1的表达减少有关[15]。同时SIRT1通过P53-miRNA-34a-SIRT1-P53这一环路调节miRNA的表达已被证实[16]。在本次实验中,血清外泌体miRNA-132及SIRT1在两组间的表达水平表现为同向下调,但对二者进行相关性分析时也并未发现明显的相关性,与上述既往研究结果存在一定程度不一致。分析考虑可能与本研究样本量不大,样本来源不同以及研究对象不同有关,而目前也并未发现在T2DM患者中开展的类似研究,故有待在今后的研究工作中深入探讨。
参考文献:
[1]Ott A, Stolk R P, van Harskamp F, et al. Diabetes mellitus and the risk of dementia: The Rotterdam Study[J]. Neurology, 1999, 53(9): 1937-1942.
[2]杨明月,杨淑芳,王珏,等. 2型糖尿病伴认知障碍的研究进展[J].泰州职业技术学院学报,2023,23(1):66-70.
[3]Molinaro R,Corbo C,Martinez J. O, et al. Biomimetic proteolipid vesicles for targeting inflamed tissues[J]. Nature materials,2016,15(9):1037-1046.
[4]Eren E, Hunt J F V, Shardell M, et al. Extracellular vesicle biomarkers of Alzheimer’s disease associated with sub-clinical cognitive decline in late middle age[J]. Alzheimer’s amp; Dementia: The Journal of the Alzheimer’s Association, 2020, 16(9): 1293-1304.
[5]Walgrave H, Balusu S, Snoeck S, et al. Restoring miR-132 expression rescues adult hippocampal neurogenesis and memory deficits in Alzheimer’s disease[J]. Cell Stem Cell, 2021, 28(10): 1805-1821.e8.
[6]Katayama M, Wiklander O P B, Fritz T, et al. Circulating Exosomal miR-20b-5p Is Elevated in Type 2 Diabetes and Could Impair Insulin Action in Human Skeletal Muscle[J]. Diabetes, 2019, 68(3): 515-526.
[7]Sun H, Saeedi P, Karuranga S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2022, 183: 109119.
[8]杨淑芳,陈茜,卢宇,等.2型糖尿病肾脏病患者中NGAL等肾损伤指标的研究[J].泰州职业技术学院学报,2020,20(4):47-50.
[9]高子雯,李晓舒,朱婉秋,等.阿尔茨海默病脑血流灌注改变的性别差异及其与认知损害的相关性[J].放射学实践, 2022, 37(8): 946-953.
[10]Solfrizzi V, Panza F, D’Introno A, et al. Lipoprotein(a), apolipoprotein E genotype, and risk of Alzheimer’s disease[J]. Journal of Neurology, Neurosurgery, and Psychiatry, 2002, 72(6): 732-736.
[11]Remenyi J, van den Bosch M W M, Palygin O, et al. miR-132/212 knockout mice reveal roles for these miRNAs in regulating cortical synaptic transmission and plasticity[J]. PloS One, 2013, 8(4): e62509.
[12]Bahlakeh G, Gorji A, Soltani H, et al. MicroRNA alterations in neuropathologic cognitive disorders with an emphasis on dementia: Lessons from animal models[J]. Journal of Cellular Physiology, 2021, 236(2): 806-823.
[13]蒋娟莉,喻良,刘爱东,等.老年痴呆症患者血清中miR-132的表达及临床意义[J].海南医学, 2018, 29(3): 312-315.
[14]Shi X, Pi L, Zhou S, et al. Activation of Sirtuin 1 Attenuates High Glucose-Induced Neuronal Apoptosis by Deacetylating p53[J]. Frontiers in Endocrinology, 2018, 9: 274.
[15]Romeo S G, Conti A, Polito F, et al. miRNA regulation of Sirtuin-1 expression in human astrocytoma[J]. Oncology Letters, 2016, 12(4): 2992-2998.
[16]Guo Y,Li P,Gao L,et al.Kallistatin reduces vascular senescence and aging by regulating microRNA-34a-SIRT1 pathway[J].Aging Cell,2017 ,16(4):837.
(责任编辑 刘 红)
Exploration on the Diagnostic Value of Serum Exosome miRNA-132 and SIRT1 in Type 2 Diabetes Mellitus with Mild Cognitive Impairment
WEI Jing-wen1, LIU Chen1, CHEN Qian1, YANG Shu-fang1,2
(1. The Affiliated Taizhou People’s Hospital of Nanjing Medical University, Taizhou Jiangsu 225300;
2. Zhongda Hospital Southeast University, Nanjing Jiangsu 210000, China)
Abstract: Objective This study was to investigate the expression levels of serum exosome miRNA-132 and silent information regulator1 (SIRT1) in patients with type 2 diabetes mellitus (T2DM) and mild cognitive impairment (MCI), and their diagnostic value in the diagnosis of T2DM with MCI. Methods 60 patients with type 2 diabetes mellitus (T2DM) from the Endocrinology Department of Taizhou People’s Hospital were selected, including 30 patients with normal cognition (T2DM+NCI) and 30 patients with mild cognitive impairment (T2DM+MCI). The expression levels of exosomal miRNA-132 and SIRT1 in the serum were detected. Results There were significant differences in gender, age, education level, and LPA between the T2DM+MCI group and the T2DM+NCI group (Plt;0.05). Compared with the T2DM+NCI group, the expression levels of serum exosomal miRNA-132 and SIRT1 were lower in the T2DM+MCI group, and the differences were statistically significant (Plt;0.05). The ROC curve shows that when serum exosomal miRNA-132 is detected alone, its sensitivity is 0.933, its specificity is 0.5, and the area under the curve (AUC) is 0.727. When serum SIRT1 is detected alone, the sensitivity is 0.433, the specificity is 1, and the area under the curve (AUC) is 0.673. When the two are jointly detected, the sensitivity is 0.867, the specificity is 0.6, and the area under the curve (AUC) is 0.752. Conclusions Compared with the T2DM+NCI group, the expression levels of serum miRNA-132 and SIRT1 in the T2DM+MCI group were lower in the same direction. The expression of miRNA-132 in serum exosomes and serum SIRT1 are of certain significance in diagnosing T2DM with mild cognitive impairment, and the diagnostic value is higher when the two are jointly detected.
Key words: type 2 diabetes mellitus; mild cognitive impairment; exosome miRNA-132; SIRT1

