超声诊断的短股骨胎儿产前诊断结果和随访研究



[摘要]目的对胎儿股骨发育小于两个标准差及以上(≤-2SD)孕妇的产前诊断结果、妊娠结局及胎儿出生后生长水平情况进行分析,从而更好地促进短股骨(SF)胎儿的产前优生咨询。方法选取2018年12月至2022年12月期间因超声诊断股骨发育≤-2SD,就诊于淮安市妇幼保健院产前诊断中心行介入性产前诊断的35例孕妇为研究对象。依据胎儿超声表现分为单纯SF组和SF合并其他超声异常组。对两组产前诊断结果包括染色体微阵列(CMA)和家系全外显子组测序(TrioWES)、妊娠结局、生长水平进行随访和比较分析。结果SF胎儿致病性染色体异常诊断率为5.71%(2/35),其中单纯SF组和SF合并超声异常组分别为4.76%(1/21)和7.14%(1/14)。SF胎儿TrioWES总体诊断率为26.32%(5/19),其中单纯SF组和SF合并超声异常组分别为33.33%(4/12)和14.29%(1/7)。孕有SF胎儿的孕妇引产率22.86%(8/35)、妊娠丢失率17.14%(6/35)、活产率54.29%(19/35)。两组之间引产率、妊娠丢失率、活产率均无统计学差异(P>0.05)。SF胎儿出生后成功随访19例,为3~48月龄,均未见其他异常,身高水平处于下等和中下等的频率为57.89%(11/19),其中单纯SF组和SF合并超声异常组分别为63.64%(7/11)和50.00%(4/8),两组差异无统计学意义(P>0.05)。结论SF胎儿染色体异常诊断率5.71%,TrioWES诊断率26.32%,二者联合应用是SF遗传学病因诊断的优化组合。排除遗传学原因后SF胎儿相关孕妇仍有较高的丢失率。SF胎儿出生后、身高水平位于中下等的频率较高。
[关键词]短股骨;产前诊断;妊娠结局;生长水平;随访" " "Doi:10.3969/j.issn.1673-5293.2024.12.010
[中图分类号]R173[文献标识码]A" [文章编号]1673-5293(2024)12-0066-07
[Abstract] Objective To promote and benefit prenatal consultation for families with fetuses affected by short femur (SF) (≤-2SD),the prenatal diagnosis results and pregnancy outcomes of pregnant women with fetuses with SF and postnatal growth levels of SF fetus were analyzed. Methods A total of 35 pregnant women who were diagnosed with femoral development ≤-2SD through ultrasound and received invasive prenatal diagnosis at the department of prenatal diagnosis of Huai′an Maternal and Child HealthCare Center between December 2018 and December 2022 were selected for the study.According to the fetal ultrasound findings,the fetus was divided into the isolated SF group and the SF with other abnormal ultrasound findings group.The prenatal diagnosis results including chromosomal microarrays (CMA) and trio whole exome sequencing (TrioWES),pregnancy outcomes,and growth levels between the two groups were followed up and compared. Results The pathogenic chromosomal abnormality diagnosis rate for SF fetuses was 5.71% (2/35),with 4.76% (1/21) in the isolated SF group and 7.14% (1/14) in the SF with other ultrasound abnormalities group.The overall TrioWES diagnostic rate for SF fetuses was 26.32% (5/19),with 33.33% (4/12) in the isolated SF group and 14.29% (1/7) in the SF with other ultrasound abnormalities group.The induction rate for pregnant women with SF fetuses was 22.86% (8/35),the pregnancy loss rate was 17.14% (6/35),and the live birth rate was 54.29% (19/35).There were no statistically significant differences between the two groups in terms of induction rate,pregnancy loss rate,or live birth rate (P>0.05).After birth,19 SF fetuses were successfully followed up,aged 3 to 48 months,and no other abnormalities were observed.The height level was in the lower and lowermiddle range in 57.89% (11/19),with 63.64% (7/11) in the isolated SF group and 50.00% (4/8) in the SF with other ultrasound abnormalities group.There was no statistically significant difference between the two groups (P>0.05). Conclusion The chromosomal abnormality diagnosis rate for SF fetuses was 5.71%,and the TrioWES diagnostic rate was 26.32%.The combination of both methods is an optimized approach for genetic etiology diagnosis of SF.After excluding genetic causes,pregnant women carrying SF fetuses still have a relatively high pregnancy loss rate.After birth,the frequency of SF fetuses with height levels in the lowermiddle range was relatively high.
[Key words] short femur;prenatal diagnosis;pregnancy outcome;growth level;followup
在妊娠早期,常采用胎儿顶臀长和双顶径来预测胎龄和胎儿体重,而在孕中期和晚期还需结合头围、腹部直径周长及股骨长度来评估胎儿胎龄和胎儿体重[1]。因此在孕中晚期胎儿股骨长度的测量是非常重要的一个指标。临床上股骨是最易识别的长骨,较其他径线测量值更有意义。目前临床上胎儿股骨长度低于孕周均值两个标准差(≤-2SD)或同孕周胎儿股骨长度第5百分位数则定义为短股骨(short femur,SF)[23]。短股骨可能与种族和家族遗传有关,也可能提示生长受限、胎盘功能异常、妊娠并发症、染色体疾病、单基因疾病如软骨发育不全和成骨不全等[47]。其中由染色体和基因变异导致的短股骨缺乏有效的治疗手段,对胎儿结局、新生儿生命质量乃至人口素质造成巨大负面影响,给家庭及社会带来极大的经济负担。因此,需通过影像监测胎儿长骨发育情况,对SF胎儿及时地进行介入性产前诊断,以确定胎儿是否存在遗传异常。此外,关于孕有SF胎儿的孕妇妊娠结局和SF胎儿出生后生长水平情况尚无报道。因此,本研究对行产前诊断的短股骨胎儿相关孕妇的产前诊断结果和妊娠结局进行回顾性分析,并对产前诊断后继续妊娠的孕妇进行随访、对顺利出生的SF胎儿生长水平情况进行随访,旨在为短股骨胎儿的产前诊断和优生咨询提供依据。
1对象与方法
1.1研究对象
选取2018年12月至2022年12月期间因超声诊断股骨发育≤-2SD,就诊于淮安市妇幼保健院产前诊断中心行介入性产前诊断的35例孕妇为研究对象。依据胎儿超声表现分为单纯SF胎儿组和SF合并其他超声异常胎儿组。纳入标准:①单胎妊娠;②母亲无慢性病、精神病史,无烟酒嗜好及放射物毒物接触史;③第一次产检时母亲无妊娠相关高血压疾病、妊娠期糖尿病、肝肾功能不全、自身免疫性疾病、紫绀型心脏病等。排除标准:①双胎、多胎妊娠;②产前诊断前出现严重的可影响胎儿生长发育的妊娠合并症(如子痫前期、肝内胆汁淤积症、血糖控制不佳的妊娠期糖尿病等);③宫内弓形虫病毒、巨细胞病毒、风疹病毒、单纯疱疹病毒感染。所有研究对象均知情同意自愿参与研究。
1.2研究方法
1.2.1股骨长度测量与短股骨判读标准
股骨两端骨化的干骺端清晰可见,测量骨化的干骺端之间的最长直线距离即为股骨长度[8]。标尺均放置于股骨两端骨化的干骺端边缘,不包括远侧的骨骺,避免将三角形凸起毛刺伪影包括在内,使股骨边缘长度延伸并引起测量误差。对获得的胎儿股骨超声测量数值使用香港中文大学路晶教授团队开发的孕生通软件进行Z值计算,该计算方式参考的人群数据是基于中国胎儿的生长参数。本研究中孕14周~分娩前均对胎儿进行股骨长度测量,胎儿长骨小于相应孕周两个及以上标准差且一周后经过另一超声医生复查仍然小于相应孕周两个及以上标准差则定义为短长骨[2]。
1.2.2羊水穿刺
采用羊膜穿刺术抽吸羊水40mL。将羊水以1 500rpm离心10分钟。用PBS缓冲液洗涤沉积物,然后用Thermo Fisher MagMAXTM DNA MultiSample Ultra 2.0 Kit(A36570,Thermo Fisher)提取基因组DNA。21个短串联重复序列(short tandem repeats,STR)标记(用FAM标记:D2S441、D5S818、D19S433、FGA、D6S1043;用NED标记:TH01、D8S1179、D18S51、Penta D;用HEX标记:TPOX、D16S539、D12S391、D10S1248、D2S1338、Penta E;用ROX标记:AMEL、vWA、D7S820、D13S317、D1S1656、CSF1PO)用作质量控制,以检测胎儿样本中的母体DNA污染。
1.2.3基因芯片
使用Affymetrix CytoScan 750K基因芯片对羊水进行染色体拷贝数分析。通过染色体分析软件CHAS 2.0软件对CEL文件中的芯片数据进行分析,以生成CYCHP文件。使用CHAS分析CYCHP文件中的拷贝数变异。
1.2.4全外显子组测序
本研究采用IDT probe对人的特定目标区域DNA进行高效富集,然后在Illumina NovaSeq 6000仪器上进行测序。获得的测序序列经BWA(BurrowsWheeler Aligner)软件比对在人类基因组GRCh37/hg19参考序列上。通过Picard软件获取BAM(binary sequence alignment map format)文件。分别采用GATK4(Genome Analysis Toolkit)Realigner Target Creator软件和Haplotype Caller软件对序列进行校准、变异提取并生成VCF(Variant Call Format)文件。在千人基因组数据库(1 000g)和人类外显子组整合数据库(ExAC)中查询突变情况,用MutationTaster(http://www.mutationtaster.org/)、SIFT(http://sift.jcvi.org/)和Polyphen进行突变位点有害性的预测。
1.2.5致病性变异解读
拷贝数变异和单核苷酸变异(single nucleotide variants,SNVs)位点致病性的判读参考美国医学遗传学会(American College of Medical Genetics and Genomics,ACMG)发表的致病性解读指南[910]。
1.2.6出生后生长水平随访及生长水平评价
由出生缺陷小组的工作人员采用电话进行随访,同时在江苏省妇幼保健信息系统进行新生儿体检信息查询。参考中华人民共和国国家卫生健康委员会发布的《7岁以下儿童生长标准》(WS/T 423—2022版)[11],对随访的儿童参照相应性别和月龄按照儿童生长水平的百分位数评价方法进行评价,见表1。
1.3统计学方法
采用GraphPad Prism 8对单纯SF和SF合并超声异常两组胎儿妊娠结局进行比较。计数资料用例数(n)和百分比(%)表示,组间比较采用χ2检验或Fisher确切概率法;计量资料以均数±标准差(x-±s)表示,组间比较采用t检验。P<0.05表示差异有统计学意义。
2结果
2.1 SF胎儿一般临床资料
本研究共纳入35例短股骨且进行产前诊断的胎儿,其中单纯SF胎儿21例,母体年龄范围为24~40岁,平均年龄31.48岁,平均诊断孕周26+4周;SF胎儿合并超声异常14例,母体年龄范围为27~37岁,平均年龄30.64岁,平均孕周25+4周。单纯SF组与SF合并其他超声异常组孕妇孕周、年龄差异无统计学意义(t值分别为0.84、0.48,P>0.05)。
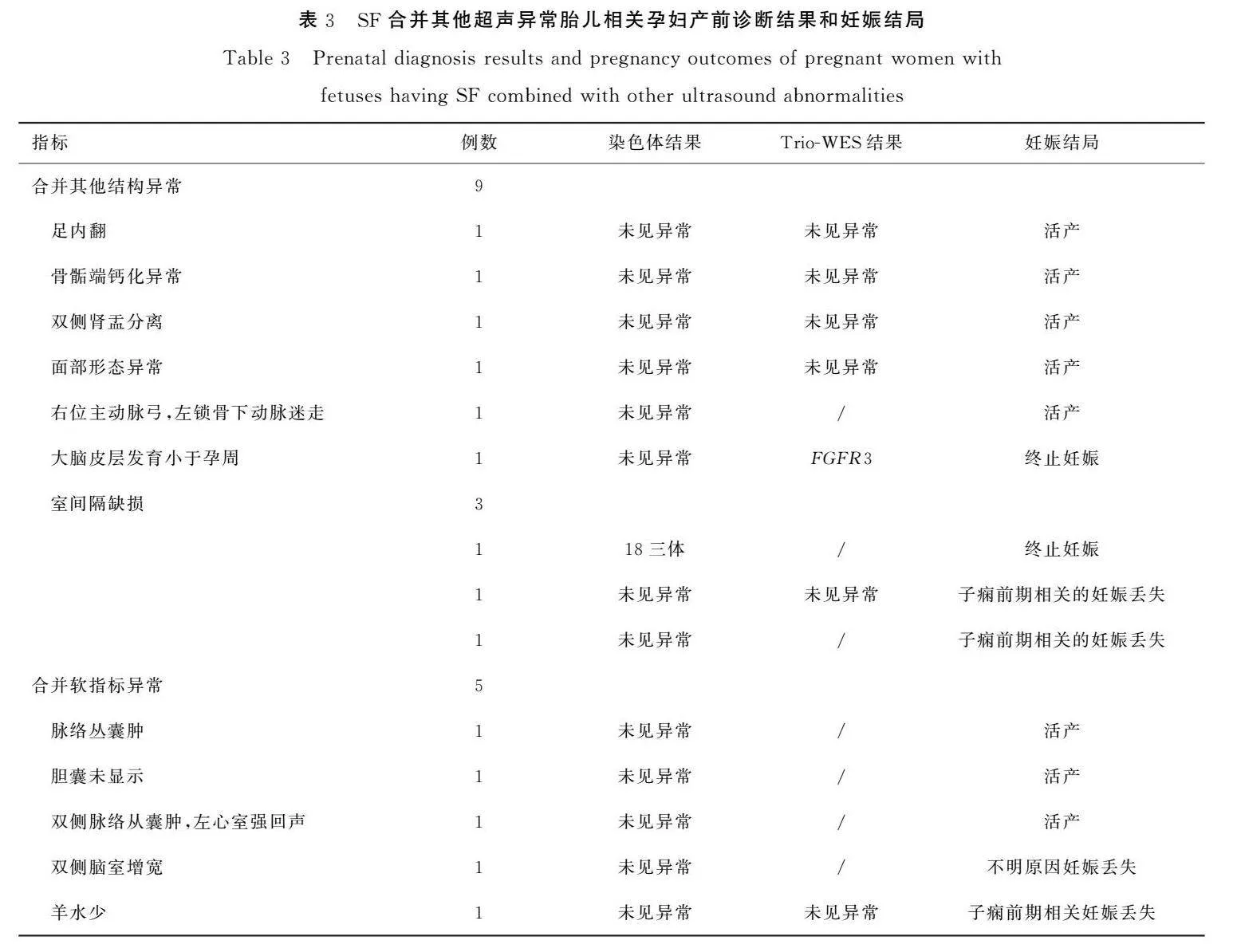
14例SF合并超声异常胎儿中超声软指标异常6例,结构异常8例,后者包括心血管结构异常4例、足内翻1例、单侧骨骺钙化异常1例、颜面部异常1例、大脑发育异常1例。
2.2 SF胎儿产前诊断结果
35例SF胎儿中致病性染色体异常2例,诊断率为5.71%(2/35),TrioWES发现与表型相关的致病性单基因变异5例,诊断率为26.32%(5/19)。
21例单纯SF胎儿相关孕妇共检出1例与表型相关的致病性16p11.2微缺失,经遗传咨询后选择终止妊娠,致病性染色体异常诊断率为4.76%(1/21);其余20例中有12例继续选择TrioWES进行诊断,有4例发现与临床表型相关的致病性变异,包括EXT2 c.1945C>T(p.Arg649*)变异1例、FGFR3 c.1138G>A(p.Gly380Arg)变异2例、COL2A1 c.2059G>A(p.Gly687Ser)变异1例,按照ACMG指南均判读为致病性变异,TrioWES诊断率为33.33%(4/12),见表2。
14例SF合并超声异常胎儿家庭均选择CMA进行染色体数目和结构异常检测,结果检出18三体1例,染色体异常诊断率为7.14%(1/14)。有7例选择TrioWES进一步诊断,1例检出FGFR3 c.1138G>A(p.Gly380Arg)新发变异,诊断率为14.29%(1/7),见表3。
2.3 SF胎儿结局
35例SF胎儿相关孕妇失访2例,8例选择引产(22.86%,8/35,包括遗传学原因7例和自愿1例)、妊娠丢失6例(17.14%,6/35)、活产19例(54.29%,19/35,包括早产1例、足月适于胎龄儿18例),见表4。
21例单纯SF相关孕妇中选择引产6例,包括1例致病性16p11.2微缺失、1例自动放弃和4例致病性单基因变异。继续妊娠15例,其中2例失访、2例妊娠丢失(9.52%,2/21)、11例活产(52.38%,11/21)包括1例早产和10例足月分娩,见表4。
14例SF胎儿合并超声异常相关孕妇中2例选择引产,包括1例18三体和1例致病性单基因变异。继续妊娠12例,其中4例妊娠丢失(28.57%,4/14,3例与迟发型子痫前期有关),其余8例为活产且均为足月分娩(57.14%,8/14),见表4。
两组之间引产率、妊娠丢失率、活产率均未发现有统计学差异(P>0.05),见表4。
2.4 SF胎儿出生后身高水平随访
本研究SF成功分娩和顺利随访者共19例,均未见明显出生缺陷及神经系统发育性异常,身高水平处于中下等和下等水平的发生率为57.89%(11/19)。单纯SF组中成功分娩和随访者共11例,年龄范围为3~48月龄,身高水平处于中下等和下等水平的发生率为63.64%(7/11),其中身高处于下等水平的有2例(18.18%,2/11)。SF合并超声异常组中成功分娩和随访者共8例,年龄范围为6~12月龄,身高处于中下等的有4例(50.00%,4/8)。两组之间身高处于中下等的发生率无统计学差异(P=0.657)。
3讨论
3.1短股骨与染色体异常
短股骨的发生率为0.5%~5%,其与遗传因素、种族、营养状况及超声医生的测量误差等密切相关[12]。然而部分短股骨可能提示染色体异常和单基因疾病,因此给孕妇及其家属带来了巨大的心理压力,也给产前诊断带来了挑战。之前的研究报道在短股骨胎儿中使用染色体核型分析技术发现13%~16%的染色体异常,而对染色体未见异常的胎儿继续行基因芯片检测结果发现6%~27%的短股骨胎儿携带致病性拷贝数变异[1314]。本研究中35例SF胎儿致病性染色体异常总诊断率为5.71%(2/35),单纯SF组和SF合并超声异常组分别为4.76%(1/21)和7.14%(1/14)。其中1例SF合并超声异常为18三体,超声提示室间隔缺损等结构异常。另1例单纯SF胎儿在16p11.2区段存在1.1Mb片段的缺失。16p11.2复发性微缺失区域(BP2BP3)(chr16:2882263529046499)为单倍剂量不足敏感区域(得分为3),2013年Shaffer团队报道该区域存在外显不全,外显率为62.4%,该区域缺失与不同程度的发育迟、肥胖等非特异性临床表型相关[1517]。因此对于单纯短股骨胎儿要警惕是否与外显不全致病性拷贝数变异有关。
3.2短股骨与单基因变异
除了染色体异常,基因变异也是导致短股骨的重要遗传因素,广东省妇幼最新发表的文献对94例短股骨胎儿进行TrioWES测序,结果检测与表型相关致病性变异38例,诊断率达到40.4%。单纯短股骨全外诊断率为27.3%(6/22),短股骨合并超声异常诊断率为44.4%(32/72),其中合并超声软指标异常诊断率为32.5%,而合并其他骨骼异常的TrioWES诊断率为59.4%,该研究提示当产前超声扫描显示胎儿股骨低于2个或多个SD,应检测其他长骨及形态以确定是否存在其他骨骼形态异常,若存在其他骨骼异常则提示存在骨骼系统疾病的可能性增高[12]。本研究中,短股骨TrioWES总体诊断率为26.32%(5/19),值得注意的是虽然两组差异无统计学意义,但是单纯SF组TrioWES诊断率高于SF合并超声异常组。目前已经明确的与骨骼发育相关疾病的基因约400多个,其中FGFR3、COL1A1、COL1A2和COL2A1的致病变异是孤立性身材矮小常见原因[18]。本研究中FGFR3和COL2A1基因变异导致的短股骨占比67%(4/6),其中只有1例FGFR3基因变异胎儿表现为短股骨合并大脑皮质发育落后,其余3例均表现为单纯SF,这个结果提示FGFR3和COL2A1基因胎儿超声表现多为单纯的短股骨,少数合并其他结构异常。这也解释了单纯SF组TrioWES诊断率高于SF合并超声异常组的现象。
本研究中FGFR3变异均为c.1138G>A位点变异,该位点变异导致软骨发育不全。文献报道FGFR3基因变异导致的软骨发育不全产前临床表型多出现在孕中晚期,本研究超声发现FGFR3基因变异相关的软骨发育不全胎儿超声诊断时间在28周左右,这与文献一致[19]。值得注意的是除了软骨发育不全,FGFR3 c.742C>T(p.Arg248Cys)变异还可导致死性骨发育不全,临床表现包括胸廓狭小继发呼吸功能不全和肺发育不全最终致死。Zhou等[20]报告了4例FGFR3 c.742C>T(p.Arg248Cys)变异导致的产前致死性骨发育不全胎儿,超声发现时间为23~26周,股骨长度小于相应孕周的第五个百分位数,这些结果提示致死性骨发育不全和软骨发育不全股骨都发生严重短小,但是致死性骨发育不全诊断孕周早于软骨发育不全。有研究对9例软骨发育不全和10例独立短长骨胎儿的长骨Z值进行比较发现软骨发育不良组股骨长度SD均值为-5.04,高于独立性短长骨胎儿[19],这些研究结果提示对孕中期和孕晚期发现的严重短股骨胎儿进行介入性产前诊断是非常必要的。
3.3短股骨胎儿妊娠结局与出生后生长发育情况
本研究中我们还对短股骨胎儿进行了随访,对不良妊娠结局进行分析。其中妊娠丢失6例(17.14%,6/35),这个结果提示排除遗传学原因后SF胎儿仍有较高的妊娠丢失率。本研究SF合并超声异常组妊娠丢失率高于单纯SF组,SF合并超声异常组中有3例与迟发型子痫前期有关。王影等[21]报道妊娠期高血压与胎儿生长受限密切相关,因此,这个结果提示产前出现胎儿短股骨或生长受限时需要密切关注孕妇子痫前期相关临床表现,例如进行血压、尿蛋白等指标的密切监视。
出生后生长水平随访月龄3~48月龄,均未见明显出生缺陷及神经系统发育异常。身高水平处于下等和中下等(<P25)的频率为57.89%(11/19)。单纯SF组中身高小于P25的频率为63.64%(7/11),合并超声异常组中身高小于P25的频率为50%(4/8),差异无统计学意义,这些结果提示SF胎儿出生后身高水平位于中下等的频率较高。
综上所述,对于产前发现的短股骨胎儿需要首先排除遗传学因素,这将极大避免出生缺陷、促进健康中国的建设。通过对排除常见遗传学原因后出生的SF胎儿进行生长发育情况随访,本研究发现SF胎儿出生后身高水平位于中下等的频率较高,这些结果为短股骨胎儿的产前优生咨询提供了非常有价值的参考依据。
[参考文献]
[1]中华医学会围产医学分会胎儿医学学组,中华医学会妇产科学分会产科学组.胎儿生长受限专家共识(2019版)[J].中华围产医学杂志,2019,22(6):361380.
[2]张倩雯,龚云辉,周容,等.胎儿短股骨诊治的临床进展[J].中国计划生育和妇产科,2019,11(1):2729,40.
[3]MohrSasson A,ToussiaCohen S,Shapira M,et al.Longterm followup on fetuses with isolated sonographic finding of short long bones:a cohort study[J].Arch Gynecol Obstet,2020,301(2):459463.
[4]Saccone G,Berghella V,Maruotti G M,et al.Antiphospholipid antibody profile based obstetric outcomes of primary antiphospholipid syndrome:the PREGNANTS study[J].Am J Obstet Gynecol,2017,216(5):525.e1525.e12.
[5]Borrell A,Grande M,Meler E,et al.Genomic microarray in fetuses with early growth restriction:a multicenter study[J].Fetal Diagn Ther,2017,42(3):174180.
[6]Zhu H,Lin S,Huang L,et al.Application of chromosomal microarray analysis in prenatal diagnosis of fetal growth restriction[J].Prenat Diagn,2016,36(7):686692.
[7]Mustafa H J,Tessier K M,Reagan L A,et al.Fetal growth standards for Somali population[J].J Matern Fetal Neonatal Med,2021,34(15):24402453.
[8]陈佩文,陈欣林.国际妇产科超声协会2022年更新版《中孕期常规胎儿超声检查》临床指南解读[J].中国产前诊断杂志:电子版,2023,15(2):3446.
[9]Riggs E R,Andersen E F,Cherry A M,et al.Technical standards for the interpretation and reporting of constitutional copynumber variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics(ACMG) and the Clinical Genome Resource(ClinGen)[J].Genet Med,2020,22(2):245257.
[10]王秋菊,沈亦平,邬玲仟,等.遗传变异分类标准与指南[J].中国科学:生命科学,2017,47(6):668688.
[11]国家卫生健康委.关于发布推荐性卫生行业标准《7岁以下儿童生长标准》的通告[DB/OL].http://www.nhc.gov.cn/fzs/s7848/202211/8b94606198e8457dafb3f835 5135f1a3.shtml,20220919/20230420.
[12]Huang Y,Liu C,Ding H,et al.Exome sequencing in fetuses with short long bones detected by ultrasonography:a retrospective cohort study[J].Front Genet,2023,14:1032346.
[13]Liu J,Huang L,He Z,et al.Clinical value of genetic analysis in prenatal diagnosis of short femur[J].Mol Genet Genomic Med,2019,7(11):e978.
[14]Hu T,Tian T,Zhang Z,et al.Prenatal chromosomal microarray analysis in 2466 fetuses with ultrasonographic soft markers:a prospective cohort study[J].Am J Obstet Gynecol,2021,224(5):516.e1516.e16.
[15]WoodburySmith M,DAbate L,Stavropoulos D J,et al.The phenotypic variability of 16p11.2 distal BP2BP3 deletion in a transgenerational family and in neurodevelopmentally ascertained samples[J].J Med Genet,2023,60(12):11531160.
[16]Yue F,Hao M,Jiang D,et al.Prenatal phenotypes and pregnancy outcomes of fetuses with 16p11.2 microdeletion/microduplication[J].BMC Pregnancy Childbirth,2024,24(1):494.
[17]Li M,Liu L,Wu Y,et al.Prenatal diagnosis and molecular cytogenetic characterization of an inherited microdeletion of chromosome 16p11.2[J].J Int Med Res,2022,50(7):3000605221109400.
[18]Mortier G R,Cohn D H,CormierDaire V,et al.Nosology and classification of genetic skeletal disorders:2019 revision[J].Am J Med Genet A,2019,179(12):23932419.
[19]任远,游艳琴,周红辉,等.妊娠晚期股骨短小胎儿21例临床分析[J].中华妇产科杂志,2017,52(2):8692.
[20]Zhou X,Chandler N,Deng L,et al.Prenatal diagnosis of skeletal dysplasias using a targeted skeletal gene panel[J].Prenat Diagn,2018,38(9):692699.
[21]王影,樊阳阳,胡盈,等.妊娠期高血压疾病伴发胎儿生长受限的研究[J].中国妇幼健康研究,2020,31(1):104108.
[专业责任编辑:陈倩]
[中文编辑:郭乐倩;英文编辑:方柳]
[收稿日期]2023-11-28
[基金项目]江苏省妇幼健康项目(F201714、F201707);江苏省新药研究与临床药学重点实验室(XZSYSKF2020024);淮安市自然科学研究计划(HAB202217)
[作者简介]樊晋余(1986—),女,主治医师,主要从事生长受限相关研究。
[通讯作者]潘琼,研究员。

