EHD2、miR-let-7c 和lncRNA FOXD2-AS1 在人喉鳞状细胞癌组织中的表达及其关联性分析
[摘 要] 目的:探讨 Eps15同源结构域蛋白 2(EHD2)、微小 RNA let-7c(miR-let-7c) 和长链非编码RNA (lncRNA) FOXD2-AS1 在喉鳞状细胞癌(LSCC) 组织中的表达水平,阐明EHD2/miRlet-7c/FOXD2-AS1信号轴与LSCC发生的关联性。方法:收集40例LSCC患者的癌组织标本,按照病理类型分为低级别组(中或高分化, 32 例) 和高级别组(低分化, 8 例), 按照肿瘤淋巴结转移(TNM) 临床分期分为TNM 早期组(Ⅰ-Ⅱ期, 13 例) 和TNM 晚期组(Ⅲ-Ⅳ期, 27 例), 按照有无淋巴结转移分为转移组(21 例) 和无转移组(19 例)。另取40 例对应癌旁正常组织标本作为对照组。采用免疫组织化学法检测各组标本中EHD2 表达情况,分析其与LSCC 患者临床病理参数之间的关系,采用生物信息学方法筛选出miR-let-7c 作为候选微小RNA (miRNA),与其启动子区域存在结合位点的FOXD2-AS1 作为候选lncRNA。取10 对新鲜的LSCC 组织标本和癌旁正常组织标本,采用实时荧光定量PCR (RT-qPCR) 法检测2 组样本中EHD2 mRNA、miRNA-let-7c 和FOXD2-AS1 表达水平,并验证其关联性。结果:与癌旁正常组织比较,LSCC组织中EHD2表达水平明显降低 (Plt;0. 01),且TNM 早期组患者LSCC 组织中EHD2 阳性表达率明显高于TNM 晚期组(Plt;0. 05),病理类别和有无淋巴结转移与EHD2 表达无明显关联(Pgt;0. 05)。与癌旁正常组织比较,LSCC 组织中miR-let-7c 表达水平明显降低(Plt;0. 01),FOXD2-AS1 表达水平明显升高(Plt;0. 05)。LSCC 组织中FOXD2-AS1 与miR-let-7c 表达水平呈负相关关系(r=-0. 67,Plt;0. 05),miR-let-7c 与EHD2 mRNA表达水平呈负相关关系 (r=-0. 83,Plt;0. 01)。结论:EHD2和 miR-let-7c在 LSCC 组织中呈低表达,可能是新的抑癌基因;FOXD2-AS1 在LSCC 组织中高表达,可能是新的原癌基因;FOXD2-AS1/miR-let-7c/EHD2 信号轴可能参与了LSCC 的发生发展。
[关键词] Eps15 同源结构域蛋白2; 微小RNA let-7c; 喉鳞状细胞癌; 长链非编码核糖核酸; 原癌基因
[中图分类号] R767. 19 [文献标志码] A
喉癌的全球发病率约为2. 4/10 万[1], 是常见的头颈部恶性肿瘤之一,93%~99% 的喉癌病理类型属于喉鳞状细胞癌(laryngeal squamous cellcarcinoma, LSCC)[2], 探讨LSCC 的发生机制和发展规律十分重要。Eps15 同源结构域蛋白2(Eps15 homologous domain protein 2, EHD2) 是EHD 蛋白家族成员之一,作为近年来新发现的一种膜转运调控蛋白,具有参与和调节细胞受体内吞的功能[3]。研究[4] 显示:EHD2 可能是喉癌潜在的抑癌基因,但其分子机制尚未见报道。分析美国癌症基因组图谱(The Cancer Genome Atlas,TCGA)-头颈部鳞状细胞癌(Head and Neck Squamous CellCarcinoma,HNSCC) 数据库(http://www. cancer.gov/tcga) 发现:微小RNA let-7c (microRNA-let-7c,miR-let-7c) 与EHD2 表达呈负相关关系, 长链非编码核糖核酸(long non-coding RNA, lncRNA)FOXD2-AS1 在人LSCC 组织中明显高表达,且与miR-let-7c 启动子区域存在结合位点。目前,关于EHD2、miR-let-7c 和FOXD2-AS1 与LSCC 发生发展的关联性未见报道。本研究通过分子生物学实验探讨EHD2、miR-let-7c 和FOXD2-AS1 与LSCC 发生发展的关联性。
1 资料与方法
1. 1 一般资料 选取2018年1月-2019年12月在吉林大学第一医院耳鼻咽喉头颈外科接受手术的40 例LSCC 患者的癌组织标本,另取与其配对的癌旁正常组织标本作为对照组。所有患者均诊断明确, 肿瘤淋巴结转移(tumor node metastasis,TNM) 分期按照国际抗癌联盟和美国癌症联合委员会共同制定的第8 版头颈部肿瘤分期标准。纳入标准:①经临床病理确诊为LSCC;②术前未行化疗、放疗或靶向治疗等; ③ 无重大免疫系统疾病; ④ 同意参与本研究并签署《知情同意书》。排除标准:①既往有LSCC 或其他肿瘤病史;②既往手术史且为术后复发; ③ 伴随严重的心、肺和肾等疾病;④未达到肿瘤完整切除标准;⑤术前行中医治疗、新辅助化疗或生物靶向治疗等。纳入本研究的LSCC 患者中, 女性13 例, 男性27 例,年龄42~82 岁,平均年龄为(60. 3±8. 4) 岁,按照病理类别分为低级别组(中或高分化, 32 例)和高级别组(低分化, 8 例), 按照TNM 临床分期分为TNM 早期组(Ⅰ-Ⅱ 期, 13 例) 和晚期组(Ⅲ-Ⅳ期,27 例),按照是否淋巴结转移分为转移组(21 例) 和无转移组(19 例)。本研究方案经吉林大学第一医院医学伦理委员会批准,伦理审批号:2022416。
1. 2 主 要 试 剂 和 仪 器 即 用 型 免 疫 组 织 化 学UltraSensitiveTM 链霉素抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase, SP) 试剂盒、3, 3'- 二氨基联苯胺(3, 3'-diaminobenzidine,DAB) 显色剂和EHD2 抗体购于北京博奥森生物技术有限公司, TRIzol 试剂购于美国赛默飞世尔科技公司, All-in-OneTM 微小RNA (micro RNA,miRNA) 和实时荧光定量PCR (real-timefluorescence quantitative PCR, RT-qPCR) 试剂盒和验证引物HsnRNA U6 primer 购于广州复能基因有限公司, MonAmpTM ChemoHS qPCR Mix 试剂盒购于莫纳生物科技有限公司, 引物由吉林省库美生物科技有限公司合成。RT-qPCR 仪购于瑞士罗氏公司。
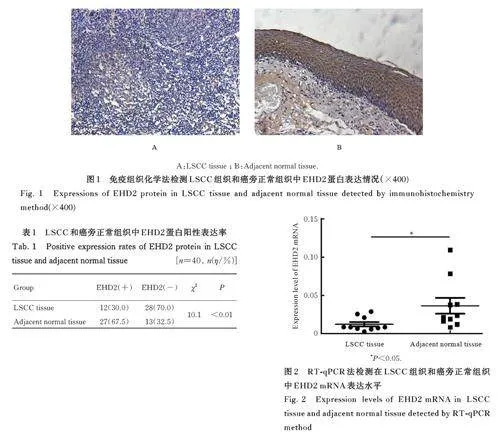
1. 3 免疫组织化学法检测 LSCC 组织中 EHD2蛋白阳性表达率 按照 SP说明书染色程序操作。将石蜡冰冻切片从-80℃冰箱中取出,置于-20 ℃冰箱过夜,次日置于4 ℃冰箱1 h。采用75% 乙醇溶液固定1 h, 磷酸盐缓冲液(phosphate bufferedsaline, PBS) 洗涤3 次, 每次5 min, 蛋白酶K(protease K, PK)(20 mg·L-1) 消化10~15 min,PBS 缓冲液洗涤后, SP 试剂盒阻断30 min, 封闭30 min,一抗37 ℃孵育1 h 或4 ℃过夜。滴加二抗,DAB 显色,苏木素复染,脱水,透明,(中性) 树胶封片,镜下观察LSCC 组织中EHD2 表达情况。由2 名病理科医生采用双盲法阅片。EHD2 蛋白在细胞膜或细胞质中呈弥漫分布的黄色或黄褐色为EHD2 蛋白阳性表达。每张组织切片随机观察10 个高倍视野(×400), 采用免疫反应评分进行半定量分析,参照朱红珍等[5] 的分级及评分标准计算EHD 蛋白阳性表达率,EHD 蛋白阳性表达率=阳性细胞数/细胞总数×100%, EHD 蛋白阳性表达率分为4 个等级, 细胞染色强度分为4 个等级。每张切片阳性表达率与染色强度得分乘积0~1 分为阴性表达,≥2 分为阳性表达。
1. 4 RT-qPCR法检测LSCC组织中EHD2 mRNA、miR-let-7c和 FOXD2-AS1 表达水平 TRIzol法提取组织标本中的总RNA。采用罗氏LC-96 RT-qPCR仪进行扩增, miRNA qPCR 按照All-in-OneTMcDNA 第一链合成试剂盒进行逆转录,采用All-in-OneTM miRNA qPCR 试剂盒进行扩增, 以U6 作为内参基因。扩增体系:qPCR Mix 10 μL,cDNA 2 μL,miRNA-let-7c 引物(上游引物: 5'- TGAGGTAGTAGGTTGTATGGTT-3', 下游引物采用试剂盒中通用引物) 各2 μL,通用适配器PCR 引物2 μL,无酶水4 μL。扩增条件为: 95 ℃ 预变性10 min,95 ℃、20 s,60 ℃ 、30 s,72 ℃、10 s,共35 个循环。FOXD2-AS1 和 EHD2 采 用 MonAmpTMChemoHS qPCR Mix 试剂盒,反应体系:qPCR Mix10 μL, 上、下游引物(10 μmol·L-1) 0. 4 μL,cDNA 模板2 μL, 无菌超净水7. 2 μL, 共20 μL。反应条件:预变性95 ℃、10 min。首次变性95 ℃、15 s, 55 ℃ 退火20 s, 72 ℃ 延伸10 s, 共40 个循环。采用2-ΔΔCT 法进行定量计算,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 为 内 参, 检 测 FOXD2-AS1 和 EHD2mRNA 表达水平。引物序列: GAPDH 上游引物GGTCGGAGTCAACGGATTTG,GAPDH 下游引物GGAAGATGGTGATG GGATTTC; FOXD2-AS1 上游引物TGGACCTAGCAGCTCCA,FOXD2-AS1 下游引物AGTTGAAGGTGCACACTG; EHD2 上游引物TTTGCGAAGATTCAGCTGGAACAT, EHD2 下游引物GGCTTCAGCGAGTGAAACTTGGT。
1. 5 统计学分析 采用 GrahPad Prism5. 0统计软件进行统计学分析和图表绘制。免疫组织化学结果为半定量资料,组间比较采用χ2 检验。LSCC 组织中EHD2 mRNA、miR-let-7c 和FOXD2-AS1 表达水平为配对计量资料,符合正态分布,组间比较采用Mann Whitney t 检验。LSCC 组织中EHD2 mRNA、miR-let-7c 和FOXD2-AS1 表达水平的相关性分析采用Spearman 相关性检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
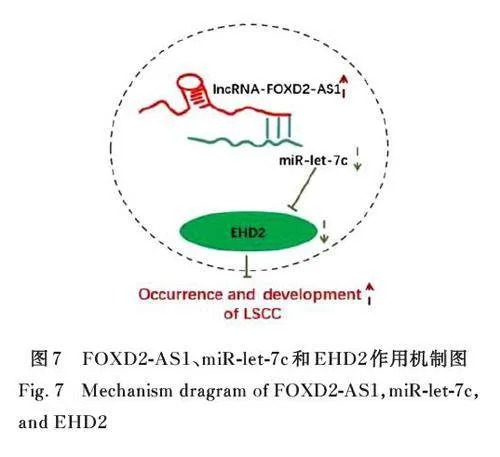
2. 1 LSCC组织中 EHD2蛋白阳性表达率、EHD2mRNA 表达水平及 EHD2蛋白阳性表达率与患者临床病理参数的关系 免疫组织化学分析结果显示: LSCC 组织中EHD2 蛋白呈低表达或不表达,在癌旁正常组织中EHD2 蛋白呈高表达, 见图1。癌旁正常组织中EHD2 蛋白阳性表达率(67. 5%,27/40) 明显高于LSCC 组织(30%, 12/40), 组间比较差异有统计学意义(χ2=10. 1, Plt;0. 01),见表1。RT-qPCR 结果显示: 癌旁正常组织中EHD2 mRNA 表达水平高于LSCC 组织(Plt;0. 05),见图2。TNM 早期组患者中EHD2 蛋白阳性表达率为54%, 明显高于TNM 晚期组(19%)(Plt;0. 05), 表明EHD2 表达与TNM 分期有明显关联,随着TNM 分期的进展,EHD2 蛋白阳性表达率降低。EHD2 蛋白阳性表达率与患者病理类别和有无淋巴结转移无明显关联(Pgt;0. 05)。见表2。
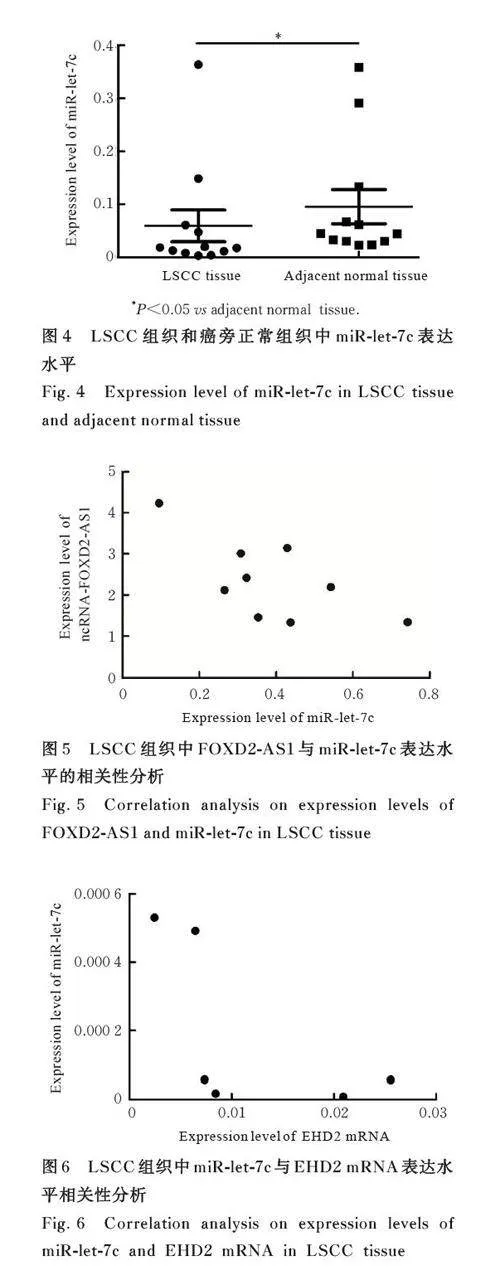
2. 2 LSCC组织中FOXD2-AS1和miR-let-7c表达水平 与癌旁正常组织比较,LSCC组织中FOXD2-AS1 表达水平明显升高(Plt;0. 05),miR-let-7c 表达水平明显降低(Plt;0. 05)。见图3 和4。
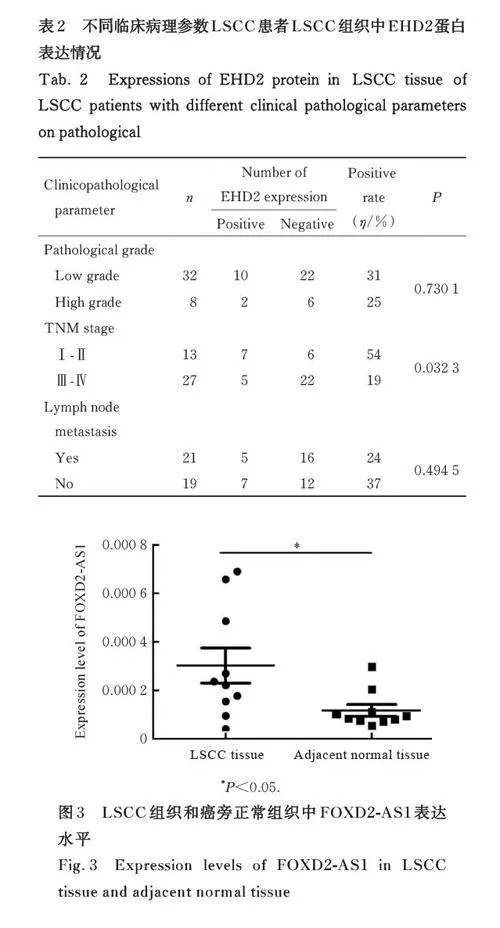
2. 3 LSCC 组 织 中 FOXD2-AS1 与 miR-let-7c、EHD2 mRNA 与 miRNA-let-7c表达水平的相关性 相关性分析显示:LSCC 组织中FOXD2-AS1 与miR-let-7c 表达水平呈负相关关系(r=-0. 67,Plt;0. 05),提示FOXD2-AS1可负向调控miR-let-7c表达,见图5。miR-let-7c与EHD2 mRNA表达水平呈负相关关系(r=-0. 83,Plt;0. 01),提示miR-let-7c可负向调控EHD2 mRNA 表达, 见图6。FOXD2-AS1、miR-let-7c 和EHD2 相互作用机制见图7。
3 讨 论
2018 年全球约有95 000 例患者死于喉癌 [6]。尽管治疗手段不断进步,LSCC 患者的5 年生存率并未提高[7]。手术是LSCC 的主要的治疗手段[8],但患者术后存在言语功能和吞咽功能丧失的风险。此外,LSCC 细胞对大部分化疗药物并不敏感,因此,深入探讨影响LSCC 发生发展的驱动基因及潜在分子机制和寻找治疗靶点非常重要。
本研究结果显示:LSCC 组织中EHD2 阳性表达率明显降低, 与既往报道[5] 的食管鳞癌组织中EHD2 阳性表达率明显降低一致,提示EHD2 可能是LSCC 潜在的抑癌基因。本研究结果显示:EHD2 在LSCC 组织中呈低表达,在癌旁正常组织中呈高表达;EHD2 表达与TNM 分期存在明显关联,随着分期进展,EHD2 阳性表达率降低,与鲁科利等[4] 的研究结果一致。吕丽婷等[9] 发现:EHD2 表达水平可能与非小细胞肺癌的恶性程度有关,EHD2 高表达的非小细胞肺癌患者预后较好。鲁科利等[4] 认为:EHD2 阳性表达率与喉癌患者的病理类别和淋巴结转移情况有密切关联,但本研究结果表明EHD2 蛋白阳性表达率与淋巴结转移及病理类别无明显关联,因此需要进一步扩大样本量明确EHD2 表达水平与LSCC 临床病理参数之间的关系。EHD2 还在多种肿瘤进展中起作用,如结肠腺癌[10]、甲状腺乳头状癌[11] 和肝癌[12] 等, 提示EHD2 可能可以作为评价包括LSCC 在内的多种肿瘤预后的客观指标之一。
miRNA 是一类长度为18~25 个核苷酸的单链RNA[13],可与特定mRNA 结合或者调节特定mRNA 的翻译过程来调控基因表达。王苹等[14] 证实:多个miRNA 在喉癌组织中呈差异表达,推测部分miRNA 可能参与喉癌发生。本研究结果显示:癌旁正常组织中miR-let-7c 表达水平明显高于LSCC 组织, 其可能发挥抑癌作用。WU 等[15] 发现: circCORO1C 通过竞争性结合miR-let-7c, 降低前B 细胞白血病转录因子3 表达水平, 促进LSCC 发生。研究[16-17] 显示: miR-let-7c 在多种癌组织中表达水平降低, 可能发挥抑癌作用, 如miR-let-7c 靶向高迁移率蛋白抑制膀胱癌细胞侵袭和迁移,靶向胸苷激酶1 影响肝癌细胞增殖、迁移和侵袭等,miR-let-7c 有望作为肿瘤生物标志物。
lncRNA 分布于细胞核和细胞质,在转录、转录后和表观异常等多个水平调控基因表达。FOXD2-AS1 是一类常见的lncRNA, 位于染色体1p33 上,含2 527 个核苷酸,与癌症的发生和恶化关系密切[7]。本研究结果显示: LSCC 组织中FOXD2-AS1 表达水平明显高于癌旁正常组织,与陈伟等[18] 的研究结果一致。LI 等[19] 发现:FOXD2-AS1 主要位于LSCC 细胞核中,可以作为蛋白支架提高信号转导因子和转录激活因子3 的转录活性, 调控喉癌干细胞特性和促进喉癌化疗耐药。研究[20-23] 显示:FOXD2-AS1 在直肠癌、甲状腺癌、胶质瘤和食管癌中呈异常高表达,是一种促癌基因, 影响癌症进展。FOXD2-AS1 在包括LSCC 在内的多种恶性肿瘤中可能是原癌基因,有望成为新型的肿瘤标志物和治疗靶点。
本研究结果显示: EHD2 和miR-let-7c 在LSCC 组织中存在明显负相关关系,尽管miR-let-7c在LSCC 组织中与癌旁正常组织中的表达趋势与EHD2 相同, 但仍可能通过负向调控EHD2 抑制LSCC的发生发展;另外,FOXD2-AS1与miR-let-7c呈明显负相关关系。研 究[24] 显 示: miRNA 是lncRNA 发挥作用的重要环节。lncRNA 竞争性结合目标miRNA, 从而降低其对下游基因的转录抑制[25]。本文作者推测FOXD2-AS1 可能竞争性结合miR-let-7c,从而对LSCC 的发生发展产生影响。
综上所述,EHD2、miR-let-7c 和FOXD2-AS1在LSCC 组织和癌旁正常组织中的表达存在差异性, 且FOXD2-AS1 表达与miR-let-7c 表达呈负相关关系, EHD2 表达与miR-let-7c 表达呈负相关关系,提示EHD2/miR-let-7c/FOXD2-AS1 信号轴可能参与调控LSCC 的发生,本课题组将在后续实验中进一步深入研究其具体调控机制。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:宫美恒参与实验设计、实验操作、数据整理和论文撰写,陈沫参与实验操作和病理制片,韩慧参与实验设计和病理阅片,于婷婷参与实验设计、数据分析和论文审校。
[参考文献]
[1] HARRIS A T, TANYI A, HART R D, et al.
Transoral laser surgery for laryngeal carcinoma: has
Steiner achieved a genuine paradigm shift in oncological
surgery?[J]. Ann R Coll Surg Engl, 2018, 100(1): 2-5.
[2] 吴东宁. 喉鳞状细胞癌的遗传学研究概况[J]. 国际遗传
学杂志, 1998, 3:134-138.
[3] LI Z P, SCHULZE R J, WELLER S G, et al. A novel
Rab10-EHBP1-EHD2 complex essential for the
autophagic engulfment of lipid droplets[J]. Sci Adv,
2016, 2(12): e1601470.
[4] 鲁科利, 江青山, 刘志锋, 等. EHD2在喉鳞状细胞癌组
织中的表达及其临床意义[J]. 中南医学科学杂志,
2018, 46(6): 653-656.
[5] 朱红珍, 施公胜, 茅国新, 等. EHD2 蛋白在食管鳞状
细胞癌组织中的表达及意义[J]. 现代肿瘤医学, 2015,
23(7): 950-953.
[6] BRAY F, FERLAY J, SOERJOMATARAM I, et al.
Global cancer statistics 2018: GLOBOCAN estimates of
incidence and mortality worldwide for 36 cancers in 185
countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[7] SIEGEL R L, MILLER K D, JEMAL A. Cancer
statistics, 2016. CA Cancer J clin. 2016;66: 7-30.
[8] ANG K K, ZHANG Q, ROSENTHAL D I, et al.
Randomized phase Ⅲ trial of concurrent accelerated
radiation plus cisplatin with or without cetuximab
for stage Ⅲ to Ⅳ head and neck carcinoma: RTOG
0522[J]. J Clin Oncol, 2014, 32(27): 2940-2950.
[9] 吕丽婷, 刘益飞, 刘 军, 等. EHD2 在非小细胞肺癌
中的表达及其临床意义[J]. 实用医学杂志, 2017,
33(22): 3769-3772.
[10]管程齐. EHD2对结肠癌增殖、迁移和侵袭生物学行为
的影响及机制的初步研究[D]. 苏州:苏州大学, 2021.
[11]KIM Y, KIM M H, JEON S, et al. Prognostic
implication of histological features associated with EHD2
expression in papillary thyroid carcinoma [J]. PLoS
One, 2017, 12(3): e0174737.
[12]LIU J X, NI W K, QU L S, et al. Decreased expression
of EHD2 promotes tumor metastasis and indicates poor
prognosis in hepatocellular carcinoma[J]. Dig Dis Sci,
2016, 61(9): 2554-2567.
[13]WANG Y, ZHOU S Y, FAN K F, et al. MicroRNA-21
and its impact on signaling pathways in cervical
cancer[J]. Oncol Lett, 2019, 17(3): 3066-3070.
[14]王 苹, 付 涛, 王绪锐, 等. 应用微阵列芯片分析
喉鳞状细胞癌miRNA 与正常黏膜表达差异的初步
研究[J]. 临床耳鼻咽喉头颈外科杂志, 2010, 24(12):
535-538.
[15]WU Y Y, ZHANG Y L, ZHENG X W, et al. Circular
RNA circCORO1C promotes laryngeal squamous cell
carcinoma progression by modulating the let-7c-5p/
PBX3 axis[J]. Mol Cancer, 2020, 19(1): 99.
[16]姚 越. MiR-let-7c-5p靶向HMGA2抑制膀胱癌细胞侵
袭和迁移[D]. 蚌埠: 蚌埠医学院, 2022.
[17]雷林翰. MicroRNA has-let-7c-5p 靶向TK1 影响肝癌
细胞的增殖、迁移和侵袭[D]. 贵阳: 贵州医科大学,
2022.
[18]陈 伟, 孙苏光, 江梦贤, 等. FOXD2-AS1与喉鳞状
细胞癌临床病理参数的关系及其对喉癌细胞增殖的
作用[J]. 临床耳鼻咽喉头颈外科杂志, 2019, 33(5):
436-440.
[19]LI R, CHEN S W, ZHAN J D, et al. Long noncoding
RNA FOXD2-AS1 enhances chemotherapeutic resistance
of laryngeal squamous cell carcinoma via STAT3
activation[J]. Cell Death Dis, 2020, 11(1): 41.
[20]CANTELLI G, CROSAS-MOLIST E,
GEORGOULI M, et al. TGFΒ -induced transcription in
cancer[J]. Semin Cancer Biol, 2017, 42: 60-69.
[21]HUANG T, HUANG W, LU H, et al. Identification
and validation a TGF- β -associated long non-coding
RNA of head and neck squamous cell carcinoma by
bioinformatics method[J]. J Transl Med, 2018, 16(1): 46.
[22]LIU M, GAO X, LIU C L. Increased expression of
lncRNA FTH1P3 promotes oral squamous cell
carcinoma cells migration and invasion by enhancing
PI3K/Akt/GSK3b/Wnt/β-catenin signaling[J]. Eur Rev
Med Pharmacol Sci, 2018, 22(23): 8306-8314.
[23]SUN S G, GONG C, YUAN K. LncRNA UCA1
promotes cell proliferation, invasion and migration of
laryngeal squamous cell carcinoma cells by activating
Wnt/β -catenin signaling pathway[J]. Exp Ther Med,
2019, 17(2): 1182-1189.
[24]LAI X J, CHENG H F. LncRNA colon cancerassociated
transcript 1 (CCAT1) promotes proliferation
and metastasis of ovarian cancer via miR-1290[J]. Eur
Rev Med Pharmacol Sci, 2018, 22(2): 322-328.
[25]HUANG G Z, WU Q Q, ZHENG Z N, et al.
Identification of candidate biomarkers and analysis of
prognostic values in oral squamous cell carcinoma[J].
Front Oncol, 2019, 9: 1054.

