沉默CDC20 基因通过抑制Wnt/β-连环蛋白信号通路对子宫内膜癌细胞增殖和细胞周期的影响


[摘 要] 目的:探讨细胞分裂周期蛋白20(CDC20) 对子宫内膜癌 (EC) 细胞增殖和细胞周期的影响,并阐明其作用机制。方法:实时荧光定量PCR (RT-qPCR) 和Western blotting法检测人子宫内膜基质T-HESC 细胞和人EC 细胞(KLE、RL95-2、ZJB-ENC1 和ECC-1 细胞) 中CDC20 mRNA及蛋白表达水平,选择RL95-2 细胞用于后续实验。将CDC20 shRNA 干扰慢病毒转染至RL95-2 细胞中, 分为对照组、sh-NC 组(感染阴性对照慢病毒)、sh-CDC20 组(感染CDC20 shRNA 干扰慢病毒)、sh-NC+SM04690 组(感染阴性对照慢病毒后,加入64 nmol·L-1 Wnt/β-连环蛋白信号通路抑制剂SM04690 干预48 h) 和sh-CDC20+SM04690 组(感染CDC20 shRNA 干扰慢病毒后, 加入64 nmol·L-1 SM04690 干预48 h)。RT-qPCR 法和Western blotting 法检测不同细胞中CDC20 mRNA 和蛋白表达水平,CCK-8 法检测各组细胞增殖活性,BrdU 法检测各组细胞中BrdU 阳性细胞百分率,流式细胞术检测各组G2/M 期细胞百分率, Western blotting 法检测各组细胞中β-连环蛋白、c-Myc 和细胞周期素D1蛋白表达水平。结果:与T-HESC细胞比较,KLE、RL95-2、ZJB-ENC1和ECC-1细胞中CDC20 mRNA 和蛋白表达水平均明显升高(Plt;0. 05),其中RL95-2 细胞中CDC20 mRNA 和蛋白表达水平最高。与sh-NC 组比较,sh-CDC20 组和sh-NC+SM04690 组细胞增殖活性和BrdU 阳性细胞百分率明显降低(Plt;0. 05),G2/M 期细胞百分率明显升高(Plt;0. 05),细胞中β-连环蛋白、c-Myc和细胞周期素D1 蛋白表达水平明显降低(Plt;0. 05)。与sh-CDC20 组比较,sh-CDC20+SM04690 组细胞增殖活性和BrdU 阳性细胞百分率明显降低(Plt;0. 05),G2/M 期细胞百分率明显升高(Plt;0. 05),细胞中 β-连环蛋白、c-Myc和细胞周期素 D1蛋白表达水平明显降低 (Plt;0. 05)。结论:EC细胞中CDC20 呈高表达,沉默CDC20 可能通过调控Wnt/β-连环蛋白信号转导诱导RL95-2 细胞G2/M 期阻滞,抑制细胞增殖。
[关键词] 子宫内膜癌; 细胞分裂周期蛋白20; 细胞周期; 细胞增殖; Wnt/β-连环蛋白信号通路
[中图分类号] R737. 33 [文献标志码] A
子宫内膜癌(endometrial cancer,EC) 是全球范围内最常见的妇科癌症之一,其发病率逐年呈上升趋势[1]。早期EC 的治疗以手术切除为主,对于有妊娠意愿的育龄患者,如果是不典型增生或子宫内膜腺癌,通常更倾向于保守治疗[2]。目前,针对EC 的保守治疗方法有化疗、放疗、激素治疗和靶向治疗等[3-4],但上述方法并不能很好地满足年轻EC 患者的需求。因此,探讨提高生存率并保留生育能力的治疗方案对于年轻EC 患者具有重大意义。细胞分裂周期蛋白20 (cell division cycle protein 20,CDC20) 是细胞周期蛋白家族的一员, 在有丝分裂的早期阶段激活后期促进复合物,形成E3 泛素连接酶复合物,破坏细胞周期的关键调控因子,促进有丝分裂[5]。CDC20 作为一种癌蛋白, 在多种恶性肿瘤中均呈异常高表达,且与肿瘤的不良预后相关,是新兴的癌症治疗靶点[5-6]。研究[7-8] 显示:CDC20 可通过调控Wnt/β-连环蛋白信号转导影响细胞增殖和周期。研究[9] 显示: CDC20 在EC 组织中呈高表达,与EC 患者预后不良有关联,可作为EC 诊断和预后的标志物。CDC20 在EC 中的具体作用及其机制尚未完全阐明。本研究探讨沉默CDC20 基因对EC 细胞增殖和周期的影响及其作用机制,为EC 靶向治疗方案的研究提供新思路。
1 材料与方法
1. 1 细胞、主要试剂与仪器 人子宫内膜基质T-HESC细胞(美国ATCC 公司),人EC 细胞KLE 和ECC-1细胞(中国医学科学院基础医学研究所细胞资源中心), 人EC 细胞RL95-2 和ZJB-ENC1 细胞(中国典型培养物保藏中心细胞库)。RPMI-1640 培养基、杜氏改良Eagle 培养基/F12 营养混合液(Dulbecco’s modified Eagle medium/nutrient mixtureF12, DMEM/F12) 和胎牛血清(美国Gibco 公司),Wnt/β - 连环蛋白信号通路抑制剂SM04690(美国MCE公司),逆转录试剂盒和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(日本TaKaRa 公司),CDC20 shRNA 干扰慢病毒和阴性对照慢病毒(上海吉玛基因公司),细胞计数试剂盒-8 (cell counting kit-8, CCK-8)、二喹啉甲酸(2-quinolinecarboxylic acid, BCA) 蛋白浓度测定试剂盒和超敏增强化学发光(enhancedchemiluminescence,ECL) 试剂盒(上海碧云天生物技术有限公司),BrdU 检测试剂(北京索莱宝科技有限公司),细胞周期检测试剂盒(沈阳万类生物科技有限公司),CDC20 抗体、β-连环蛋白抗体、c-Myc 抗体、细胞周期素D1 抗体和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 抗体(英国Abcam 公司)。倒置显微镜(日本奥林巴斯公司), 流式细胞仪(美国BD 公司),RT-qPCR 仪(美国应用生物系统公司),酶标仪(美国Bio-TEK 公司)。
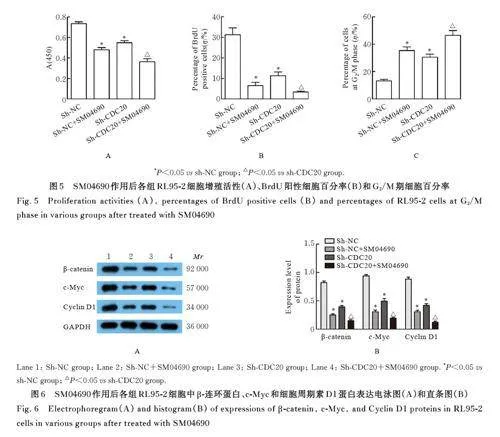
1. 2 细胞培养、慢病毒感染和实验分组 采用含10% 胎牛血清的RPMI-1640 培养基培养RL95-2、ZJB-ENC1 和ECC-1 细胞, 采用含10% 胎牛血清的DEME/F12 培养基培养T-HESC 和KLE 细胞,待细胞贴壁后继续培养1~2 d,采用胰酶消化后进行传代培养。收集对数生长期的RL95-2 细胞,调整细胞密度并接种于24 孔细胞培养板中, 每孔约5×104个细胞。待细胞生长至约90% 融合度时,将原细胞培养基更换为含5 mg·L-1 凝聚胺的新鲜培养基, 按照感染复数为50 加入阴性对照慢病毒或CDC20 shRNA 干扰慢病毒。病毒感染48 h 后,收集细胞,采用RT-qPCR 法和Western blotting 法检测各种细胞中CDC20 mRNA 和蛋白质表达水平。将RL95-2 细胞分为对照组、sh-NC 组(感染阴性对照慢病毒)、sh-CDC20 组(感染CDC20 shRNA干扰慢病毒)、sh-NC+SM04690 组(感染阴性对照慢病毒后,加入64 nmol·L-1 Wnt/β-连环蛋白信号通路抑制剂SM04690 干预48 h[10] ) 和sh-CDC20+SM04690 组(感染CDC20 shRNA 干扰慢病毒后,加入64 nmol·L-1 SM04690 干预48 h)。
1. 3 RT-qPCR 法检测 EC 细胞中 CDC20 mRNA表达水平 收集细胞,加入 TRIzol试剂提取细胞中总RNA, 按照逆转录试剂盒说明书步骤合成cDNA, 采用RT-qPCR 试剂盒进行扩增反应。反应条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s (共40 个循环)。引物序列: CDC20 上游引物5'-GACCACTCCTAGCAAACCTGG-3', CDC20 下游引物5'-GGGCGTCTGGCTGTTTTCA-3'; GAPDH 上游引物: 5'-TGACTTCAACAGCGACACCCA-3', GAPDH 下游引物5'-CACCCTGTTGCTGTAGCCAAA-3'。以GAPDH 为内参基因, 采用2-ΔΔCt 法计算目的基因表达水平。
1. 4 CCK-8 法检测各组 RL95-2 细胞增殖活性 取对数生长期转染后的RL95-2 细胞,接种于96 孔细胞培养板中,每孔约3×103个细胞,每组设置3 复孔, 细胞贴壁后分别培养24、48 和72 h。每孔加入10 μL CCK-8 溶液,继续培养2 h。酶标仪上机检测450 nm 波长处吸光度(A) 值,以A (450) 值表示细胞增殖活性。
1. 5 BrdU 法检测各组 RL95-2 细胞中 BrdU 阳性细胞百分率 取对数生长期转染后的RL95-2细胞,接种于内置无菌盖玻片的24 孔细胞培养板中, 每孔约2×105 个细胞, 每组设置3 复孔, 分组处理。每孔加入BrdU 铺满细胞培养板孔面,继续培养24 h。加 入 4% 多 聚 甲 醛 固 定 30 min, 加 入 0. 2%Triton X-100通透细胞10 min,加入3%BSA室温封闭1 h。加入BrdU 一抗(1∶200),4 ℃孵育过夜,洗涤后,加入二抗室温避光孵育1 h。加入1 g·L-1 4',6-二脒基-2-苯基吲哚染液,室温避光孵育10 min。中性树脂封片, 荧光显微镜下观察细胞染色情况,计算BrdU 阳性细胞百分率, 以BrdU 标记的阳性细胞占总细胞数百分率表示细胞中BrdU 阳性细胞百分率。
1. 6 流式细胞术检测各组 G2/M 期 RL95-2 细胞百分率 取对数生长期转染后的 RL95-2细胞,接种于6 孔细胞培养板中, 每孔约2×106 个细胞,每组设置3复孔,分组处理。800 r·min-1离心5 min,收集细胞沉淀,加入预冷75% 乙醇,4 ℃固定过夜。加入100 μL 核糖核酸酶 A 试剂,37 ℃孵育30 min。加入500 μL 碘化丙啶溶液,室温避光孵育30 min。流式细胞术检测各组G2/M 期RL95-2 细胞百分率。
1. 7 Western blotting 法 检 测 各 组 EC 细 胞 中CDC20、β-连环蛋白、c-Myc和细胞周期素 D1蛋白表达水平 收集细胞,加入放射免疫沉淀法裂解缓冲液裂解细胞, 提取总蛋白。BCA 法蛋白定量,十二烷基硫酸钠-聚丙烯酰胺凝聚电泳分离,湿转法将蛋白转移至聚偏二氟乙烯膜上,5% 脱脂奶粉室温封闭2 h。分别加入CDC20 (1∶2 000)、β-连环蛋白(1∶5 000)、c-Myc (1∶1 000)、细胞周期素D1 (1∶200) 和GAPDH (1∶2 500) 抗体,室温孵育2 h。加入二抗,室温孵育1 h。加入超敏ECL化学发光试剂,曝光。采用Bio-Rad 成像系统计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1. 8 统计学分析 采用 SPSS 22. 0统计软件进行统计学分析。各组细胞中CDC20 mRNA 表达水平,细胞增殖活性,细胞中BrdU 阳性细胞百分率,不同细胞周期细胞百分率,细胞中CDC20、β-连环蛋白、c-Myc 和细胞周期素D1 蛋白表达水平均符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 各种细胞中 CDC20 mRNA 和蛋白表达水平 与T-HESC细胞比较,KLE、RL95-2、ZJB-ENC1和ECC-1 细胞中CDC20 mRNA 和蛋白表达水平均明显升高(Plt;0. 05), 见图1 。RL95-2 细胞中CDC20 mRNA 和蛋白表达水平较其他EC 细胞更高,故选择RL95-2 细胞作为后续实验研究对象。
2. 2 各组 RL95-2细胞中 CDC20 mRNA和蛋白表达水平 与对照组比较,sh-NC 组细胞中 CDC20mRNA 和蛋白表达水平差异无统计学意义(Pgt;0. 05),sh-CDC20 组细胞中CDC20 mRNA 和蛋白表达水平明显降低(Plt;0. 05),表明CDC20 沉默表达的RL95-2 细胞构建成功。见图2。
2. 3 各组 RL95-2 细胞增殖活性、BrdU 阳性细胞百分率和 G2/M 期细胞百分率 与对照组比较,sh-NC 组RL95-2 细胞增殖活性、BrdU 阳性细胞百分率及G2/M 期细胞百分率无明显差异(Pgt;0. 05); 与sh-NC 组比较, sh-CDC20 组RL95-2 细胞增殖活性和BrdU 阳性细胞百分率明显降低(Plt;0. 05),G2/M 期细胞百分率明显升高(Plt;0. 05)。见图3。
2. 4 各组RL95-2细胞中β-连环蛋白、c-Myc和细胞周期素D1蛋白表达水平 与对照组比较,sh-NC组RL95-2 细胞中β-连环蛋白、c-Myc 和细胞周期素D1 蛋白表达水平差异无统计学意义(Pgt;0. 05)。与sh-NC 组比较,sh-CDC20 组细胞中β-连环蛋白、c-Myc 和细胞周期素D1 蛋白表达水平明显降低(Plt;0. 05)。见图4。
2. 5 SM04690作用后各组 RL95-2细胞增殖活性、BrdU 阳性细胞百分率和 G2/M 期细胞百分率 与sh-NC 组比较,sh-CDC20 组及sh-NC+SM04690 组细胞增殖活性和BrdU 阳性细胞百分率明显降低(Plt;0. 05), G2/M 期细胞百分率明显升高(Plt;0. 05), 细胞中β-连环蛋白、c-Myc 和细胞周期素D1 蛋 白 表 达 水 平 明 显 降 低(Plt;0. 05)。 与sh-CDC20 组比较, sh-CDC20+SM04690 组细胞增殖活性和BrdU 阳性细胞百分率明显降低(Plt;0. 05),G2/M 期细胞百分率明显升高(Plt;0. 05),细胞中β-连环蛋白、c-Myc 和细胞周期素D1 蛋白表达水平明显降低(Plt;0. 05)。见图5 和6。
3 讨 论
细胞周期失调是细胞异常增殖导致肿瘤进展的主要原因之一,无节制的增殖是恶性肿瘤的共同特征,以细胞周期为靶点是防止细胞无限分裂的治疗策略之一[11]。细胞周期蛋白CDC20 在多种女性生殖系统肿瘤,如EC、宫颈癌、卵巢癌和乳腺癌等组织中高表达,导致细胞周期失调,并与患者不良预后相关,是潜在肿瘤治疗靶点[12-13]。本研究结果显示: CDC20 基因在KLE、RL95-2、ZJB-ENC1和ECC-1 细胞中均呈高表达;干扰RL95-2 细胞中CDC20 表达后,细胞增殖活性降低,G2/M 期细胞百分率升高,提示沉默CDC20 可抑制RL95-2 细胞增殖,并诱导G2/M 期细胞周期阻滞。
Wnt/β-连环蛋白信号通路是一种极其保守的通路,参与女性生殖系统细胞增殖、存活、细胞周期和黏附等各种细胞过程, 异常Wnt/β-连环蛋白信号转导可调节子宫内膜增生, 可能导致EC[14]。研究[15-17] 显示: Wnt/β-连环蛋白信号通路在调控癌细胞增殖和细胞周期方面发挥重要作用。抑制Wnt/β-连环蛋白信号转导可导致细胞发生G2/M 期阻滞[18]。β-连环蛋白是Wnt/β-连环蛋白信号通路中的重要组成部分,当通路被激活后,酪蛋白酶和糖原合成激酶失活,β-连环蛋白无法被降解,使其活化并大量聚集于细胞质中, 从而激活下游靶基因, 包括c-Myc 和细胞周期素D1 等, 进而影响细胞增殖和细胞周期[16,19]。促进细胞周期进程加快是致癌基因c-Myc 的主要致癌机制,c-Myc 不仅可以通过激活或诱导细胞周期蛋白和细胞周期蛋白依赖性激酶诱导细胞周期阻滞,还可以通过下调细胞周期“制动器”的相关蛋白活性来诱导细胞周期阻滞[20]。细胞周期素D1 是调控细胞周期的关键因子,当细胞周期素D1 过表达时,细胞周期进程加速,细胞增殖调节机制失控,最终导致肿瘤的发生发展[21-22]。当β-连环蛋白表达受到干扰后,其下游靶基因c-Myc 和细胞周期素D1 表达均下调[16]。研究[23] 显示: 沉默CDC20 基因可抑制Wnt/β-连环蛋白信号转导,进而导致癌细胞增殖活性降低,化疗敏感性增强。下调CDC20 通过调控Wnt/β-连环蛋白信号转导诱导细胞周期阻滞[7]。本研究结果显示:沉默CDC20 基因后,RL95-2 细胞中β-连环蛋白、c-Myc 和细胞周期D1 蛋白表达水平均明显降低, 而Wnt/β-连环蛋白信号通路抑制剂SM04690可促进CDC20 下调对RL95-2 细胞增殖的抑制作用, 加剧G2/M 期细胞周期阻滞情况, 提示沉默CDC20 基因可能对RL95-2 细胞中Wnt/β-连环蛋白信号转导具有调控作用。
综上所述, CDC20 在EC 细胞系中呈高表达,沉默CDC20 基因可诱导RL95-2 细胞G2/M 期阻滞,抑制细胞增殖,其作用机制可能与抑制Wnt/β-连环蛋白信号转导有关。鉴于沉默CDC20 基因所发挥的抗EC 作用,CDC20 基因可能成为治疗EC 的新靶点。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:刘春静负责实验方案设计和论文撰写,王娜负责实验方案设计和论文修改,杨钰杰和赵薇负责实验过程,刘丽晶负责实验数据统计学分析。
[参考文献]
[1] CROSBIE E J, KITSON S J, MCALPINE J N, et al.
Endometrial cancer[J]. Lancet, 2022, 399(10333):
1412-1428.
[2] EID M, GONTHIER C, BUCAU M, et al.
Conservative treatments for endometrial cancer[J].
Rev Prat, 2022, 72(7): 747-749.
[3] GARG V, JAYARAJ A, KUMAR L. Novel
approaches for treatment of endometrial carcinoma[J].
Curr Probl Cancer, 2022, 46(5):100895.
[4] MARKOWSKA A, CHUDECKA-GŁAZ A,
PITYŃSKI K, et al. Endometrial cancer management in
young women[J]. Cancers( Basel), 2022, 14(8): 1922.
[5] HE W N, MENG J. CDC20: a novel therapeutic target
in cancer[J]. Am J Transl Res, 2023, 15(2): 678-693.
[6] JEONG S M, BUI Q T, KWAK M, et al. Targeting
Cdc20 for cancer therapy[J]. Biochim Biophys Acta Rev
Cancer, 2022, 1877(6):188824.
[7] CHU Z W, ZHANG X Y, LI Q Y, et al. CDC20
contributes to the development of human cutaneous
squamous cell carcinoma through the Wnt/β -catenin
signaling pathway[J]. Int J Oncol, 2019, 54(5):1534-
1544.
[8] HADJIHANNAS M V, BERNKOPF D B,
BRÜCKNER M, et al. Cell cycle control of Wnt/β-catenin
signalling by conductin/axin2 through CDC20 [J].
EMBO Rep, 2012, 13(4):347-354.
[9] ZHANG Q L, WANG Y M, XUE F X. ASPM,
CDC20, DLGAP5, BUB1B, CDCA8, and NCAPG
may serve as diagnostic and prognostic biomarkers in
endometrial carcinoma[J]. Genet Res (Camb), 2022,
2022: 3217248.
[10]MORONEY M R, WOODRUFF E, QAMAR L, et al.
Inhibiting wnt/beta-catenin in CTNNB1-mutated
endometrial cancer[J]. Mol Carcinog, 2021, 60(8):
511-523.
[11]ANDO K, NAKAGAWARA A. Acceleration or
brakes: which is rational for cell cycle-targeting
neuroblastoma therapy?[J]. Biomolecules, 2021,
11(5): 750.
[12]NI K, HONG L. Current progress and perspectives of
CDC20 in female reproductive cancers[J]. Curr Mol
Med, 2023, 23(3):193-188.
[13]BHUNIYA R, YUAN X R, BAI L C, et al. Design,
synthesis, and biological evaluation of apcin-based
CDC20 inhibitors[J]. ACS Med Chem Lett, 2022,
13(2):188-195.
[14]FATIMA I, BARMAN S, RAI R, et al. Targeting
wnt signaling in endometrial cancer[J]. Cancers, 2021,
13(10): 2351.
[15]XIONG J, XING S G, DONG Z, et al. STK31
regulates the proliferation and cell cycle of lung cancer
cells via the Wnt/β -catenin pathway and feedback
regulation by c-myc[J]. Oncol Rep, 2020, 43(2):
395-404.
[16]ZHAO Z Q, WU X J, CHENG Y H, et al. TROAP
regulates cell cycle and promotes tumor progression
through Wnt/ β -catenin signaling pathway in glioma
cells[J]. CNS Neurosci Ther, 2021, 27(9): 1064-1076.
[17]YE R Y, KUANG X Y, SHAO N, et al.
Downregulation of NPTX1 induces cell cycle
progression through Wnt/β -catenin signaling in breast
cancer[J]. J Biol Regul Homeost Agents, 2021, 35(3):
1177-1183.
[18]KAPOOR S, PADWAD Y. Phloretin induces G2/M
arrest and apoptosis by suppressing the β-catenin
signaling pathway in colorectal carcinoma cells [J].
Apoptosis, 2023, 28(5/6):810-829.
[19]李大众, 黄敏敏, 刘慧玲. 富含半胱氨酸蛋白61对子宫
内膜癌细胞增殖及细胞周期的影响及其机制研究[J].
中国现代医学杂志, 2022, 32(21):13-17.
[20]GARCÍA-GUTIÉRREZ L, DELGADO M D, LEÓN J.
MYC oncogene contributions to release of cell cycle
brakes[J]. Genes, 2019, 10(3):244.
[21]黄莹莹, 陈 誉, 费召东, 等. 细胞周期蛋白D1的研究
现状及展望[J]. 中华转移性肿瘤杂志, 2021, 4(1):
70-75.
[22]陆 芳, 周健红, 陈宇航, 等. 绝经后期子宫内膜增
厚与子宫内膜癌的风险因素分析及列线图预测模型
构建[J]. 同济大学学报(医学版), 2023, 44(1): 24-31.
[23]LI K, MAO Y H, LU L, et al. Silencing of CDC20
suppresses metastatic castration-resistant prostate cancer
growth and enhances chemosensitivity to docetaxel[J].
Int J Oncol, 2016, 49(4):1679-1685.

