水泡性口炎病毒对体外血管内皮屏障功能的损伤作用及其机制






[摘 要] 目的:探讨水泡性口炎病毒 (VSV) 对血管内皮 (VE) 屏障的损伤作用,并阐明其作用机制。方法:采用犬肾细胞对VSV进行扩增,采用小鼠脑血管内皮瘤bEnd. 3细胞检测VSV的半数组织培养感染剂量(TCID50),采用300 倍TCID50 进行后续实验。将bEnd. 3 细胞分为感染0 h 组、感染4 h 组、感染8 h 组和感染12 h 组,进行VSV 感染损伤VE 屏障实验;将bEnd. 3 细胞分为对照组、感染组和纠正组,进行抑制VSV 复制与VE 屏障恢复实验。将bEnd. 3 细胞接种于Transwell 小室,构建体外VE 屏障模型, 采用细胞电压电阻仪检测感染VSV 不同时间后各组bEnd. 3 细胞中跨上皮电阻(TER),采用异硫氰酸荧光素-葡聚糖渗漏实验检测各组渗透系数,采用免疫荧光染色法观察VSV 感染后各组bEnd. 3 细胞骨架及黏附连接(AJs) 中VE-钙黏蛋白、β-连环蛋白(β-catenin) 和磷酸化β-连环蛋白(p-β-catenin) 定位变化,采用实时荧光定量PCR (RT-qPCR) 法检测各组细胞中Wnt 和β-catenin mRNA 表达水平,采用Western blotting 法检测各组细胞中Wnt、β-catenin 和p-β-catenin 表达水平。结果:VSV的TCID50为10-4. 5·100 μL-1。Transwell小室实验检测,与感染0 h比较,其他各组细胞中TER 明显降低(Plt;0. 05),渗透系数明显升高(Plt;0. 05)。免疫荧光染色,与对照组比较,感染组bEnd. 3 细胞骨架紊乱,细胞间隙增大,AJs 线性指数明显降低(Plt;0. 05),β-catenin 和p-β-catenin从细胞膜转移至细胞核周围。RT-qPCR 法检测,与感染0 h 比较,其他各组细胞中Wnt mRNA 表达水平明显降低(Plt;0. 05), β-catenin mRNA 表达水平差异无统计学意义(Pgt;0. 05)。Western blotting法检测,与感染0 h 比较,其他各组细胞中Wnt 蛋白表达水平明显降低(Plt;0. 05),β-catenin 表达水平差异无统计学意义(Pgt;0. 05),p-β-catenin 表达水平明显升高(Plt;0. 05)。在抑制VSV 复制并纠正低密度脂蛋白受体(LDLR) 异常后,Transwell 小室实验检测,与感染组比较,纠正组 bEnd. 3 细胞中TER 明显升高(Plt;0. 05),渗透系数明显降低(Plt;0. 05)。免疫荧光染色,与感染组比较,纠正组细胞间隙减小,细胞中β-catenin 和p-β-catenin 核周聚集现象有所改善。RT-qPCR 法检测,与感染组比较,纠正组细胞中Wnt mRNA 表达水平明显升高(Plt;0. 05)。Western blotting 法检测,与感染组比较,纠正组细胞中Wnt 蛋白表达水平明显升高(Plt;0. 05),β-catenin 表达水平差异无统计学意义(Pgt;0. 05),p-β-catenin表达水平明显降低 (Plt;0. 05)。结论:VSV感染后可引起LDLR失活,降低Wnt 蛋白表达水平,造成β-catenin 磷酸化水平升高并发生内化,破坏AJs 稳定性,最终导致VE 屏障损伤。
[关键词] 水泡性口炎病毒; 血管内皮屏障; 黏附连接; 低密度脂蛋白受体; Wnt/β-连环蛋白信号通路
[中图分类号] S852. 65 [文献标志码] A
水泡性口炎病毒(vesicular stomatitis virus,VSV) 是一种负性单链RNA 病毒, 属弹状病毒科[1],可破坏血脑屏障(blood-brain barrier,BBB),侵犯中枢神经系统,引起病毒性脑炎[2-3],但其具体机制尚未阐明。
血管内皮细胞(endothelial cells, ECs) 分布于血管内表面, 通过彼此相连接形成血管内皮(vascular endothelial,VE) 屏 障。 黏 附 连 接(adherent junctions, AJs) 是相邻ECs 连接的关键结构[4],由细胞外VE-钙黏蛋白和细胞中连环蛋白(catenin) 组成。β-连环蛋白(β-catenin) 作为细胞中重要的连接蛋白之一, 受到细胞外信号如Wnt/β-catenin 信号通路调节[5]。研究[6] 显示:低密度脂蛋白受体(low density lipoprotein receptor,LDLR) 是VSV 感染人类和小鼠细胞的重要受体,其家族亚群LDLR 相关蛋白5 (LDLR-relatedprotein 5, LRP5) 和LRP6 是Wnt 通路的共受体[7],可触发典型的Wnt/β-catenin 信号传导。
VSV 是否可通过LDLR 影响Wnt/β-catenin 信号通路,引起AJs 结构异常并最终破坏VE 屏障尚无相关研究。本研究通过构建体外VE 屏障模型,探讨VSV 对VE 屏障的损伤作用及其机制,为阐明VSV 破坏BBB 的机制提供依据。
1 材料与方法
1. 1 细胞、病毒、主要试剂和仪器 小鼠脑血管内皮瘤bEnd. 3 细胞(中国国家生物医学实验细胞资源库), VSV 病毒和犬肾细胞(本实验室自备),RNA 提取试剂盒(上海奕杉生物科技有限公司),实时荧光定量PCR (real-time fluorescencequantitative PCR, RT-qPCR) 试剂盒(大连宝生物工程有限公司),逆转录试剂盒(美国赛默飞世尔科技公司),二喹啉甲酸蛋白定量试剂盒(上海碧 云 天 公 司), 增 强 化 学 发 光(enhancedchemiluminescence, ECL) 试剂盒、4× 十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis, SDSPAGE)上样缓冲液(日本TaKaRa 公司),β-肌动蛋白引物(广州复能基因公司), 胎牛血清(fetalbovine serum, FBS)、杜 氏 改 良 Eagle 培 养 基(Dulbecco’s modified Eagle’s medium,DMEM) 和0. 25% 胰酶(美国Gibco 公司),干扰素α1b (北京三元基因工程有限公司), 磷酸盐缓冲液(phosphate buffer saline,PBS) 干粉(武汉博士德生物公司), VE- 钙黏蛋白抗体(英国Abcam 公司),Wnt 抗体、β-catenin 抗体、β-肌动蛋白抗体、CoraLite594-标记山羊抗兔荧光二抗、CoraLite488-标记山羊抗兔荧光二抗、羊抗兔和羊抗鼠IgG 抗体(武汉三鹰生物技术有限公司),磷酸化β-连环蛋白(phosphorylated β -catenin, p- β -catenin) 抗体(美国亲科生物公司),微丝红色荧光探针、4',6-二脒基-2- 苯基吲哚(4', 6-diamidino-2-phenylindole,DAPI) 和防淬灭封片剂(上海碧云天生物技术有限公司), 异硫氰酸荧光素- 葡聚糖(fluoresceinisothiocyanate-dextran, FITC-Dextran)(上海麦克林生化科技股份有限公司)。CO2 细胞培养箱、低温高速离心机和转膜仪(美国赛默飞世尔科技公司), 荧光显微镜(日本奥林巴斯公司), PCR 仪(美国珀金埃尔默仪器有限公司), RT-qPCR 仪(美国应用生物系统公司), 微量紫外分光光度计(美国通用电器公司),Infinite F500 多功能高端酶标仪(奥地利帝肯公司),电转套装(美国赛默飞世尔科技公司), 电泳仪( 美国伯乐公司),Gelview 6000Plus 智能图像工作站(广州博鹭腾生物科技有限公司),Millicell ERS-2 细胞电阻电压仪器(美 国 Millipore 公 司),Transwell 小 室(孔 径0. 4 μm)(美国Corning 公司)。
1. 2 病毒扩增 提前将犬肾细胞接种于 T25细胞培养瓶中, 待细胞融合率达80% 后采用无血清培养基洗涤3 次。吸净残余培养液, 加入100 μLVSV 原液和900 μL 2% FBS DMEM,置入培养箱中孵育。每15 min 振荡1 次,使病毒悬液充分均匀接触细胞表面。1 h 后加入4 mL 2% FBS DMEM,置于37 ℃、CO2 细胞培养箱中培养。待细胞80%变圆飘起后,采用吹打管多次吹打混匀病毒培养上清液,分装置于-80 ℃保存。
1. 3 VSV 感染 bEnd. 3细胞半数组织培养感染剂量(50% tissue culture infective dose,TCID50)的测定 提前将bEnd. 3 细胞以每孔2×104个的密度接种于96 孔细胞培养板中, 待细胞完全贴壁后, 弃去培养基。采用无血清培养基洗涤3 次,10 倍梯度向下将待测病毒原液稀释10 个浓度。每个浓度5 个复孔,每孔加入相应病毒稀释液100 μL,同时设置对照组。置于37 ℃、CO2细胞培养箱中培养24 h,观察细胞病变情况并统计不同稀释倍数下出现病变的孔数, 根据Reedamp;Muench 法检测VSV 的TCID50[8]:TCID50=log10 (高于50% 感染病毒稀释度) +距离比×log10 稀释系数, 距离比计算公式: 距离比=(高于50% 的病变病毒百分率-50%) / (高于50% 的病变百分率-低于50% 的病变病毒百分率)
1. 4 细胞分组和培养方式 bEnd. 3 细胞采用含10%FBS 和1% 双抗DMEM, 置于37 ℃ 、CO2 细胞培养箱中培养,每24 h 更换培养液1 次,取对数生长期细胞进行后续实验。
VSV 感染损伤VE 屏障实验:以300 倍TCID50感染细胞, 感染前24 h 将培养液更换为无血清DMEM。将细胞分为感染0 h 组、感染4 h 组、感染8 h 组和感染12 h 组。
抑制VSV 复制和VE 屏障恢复实验:将细胞分为对照组、感染组和纠正组, 纠正组细胞于VSV感染4 h 后将培养液更换为含干扰素的10%FBSDMEM 继续培养。
1. 5 Wnt和β-catenin引物序列 本研究所采用的引物由吉林省库美生物科技有限公司设计合成。引物序列见表1。
1. 6 VE屏障跨上皮电阻(transepithelial electricalresistance, TER)和渗透系数检测 将各组bEnd. 3细胞以每孔5×104个的密度接种于Transwell 小室,同时设置空白无细胞孔。每日检测TER 直至数值稳定。上室加入VSV 进行诱导,并在不同时间点进行TER 检测,TER 计算公式[9]:电阻值= (检测值- 无细胞孔值) ×0. 33 Ω·cm2。诱导结束后将上室每孔加入10 g·L-1 FITC-Dextran 10 μL,37 ℃作用5 min。收集上下室培养液,各取100 μL加入96 孔细胞培养板中, 将多功能酶标仪调整为荧光模式,检测各孔吸光度(A) 值,计算渗透系数。渗透系数=下室荧光A 值/上室荧光A 值。
1. 7 RT-qPCR法检测各组细胞中Wnt和β-cateninmRNA表达水平 VSV感染后,各组细胞弃培养液并采用PBS 冲洗, 加入500 μL 细胞裂解液, 用力吸吹10 次后转移至微量离心管中, 振荡10 s 以充分裂解细胞。加入等体积无水乙醇充分混匀后加入离心柱,按照试剂盒说明书操作步骤进行后续操作。采用微量分光光度计检测所提取RNA 浓度,按照1 ng 取相应体积RNA,根据逆转录试剂盒说明书加入逆转录试剂、RNA 和ddH2O, 置于PCR仪中进行逆转录。获得cDNA 后,采用SYBRTMGreen PCR Master Mix 进行RT-qPCR 反应。采用2-ΔΔCt 法计算各组细胞中Wnt 和β-catenin mRNA 表达水平。
1. 8 Western blotting 法 检 测 各 组 细 胞 中 Wnt、β-catenin 和 p-β-catenin蛋白表达水平 采用放射免疫沉淀法裂解液裂解各组bEnd. 3 细胞,提取总蛋白。采用BCA 蛋白定量试剂盒测定蛋白浓度,剩余按照1/3 体积,加入4×SDS-PAGE 上样缓冲液, 100 ℃ 水浴5 min, 每样本取等量蛋白进行SDS-PAGE,将电泳分离蛋白转移至聚偏二氟乙烯膜上, 采用5% 脱脂奶粉封闭1 h 后,将膜分别与Wnt 抗体(1∶1 000)、β-catenin 抗体(1∶5 000)、p- β -catenin 抗体(1∶ 2 000) 和β - 肌动蛋白抗体(1∶5 000) 室温孵育2 h 后,4 ℃条件下孵育过夜,磷酸盐吐温缓冲液(phosphate buffer solution withTween-20, PBST) 洗膜5 次, 每次10 min, 二抗(1∶ 8 000) 室温孵育1 h, PBST 洗膜3 次, 每次10 min,ECL 发光后使用凝胶成像系统成像,拍照保存。采用Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-肌动蛋白条带灰度值。
1. 9 免疫荧光法检测各组细胞中 VE-钙黏蛋白和细胞骨架形态表现并计算 AJs线性指数 bEnd. 3细胞接种于24 孔细胞培养板上,生长至80% 左右分组诱导。4% 多聚甲醛固定10~20 min, 0. 1%Triton X-100 作用10 min, 1% 牛血清白蛋白(bovine serum albumin, BSA) 封闭液室温封闭30 min,加入VE-钙黏蛋白(1∶1 000) 一抗,4 ℃孵育过夜。加入对应抗兔488 荧光二抗室温避光孵育1 h, 细胞骨架染色直接采用微丝红色荧光探针室温避光孵育1 h, DAPI 核染料染色10 min,采用防淬灭封片剂进行封片。荧光显微镜下对各组细胞进行拍摄,采用Image J 软件进行分析。细胞AJs 线性指数= 细胞外围连接总周长/净线性连接长度[9]。
1. 10 免疫荧光法检测各组细胞中 β -catenin 和p-β-catenin定位情况 bEnd. 3细胞接种于 24孔细胞培养板上,生长至80% 左右分组诱导。4% 多聚甲醛固定10~20 min, 0. 1% Triton X-100 作用10 min, 1%BSA 封闭液室温封闭30 min, 分别加入β -catenin (1∶ 300)、p- β -catenin (1∶ 200) 一抗, 4 ℃ 孵育过夜。加入对应荧光二抗室温避光孵育1 h,DAPI 核染料染色10 min,采用防淬灭封片剂进行封片。荧光显微镜下观察各组细胞中β-catenin 和p-β-catenin 的定位情况。
1. 11 统计学分析 采用GraphPad Prism 9. 5统计软件进行统计学分析。各组细胞TER、渗透系数和线性指数, 各组细胞中Wnt 和β-catenin mRNA表达水平及Wnt、β-catenin 和p-β-catenin 蛋白表达水平均符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Tukey 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 VSV感染 bEnd. 3细胞的 TCID50 采用显微镜观察并记录VSV 感染后bEnd. 3 细胞病变情况。见表2。采用Reedamp;Muench 法测定VSV 的TCID50为10-4. 5·100 μL-1。
2. 2 VSV感染后各组细胞VE屏障TER和渗透系数 bEnd. 3 细胞接种于Transwell 小室后连续检测上室和下室TER, 5~6 d 可形成稳定屏障。随着VSV 感染时间延长,与感染0 h 比较,其他各组细胞中TER 明显降低(Plt;0. 05),渗透系数明显升高(Plt;0. 05)。见图1。
2. 3 VSV感染后VE-钙黏蛋白和细胞骨架形态表现 感染0 h 组bEnd. 3 细胞间AJs 为清晰、连续且紧密的线状分布,AJs 线性指数几乎为1。与感染0 h组比较, VSV 感染不同时间组AJs 由线状变为锯齿状,细胞间距增宽,形成间隙,AJs 线性指数明显降低(Plt;0. 05)。感染12 h 组细胞中VE-钙黏蛋白连接中断, 细胞膜结构出现损伤。VSV 感染后细胞骨架发生重组,在核周聚拢且出现典型的应力纤维。见图2 和3。
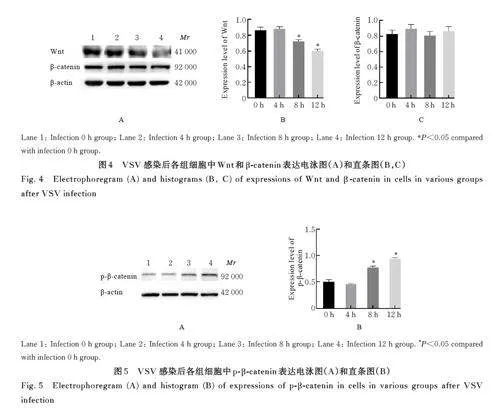
2. 4 VSV 感 染 后 各 组 细 胞 中 Wnt 和 β -cateninmRNA及蛋白表达水平 RT-qPCR法检测结果显示:随着VSV 作用时间延长,与感染0 h 组比较,其他各组细胞中Wnt mRNA 表达水平明显降低(Plt;0. 05),β-catenin mRNA 表达水平差异无统计学意义(Pgt;0. 05),见表3。Western blotting 法检测结果显示:与感染0 h 组比较,随着VSV 感染时间延长,与感染0 h 组比较,其他各组细胞中Wnt蛋白表达水平明显降低(Plt;0. 05),β-catenin 表达水平差异无统计学意义(Pgt;0. 05)。见图4。
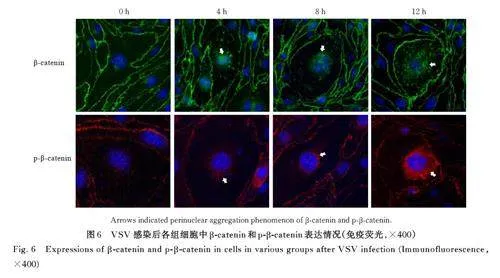
2. 5 VSV感染后各组细胞中p-β-catenin表达水平及其细胞内定位 Western blotting 法检测结果显示:随着VSV 感染时间延长,与感染0 h 组比较,感染8 h 和感染12 h 组细胞中p-β-catenin 表达水平明显升高(Plt;0. 05)。见图5。免疫荧光染色结果显示:与对照组比较,VSV 感染后bEnd. 3 细胞中β-catenin 内化进入细胞质,p-β-catenin 呈现核周围聚集增加。见图6。
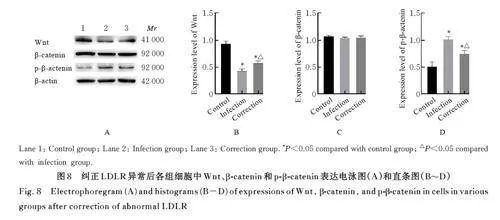
2. 6 纠正LDLR异常后各组细胞TER和渗透系数 与对照组比较,感染组和纠正组TER 均明显降低, 渗透系数均明显升高(Plt;0. 05); 与感染组比较,纠正组TER 明显升高,渗透系数明显降低(Plt;0. 05)。见图7。
2. 7 纠正LDLR异常后各组细胞中Wnt mRNA表达水平 对照组、感染组和纠正组细胞中 WntmRNA 表达水平分别为1. 00±0. 06、0. 78±0. 03和0. 89±0. 02。与对照组比较, 感染组和纠正组细胞中Wnt mRNA 表达水平明显降低(Plt;0. 05);与感染组比较, 纠正组细胞中Wnt mRNA 表达水平明显升高(Plt;0. 05)。
2. 8 纠正LDLR异常后各组细胞中Wnt、β-catenin和p-β-catenin表达水平 与对照组比较,感染组和纠正组细胞中Wnt 蛋白表达水平明显降低(Plt;0. 05),β-catenin 表达水平差异无统计学意义(Pgt;0. 05),p-β-catenin 表达水平明显升高(Plt;0. 05);与感染组比较,纠正组细胞中Wnt 蛋白表达水平明显升高(Plt;0. 05),β-catenin 表达水平差异无统计学意义(Pgt;0. 05),p-β-catenin 表达水平明显降低(Plt;0. 05)。见图8。
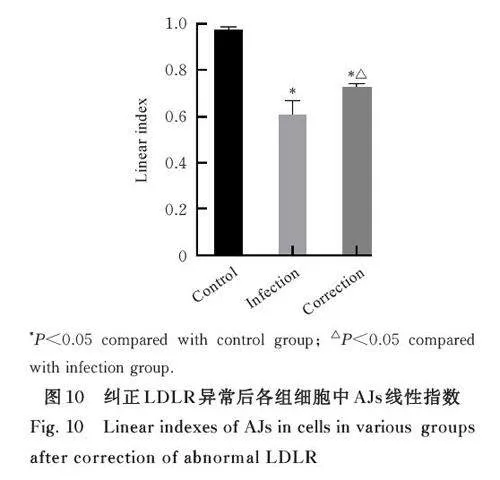
2. 9 各组细胞中β-catenin和p-β-catenin细胞内定位及 VE-钙黏蛋白荧光染色情况 免疫荧光结果显示:与感染组比较,纠正组细胞中β-catenin 内化进入细胞质的现象减少, 在细胞核周围聚集的程度减轻, p- β-catenin 的内化和核周围聚集现象均有所改善,VE-钙黏蛋白染色后锯齿状程度减轻,细胞间隙变小,细胞膜损伤减轻。与感染组比较,纠正组细胞中AJs 线性指数明显升高(Plt;0. 05)。见图9 和10。
3 讨 论
VSV 是一种较为常见的人畜共患病毒, 其神经嗜性和神经毒力在动物模型中已被证实。研究[10-12] 显示:VSV 具有诱导BBB 损伤的作用,可引起脑和脊髓病变等,但其机制尚未明确。
VE 屏障由ECs、细胞间连接和细胞外成分组成,其中ECs 是防止病毒、细菌等病原微生物侵入组织器官的“守门人”[10]。研究[11-12] 显示:VSV 等病毒感染能够破坏AJs 并导致血管渗漏。Transwell小室常用于模拟VE 屏障模型,同时联合细胞电阻仪测量TER, 能够较好地反映VE 屏障的损伤情况[9]。本研究采用bEnd. 3 细胞构建体外VE 屏障模型,结果显示:VSV 感染后TER 降低且渗透系数增加, 表明VSV 感染能够损伤VE 屏障, 导致VE 屏障通透性增加。
细胞间连接主要由AJs、紧密连接和间隙连接组成,其中AJs 具有介导细胞识别、黏附、形态发生和组织完整性的功能, 是VE 屏障的关键结构[13]。AJs 是VE-钙黏蛋白与连接蛋白共同构成的复合体,VE-钙黏蛋白的胞外域相互连接形成异源二聚体,胞内域尾端借助β-连环蛋白等连接蛋白与细胞骨架肌动蛋白相连[14]。因此,AJs 的稳定性与VE-钙黏蛋白、β-catenin 和肌动蛋白有密切关联。VE 屏障的稳定性是细胞间连接代表的离心力和细胞骨架代表的收缩力共同作用的结果[15]。本研究结果显示:VSV 感染bEnd. 3 细胞后,ECs 力平衡被打破,细胞骨架肌动蛋白形成应力纤维提示收缩力增强, VE-钙黏蛋白呈现锯齿状提示离心力减弱,从而引起细胞间隙增大,VE 屏障破坏。另一方面,β-catenin 在VE 屏障中的作用也得到了较多关注。研究[16] 显示:黄病毒的非结构蛋白1 (nonstructural1, NS1) 可通过改变VE- 钙黏蛋白和β-catenin 的正常分布导致VE 通透性增加和血管功能障碍。WENG 等[17] 研究显示:β-catenin 磷酸化会导致细胞间连接完整性降低和ECs 通透性升高。本研究结果显示:随着VSV 感染时间延长,细胞中β-catenin 表达水平并未发生改变, 说明VSV 并不会影响细胞中总β-catenin 表达水平。bEnd. 3 细胞膜处的β-catenin 会内化进入细胞,同时p-β-连环蛋白表达水平升高,并且p-β-catenin 在细胞核周围聚集, 说明VSV 可能通过影响β-catenin 的分布和磷酸化状态进而影响VE-钙黏蛋白,导致VE 屏障通透性增加,而与其表达水平变化无关。β-catenin的磷酸化和异常分布是VSV 作用于ECs 引起AJs结构破坏的关键。
Wnt 是一种分泌性糖蛋白,具有调节细胞生物活性的作用,可激活不同的细胞内信号转导途径,参与维持机体的稳态[5]。Wnt/β-catenin 信号通路是维持VE 屏障或者ECs 正常生理功能的重要通路[18],其功能丧失影响脑血管发育和BBB 的完整性[19]。研究[20-21] 显示: Wnt/β-catenin 信号通路激活可以促进血管生成,有助于损伤后的血管修复,维持BBB 功能的完整性。MARTIN 等[22] 研究显示:特异性调节Wnt 信号能够恢复BBB 正常功能。当Wnt 信号异常时, β-catenin 在细胞质中被磷酸化;当Wnt 信号被激活时,β-catenin 磷酸化蛋白质复合物破坏,β-catenin 结构恢复稳定[23]。本研究结果显示:VSV 感染后bEnd. 3 细胞中Wnt 表达水平降低。抑制VSV 复制, bEnd. 3 细胞表面LDLR 的正常生理状态恢复后,细胞中Wnt 信号表达水平升高,β-catenin 内化程度和磷酸化水平降低,AJs 的损伤得到修复,ECs 间隙缩小。本研究结果显示:VSV 感染可能通过LDLR 影响Wnt 蛋白的表达水平,引起ECs 中β-catenin 修饰和定位的改变,进而影响VE 屏障的通透性,涉及的Wnt/β-catenin 信号通路具体分子机制有待进一步探讨。
综上所述, VSV 通过LDLR 感染血管ECs 后影响Wnt/β-catenin 信号通路相关蛋白表达, 引起VE-钙黏蛋白异常分布和AJs 损伤, 最终导致VE屏障的通透性增加。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:曹宇璇和陈为参与研究选题、实验设计、数据分析及论文撰写,孙成彪、赵娜、王燕和董明鑫参与实验操作及数据分析,许娜、刘文森和李咏梅与课题指导、论文审阅及修改。
[参考文献]
[1] LETCHWORTH G J, RODRIGUEZ L L, DEL
CBARRERA J. Vesicular stomatitis[J]. Vet J, 1999,
157(3): 239-260.
[2] COOPER D, WRIGHT K J, CALDERON P C, et al.
Attenuation of recombinant vesicular stomatitis virushuman
immunodeficiency virus type 1 vaccine vectors by
gene translocations and g gene truncation reduces
neurovirulence and enhances immunogenicity in mice[J].
J Virol, 2008, 82(1): 207-219.
[3] TOMCZYK T, WRÓBEL G, CHABER R, et al.
Immune consequences of in vitro infection of human
peripheral blood leukocytes with vesicular stomatitis
virus[J]. J Innate Immun, 2018, 10(2): 131-144.
[4] 黄焰霞, 刘艾然, 杨 毅. 内皮细胞间黏附连接调节
机制的研究进展[J]. 中国危重病急救医学, 2013,
25(3): 190-192.
[5] 张 新, 巨朝娟, 金 鑫, 等. 外源性神经生长因子
对形觉剥夺性近视豚鼠巩膜组织的保护作用及其
机制[J]. 吉林大学学报(医学版), 2021, 47(6): 1455-
1461.
[6] FINKELSHTEIN D , WERMAN A , NOVICK D ,
et al. LDL receptor and its family members serve as the
cellular receptors for vesicular stomatitis virus[J]. Proc
Natl Acad Sci U S A, 2013, 110(18): 7306-7311.
[7] 王海英, 武心洁, 苑金香, 等. Wnt5a/Frizzled-2/Ca2+和
Wnt3a/Frizzled通路的生理及病理学研究进展[J]. 吉林
大学学报(医学版), 2021, 47(3): 811-818.
[8] 孙成彪. 犬干扰素α/RTB重组融合蛋白制备及抗病毒
活性研究[D]. 北京:军事科学院, 2020.
[9] CHEN W, YU H T, SUN C B, et al. γ -Bungarotoxin
impairs the vascular endothelial barrier function by
inhibiting integrin α5[J]. Toxicol Lett, 2023, 383:
177-191.
[10]CHEN Y, TANG D, ZHU L J, et al. hnRNPA2/B1
ameliorates LPS-induced endothelial injury through
NF- κB pathway and VE-cadherin/β -catenin signaling
modulation in vitro [J]. Mediators Inflamm, 2020,
2020: 6458791.
[11]LIU L, DODD S, HUNT R D, et al. Early detection of
cerebrovascular pathology and protective antiviral
immunity by MRI[J]. Elife, 2022, 11: e74462.
[12]HASHIMOTO R, TAKAHASHI J, SHIRAKURA K,
et al. SARS-CoV-2 disrupts respiratory vascular barriers
by suppressing Claudin-5 expression[J]. Sci Adv, 2022,
8(38): eabo6783.
[13]MACIEL R A P, CUNHA R S, BUSATO V, et al.
Uremia impacts VE-cadherin and ZO-1 expression in
human endothelial cell-to-cell junctions [J]. Toxins,
2018, 10(10): 404.
[14]MISHRA J, DAS J K, KUMAR N. Janus kinase 3
regulates adherens junctions and epithelial mesenchymal
transition through β -catenin[J]. J Biol Chem, 2017,
292(40): 16406-16419.
[15]MCEVOY E, SNEH T, MOEENDARBARY E, et al.
Feedback between mechanosensitive signaling and active
forces governs endothelial junction integrity[J]. Nat
Commun, 2022, 13(1): 7089.
[16]PUERTA-GUARDO H, BIERING S B, DE SOUSA
F T G, et al. Flavivirus NS1 triggers tissue-specific
disassembly of intercellular junctions leading to barrier
dysfunction and vascular leak in a GSK-3β -dependent
manner[J]. Pathogens, 2022, 11(6): 615.
[17]WENG J, CHEN Z F, LI J Y, et al. Advanced
glycation end products induce endothelial
hyperpermeability via β -catenin phosphorylation and
subsequent up-regulation of ADAM10[J]. J Cell Mol
Med, 2021, 25(16): 7746-7759.
[18]SCHULTE G, BRYJA V. WNT signalling:
mechanisms and therapeutic opportunities [J]. Br J
Pharmacol, 2017, 174(24): 4543-4546.
[19]黄晓雯. 脑血管内皮Wnt/β: catenin 信号通路对外周
炎症导致的血脑屏障损伤的介导作用和机制研究[D].
北京: 中国科学院大学, 2021.
[20]SONG S S, HUANG H C, GUAN X D, et al.
Activation of endothelial Wnt/β -catenin signaling by
protective astrocytes repairs BBB damage in ischemic
stroke[J]. Prog Neurobiol, 2021, 199: 101963.
[21]GUO R L, WANG X, FANG Y N, et al. rhFGF20
promotes angiogenesis and vascular repair following
traumatic brain injury by regulating Wnt/β -catenin
pathway[J]. Biomedecine Pharmacother, 2021, 143:
112200.
[22]MARTIN M , VERMEIREN S , BOSTAILLE N ,
et al. Engineered Wnt ligands enable blood-brain barrier
repair in neurological disorders[J]. Science, 2022,
375(6582): eabm4459.
[23]NUSSE R, CLEVERS H. Wnt/β -catenin signaling,
disease, and emerging therapeutic modalities[J]. Cell,
2017, 169(6): 985-999.

