Wnt/β-catenin 信号通路抑制剂MSAB 对人子宫内膜基质细胞纤维化反应的影响

[摘 要] 目的:探讨Wnt/β-连环蛋白 (β-catenin) 信号通路抑制剂3-(4-甲基苯基磺酰胺基) 苯甲酸甲酯(MSAB) 对人子宫内膜基质细胞(HESCs) 纤维化反应的影响, 为MSAB 应用于宫腔粘连 (IUA) 靶 向 治 疗 提 供 依 据 。 方法:体外培养正常 HESCs,分为对照组和转化生长因子 β1(TGF-β1) 组; 体外培养IUA 患者粘连部分的HESCs, 作为IUA 组。采用Western blotting 法检测TGF- β1 作用不同时间(0、12、24、48 和60 h) 后各组细胞中纤维化标志蛋白Ⅰ 型胶原α1(COL1A1) 蛋白表达水平。采用MTT 实验检测各组细胞增殖活性。采用Western blotting 法检测对照组和IUA 组细胞中细胞COL1A1、间质标志蛋白[N-钙黏蛋白和α-平滑肌肌动蛋白(α-SMA) ]以及Wnt/β-catenin 信号通路相关蛋白β-catenin 表达水平。根据MSAB 浓度, 将正常HESCs 分为0(对照组)、0. 25、0. 50、0. 75 和1. 00 μmol·L-1 MSAB 组, MTT 实验检测各组细胞存活率。MSAB 作用后, 将正常HESCs 分为对照组(正常HESCs)、TGF- β1 组(10 μg·L-1 TGF-β1 诱导正常HESCs 24 h 后撤药,更换为完全养基并继续培养24 h) 和MSAB 组(10 μg·L-1 TGF-β1 诱导正常HESCs 24 h 后撤药, 更换为含0. 75 μmol·L-1 MSAB 的完全培养基并继续培养24 h)。采用实时荧光定量PCR (RT-qPCR) 法检测各组细胞中上皮-间质转化(EMT) 相关转录因子Snail、Slug、Smuc、ZEB1 和ZEB2 和COL1A1 mRNA 表达水平, 采用Western blotting 法检测各组细胞中COL1A1 蛋白、N-钙黏蛋白、α -SMA 蛋白、β -catenin 和 c-myc 蛋白表达水平。结果:与对照组(TGF-β1 作用0 h) 比较, TGF-β1 组作用12、24、48 和60 h 时HESCs 中COL1A1 蛋白表达水平升高(Plt;0. 05 或Plt;0. 01)。与对照组比较,IUA 组和TGF-β1 组HESCs 增殖活性差异无统计学意义(Pgt;0. 05)。与对照组比较,IUA 组HESCs 中COL1A1、β-连环蛋白、N-钙黏蛋白和α-SMA 蛋白表达水平升高(Plt;0. 05 或Plt;0. 01)。与对照组比较, 0. 75 和1. 00 μmol·L-1 MSAB 组细胞存活率降低(Plt;0. 05 或Plt;0. 01)。与对照组比较,TGF-β1 组细胞中Snail、Slug 和COL1A1 mRNA 表达水平升高(Plt;0. 05 或Plt;0. 01);与TGF-β1 组比较,MSAB 组细胞中Snail、Slug 和COL1A1 mRNA表达水平降低(Plt;0. 05 或Plt;0. 01)。与对照组比较,作用24 h 时TGF-β1 组细胞中COL1A1 蛋白、N-钙黏蛋白、α -SMA 蛋白、β -catenin 和c-myc 蛋白表达水平升高(Plt;0. 01); 与TGF-β1 组比较,MSAB 组细胞中COL1A1 蛋白、N- 钙黏蛋白、α-SMA 蛋白、β -catenin 和c-myc 蛋白表达水平降低(Plt;0. 05 或 Plt;0. 01)。结论:MSAB可抑制体外培养HESCs的纤维化反应,该结果为MASB应用于IUA 靶向治疗提供了理论基础。
[关键词] 子宫内膜纤维化; 转化生长因子β1; 上皮-间质转化; Asherman 综合征; 宫腔粘连
[中图分类号] R711 [文献标志码] A
Asherman 综合征是由于子宫内膜损伤引起的一种以宫腔粘连(intrauterine adhesion, IUA) 为特征的疾病,主要的临床表现有少经、闭经、不孕和反复自然流产[1],其基本组织学表现是子宫内膜纤维化[2]。纤维化是对急性或慢性细胞损伤的创伤愈合反应,其特征是细胞外基质(extracellular matrix,ECM) 的累积[3]。正常伤口愈合受一系列复杂的促纤维化和抗纤维化过程的调节,包括3 个独立、连续和重叠的步骤:止血炎症阶段、增殖阶段和重塑阶段[2]。在伤口愈合时,肉芽组织中的成纤维细胞被激活,成为肌成纤维细胞(myofibroblasts,MFs),主要负责合成和沉积ECM 成分,同时也表现出收缩特性; MFs 在肉芽组织的收缩、牵引和成熟中起重要作用[4]。虽然MFs 仅在组织生理反应(如正常伤口愈合) 中短暂出现,但在纤维化疾病中不断积累[5]。促纤维化信号的异常激活导致伤口重塑不良[2]。活化的MFs 是纤维化形成的关键效应细胞[6],可引起胶原蛋白等ECM 过度沉积而导致组织纤维化[3]。MFs 可通过上皮- 间质转化(epithelial-mesenchymal transition, EMT) 来源于上皮细胞。发生EMT 的细胞主要表达间质标志蛋白如N- 钙黏蛋白、波形蛋白、纤维连接蛋白和α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)[3]。
研究[7-9] 显示Wnt/β-连环蛋白(β-catenin) 信号通路已成为一种核心促纤维化途径。在多种已发生纤维化的器官中显示出典型的Wnt/β-catenin 信号激活,纤维化子宫内膜基质细胞中Wnt/β-catenin信号也被激活[10], 但其内在机制尚不清楚。目前已知3- (4- 甲基苯基磺酰胺基) 苯甲酸甲酯[methyl 3- {[(4-methyl- phenyl) sulfonyl] amino}benzoate,MSAB] 是一种Wnt 依赖性细胞的有效选择性抑制剂,可抑制Wnt/β-catenin 信号的激活[11]。本研究观察在转化生长因子β1 (transforminggrowth factor- β1, TGF- β1) 诱导的子宫内膜纤维化中, MSAB 是否通过抑制Wnt/β-catenin 信号通路对子宫内膜纤维化进程进行调控, 为初步阐明MSAB 在子宫内膜纤维化疾病中的作用提供依据。
1 材料与方法
1. 1 细胞、主要试剂和仪器 正常人子宫内膜基质细胞(human endometrial stromal cells, HESCs)和IUA 患者的HESCs 均由吉林省人民医院中心实验室分离传代保存,前者来源于无子宫内膜粘连女性, 后者来源于宫腔镜下行IUA 分解术的患者。DMEM/F12 购自美国HyClone 公司, 标准胎牛血清购自美国Clark 生物公司,磷酸盐缓冲液、青霉素-链霉素溶液、胰蛋白酶-EDTA、TransZol Up和TransScript® miRNA First-Strand cDNASynthesis SuperMix 均购自北京全式金生物技术有限公司,TGF-β1 购自北京翘神州科技股份有限公司,MSAB 购自美国MedChemExpress 公司,实时荧光定量PCR (real-time fluorescence quantitativePCR,RT-qPCR) 反应体系SYBR Green 试剂盒购自北京全式金生物技术有限公司,RT-qPCR 引物序列购自苏州金唯智生物科技公司,GAPDH 抗体购自上海圣克鲁斯生物技术有限公司,Ⅰ型胶原α1(type Ⅰ collagen α1, COL1A1) 抗体、N-钙黏蛋白抗体、α-SMA 抗体和β-catenin 抗体均购自美国Cell Signaling Technology 公司, c-myc 抗体购自安诺伦(北京) 生物科技有限公司, 甘氨酸和TrisBase 均购自美国苏州瑞诺德生物科技有限公司,甲醇购自北京国药集团化学试剂有限公司,放射免疫沉淀法缓冲液(radioimmunoprecipitation assaybuffer,RIPA) 购自中国上海碧云天生物科技有限公司,脱脂奶粉购自加拿大BioSharp 公司,二喹啉甲酸(bicinchoninic acid, BCA) 蛋白定量试剂盒购自上海碧云天生物技术有限公司, SDS-PAGE制备试剂盒购自深圳达科为生物工程有限公司,PVDF 购自美国Millipore 公司。CO2 恒温培养箱购自美国赛默飞世尔科技公司, 倒置荧光显微镜购自 日 本 Olympus 公 司, RT-qPCR 仪 购 自 美 国Applied Biosystems 公司。
1. 2 纤维化细胞模型制备和细胞分组 采用体外纤维化细胞模型模拟IUA 患者粘连部位的HESCs。将正常HESCs 密度调整至0. 75×105 mL-1, 接种于6 孔细胞培养板, 每孔加入2 mL 培养液, 细胞贴壁后设定为0 h。采用 10 μg·L-1 TGF-β1 处理正常HESCs (TGF-β1 组),0、12、24、48 和60 h 后收集各孔细胞总蛋白,诱导0 h 的细胞设定为正常HESCs (对照组), 采用Western blotting 法检测2 组细胞中COL1A1 蛋白表达水平。采用10 μg·L-1TGF-β1 处理正常HESCs 0、6、12、24、48 和72 h后,MTT 法检测对照组(正常HESCs)、TGF-β1组(TGF-β1 诱导的正常HESCs) 和IUA 组(宫腔粘连患者粘连部分的HESCs) 细胞增殖活性。以10 μg·L-1 TGF-β1 处理HESCs 12、24、48 和60 h后, 细胞中COL1A1 蛋白表达水平高于处理0 h,各组细胞增殖活性比较差异有统计学意义, 表明TGF- β1 诱导纤维化细胞模型建立成功。采用Western blotting 法检测对照组和IUA 组细胞中细胞COL1A1、间质标志蛋白(N-钙黏蛋白和α-SMA 蛋白) 以及Wnt/β-catenin 信号通路相关蛋白β-catenin表达水平。后续实验选取10 μg·L-1 TGF-β1 处理正常HESCs 24 h,诱导其纤维化。
采用不同浓度(0、 0. 25、 0. 50、 0. 75 和1. 00 μmol·L-1) MSAB 处理正常HESCs 24 h, 采用MTT 法检测正常HESCs 存活率, 选取的MSAB 浓度为细胞存活率达80%~100% 时使用的MSAB 浓度。 因此后续实验选取 0. 75 μmol·L-1MSAB 处理HESCs 24 h。各组细胞处理方式: 对照组为正常HESCs; TGF- β1 组采用10 μg·L-1TGF-β1 诱导正常HESCs 24 h 后撤药,更换为完全养基并继续培养24 h; MSAB 组采用10 μg·L-1TGF- β1 诱导正常HESCs 24 h 后撤药, 更换为含0. 75 μmol·L-1 MSAB 的完全培养基并继续培养24 h;IUA 组为IUA 患者粘连部位的HESCs。
1. 3 MTT法检测各组细胞增殖活性 取对数生长期HESCs,采用胰蛋白酶-EDTA 消化后,制成单细胞悬液, 以每孔3×103 个细胞的密度接种到96 孔细胞培养板中,置于37 ℃孵箱孵育。细胞贴壁后设置为0 h, 各组细胞分别在0、6、12、24、48 和72 h 进行MTT 实验测定,步骤如下:在需要测量的培养孔中加入20 μL MTT 测定液,每孔充分混匀,37 ℃孵育4~6 h。采用无菌吸管吸出上清液, 每孔加入100 μL 二甲基亚砜, 在室温下置于摇床上低速振荡3~5 min,使结晶充分溶解。于酶标仪490 nm 处检测各孔吸光度(A) 值,以A 值表示各组细胞增殖活性。
1. 4 MTT法检测各组细胞存活率 取对数期正常HESCs,采用胰蛋白酶-EDTA 消化后,制成单细胞悬液, 以每孔8×103 个细胞的密度接种至96 孔细胞培养板, 置于37 ℃孵箱中孵育。分为对照组和不同浓度MSAB 组,细胞贴壁后弃掉原培养液,分别加入含0、0. 25、0. 50、0. 75 和1. 00 μmol·L-1MSAB 的DMEM/F12 培养基, 每组设3 个复孔,分别作用24 h 后进行MTT 实验测定。于酶标仪490 nm 处检测各孔A 值, 计算细胞存活率。细胞存活率= (处理组A 值-空白孔A 值) / (对照组A 值-空白孔A 值) ×100%。
1. 5 RT-qPCR法检测各组细胞中 EMT相关转录因子和 COL1A1 mRNA表达水平 TRIzol法提取对照组、TGF-β1 组和MSAB 组HESCs 中总RNA;RNA 定量后参照逆转录试剂盒说明书进行逆转录操作,合成 cDNA,将 cDNA 置于 -20 ℃ 储存备用。每组反应体系的体积为20 μL,并设置3 个复孔。采用 SYBR Green 试剂盒检测细胞中 Snail、Slug、Smuc、ZEB1、ZEB2 和COL1A1 mRNA 表达水平,采用 U6 作为内部对照引物。实验重复3 次。引物序列: U6 F 5'-AACGAGACGACGACAGAC-3', U6 R 5'-GCAAATTCGTGAAGCGTTCCATA-3'; COL1A1 F 5'-GAGGGCCAAGACGAAGACATC-3', COL1A1 R 5'-CAGATCACGTCATCGCACAAC-3';Snail F 5'-GCGAGCTGCAGGACTCTAAT-3',Snail R 5'-GCCTCCAAGGAAGAGACTGA-3'; Slug F 5'-CCTGGTTGCTTCAAGGACAC-3', Slug R 5'-TCCATGCTCTTGCAGCTCTC-3'; Smuc F 5'-GTGAAAACGCACTCCAGC-3', Smuc R 5'-AGAGCAGGCACCATTGATT-3'; ZEB1 F 5'-TTACACCTTTGCATACAGAACCC-3', ZEB1 R 5'-TTTACGATTACACCCAGACTGC-3'; ZEB2 F 5'-GGAGACGAGTCCAGCTAGTGT-3', ZEB2 R 5'-CCACTCCACCCTCCCTTATTTC-3'。反应程序:94 ℃预变性5 min; 94 ℃ 变性1 min、55 ℃ 退火30 s、72 ℃延伸1 min, 循环40 次; 72 ℃、10 min; 4 ℃保存。采用2−ΔΔCt法计算靶基因mRNA 表达水平。
1. 6 Western blotting法检测各组细胞中间质和纤维化标志蛋白及 Wnt/β-catenin信号通路相关蛋白表达水平 收集各组细胞,加入RIPA缓冲液提取细胞中总蛋白, BCA 蛋白定量法测定细胞中蛋白浓度。取20 μg 各组细胞总蛋白上样行10% SDSPAGE凝胶电泳,将蛋白转移至PVDF 上,5% 脱脂奶粉封闭1 h 后, 加入GAPDH (1∶ 1 000)、COL1A1 (1∶ 1 000)、N-钙黏蛋白(1∶ 1 000)、α-SMA (1∶ 1 000)、 β -catenin (1∶ 1 000) 和c-myc (1∶ 1 000) 抗体4 ℃ 孵育过夜。采用TBST 缓冲液洗涤PVDF 膜后,加入辣根过氧化物酶偶联的抗小鼠或抗兔(1∶2 000) 二抗在室温下再孵育2 h。TBST 缓冲液洗涤PVDF 膜3 次后,采用极敏感增强型化学发光试剂试剂盒曝光成像,以GAPDH作为内参蛋白, 采用Image J 软件量化条带强度,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。
1. 7 统计学分析 采用 SPSS 20. 0统计软件进行统计学分析。采用Shapiro-Wilk 检验对各组数据进行正态性检验,各组细胞增殖活性,细胞存活率,细胞中Snail、Slug、Smuc、ZEB1、ZEB2 和COL1A1 mRNA 表达水平及细胞中COL1A1、N-钙黏蛋白、α-SMA、β-catenin 和c-myc 蛋白表达水平均符合正态分布, 以-x±s 表示, 两组间样本均数比较采用两独立样本t 检验,多组间样本均数比较采用单因素方差分析, 组间两两比较采用LSD-t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
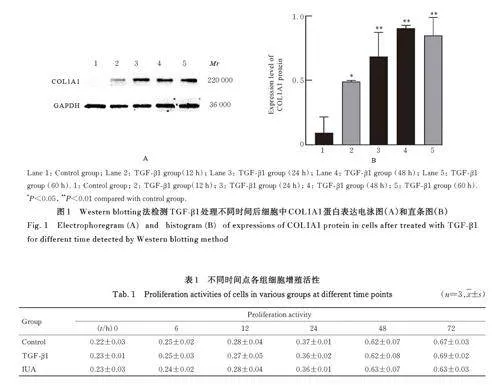
2. 1 TGF-β1处理不同时间后2组细胞中COL1A1蛋白表达水平 与对照组比较,TGF-β1组诱导正常HESCs 12 h 时细胞中COL1A1 蛋白表达水平升高(Plt;0. 05); TGF- β1 组诱导正常HESCs 24、48 和60 h 时细胞中COL1A1 蛋白表达水平明显升高(Plt;0. 01)。见图1。
2. 2 各组细胞增殖活性 与对照组比较,不同时间点(0、6、12、24、48 和72 h) IUA 组和TGF-β1组细胞增殖活性差异无统计学意义(Pgt;0. 05)。见表1。
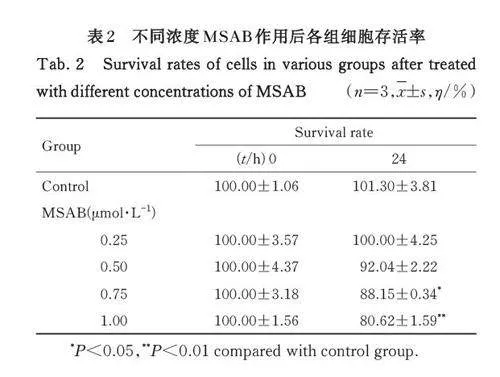
2. 3 不同浓度MSAB作用后各组细胞存活率 与对照组比较, 0. 25、0. 50、0. 75 和1. 00 μmol·L-1MSAB 组细胞存活率呈现逐渐降低趋势; 其中作用24 h 后,0. 75 和1. 00 μmol·L-1 MSAB 组细胞存活率明显降低(Plt;0. 05 或Plt;0. 01)。见表2。
2. 4 对照组和IUA组细胞中间质和纤维化标志蛋白及 Wnt/β -catenin 信号通路相关蛋白表达水平 与对照组比较, IUA 组细胞中纤维化标志蛋白COL1A1 蛋白表达水平明显升高(Plt;0. 01); 间质标志蛋白N-钙黏蛋白和α-SMA 蛋白表达水平升高(Plt;0. 05); Wnt/β-catenin 信号通路相关蛋白β -catenin 表达水平也明显升高(Plt;0. 01)。见图2。
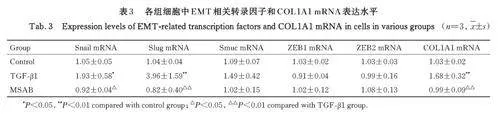
2. 5 各组细胞中 EMT 相关转录因子和 COL1A1mRNA表达水平 与对照组比较,TGF-β1组细胞中EMT 相关转录因子Snail mRNA 表达水平升高(Plt;0. 05),Slug mRNA 表达水平明显升高(Plt;0. 01),COL1A1 mRNA 表达水平也明显升高(Plt;0. 01),其余转录因子mRNA 表达水平差异无统计学意义(Pgt;0. 05);与TGF-β1 组比较,MSAB 组细胞中EMT 相关转录因子Snail mRNA 表达水平降低(Plt;0. 05),Slug mRNA 表达水平降低(Plt;0. 01), COL1A1 mRNA 表达水平降低(Plt;0. 01),其余转录因子mRNA 表达水平差异无统计学意义(Pgt;0. 05)。见表3。
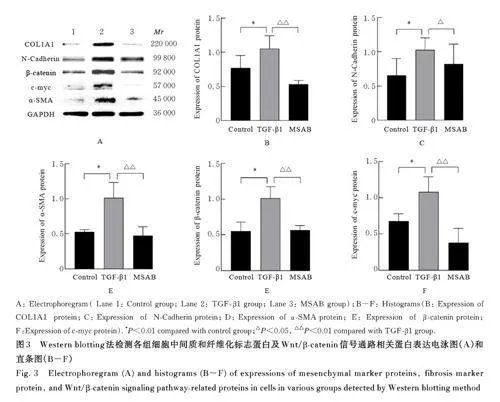
2. 6 各组细胞中间质和纤维化标志蛋白及 Wnt/β-catenin信号通路相关蛋白表达水平 与对照组比较, TGF- β1 组细胞中纤维化标志蛋白COL1A1、N-钙黏蛋白和α-SMA 蛋白表达水平明显升高(Plt;0. 01), Wnt/β-catenin 信号通路相关蛋白β-catenin和c-myc蛋白表达水平也升高(Plt;0. 01);与TGF-β1组比较,MSAB 组细胞中纤维化标志蛋白COL1A1表达水平明显降低(Plt;0. 01), 间质标志蛋白N- 钙黏蛋白和α -SMA 蛋白表达水平降低(Plt;0. 05),Wnt/β-catenin 信号通路相关蛋白β-catenin 和c-myc 蛋白表达水平明显降低(Plt;0. 01)。见图3。
3 讨 论
IUA 是导致不孕的主要原因之一 [1]。对于有生育要求或者有症状的IUA 需要行宫腔镜手术治疗者, 子宫内膜进一步损伤易导致IUA 复发[12]。术后为预防宫腔再次粘连,常采用雌孕激素周期疗法治疗[13],其预防IUA 的效果有限。因此,探讨高效预防和治疗IUA 的方法十分重要。
TGF- β1 作为TGF- β 超家族的一员, 在癌症[14]、生理愈合[15]、免疫[16] 和纤维化[17] 中有重要的调节作用。在肺纤维化和肝肾纤维化等疾病中已证实TGF-β1 为纤维化的驱动因素[18]。研究[19]显示:在IUA 临床样本和动物模型中均发现TGF-β1高表达。TGF- β1 通过TGF- β1/Smad 信号通路诱导或调控EMT, 是EMT 强有力的诱导因子[17] 。在细胞实验中,通常采用TGF-β1 构建IUA 细胞模型。CHEONG 等[20] 研究显示: 2 μg·L-1 TGF- β1处理HESCs 16 h 可以引起细胞中COL1A1 和结缔组织生长因子(connective tissue growth factor,CTGF) 的表达水平上调; LIU 等[21] 研究显示:10 μg·L-1 TGF-β1 处理HESCs 72 h 是建立IUA 细胞模型的最佳条件。本研究结果显示: 10 μg·L-1TGF- β1 处理HESCs 12 h 后细胞中COL1A1 蛋白表达水平升高; 处理24、48 和60 h 后细胞中COL1A1 蛋白表达水平明显升高, 提示HESCs 纤维化模型建立成功。
EMT 分为3 种不同的亚型:1 型参与胚胎发生和器官发育;2 型与伤口愈合、组织再生和器官纤维化有关;3 型与癌症进展相关。IUA 的基本组织学表现是促纤维化信号的异常激活导致上皮细胞通过2 型EMT 转化为MFs[22],表现为迁移能力、侵袭性和抗凋亡能力增强及ECM 累积[23]。发生EMT 时上皮标志分子E-钙黏蛋白表达水平降低,EMT 间质标志分子如N-钙黏蛋白、波形蛋白和α-SMA 表达水平升高[24]。其中α-SMA 既是间质标志物[3],又是纤维化标志物[25]。近期研究[7-9] 显示:除TGF-β1 外, Wnt/β -catenin 信号通路也是促进EMT 的有效介质。TGF- β1 不仅通过经典通路TGF-β1/Smad 信号通路诱导EMT,也可以通过与非经典通路MAPK/ERK 、Hedgehog 、PI3K/Akt和Wnt/ β-catenin 信号通路发生串扰引起EMT,最终导致纤维化标志蛋白的沉积[26-27]。本研究结果显示: 与对照组比较, IUA 组细胞中N-钙黏蛋白、COL1A1 和β-catenin 表达水平升高, 提示IUA 组比对照组更易发生EMT 及COL1A1 沉积, Wnt/β-catenin 信号通路与HESCs 纤维化有关。
Wnt/β-catenin 信号通路不仅在肿瘤疾病中发挥关键作用,在许多非肿瘤疾病中也发挥重要作用,如脱发、色素紊乱、伤口愈合、骨骼疾病、神经退行性疾病和慢性阻塞性肺疾病[28]。Wnt/β-catenin信号通路的过度激活与子宫内膜纤维化也有密切关联,其是促进EMT 的有效介质[10]。Wnt/β-catenin信号通路由EMT 相关转录因子启动, 包括Snail、Slug、Twist、ZEB1 和ZEB2[22,29] 。HWANG等[11] 研究显示:MSAB 是Wnt/β-catenin 信号传导的选择性抑制剂,可以选择性抑制Wnt 依赖性细胞中Wnt 信号活性,而对Wnt 非依赖性细胞和正常人细胞几乎无影响。本研究结果显示:TGF-β1 诱导的HESCs 纤维化中, 转录因子Snail、Slug 和COL1A1 mRNA 表达水平升高、N- 钙黏蛋白和COL1A1 蛋白表达水平升高;同时β-catenin 和c-myc蛋白表达水平升高。MSAB抑制TGF-β1诱导HESCs纤维化时, 转录因子Snail、Slug 和COL1A1mRNA 表达水平降低, N-钙黏蛋白和COL1A1 蛋白表达水平降低; Wnt/β-catenin 信号通路相关蛋白(β-catenin 和c-myc) 表达水平降低。
综上所述, MSAB 干预后HESCs 纤维化反应降低, 其作用机制与抑制Wnt/β-catenin 信号通路有关。该结果为IUA 的发生发展提供了理论基础,有助于开发IUA 的新型辅助治疗策略。未来应该在细胞水平和动物水平对MSAB 的机制进行深入研究, 为MSAB 靶向治疗应用至临床及开发IUA的新型辅助治疗策略提供依据。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:王飞娜参与研究设计和论文撰写,于歆悦、臧欢欢和刘霖君参与研究数据的获取和分析,刘磊、林秀英和付建华参与论文修改和审校,米旭光和方艳秋参与研究设计。
[参考文献]
[1] ESFANDYARI S, CHUGH R M, PARK H S, et al.
Mesenchymal stem cells as a bio organ for treatment of
female infertility[J]. Cells, 2020, 9(10): 2253.
[2] LEE W L, LIU C H, CHENG M, et al. Focus on the
primary prevention of intrauterine adhesions: current
concept and vision[J]. Int J Mol Sci, 2021, 22(10):
5175.
[3] HU H H, CHEN D Q, WANG Y N, et al. New
insights into TGF-β/Smad signaling in tissue fibrosis[J].
Chem Biol Interact, 2018, 292: 76-83.
[4] LODYGA M, HINZ B. TGF- β1 - A truly transforming
growth factor in fibrosis and immunity[J]. Semin Cell
Dev Biol, 2020, 101: 123-139.
[5] GYÖRFI A H, MATEI A E, DISTLER J H W.
Targeting TGF- β signaling for the treatment of
fibrosis[J]. Matrix Biol, 2018, 68/69: 8-27.
[6] PAKSHIR P , NOSKOVICOVA N , LODYGA M ,
et al. The myofibroblast at a glance[J]. J Cell Sci,
2020, 133(13): jcs227900.
[7] ZHANG Q, WANG L, WANG S Q, et al. Signaling
pathways and targeted therapy for myocardial
infarction[J]. Signal Transduct Target Ther, 2022,
7(1): 78.
[8] SHREE HARINI K, EZHILARASAN D. Wnt/beta-
catenin signaling and its modulators in nonalcoholic fatty
liver diseases[J]. Hepatobiliary Pancreat Dis Int, 2023,
22(4): 333-345.
[9] HADPECH S, THONGBOONKERD V. Epithelialmesenchymal
plasticity in kidney fibrosis[J]. Genesis,
2023: e23529.
[10]XIONG Z H, MA Y R, HE J, et al. Apoptotic bodies
of bone marrow mesenchymal stem cells inhibit
endometrial stromal cell fibrosis by mediating the Wnt/
β-catenin signaling pathway[J]. Heliyon, 2023, 9(11):
e20716.
[11]HWANG S Y, DENG X M, BYUN S, et al. Direct
targeting of β-catenin by a small molecule stimulates
proteasomal degradation and suppresses oncogenic Wnt/
β-catenin signaling[J]. Cell Rep, 2016, 16(1): 28-36.
[12]SURGERY A E G. AAGL practice report: practice
guidelines on intrauterine adhesions developed in
collaboration with the European Society of
Gynaecological Endoscopy (ESGE)[J]. Gynecol Surg,
2017, 14(1): 6.
[13]MAGOS A. Hysteroscopic treatment of Asherman’s
syndrome[J]. Reprod Biomed Online, 2002, 4(Suppl 3):
46-51.
[14]BATLLE E, MASSAGUÉ J. Transforming growth
factor-β signaling in immunity and cancer[J]. Immunity,
2019, 50(4): 924-940.
[15]LICHTMAN M K, OTERO-VINAS M, FALANGA
V. Transforming growth factor beta (TGF- β) isoforms
in wound healing and fibrosis[J]. Wound Repair Regen,
2016, 24(2): 215-222.
[16]CHEN W J. TGF- β regulation of T cells[J]. Annu Rev
Immunol, 2023, 41: 483-512.
[17]KIM K K, SHEPPARD D, CHAPMAN H A. TGF-β1
signaling and tissue fibrosis [J]. Cold Spring Harb
Perspect Biol, 2018, 10(4): a022293.
[18]BUDI E H, SCHAUB J R, DECARIS M, et al. TGF-
β as a driver of fibrosis: physiological roles and
therapeutic opportunities[J]. J Pathol, 2021, 254(4):
358-373.
[19]GUO L P, CHEN L M, CHEN F, et al. Smad
signaling coincides with epithelial-mesenchymal
transition in a rat model of intrauterine adhesion[J]. Am
J Transl Res, 2019, 11(8): 4726-4737.
[20]CHEONG M L, LAI T H, WU W B. Connective
tissue growth factor mediates transforming growth factor
β-induced collagen expression in human endometrial
stromal cells[J]. PLoS One, 2019, 14(1): e0210765.
[21]LIU L M, CHEN G B, CHEN T L, et al. Si-SNHG5-
FOXF2 inhibits TGF- β1-induced fibrosis in human
primary endometrial stromal cells by the Wnt/β -catenin
signalling pathway[J]. Stem Cell Res Ther, 2020,
11(1): 479.
[22]MARCONI G D, FONTICOLI L, RAJAN T S, et al.
Epithelial-mesenchymal transition (EMT): the type-2
EMT in wound healing, tissue regeneration and organ
fibrosis[J]. Cells, 2021, 10(7): 1587.
[23]KALLURI R, WEINBERG R A. The basics of
epithelial-mesenchymal transition [J]. J Clin Invest,
2009, 119(6): 1420-1428.
[24]GAETJE R, KOTZIAN S, HERRMANN G, et al.
Nonmalignant epithelial cells, potentially invasive in
human endometriosis, lack the tumor suppressor
molecule E-cadherin[J]. Am J Pathol, 1997, 150(2):
461-467.
[25]ZHANG L, LI Y, GUAN C Y, et al. Therapeutic
effect of human umbilical cord-derived mesenchymal
stem cells on injured rat endometrium during its chronic
phase[J]. Stem Cell Res Ther, 2018, 9(1): 36.
[26]MENG X M, NIKOLIC-PATERSON D J, LAN H Y.
TGF- β: the master regulator of fibrosis[J]. Nat Rev
Nephrol, 2016, 12(6): 325-338.
[27]YANG N, ZHANG H, CAI X X, et al.
Epigallocatechin-3-gallate inhibits inflammation and
epithelial-mesenchymal transition through the PI3K/
AKT pathway via upregulation of PTEN in asthma[J].
Int J Mol Med, 2018, 41(2): 818-828.
[28]LIU J Q, XIAO Q, XIAO J N, et al. Wnt/β -catenin
signalling: function, biological mechanisms, and
therapeutic opportunities[J]. Signal Transduct Target
Ther, 2022, 7(1): 3.
[29]TAKI M, ABIKO K, UKITA M, et al. Tumor
immune microenvironment during epithelialmesenchymal
transition[J]. Clin Cancer Res, 2021,
27(17): 4669-4679.

