氢氧化亚铁制备实验的再改进


摘 要:为延长氢氧化亚铁制备实验中白色沉淀存在的时间,加快灰绿色转变为红褐色的速率,利用市售清凉冻密封性好、不易进入氧气的结构特点,将清凉冻作为载体制备氢氧化亚铁。随后通入氧气,清凉冻中出现红褐色、灰绿色、白色三种颜色共存的现象,帮助学生直观感受氢氧化亚铁的生成与转化。
关键词:氢氧化亚铁;清凉冻;白色沉淀;红褐色
中图分类号:G434 文献标识码:A
一、问题的提出
“氢氧化亚铁的制备”是《普通高中化学课程标准(2017 年版2020 年修订)》提出的一项活动建议,在中学教学中有着重要的地位。氢氧化亚铁的制备实验有助于学生关联宏观现象、微观机理与符号表征,总结难溶性碱生成的一般规律,提升学生知识表征水平,帮助学生建构铁及其重要化合物之间相互转化的关系,培养学生微粒观、变化观等学科观念。
人教版、鲁科版、苏教版三个不同版本的普通高中化学教科书均展示了氢氧化亚铁的制备及其变化的实验。实验操作方法及现象解释如表1 所示。综合三个不同版本普通高中化学教科书中的相关内容,可知教科书实验期待实验者观察到的现象为:FeSO4 溶液与NaOH 溶液反应先产生氢氧化亚铁白色沉淀,然后白色沉淀迅速变为灰绿色,最后被氧化生成红褐色的氢氧化铁。但在实际操作过程中,由于新制的氢氧化亚铁沉淀迅速被氧化而变色,学生不易观察到氢氧化亚铁沉淀应呈现出的白色;一段时间后,学生仅仅在灰绿色悬浊液与空气交界处观察到一圈红褐色,液面以下的灰绿色沉淀被氧化为红褐色需要数小时甚至更长时间。因此,传统实验存在白色沉淀存在时间过短,而灰绿色沉淀存在时间过长的缺点,不利于学生在有限的课堂教学时间内直观感受氢氧化亚铁的生成和转化,实验的教学价值没有得到充分发挥。
二、部分改进实验的综述
为弥补传统实验中学生不易观察到白色沉淀的不足,现有实验改进主要朝着以下两个方向进行:一种观点与教材观点类似,认为沉淀变色是氢氧化亚铁被氧化所致[4] ,故此种改进方向是排除反应体系和环境中氧气的干扰[5] ;另一种观点认为由于氢氧化亚铁吸附多余的亚铁离子而导致沉淀变色[6] ,故改进方向为减少或消除氢氧化亚铁沉淀对多余亚铁离子的吸附。另外,还有一些改进实验兼顾了以上两个方向。
陈彩凤等[7] 从减少反应体系中的氧气等角度出发,结合煮沸的方法,使用软管作为反应容器,减少反应中的氧气,并利用Fe2+ 与HCO3-双水解产生的二氧化碳气体排除氧气,延长了白色沉淀存在的时间。但是,经专家[8] 理论计算和实验证明,此改进方案中产生的白色沉淀为FeCO3 ,因此,通过Fe2+ 与HCO3- 双水解制备氢氧化亚铁的方案有待商榷。董景礼,马善恒[9] 认为由于氢氧化亚铁凝胶吸附亚铁离子并聚集,导致灰绿色沉淀的生成,并在反应体系中不断通入氮气阻碍这种吸附,能够长时间看到白色沉淀。张宏艳[10] 主要从试剂改进、仪器改进角度进行实验创新设计,使用西林瓶和一次性注射器设计微型实验。采用碱性相对较弱的氨水代替教材实验中的氢氧化钠溶液,通过降低溶液的碱性来降低Fe2+ 的还原性,然后,进一步向氨水中加入Na2 SO3 溶液,以除去溶液和装置中的氧气,该项改进实验现象明显、试剂用量少、白色沉淀长时间稳定存在。霍本斌[11] 使用结块的亚铁盐固体与浓的氢氧化钠溶液反应,保证了亚铁盐固体溶解产生的少量亚铁离子与大量的氢氧化钠接触,避免生成的氢氧化亚铁吸附 Fe2+而变成灰绿色。该法制得的氢氧化亚铁白色沉淀不仅保存时间长,而且实验操作简单可行。周红杰等[12] 用钠与水反应制备氢氧化钠溶液,同时利用该反应生成的氢气排除溶液中的氧气,并用苯液封,除氧效果良好,使在氢气氛围中生成的氢氧化亚铁与空气很好地隔绝,白色的氢氧化亚铁沉淀可以长时间保存。张婉莹等[13] 采用简易的套管装置,利用酵母菌呼吸作用去除管内的氧气,综合生物和物理知识,跨学科创造性地在无氧环境中制备氢氧化亚铁沉淀,现象清晰,操作简便,激发了学生跨学科综合分析问题、解决问题的能力。
已有的改进实验通过优选试剂、仪器改进、操作改进等策略,实现了长时间保存氢氧化亚铁沉淀的目的,甚至还可以实现趣味化[14] 。然而,部分改进实验存在药品的消耗量比较大、过度强调实验微型化导致现象不易观察、使用稀缺仪器、对仪器进行复杂的改造等缺点,增加了实验推广的难度,削弱了实验被其他同行借鉴的价值,还可能给实验准备工作带来不小的负担。若改进实验操作步骤繁琐或装置搭建复杂,会导致紧凑的教学节奏变得松散,分散学生的注意力,削弱了实验的教学价值。另外,部分改进实验易造成苯等有毒试剂的挥发,不利于师生身心健康。
大多数改进实验只是片面地强调如何延长白色沉淀存在的时间,而忽略了该实验还承担着让学生感知氢氧化亚铁的氧化、变色,进一步建构铁及其重要化合物之间相互转化的关系等教学任务。因此,实验改进不仅应聚焦于如何延长白色沉淀存在的时间,还应满足在有限的课堂教学时间内,让学生感知白色沉淀被氧化而迅速变成灰绿色,最终变为红褐色等要求,以便于学生通过实验探究了解铁的氢氧化物的性质与转化,并通过创新实验提升“科学探究与创新意识”等维度的学科核心素养。
三、氢氧化亚铁制备实验的再改进
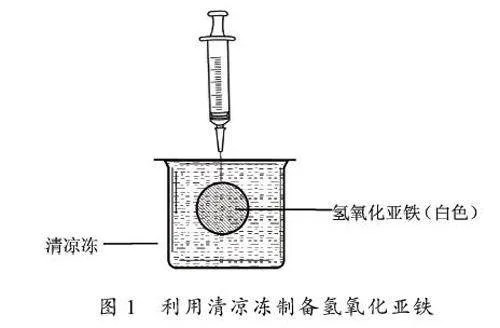
为发挥创新实验的教学价值与育人价值,笔者对氢氧化亚铁制备实验进行了再改进。参考吴文中老师的建议[15] ,往高浓度的氢氧化钠溶液中注入较低浓度的硫酸亚铁溶液,确保氢氧化亚铁基本无亚铁离子吸附。同时,为了避免新制氢氧化亚铁被环境中的氧气氧化,师生利用某品牌清凉冻呈凝胶状,包装密封性好,不易进入氧气,且外观几乎透明不影响实验观测特点,将清凉冻作为实现载体,制备了氢氧化亚铁白色沉淀。随后,用注射器在新制的氢氧化亚铁中注入空气,让学生观察到白色的氢氧化亚铁沉淀迅速被氧化,并且出现红褐色、灰绿色、白色三种颜色共存的现象。此项改进实验可以帮助学生建构铁及其重要化合物之间相互转化的关系,体现创新实验的教学价值。
( 一) 实验药品及仪器
实验药品:FeSO4·7H2 O;氢氧化钠;蒸馏水,稀硫酸,还原铁粉。
实验仪器:烧杯;注射器;某品牌清凉冻;玻璃棒。
( 二) 实验操作步骤
① 用新煮沸冷却的蒸馏水配制浓度约为0. 1 mol/ L 的 FeSO4 溶液,加入数滴稀硫酸,并加入过量的还原铁粉。
② 用新煮沸冷却的蒸馏水配制6 mol/ LNaOH 溶液,冷却至室温备用。
③ 如图1 所示,取一只包装完好的清凉冻置于实验台上,用带针头的注射器向其中注入1 mL 新配制的6mol/ L NaOH 溶液;然后在清凉冻的相同位置,用另一支带针头的注射器注入0. 5 mL 0. 1 mol/ L FeSO4 溶液。观察并记录现象。
④ 用另一支未使用过的注射器往新制氢氧化亚铁分布的区域中心注入适量空气。
⑤ 持续往清凉冻中注入空气或注入质量分数为3%的过氧化氢溶液,观察并记录现象。
⑥ 设置对比实验,只向清凉冻中注入0. 5mL 0. 1 mol/ L FeSO4 溶液或只注入1 mL 新配制的6 mol/ L NaOH 溶液,观察现象。
( 三) 实验现象
只向清凉冻中注入氢氧化钠溶液或硫酸亚铁溶液,均无明显现象,可见清凉冻原有成分对氢氧化亚铁的生成无干扰。在清凉冻中注入氢氧化钠溶液与硫酸亚铁溶液后,两种试剂反应生成白色的氢氧化亚铁。在凝胶状的清凉冻中,氢氧化亚铁白色絮状沉淀分散区域较广,现象明显,便于学生观察。而且清凉冻包装具有良好的密封性、不易进入氧气的结构特点,沉淀的白色可以维持约20 分钟,满足了教学需求。
实验步骤④ 中,用注射器向新制氢氧化亚铁中注射适量空气,部分白色的氢氧化亚铁沉淀立刻变为灰绿色,同时,注射器针头周围的氢氧化亚铁由于充分接触了氧气而被氧化为红褐色。如图2 所示,出现了中心为红褐色,向外依次为灰绿色、白色三种颜色共存的现象。随后持续注入空气,一段时间后,可以看到氢氧化亚铁沉淀最终全部变为红褐色。氢氧化亚铁在清凉冻中分散性好,故可与注入的氧气接触充分,被氧化的反应速率较快,一分钟内,大部分灰绿色沉淀可变为红褐色,变色时间比传统试管实验大大缩短。若在清凉冻中,注入过氧化氢溶液,灰绿色沉淀可在数秒内变为红褐色。
( 四) 实验说明
① 挑选清凉冻时,应上下颠倒,确保包装完整且内部无气泡,以免混入氧气对实验产生干扰。
② 图1、图2 中所展示的氢氧化亚铁分布区域的形状为圆饼状,但实际操作过程中氢氧化亚铁分布区域的形状是随机的,如长条状等。
③ 步骤④中注入的空气应适量,避免由于注入过多空气导致白色的氢氧化亚铁沉淀被氧化变为灰绿色,从而影响三色共存现象的观察。
④ 由于清凉冻所能容纳的液体体积有限,故实验操作过程中所注入的氢氧化钠溶液与硫酸亚铁溶液体积不宜过大。
四、实验的优点与价值
① 选择清凉冻等生活资源作为载体,材料易得、廉价,可激发学生实验探究的兴趣,药品用量少,现象明显,成功率高。
② 以清凉冻作为载体制备氢氧化亚铁,白色絮状沉淀维持较长时间,便于学生观察,同时此条件下制备的氢氧化亚铁分散性较好,与后续注入的氧气接触充分,故变色时间较传统实验大大缩短,便于课堂演示或学生分组实验。
③ 三种不同颜色的沉淀共存,进一步激发了学生的探究兴趣。也可为一线教师扩充教学资源。教师通过完善教学设计,引导学生观察宏观的实验现象,感知氢氧化亚铁的生成、氧化、变色整个完整的过程,聚焦学生思维,揭示现象背后的反应原理,为学生建构铁及其重要化合物之间相互转化提供素材,培养学生微粒观、变化观等学科观念,提升结构化认知水平。
④ 剖析已有实验的优点和不足,积极尝试新的改进方法,并加以实验验证,可以培养学生批判思维,培养其不畏艰难的毅力与勇于创新的精神,正视科学研究中遇到的困难,运用生活经验和知识,克服困难,解决问题,实现知识的活学活用,逐步形成反思、实践、创新、坚持不懈的科学品质。
参考文献:
[1] 王晶,郑长龙主编. 普通高中教科书·化学必修第一册[ M] . 北京:人民教育出版社,2019.
[2] 王磊,陈光巨主编. 普通高中教科书·化学必修第一册[ M] . 济南:山东科学技术出版社,2019.
[3] 王祖浩主编. 普通高中化学课程标准实验教科书·化学2( 必修) [ M] . 南京:江苏教育出版社,2020.
[4] 陈章. 基于问题建构还原性物质制备模型的教学实践—以“ 氢氧化亚铁的制备” 为例[ J] . 中学化学教学参考,2022 (21) :45-48.
[5] 周如磊. 对氢氧化亚铁制备实验的疑问分析及实证[ J] . 化学教学,2020(12) :52-54.
[6] 陆鼎昌,马善恒,方方. 基于数字实验的氢氧化亚铁制备研究[ J] . 中学化学教学参考,2017 ( 11) :51-53.
[7] 陈彩凤,陈迪妹,胡加烽,等. 氢氧化亚铁制备实验的改进与创新[ J] . 化学教学,2016(9) :46.
[8] [15] 吴文中. 氢氧化亚铁变为灰绿色的理论探讨[ J] . 化学教学,2016(9) :60-61.
[9] 董景礼,马善恒. 再谈氢氧化亚铁的制备[ J] . 中学化学教学参考,2018(5) :54.
[10] 张宏艳. 基于X 射线衍射分析方法改进氢氧化亚铁制备实验[ J] . 化学教学,2021(5) :77-81.
[11] 霍本斌. 再谈氢氧化亚铁制备实验的创新[ J] .实验教学与仪器,2020(11) :30-31.
[12] 周红杰,李立芬. 氢氧化亚铁制备实验的探究[ J] . 化学教学,2003(6) :9-10.
[13] 张婉莹,张贤金,吴新建,郑瑛. 跨学科设计氢氧化亚铁制备实验[J]. 化学教学,2023(2):60-64.
[14] 石月,李悦迪,王喜贵. 玻璃板上氢氧化亚铁的制备及转化[ J] . 化学教学,2022(6) :81-84.
( 责任编辑:加顺花)

