防护风镜对眼爆震伤诱导视网膜病理损伤和自噬变化的有效改善



















摘要: 首先基于头部动态测试系统与激波管和外场实弹实爆测试环境,验证了眼部装备(护目镜和风镜)的防护性能。研究结果表明,风镜防护性能更优,建议给执勤人员配发兼容防紫外、强光、烟雾和防破片功能的风镜产品,以提高相关人员眼部防护能力。此后,研究眼部爆震伤后组织损伤、功能改变及市售风镜动物实验版的防护作用与机制,为防治眼部爆震伤及风镜后续的设计改进提供理论依据。选用比格犬和C57 小鼠进行相关动物实验,通过HE、Tunel、Nissl 染色、视觉电生理检查等检测方法,发现随着冲击波强度的提高和伤后时间的延长,视网膜损伤程度和细胞凋亡程度均提高, 其中神经节细胞层( ganglion cell layer, GCL) 和光感受器内外节交界处( layer of photoreceptorinner/outer segments, IS/OS)受到的损伤最严重;进一步研究分子变化发现,自噬相关调节蛋白SQSTM1/p62(P < 0.000 1)和LC3-Ⅱ(P = 0.843 7)、LC3-Ⅰ(P = 0.003)的表达量明显增高,说明视网膜损伤一定程度上是由爆震伤后自噬增强这一机制导致的。市售风镜的动物实验版能够有效减轻冲击波对视网膜的损伤,保护RNFL、INL/ONL、GCL 和IS/OS 的结构。同时,与其他组相比,3.5 MPa 组防护组与损伤组视网膜损伤和细胞凋亡程度差异最显著,推测该强度下防护风镜发挥了最大的保护作用,保护机制与防护降低视网膜细胞自噬相关。
关键词: 比格犬;眼部爆震伤;防护风镜;视网膜;线粒体;自噬
中图分类号: O389 国标学科代码: 13035 文献标志码: A
21 世纪以来,随着科技的快速发展及世界范围内热点地区冲突不断,爆炸性恐怖袭击、军事冲突、工业事故等所引起的爆震伤事件频频发生,爆震伤对人体健康的威胁日益凸显。眼球作为身体内最重要、复杂、脆弱的器官之一,极易受到冲击波的损伤[1-3]。由于眼球结构的特殊性,多种类型的爆震性损伤均能对其造成伤害,如:初级及三级爆震性损伤可造成眼球破裂,二级爆震性损伤可导致眼部穿通伤或贯通伤,而混合爆震性损伤还可以导致眼部烧伤。美军对战场伤亡的数据分析显示,20% 的士兵在伊拉克和阿富汗战争中经历了头面部损伤,其中83.3% 是由爆炸造成的[4-6]。有调查显示,爆炸冲击波可以造成眼部结构破坏,直接影响超过半数执勤人员的战斗能力。既往研究[7-9] 显示,当冲击波超压峰值达到120~210 kPa 时,即可引起小鼠视力显著下降,甚至失明。近年来,越来越多的研究人员开始关注爆震伤对眼部的影响及其防治策略,如何做好个体防护已成为当前研究的热点。既往研究[10] 证实,无论是军事行动中还是日常生活中,90% 的眼爆震伤都可通过正确佩戴个体防护装备得到有效防护。因此,外军特别是美军一直以来都非常重视执勤人员眼部防护技术的发展,陆续研制并装备了多款眼部防护产品[11-12]。2017-2018 年间,美军对现有防护眼镜(主要是护目镜和风镜)进行了优化升级,同时对其冲击波防护效果进行了评估,提示佩戴防护镜可提高眼部防护能力,有效减少战斗减员[12-16]。
目前,国际上已有多个团队进行了眼部爆震伤的研究[17],但我国对眼爆震伤的损伤机制及其防护的相关研究仍然处于初级阶段。既往虽然对视觉系统防护技术进行了一些初步研究,但对基于眼部防护产品的生物体视觉系统致伤机理和防护机制并未进行深入研究。因此,希望通过本研究深入了解爆震伤对眼部视网膜损伤的影响及机制,为防护措施和治疗策略的研究提供基础数据和理论支持。本文中,首次建立结合眼部防护设备的动物爆震伤冲击模型,同时针对爆炸冲击致生物体视觉系统防护“后效应”开展组织损伤和机能障碍改变研究,从而为防、治爆炸冲击致视觉系统损伤提供理论依据,为我国眼部防护及相关设备的研发与优化提供参考。
1 实验方法
1.1 基于物理模型的防护产品对比测试
分别基于外场实弹实爆环境和激波管实验平台,开展眼部防护装备冲击波防护性能测试,具体实验条件描述如下。
1.1.1 外场实弹实爆环境
实验中采用7 kg TNT 裸装炸药球,在距离爆炸中心3.8 m 处布放仿真物理头部模型开展眼部防护装备考核评测。经初步计算[18] 可知,7 kg TNT 当量炸药爆炸,在3.8 m 半径距离上,产生的冲击波超压峰值约为200 kPa。
1.1.2 激波管实验环境
基于中国科学院力学研究所的高温燃气激波管,构建超压峰值为100~300 kPa、持续作用时间为1~5 ms 的冲击波作用环境。
1.1.3 防护产品
本实验中,护目镜和风镜均选用市售个体防护成熟产品,具体外形结构见图1。头部测试系统与激波管实验平台已在前期工作中进行了详细介绍[19],利用玻璃钢手糊成型、具有中国人体尺寸的头部模型作为承载平台,分别在激波管环境和外场实弹实爆环境下对眼部防护产品的冲击波防护性能进行考核并提出合理的现场防护建议措施。
1.2 BST-Ⅰ型生物激波管
采用陆军特色医学中心研制的生物激波管开展冲击致伤试验[20]。激波管全长39.0 m,由驱动段、扩张段、过渡段、试验段、消波段及附属设备、空气压缩机、高压气罐等组成,采用双夹膜结构。驱动段长1.41 m,内径为0.348 m;扩张段长1.0 m,内径为0.348~1.000 m;过渡段和试验段共长24.0 m,消波段长11.0 m,内径为1.0 m。夹膜采用4 mm × 4 mm 的铝制膜片。
当激波管驱动段压力设置为3.5、4.0、4.5 和5.5 MPa 时,在实验动物所放置位置处,空气流场的超压峰值分别约为350、400、450 和550 kPa。
为了深入了解爆震伤对眼部的具体影响,本实验中首先选用比格犬作为实验对象,模拟人体环境,初步明确爆震伤对眼部的具体影响,进而选用小鼠进行机制的研究。所有实验均经过道德伦理测试,伦理审查编号为IACUC – 20241337。
1.3 比格犬及分组
1.3.1 不同冲击波强度
雄性比格犬10 只。设置激波管驱动段压力分别为3.5、4.0、4.5 和5.5 MPa 进行爆炸冲击致伤试验,其中4.5 MPa 试验组4 只比格犬,其余每组2 只比格犬。试验时,试验犬1 只眼睛佩戴市售风镜动物实验版进行防护(定制与试验犬眼部结构相适配的风镜外框,配套采用与上述个体防护风镜产品结构、材料完全一致的镜片产品)作为防护组,另1 只眼睛呈暴露状态作为对照组。3.5、4.0 和5.5 MPa 组爆震伤后3 h 取样,4.5 MPa 组试验犬爆炸后分别在3 和6 h 取样。爆炸时,麻醉比格犬头部及四肢固定于特质金属架,固定方向为鼻侧朝向激波管驱动端,金属架置于距离激波管试验段末端挡板前10 cm 处,末端呈封闭状态。共收集10 组眼球标本,随后进行HE、Tunel 与Nissl 染色,观察其视网膜各层的结构改变。
1.3.2 4.5 MPa 激波强度
雄性比格犬6 只,设置激波管驱动段压力为4.5 MPa 开展爆炸冲击致伤试验。对每只比格犬左眼进行防护,防护方法与1.3.1 节中相同,于爆震伤后3 h 取样。共收集6 组眼球标本,随后进行HE、Tunel 和Nissl 染色,观察其视网膜各层的结构改变。
1.4 C57/B6J 小鼠及分组
雄性C57/B6J 小鼠共30 只,将每只C57/B6J 小鼠用1% 戊巴比妥钠麻醉后单独放入固定笼位中,小鼠在笼中不能转身,将固定笼的方向调整为鼻侧朝向激波管驱动段,固定笼置于固定架上,并将固定架置于距离激波管试验段末端挡板前10 cm 处,末端呈封闭状态。试验时,激波管驱动段压力分别设置为4.5 和3.5 MPa。因小鼠头部体积过小,无法对其单眼进行有效防护,因此利用驱动段压力3.5 MPa 作为防护组,4.5 MPa 作为损伤组。共收集30 组眼球标本,进行HE、Tunel 和Nissl 染色,观察其视网膜各层的结构改变。
1.5 Tunel 染色
Tunel 染色是一种用于检测细胞凋亡中DNA 片段化的常用技术,用于实现对细胞凋亡的定性和定量分析,其分析指标包括荧光强度和细胞凋亡数目等。将比格犬和小鼠的眼球石蜡切片在二甲苯中脱蜡5~10 min。换用新鲜的二甲苯,再脱蜡5~10 min。无系列乙醇(100%、95%、85%、75%)复水,每梯度3 min。蒸馏水浸泡2 min。滴加20 μg/ml 不含DNase 的蛋白酶K,20~37 ℃ 作用15~30 min。PBS洗涤3 次。根据试剂盒说明书配制适当量的TUNEL 检测液(碧云天,C1090),在样品上加50 μl TUNEL检测液,37 ℃ 避光孵育60 min。PBS 或HBSS 洗涤3 次。用抗荧光淬灭封片液封片后荧光显微镜下观察。
1.6 HE 染色
视网膜HE 染色是一种常用的组织学染色技术,用于观察视网膜组织的形态结构,其分析指标包括视网膜的层次结构、各层厚度、细胞数量和排列以及病理变化等。将比格犬和小鼠的眼球石蜡切片在二甲苯中脱蜡5~10 min。换用新鲜的二甲苯,再脱蜡5~10min。系列乙醇(100%、95%、85%、75%)复水,每梯度3 min。蒸馏水浸泡2 min。苏木素染液染色10 min,蒸馏水洗去浮色。分化液分化10~60 s,自来水滴加或浸洗2 次,每次3~5 min。置伊红染液90 s,倾去多余染色液后快速脱水。脱水,透明,封片后观察。
1.7 Nissl 染色
Nissl 染色是一种用于显示细胞内结构的组织学染色技术,其敏感指标包括细胞核染色、阳性细胞数、尼氏小体的形态和分布等。将比格犬和小鼠的眼球石蜡切片在二甲苯中脱蜡5~10 min。换用新鲜的二甲苯,再脱蜡5~10 min。系列乙醇(100%、95%、85%、75%)复水,每梯度3 min。蒸馏水浸泡2 min。用尼氏染色液(甲苯胺蓝法)置于50~60 ℃ 温箱浸染20~40 min。蒸馏水漂洗切片。95% 乙醇迅速分化。无水乙醇脱水,二甲苯透明,中性树胶封固后观察。
1.8 电镜
视网膜电镜检查多用于观察视网膜细胞的超微结构,包括自噬溶酶体等各种细胞器、吞噬泡等各类膜性结构等。将比格犬和小鼠的眼球标本在2.5% 的戊二醛溶液中4 ℃ 固定过夜,然后按下列步骤处理样品:倒掉固定液,用浓度为0.1 M(即0.1 mol/L)、pH=7.0 的磷酸缓冲液漂洗样品3 次,每次15 min;用1% 的锇酸溶液固定样品1~2 h;倒掉固定液,用浓度为0.1 M、pH=7.0 的磷酸缓冲液漂洗样品3 次,每次15 min;用梯度浓度(50%、70%、80%、90% 和95%)的乙醇溶液对样品进行脱水处理,每种浓度处理15 min,再用100% 的乙醇处理一次,每次20 min;最后过渡到纯丙酮处理20 min;用包埋剂与丙酮体积比为1∶1 的混合液处理样品1 h;用包埋剂与丙3 酮体积比为3∶1 的混合液处理样品3 h;纯包埋剂处理样品过夜;将经过渗透处理的样品包埋起来,70 ℃ 加热过夜,即得到包埋好的样品。样品在Reichert 超薄切片机中切片,获得厚度为70~90 nm 的切片,该切片经柠檬酸铅溶液和醋酸双氧铀50% 乙醇饱和溶液各染色15 min,即可在透射电镜中观察。
1.9 视觉电生理检查
提前12 h 对大鼠进行暗适应,在标准暗室红光环境下,使用法国迈威视觉电生理检查仪参照ISCEV 国际标准进行视觉电生理检查。具体操作步骤如下:常规麻醉(3 mL/MPa 1% 戊巴比妥钠 +50 μL50% 速眠新)及复方托比卡胺滴眼液散瞳后,将麻醉好的小鼠置于电生理操作台上固定,滴入1~2 滴盐酸奥布卡因滴眼液进行眼球表面麻醉,随后安放电极依次进行视网膜电图(electroretinogram, ERG)和视觉诱发电位(visual evoked potential, VEP)的检测。将ERG 作用电极(Ag-Cl 环状电极)放于角膜上,参考电极(不锈钢针状电极)插入小鼠脸颊皮下,接地电极(不锈钢针状电极)插入小鼠尾部皮下。VEP 记录电极均为不锈钢针状电极,作用电极置于两耳连线中心皮下,参考电极和接地电极位置同ERG 作用电极。ERG 结果分析时选取暗适应3.0 反应b 波幅值、明适应3.0 反应b 波幅值和OPS 反应的O2 波幅值。VEP 结果分析时选取P2 波峰时值和幅值。
1.10 WB 检测
取新鲜比格犬或小鼠的视网膜组织放于100 mL 裂解液中,置于冰上裂解1 h,取2 μL 用BCA 试剂盒检测蛋白浓度,按照标准公式计算样品上样量。将25 mL 5xloading buffer 加入含有脑组织的裂解液中,100 ℃ 水浴10 min,12 000g 离心15 min,取上清用于检测。在12% 的分离胶和5% 的浓缩胶中进行蛋白电泳,每孔上样蛋白总量为30 μg,按恒压80 和120 V 分别跑浓缩胶和分离胶。恒压110 V 电转至PVDF 膜,5% 牛血清白蛋白封闭1 h。一抗根据试剂商说明书稀释浓度用1xTBST 进行稀释后4 ℃ 过夜。对应种属二抗孵育1 h 后凝胶成像设备曝光。
1.11 数据处理
在分子生物学实验中,每只小鼠进行3 次技术重复实验,并对数据求平均值。每组的3 个平均值用于组间统计比较。
在病理实验中,每组3 只小鼠的一个切片在免疫荧光激光共聚焦显微镜下观察,从每个切片中随机选择3 个视野以定量检测指标,并对数据进行平均。每组得到的3 个平均值用于组间统计比较。
1.12 统计学分析
统计分析采用Prism 软件9.0 版。每组的所有值均以平均值±标准差表示。根据方差的齐性,选择使用参数和非参数检验。根据不同的比较情况,使用Student t 检验或单因素方差分析以及Sidak 或Turkey 的多重比较检验来分析统计差异。P<0.05 表明差异有统计学意义。
2 实验结果与分析
2.1 基于物理模型的防护产品对比测试结果分析
2.1.1 激波管测试环境
太阳镜和风镜的防护性能测试实验装置如图2 所示,对照组为无眼部防护装备(裸头模)。图3 为了3 种不同防护状态下的实验结果。由图3(a) 可知,在裸头模、佩戴太阳镜和风镜的测试条件下,喷管出口处传感器测试3 次试验所得冲击波波形基本一致,超压峰值分别为192、203 和206 kPa。所有数据至少重复测量3 次。对比3 种不同状态头模测试结果可知(图3(b)),佩戴太阳镜和风镜可实现对眼部的有效防护,超压峰值分别由397 kPa 下降至约311 和166 kPa,且风镜的防护效果更佳。
2.1.2 外场实弹实爆环境
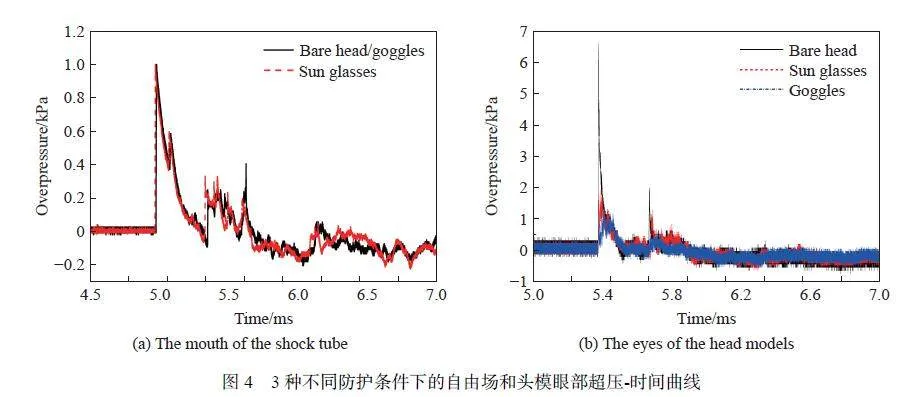
图4 为在外场实弹实爆考核测试环境下,裸头模、佩戴太阳镜和风镜头模的防护性能测试结果。其中,图4(a) 为自由场所测超压-时间(Δp-t)曲线,图4(b) 为裸头模、佩戴护目镜和风镜头模所测超压-时间(Δp-t)曲线。由图4 可知,佩戴太阳镜和风镜可有效保护执勤人员眼部免受爆炸冲击伤害,且风镜的防护效果明显优于护目镜。与裸头模相比,佩戴护目镜后,头模眼部爆炸冲击波超压峰值下降72.2%,佩戴风镜后下降约80%,该测试结果与激波管测试结果一致。所有数据至少重复测量3 次。因此,结合实际训练、演训情况,建议给执勤人员队配发兼容防紫外、强光、烟雾和防破片功能的风镜防护产品。
2.2 生物体防护效应分析
本研究中同时选用比格犬和小鼠建立了动物爆炸冲击波损伤模型。比格犬在生理结构、代谢途径和遗传背景等方面与人类更接近;且大动物模型可以模拟爆炸冲击波损伤的复杂性和多样性,可更深入地研究疾病的发病机制、病理变化、疾病进程以及防治措施。为使实验结果更具有真实性和可靠性,选用小鼠建立爆炸冲击波损伤模型进行结果验证。
2.2.1 爆炸冲击波对比格犬视网膜病理形态学的影响
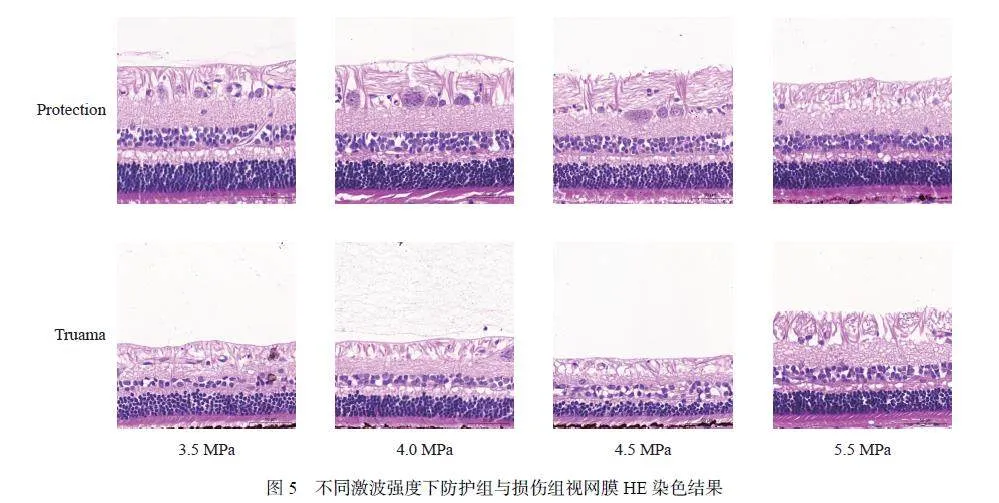
为了观察爆炸冲击波对比格犬视网膜病理形态学的影响,本研究中采用了HE 染色法(图5)。与防护组相比,损伤组的视网膜神经纤维层(retinal nerve fiber layer,RNFL)和内外核层(inner nuclear layer/outer nuclear layer,INL/ONL)厚度均减小(图6)。其中,INL 厚度减小最显著,提示其可能对冲击波损伤最敏感。试验结果同时提示,视网膜损伤程度与冲击波强度正相关。但值得注意的是,5.5 MPa 组视网膜损伤程度最低,不排除与动物个体差异相关。同时,3.5 MPa 组与其他组相比,防护前后视网膜厚度差异最大,可知该强度下防护发挥了最大的保护作用。5.5 MPa 组视网膜厚度差异最小,由于实验犬数量有限,不除外与实验动物个体差异性有关,因此进一步选用雄性C57/B6J 小鼠进行了相关实验的验证。
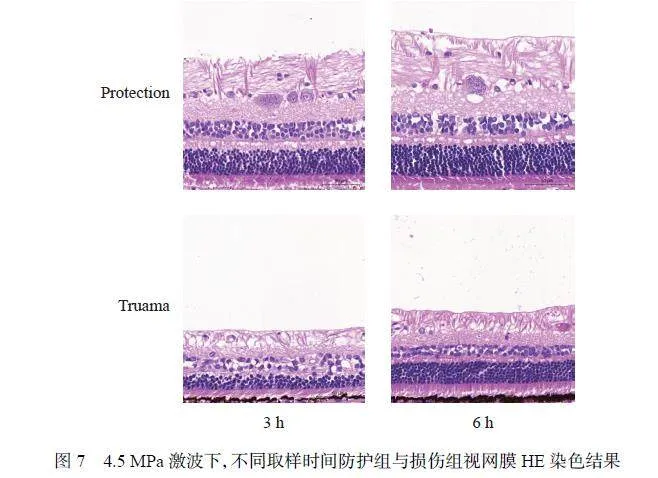
HE 结果(图7)显示,防护组的RNFL、INL 和ONL 厚度均大于损伤组,说明市售风镜动物实验版可有效减轻冲击波对视网膜的损伤。此外,在4.5 MPa 测试条件下,与冲击波损伤3 h 相比,6 h 实验组的INL 和ONL 组织较厚,如图8(a)~(b) 所示,提示可能在急性损伤后,视网膜有一定程度的恢复。此外,分别计算了3 h 实验组和6 h 实验组的INL/ONL 比值(图8(c)),发现该比值随着时间的推移而增大,且损伤组的增大幅度更大。这是由于INL 相对于ONL 具有更快的恢复能力。
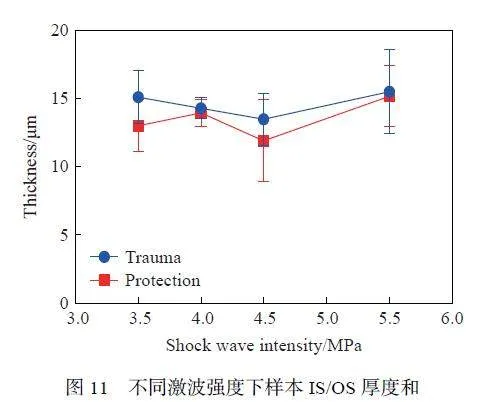
为了检测冲击波对视网膜细胞凋亡的影响,采用Tunel 染色法,将凋亡细胞标记为绿色荧光(图9~10)。由图9 可以看出,在不同强度的冲击波损伤后,损伤组的RNFL、INL 和ONL 厚度均低于防护组,说明防护措施有效地保护了视网膜细胞免受凋亡。在各个视网膜层中,发现光感受器内外节交界处(inner segment/outer segment,IS/OS)的凋亡信号最强烈,表明光感受器细胞(photoreceptor)可能对冲击波损伤最敏感靶点,凋亡细胞最多。进一步测量IS/OS 层的厚度(图11),分析发现,经过不同强度的冲击波损伤后,损伤组IS/OS 层的厚度小于防护组。这说明冲击波可能导致了IS/OS 层细胞的凋亡。其中,3.5 MPa 损伤组IS/OS 层与防护组相比,差异最显著,推测在该强度下视网膜防护措施发挥了最大的作用。
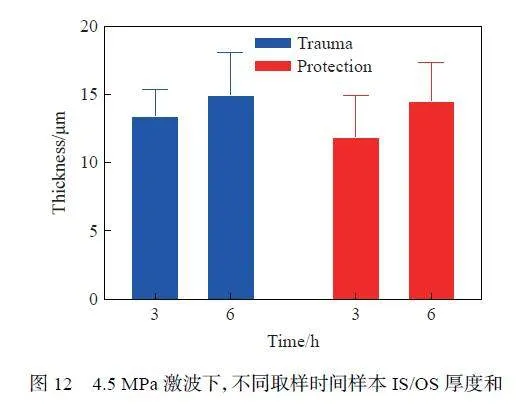
对4.5 MPa 测试条件下爆炸后不同时间点的防护组和损伤组的IS/OS 厚度(图10)进行了测量和统计分析,结果(图12)显示,该值随着时间的推移而增大,表明感光细胞整体有一定的恢复能力。相比于损伤组,防护组的IS/OS 值增大更明显,说明实验防护措施的保护作用不仅体现在直接降低视网膜的损伤程度,也体现在保护视网膜的修复潜力。
2.2.2 爆炸冲击波对比格犬视网膜RGCs 的影响
HE 染色结果(图5 和7)显示,冲击波损伤后3 h 与6 h 组RNFL 厚度没有明显变化,提示冲击波会对RNFL 造成的不可逆损伤,可能与视网膜神经节细胞不可再生的特征相关。使用与通过视乳头相邻的切片,以尽量减少视网膜厚度和位置的变化。对每只动物至少有2 个切片的计数取平均值。每张染色切片自视乳头起,于50×放大倍数平均取8 个区域,定义为单位视野。对单位视野下视网膜中RGC 数量进行统计,该结果与损伤组单位视野下的RGC 数量减少相吻合(图13),说明冲击波对神经节细胞层及其突触均造成了一定损伤。同时,也发现在4.5 MPa 测试条件下,相对3 h 实验组而言, 6 h 实验组RGC 的数量并不会随着爆炸后时间的延长而恢复,而是呈现稳定的状态(图14),与RNFL 厚度的变化趋势相似。这可能是由于RGC 及其轴突对冲击波损伤的修复能力较差,或者是其损伤机制与其他细胞不同导致。
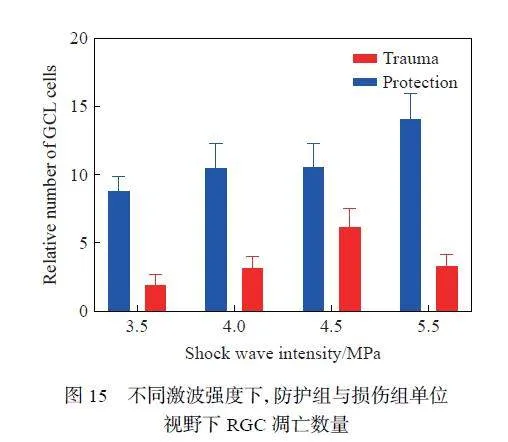
通过Tunel 染色法,对不同强度冲击波损伤后,各组视网膜单位视野下RGC 的凋亡数量进行了量化(图15),发现不同激波强度下,损伤组的RGC 凋亡数量均显著大于防护组(P < 0.001),说明防护措施对RGC 层具有较强的保护能力。对4.5 MPa 测试条件下爆炸后不同时间点的防护组和损伤组单位视野下各组RGC 的凋亡数量进行了量化(图16),结果显示,相比于损伤组,防护组RGC 的凋亡数量随时间变化更显著(P = 0.000 3),凋亡细胞数目逐渐减少趋于正常值,这也表明防护措施不仅可以减弱冲击波对视网膜细胞的即时损伤,还在一定程度上稳定了视网膜细胞的保护和修复能力。还对单位视野下各组凋亡细胞总数进行了量化(图17),结果显示,不同激波强度下,损伤组的细胞凋亡总数均大于防护组,说明防护措施在整体上对视网膜全层起到了防护作用。
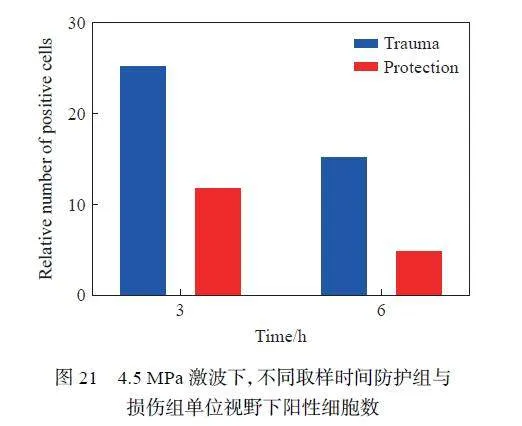
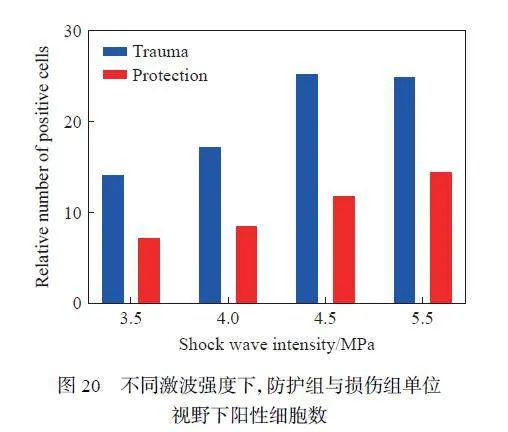
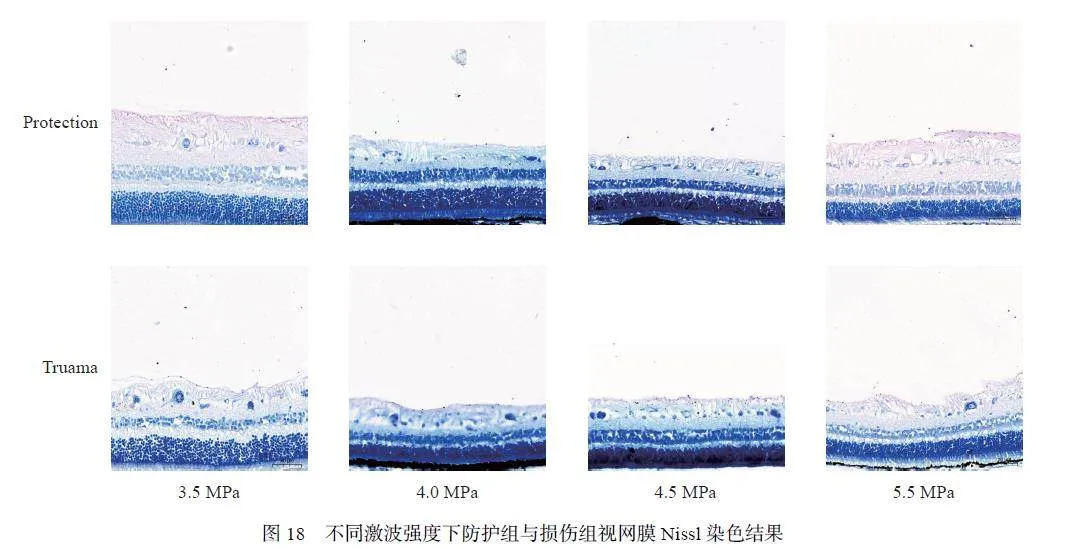
为了进一步检测冲击波对RGC 损伤情况的影响,采用了Nissl 染色法,结果如图18~19 所示,可以发现:在不同强度的冲击波损伤后,与损伤组相比,防护组的神经节细胞层(ganglion cell layer, GCL)厚度均大于损伤组,这与之前HE 染色的结果一致。统计了单位视野下视网膜GCL 的阳性细胞数,结果如图20 所示,可以看出,不同激波条件下,防护组的阳性细胞数均少于损伤组。同时,对4.5 MPa 测试条件下爆炸后不同时间点的防护组和损伤组的阳性细胞数进行统计,结果如图21 所示,可以看出,损伤组与防护组的阳性细胞数均随时间减少趋于正常值(P < 0.05)。这说明防护措施对RGC 具有一定的保护作用。
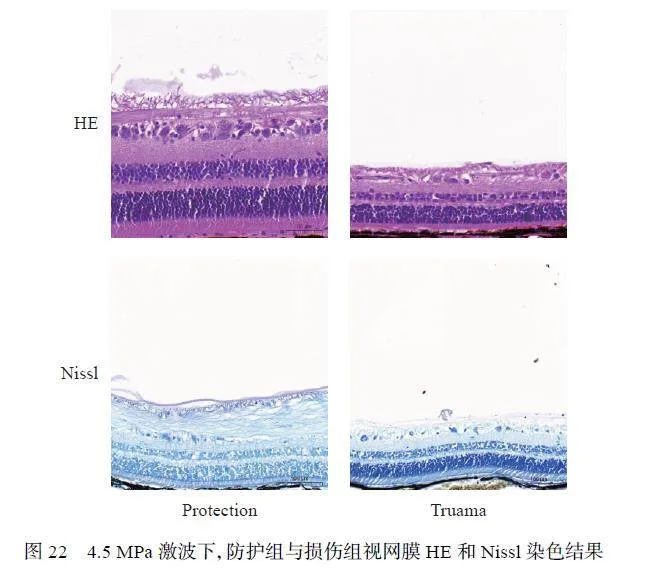
2.2.3 4.5 MPa 激波下,爆炸冲击波对比格犬视网膜的影响
为了进一步提升实验结论的真实性与可靠性,在4.5 MPa 测试条件下开展了后续实验。HE 染色结果(图22)显示,保护组的INL 厚度与ONL 厚度都明显大于防护组(图23,df 为自由度)。对单位视野下视网膜中RGC 数量进行统计(图24(a)),损伤组中的RGC 数目明显小于防护组。Nissl 染色结果(图22)显示,损伤组单位视野下视网膜GCL 的阳性细胞数大于防护组(图24(b))。差异均具有统计学意义。Tunel 检测结果(图25)显示,防护组中视网膜的GCL 层凋亡细胞数量相比较损伤组显著下降。
2.2.4 爆炸冲击波对小鼠视网膜病理形态学的影响
在小鼠冲击波损伤后第3 天,对防护组和损伤组小鼠视网膜组织进行了相关指标的检测,检测结果如图26 所示。HE 和Nissl 染色结果显示损伤组小鼠的视网膜中,内网层(inner plexiform layer, IPL)、INL、外网层(outer plexiform layer, OPL)以及ONL 细胞厚度明显小于防护组,防护组的小鼠总体视网膜厚度大于损伤组,差异具有统计学意义,提示市售风镜动物实验版能有效保护视网膜。
2.2.5 爆炸冲击波对小鼠视网膜细胞凋亡的影响
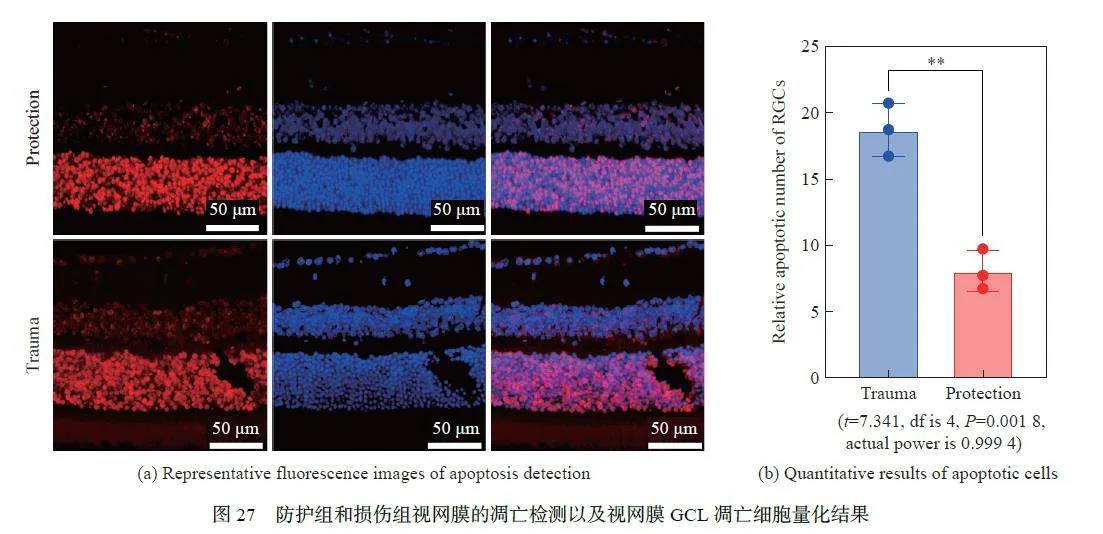
Tunel 检测结果显示,防护组中视网膜的GCL 层凋亡细胞数量相比较损伤组显著下降(P = 0.001 8),如图27 所示。而视网膜中INL、ONL、IPL、OPL 及色素上皮层(retinal pigment epithelium layer)中的凋亡细胞未观察到组间差异。该结果可能与RGC 细胞及其轴突不可再生相关,而视网膜其他细胞可能在损伤后存在修复可能。
2.2.6 爆炸冲击波对小鼠视网膜视觉功能的影响
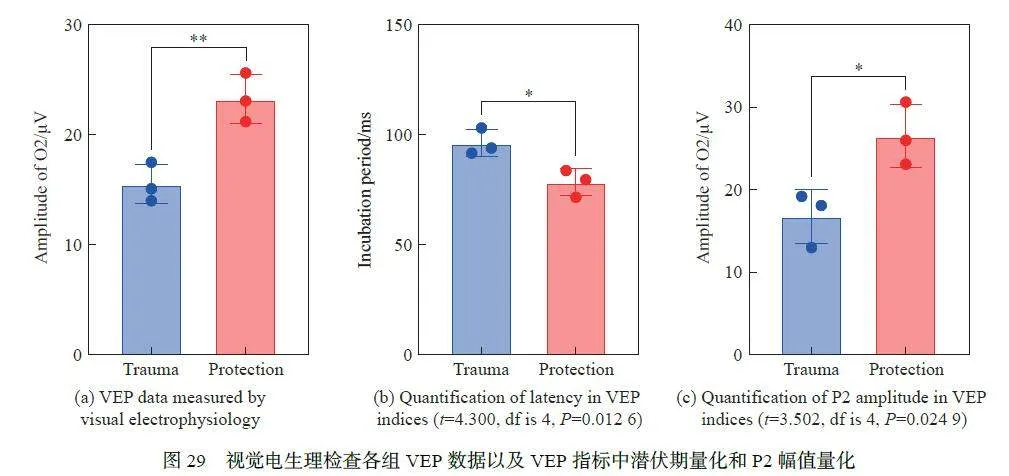
对小鼠3 d 后的视觉电生理进行了检查,发现防护组Ops 中的O2 幅值增加(P = 0.007 4)(图28),表明防护组的视网膜内层功能状态改善;VEP 的潜伏期缩短(P = 0.012 6)(图29(a)~(b))以及VEP 中的P2 幅值增加(P = 0.024 9)(图29(c)),表明防护组视觉通路健康状况改善;与损伤组相比差异具有统计学意义,说明防护组的小鼠视觉功能明显优于损伤组小鼠。
2.2.7 爆炸冲击波对小鼠视网膜细胞自噬情况的影响
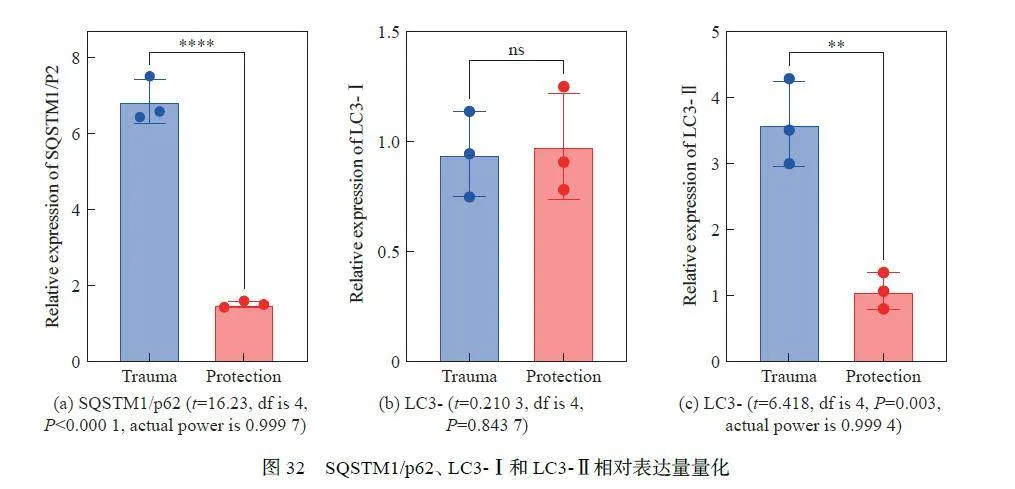
此外,还通过电镜技术进一步检测了损伤后视网膜细胞中的自噬情况,发现与防护组比较,损伤组RGC 中胞浆成分已降解的单层膜自噬溶酶体和有包绕胞浆成分的多层膜吞噬泡数量明显增多(图30),该结构为细胞自噬后形成,其数量可以用来衡量细胞内自噬现象的程度;自噬相关调节蛋白SQSTM1/p62(P < 0.000 1)和LC3-Ⅱ (P = 0.843 7)、LC3-Ⅰ (P = 0.003)的表达量明显增高,差异具有统计学意义(图31~32,图32(b) 中ns 表示不显著)。SQSTM1/p62 和LC3-Ⅱ、LC3-Ⅰ的表达量变化反映了细胞自噬活动的状态。在自噬活性正常时,SQSTM1/p62 和LC3-Ⅱ的水平会受到调控,不会异常积累。而在自噬过程受阻或增强时,这些蛋白的表达量可能会上升,从而影响细胞内环境的稳定。提示冲击波损伤可以造成视网膜细胞自噬,同时与防护组比较,损伤组中小鼠的RGC 自噬现象增强,防护组视功能较好可能与防护后RGC 自噬程度较低相关。
3 讨 论
作为重要的单兵防护装备,军用眼镜能有效抵御战场强光、沙尘、破片等多重威胁,更重要的是,军用眼镜作为眼部爆震伤的防护装置,已经在世界范围内得到了广泛使用。为了评估防护产品对眼部的防护能力及其防护机制,本实验中采用陆军特色医学中心研制的BST-Ⅰ型生物激波管,该激波管具有工作效能高、损伤程度可控等优势,可有效制作眼部爆震伤模型[19, 21-23],同时分别选用比格犬和小鼠作为被试动物,对市售护目镜和风镜两款防护产品进行抗冲击波防护性能测试,对其防护性能进行对比分析。研究发现,对于眼部爆震伤的防护,风镜的防护性能更优,其可能通过减少爆震波对眼部的直接冲击力、缓和压力波的冲击,保护眼部免受伤害。
本研究使用的市售风镜动物实验版,其特点是能够全包围眼部区域,避免爆炸波从间隙处进入,并且能够缓冲爆炸波对眼部的冲击。在本模型中,爆震伤虽然未对眼部外形未造成严重伤害,但对视网膜的结构造成了显著影响,影响了眼部功能。实验结果显示,该防护眼镜能够显著降低爆炸波对视网膜神经元的损伤程度,尤其是对GCL 的保护效果最明显。同时,随着冲击波强度的提高和爆炸后时间的延长,视网膜组织中其他多种细胞及结构均受损,细胞凋亡程度均提高,其中GCL 和IS/OS 受到的损伤最严重;而视网膜细胞也出现了较严重的自噬现象。此外,相比其他组,在3.5 MPa 测试条件下的损伤组视网膜厚度和细胞凋亡程度差异最显著,推测该强度下防护风镜发挥了最大的保护作用,可能与防护组视网膜细胞自噬减少相关。
推测该防护风镜可能通过以下机制实现其保护作用:(1) 通过吸收、分散和减少冲击能量,减少爆炸波对眼部区域的直接冲击作用,缓冲爆炸波对眼球表面的冲击力;(2) 降低爆炸超压对眼球内部结构的损伤,减轻视网膜各层的损伤;(3) 阻止爆炸波从眼周缝隙处进入眼球内部,避免视网膜缺血、缺氧和继发性损伤。这在我们的实验中可以看出,市售风镜动物实验版能有效地减轻冲击波对视网膜的损伤,保护RGC、RNFL、INL/ONL、GCL 和IS/OS 层结构的完整性和功能。
本实验结果显示,冲击波损伤眼部后,视网膜感光细胞层出现了较明显的病理改变。我们发现,当色素上皮完整性丧失、视紫红质的缺失与错定位和锥体细胞严重受损时,会出现与本实验类似的Tunel染色结果[24]。根据以往的研究,光感受器内段含有大量线粒体,视网膜超微结构改变显示,爆震伤后0.5 h,光感受器细胞的内节线粒体出现肿胀变性,外节盘膜也呈现紊乱、稀疏的状态。所以可以推测,IS/OS 层检测到的高荧光强度很可能与线粒体的变化有关。结合本次小鼠实验,发现损伤组胞浆成分已降解的单层膜自噬溶酶体和有包绕胞浆成分的多层膜吞噬泡数量明显增多;同时自噬相关调节蛋白SQSTM1/p62 和LC3-Ⅱ/LC3-Ⅰ的表达量明显降低。这表明爆炸冲击波可造成视网膜中以IS/OS 层为主的线粒体自噬现象增强。色素上皮层富含色素于抗氧化剂,具有保护和抗氧化功能。并且色素上皮层中的线粒体氧化应激可导致色素上皮层和视网膜光感受器的代谢功能障碍[25]。所以,可以推测爆炸冲击波也作用于色素上皮层导致其氧化应激,进而促进IS/OS 层的线粒体自噬现象。
本研究虽然取得了一定成果,但仍有不足之处,需要继续在今后的工作中改进。首先,本研究的实验动物主要是以小型哺乳动物,如鼠类为主,而人类与之在生理结构和反应机制上存在差异。本研究的实验结果可能无法完全套用到人类身上,因此需要进一步对人类研究进行实证支持。此外,爆震对眼部的损伤程度也会受到实验环境、爆炸距离、动物的身体状况等多种因素的影响。这些因素的变化可能会对实验结果产生影响。这方面的未尽之处也需要在未来的研究中得到改善和完善。其次,本研究主要关注的是外界压力对眼球结构的影响,但并未深入研究爆震伤对视功能的影响。另外,本研究主要关注的是爆震创伤及影响,而对于创伤后的康复过程和治疗方法并未详细探讨。对于如何提高爆震伤康复的效率,如何降低爆震对眼部的长期影响等问题值得在未来的研究中深入探讨。总之,虽然本研究取得了一定的进展,但仍有许多未尽之处需在未来的研究中继续深入。因此,今后的工作中需要从更多的角度和指标来系统性评价防护眼镜对冲击波的防护作用,并对其进行更全面的优化和改进,以提高其防护性能和适应性能,为爆震伤眼部防护和创伤恢复提供更多更准确的科学依据。
4 结 论
首先,基于头部动态测试系统与激波管和外场实弹实爆测试环境,验证了护目镜和风镜的防护性能。研究表明,风镜防护冲击波的性能更优,建议给执勤人员配发兼容防紫外、强光、烟雾和防破片功能的风镜产品,以提高相关人员眼部防护能力。然后,探索了视觉系统组织损伤和机能障碍改变及市售风镜动物实验版的防护作用与机制,选用比格犬和C57BL/6J 小鼠开展了相关动物实验,通过BST-I 型生物激波管制模后,采用病理、视觉电生理检查等测试方法,探究了冲击波伤后视网膜病理和功能改变,发现爆炸后视网膜损伤和细胞凋亡程度均提高,其中GCL 和IS/OS 受到的损伤最严重;视网膜细胞自噬现象较重。市售风镜动物实验版能够有效地减轻冲击波对视网膜的损伤,保护视网膜各层结构的完整性。同时,与其他组相比,3.5 MPa 强度下的实验组视网膜厚度和细胞凋亡程度差异最显著,推测该强度下防护眼镜发挥了最大的保护作用,可能与在防护作用下RGC 自噬现象降低有关。尽管,目前已经取得了一些关于眼部爆震伤损伤机制的重要突破,但仍然需要进一步的研究。随着技术的发展,期待未来能够采用更安全有效的防护设备和治疗手段,最终减少爆震伤对人体眼部的危害。
参考文献:
[1]DEMAR J, SHARROW K, HILL M, et al. Effects of primary blast overpressure on retina and optic tract in rats [J]. Frontiersin Neurology, 2016, 7: 59. DOI: 10.3389/fneur.2016.00059.
[2]WANG H C H, CHOI J H, GREENE W A, et al. Pathophysiology of blast-induced ocular trauma with apoptosis in the retinaand optic nerve [J]. Military Medicine, 2014, 179(S8): 34–40. DOI: 10.7205/MILMED-D-13-00504.
[3]CHOI J H, GREENE W A, JOHNSON A J, et al. Pathophysiology of blast-induced ocular trauma in rats after repeatedexposure to low-level blast overpressure [J]. Clinical amp; Experimental Ophthalmology, 2015, 43(3): 239–246. DOI: 10.1111/ceo.12407.
[4]TANIELIAN T L, JAYCOX L H. Invisible wounds of war: psychological and cognitive injuries, their consequences, andservices to assist recovery [M]. Santa Monica: Rand Corporation, 2008. DOI: 10.1176/ps.2009.60.2.273.
[5]Defense and Veterans Brain Injury Center. DoD numbers for traumatic brain injury worldwide: totals 2000–2013 (Q1-Q3)[EB/OL]. (2014-06-10)[2024-01-07]. http://dvbic.dcoe.mil/dod-worldwide-numbers-tbi.
[6]MAC DONALD C L, JOHNSON A M, WIERZECHOWSKI L, et al. Prospectively assessed clinical outcomes in concussiveblast vs nonblast traumatic brain injury among evacuated US military personnel [J]. JAMA Neurology, 2014, 71(8): 994–1002. DOI: 10.1001/jamaneurol.2014.1114.
[7]GOODRICH G L, FLYG H M, KIRBY J E, et al. Mechanisms of TBI and visual consequences in military and veteranpopulations [J]. Optometry and Vision Science, 2013, 90(2): 105–112. DOI: 10.1097/OPX.0b013e31827f15a1.
[8]BAILOOR S, BHARDWAJ R, NGUYEN T D. Effectiveness of eye armor during blast loading [J]. Biomechanics andModeling in Mechanobiology, 2015, 14(6): 1227–1237. DOI: 10.1007/s10237-015-0667-z.
[9]MOHAN K, KECOVA H, HERNANDEZ-MERINO E, et al. Retinal ganglion cell damage in an experimental rodent model ofblast-mediated traumatic brain injury [J]. Investigative Ophthalmology amp; Visual Science, 2013, 54(5): 3440–3450. DOI:10.1167/iovs.12-11522.
[10]JHA K N. Indian soldiers need eye protection [J]. Journal of Clinical and Diagnostic Research, 2017, 11(2): NE01–NE03.DOI: 10.7860/JCDR/2017/20792.9350.
[11]邹振高, 李俊红. 国外防护眼镜的现状与发展趋势 [J]. 中国个体防护装备, 2015(1): 29–31. DOI: 10.16102/j.cnki.cppe.2015.01.007.
ZOU Z G, LI J H. The current situation and development trend of foreign military protective eyewear [J]. China PersonalProtective Equipment, 2015(1): 29–31. DOI: 10.16102/j.cnki.cppe.2015.01.007.
[12]SUNDARAMURTHY A, SKOTAK M, ALAY E, et al. Assessment of the effectiveness of combat eyewear protection againstblast overpressure [J]. Journal of Biomechanical Engineering, 2018, 140(7): 071003. DOI: 10.1115/1.4039823.
[13]WILLIAMS S T, HARDING T H, STATZ J K, et al. Blast wave dynamics at the cornea as a function of eye protection formand fit [J]. Military Medicine, 2017, 182(S1): 226–229. DOI: 10.7205/MILMED-D-16-00042.
[14]PARVER L M. The national eye trauma system [J]. International Ophthalmology Clinics, 1988, 28(3): 203–205. DOI: 10.1097/00004397-198802830-00004.
[15]HORNBLASS A. Eye injuries in the military [J]. International Ophthalmology Clinics, 1981, 21(4): 121–138. DOI: 10.1097/00004397-198102140-00008.
[16]HILBER D J. Eye injuries, active component, U. S. Armed Forces, 2000–2010 [J]. Medical Surveillance Monthly Report,2011, 18(5): 2–7.
[17]蔡志华, 贺葳, 汪剑辉, 等. 爆炸波致颅脑损伤力学机制与防护综述 [J]. 兵工学报, 2022, 43(2): 467–480. DOI: 10.3969/j.issn.1000-1093.2022.02.025.
CAI Z H, HE W, WANG J H, et al. Review on mechanical mechanism of blast-induced traumatic brain injury and protectiontechnology [J]. Acta Armamentarii, 2022, 43(2): 467–480. DOI: 10.3969/j.issn.1000-1093.2022.02.025.
[18]杨亚东, 李向东, 王晓鸣. 爆炸冲击波空中传播特征参量的优化拟合 [J]. 爆破器材, 2014, 43(1): 13–18. DOI: 10.3969/j.issn.1001-8352.2014.01.004.
YANG Y D, LI X D, WANG X M. Optimum fitting for characteristic parameters of blast shockwaves traveling in air [J].Explosive Materials, 2014, 43(1): 13–18. DOI: 10.3969/j.issn.1001-8352.2014.01.004.
[19]康越, 张仕忠, 张远平, 等. 基于激波管评价的单兵头面部装备冲击波防护性能研究 [J]. 爆炸与冲击, 2021, 41(8): 085901.DOI: 10.11883/bzycj-2020-0395.
KANG Y, ZHANG S Z, ZHANG Y P, et al. Research on anti-shockwave performance of the protective equipment for thehead of a soldier based on shock tube evaluation [J]. Explosion and Shock Waves, 2021, 41(8): 085901. DOI: 10.11883/bzycj-2020-0395.
[20]王正国, 孙立英, 杨志焕, 等. 系列生物激波管的研制与应用 [J]. 爆炸与冲击, 1993, 13(1): 77–83. DOI: 10.11883/1001-1455(1993)01-0077-7.
WANG Z G, SUN L Y, YANG Z H, et al. The design production and application of a series of bio-shock tubes [J]. Explosionand Shock Waves, 1993, 13(1): 77–83. DOI: 10.11883/1001-1455(1993)01-0077-7.
[21]蒋建新, 曾灵. 肺爆炸冲击伤机制与防护研究进展 [J]. 陆军军医大学学报, 2022, 44(5): 395–398. DOI: 10.16016/j.2097-0927.202111179.
JIANG J X, ZENG L. Advance of protection and mechanism of lung blast injury [J]. Journal of Army Medical University,2022, 44(5): 395–398. DOI: 10.16016/j.2097-0927.202111179.
[22]唐承功, 杨志焕, 王正国, 等. BST-Ⅰ型生物激波管动物实验研究 [J]. 第三军医大学学报, 1989, 11(3): 172–174. DOI:10.3321/j.issn:1000-5404.1989.03.004.
TANG C G, YANG Z H, WANG Z G, et al. An experimental study on the effects of a biological shock tube [J]. Journal ofThird Military Medical University, 1989, 11(3): 172–174. DOI: 10.3321/j.issn:1000-5404.1989.03.004.
[23]冷华光, 王正国, 杨志焕, 等. 生物激波管及动物耐受性的实验研究 [J]. 爆炸与冲击, 1993, 13(3): 272–279. DOI:10.11883/1001-1455(1993)03-0272-8.
LENG H G, WANG Z G YANG Z H, et al. A biological shock tube and an experimental study on animal tolerance to blastwave [J]. Explosion and Shock Waves, 1993, 13(3): 272–279. DOI: 10.11883/1001-1455(1993)03-0272-8.
[24]SUDHARSAN R, SIMONE K M, ANDERSON N P, et al. Acute and protracted cell death in light-induced retinaldegeneration in the canine model of rhodopsin autosomal dominant retinitis pigmentosa [J]. Investigative Ophthalmology andVisual Science, 2017, 58(1): 270–281. DOI: 10.1167/iovs.16-20749.
[25]BROWN E E, DEWEERD A J, ILDEFONSO C J, et al. Mitochondrial oxidative stress in the retinal pigment epithelium(RPE) led to metabolic dysfunction in both the RPE and retinal photoreceptors [J]. Redox Biology, 2019, 24: 101201. DOI:10.1016/j.redox.2019.101201.
(责任编辑 张凌云)
基金项目: 陕西省自然科学基础研究计划重点项目(2023-JC-ZD-48);空军军医大学军事医学提升计划(2021JSTS14);西京医院医务人员培养交叉融合专项(XJZT24JC39)

