科学家开发智能计算生物医学显微成像技术提升成像精度和信息获取能力
近日,浙江大学刘智毅研究员、刘文杰博士合作课题组开发定量智能计算成像(ADQ)框架,该框架提供了一种生物医学显微成像的新范式,通过智能计算辅助传统光学显微镜帮助科学家找回数据中错失的信息。
自埃里克·白兹格等相关学者于2014年获得诺贝尔化学奖以来,超分辨显微成像技术近十年得到了蓬勃发展,大量新技术不断涌现,突破现有技术的成像分辨率、速度、深度等限制。但是每种技术均有其优缺点和适用范围,选择哪一种技术应对特定的问题是科学家们的困扰之一。
此外,超分辨显微成像技术的发展最终服务于相关生物应用,但是如何将技术发展和生物应用更紧密地结合,帮助生物学家更好地观察、发现和解释新现象,仍然是长期以来的难题。
面对上述问题,ADQ框架通过智能计算辅助传统光学显微镜充分挖掘潜藏的生物学信息,更好地助力生物学应用。
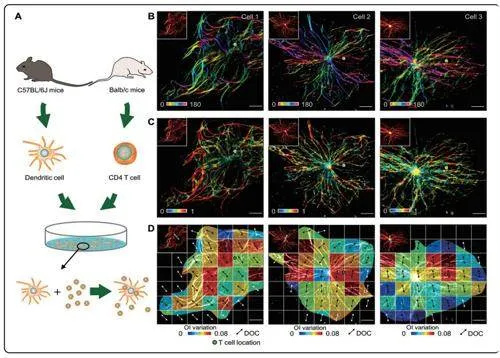
利用ADQ技术,研究人员研究了细胞骨架结构重塑与细胞迁移功能之间的关系,揭示了新现象。课题组发现了在单细胞迁移和多细胞互作诱导迁移这两种迁移方式中,细胞微管结构重塑的相似性和差异性。
具体而言,在单细胞迁移中,微管在细胞迁移前端和尾端的空间重塑尤为剧烈;而在多细胞互作迁移中,微管在多细胞接触点附近运动活跃。
有趣的是,在这两种迁移方式中,微管呈现出一致的取向变化(DOC),并且与细胞迁移方向具有相关性。
这些微管结构重塑特征的发现,有助于研究者们更好地理解微管在细胞迁移过程中所发挥的力学功能,进而开展特异性细胞运动调控。

该研究应用前景广阔,为生物医学显微成像领域提供了一种新的研究范式。从技术创新角度而言,ADQ框架也可用于指导优化结构光照明显微镜(SIM)外的其他超分辨成像技术。
从生物应用角度来看,ADQ可用于研究纳米尺度下的多种亚细胞结构,如微管、微丝、内质网和线粒体等,有助于科学家更好地理解细胞迁移、代谢、凋亡等功能,进而启发个性化疾病调控、干预和治疗。
“该工作呈现得非常准确和详尽。该研究和方法同时为亚细胞动态和行为相关的基础和应用研究打开了新的大门。”
“该工作展示了超分辨显微成像技术和定量数据分析之间的协同力量和魅力,以及如何启发重要的细胞生物新发现。该工作对于技术创新和生物应用均具有重要贡献。
生物医学显微成像新范式
该团队所提出ADQ框架建立在一套多模态SIM仪器之上,该仪器集成了多种二维和三维SIM成像技术。
基于这套多模态仪器,他们提出了细胞结构驱动的ADQ框架。
ADQ框架首先使用宽场成像技术对细胞骨架进行高速拍摄,然后在角谱空间进行实时定量计算,获取角度分布特征,用于选择最优的成像模态。当细胞骨架呈扁平/层状分布时,可选择二维成像技术,不仅具有低光毒性,也能获取样品的较完整信息。
反之,当骨架错综复杂地分布在三维空间,此时二维成像技术难以获取样品的高保真信息,需要使用三维成像技术。
ADQ框架的另一项优势在于对获取的图像实施高精度定量分析,由此揭示细胞骨架活动的基本规律。
课题组提出了二维/三维有序度指数(OI)算法对超分辨图像进行全面的时空角谱域定量表征,分析细胞骨架的结构异质分布程度,及其与细胞迁移等功能之间的联系。
OI算法对于噪声、样品密度、弯曲程度、标记方式等都具有较高的鲁棒性,其在细胞不同局域上的时间涨落特征反映了细胞在迁移过程中的结构重塑与应激。
总体而言,ADQ通过角度分布预判定,同时选取最优的超分辨成像模态并实施相应的定量表征,从图像获取和分析多方面平衡了成像的保真度与光毒性。
与现有的超分辨率成像技术相比,ADQ的改进主要体现在以下两个方面:
首先,相较于现有超分辨显微成像技术多基于单一技术分析或多种技术的手动简单关联,ADQ提出通过定量计算角度空间分布自动选择最佳的成像技术。
其次,相比于现有超分辨显微成像技术多基于定性观察,ADQ提出有序度指数OI算法进行多维度定量分析图像,揭示重要的生命活动规律。
这些改进也决定了ADQ的两大显著优势:
第一,ADQ能够“按需智能成像”,自动平衡数据获取的保真度和光毒性,以优化条件获取样品的全面信息,突破了传统单一技术的性能局限。
第二,ADQ可以对样品进行空间域、时间域和角谱域定量表征,多维度挖掘数据中的潜藏信息,推动生物研究的“定量化”。
这些潜在的大量生物应用信息在传统多基于定性观察的成像技术中很难被获取到,且定性分析容易引入人为偏差。而ADQ能够帮助生物学家更好地研究亚细胞生命过程,揭示新机制。
多学科领域交叉融合的成果
该研究体现了多学科领域之间的交叉合作,可大致分为3个重要阶段。
第一阶段是初步尝试合作
刘智毅研究员和丁志华教授课题组长期从事生物医学图像的定量表征分析研究,深入探究纤维状组织空间结构的精准解析,但多是在衍射极限尺度以上。
刘旭教授、匡翠方教授和刘文杰博士团队致力于从事显微成像相关研究,并开发了多种新型全内反射荧光显微镜(TIRFM)和SIM成像技术,提升了其分辨率和成像速度,但多是在定性成像层面。
因此,两个团队的交流产生了激烈的思想碰撞,直接启发了在更基础的纳米尺度上对亚细胞结构进行定量分析的可能性。在利用已有数据进行初步尝试后,他们进一步明确了合作的可行性。
第二阶段是ADQ框架提出
定量分析一般需要大量的统计数据才能得到较为置信的结果,而单一的超分辨成像技术,受到时空分辨率矛盾限制,想要高效获取大量有用数据非常费时费力。
为了解决这个问题,他们基于已经开发的空间角度分析方法和多模态SIM成像技术,进一步提出了ADQ框架,构建了一种超分辨成像模态自适应选择的新方案。
同时,为了对细胞骨架分布的异质程度进行更有效的定量研究,他们开发了有序度指数算法OI。
第三阶段是生物应用发现
在ADQ框架指导下,该课题组与姚雨石研究员等生物学家合作,对大量细胞迁移过程中的微管重塑进行了统计分析,发现了不同细胞迁移方式下微管结构重塑的相似性和差异性,揭示了骨架重塑在细胞迁移中的重要特征。
在研究推进的过程中,研究人员意外地发现,微管在细胞迁移过程中的角度变化与迁移方向有着紧密关联。换言之,角度变化具有预测细胞迁移轨迹的能力。这一发现极大地丰富了ADQ方法的能力与内涵。
据悉,该团队目前已经在尝试使用人工智能对图像进行定量结构分析,人工智能在低信噪比、大批量数据处理等方面具有较大的优势,有望进一步扩展ADQ的应用前景。
此外,他们在人工智能增强的超分辨显微图像重构方面已经开展了系列研究,开发的算法有效提升了传统光学显微镜的分辨率和重构保真度等,其中部分人工智能算法已经实现了商业化应用。
据悉,在后续的研究中,该课题组一方面会进一步发展ADQ框架,通过优化计算过程、图形处理器(GPU)加速等提高运算速度,人工智能分析提高分析精度和自动化,从而能够更好地对大批量生物医学数据进行统计分析。
另一方面,将与生物学家合作,对癌症等病变的细胞骨架重塑进行研究,以期能更好地理解疾病的形成过程。
