甘草根际节杆菌Arthrobacter sp. GCG3的分离鉴定及抑菌促生特性
摘要:为挖掘甘草根际兼具促生防病功能的植物根际促生菌,利用平板对峙法从甘草根际筛选出1株对甘草根腐病病原菌及常见植物病原菌抑制率均在50%以上的高活性拮抗菌株GCG3。通过形态学、生理生化特征及16S rRNA序列同源性分析,确定该菌株属于节杆菌属(Arthrobacter)。GCG3菌株的不同浓度发酵菌液对供试病原菌均具有较强的抑制作用,当菌液浓度为1%以上时,抑制率均能达到70%以上;而无细胞滤液只在浓度为20%时对病原菌灰霉菌、核盘菌、茄链格孢、大斑凸脐蠕孢菌具有较强的抑制作用,抑制率为69.49%~76.92%。菌体、发酵菌液和无细胞滤液的抑制活性强度整体表现为发酵菌液gt;菌体gt;无细胞滤液。发酵24 h的菌液对供试病原菌的抑制作用最强。该菌株能够耐受较高盐碱,具有固氮、分泌生长激素IAA的性能,且胞外多糖产量可达1 017.06 mg/L。盆栽与大田试验结果表明,接种该菌株对玉米生长具有显著的促生效果。综上,节杆菌GCG3兼具广谱抑菌活性和促生性能,在生物防治、促生及盐碱地改良中具有潜在的应用价值。
关键词:甘草;根际;节杆菌;抑菌活性;促生
中图分类号:S182" 文献标志码:A
文章编号:1002-1302(2024)23-0247-09
张" 军,郭" 琪,杨" 晖,等. 甘草根际节杆菌Arthrobacter sp. GCG3的分离鉴定及抑菌促生特性[J]. 江苏农业科学,2024,52(23):247-255.
doi:10.15889/j.issn.1002-1302.2024.23.033
收稿日期:2024-06-06
基金项目:兰州市人才创新创业项目(编号:2022-RC-75);甘肃省重点研发计划(编号:21YF5FA151)。
作者简介:张" 军(1982—),男,甘肃礼县人,助理研究员,主要从事药用植物栽培和菌植互作研究。E-mail:zhangjun-204@163.com。
通信作者:郭" 琪,硕士,研究员,主要从事植物生物技术和菌植互作研究,E-mail:guoqi9207@163.com;杨" 晖,博士,研究员,主要从事植物生物技术和菌植互作研究,E-mail:yanghui43@163.com。
甘草是甘草属(Glycyrrhiza L.)植物的统称,为豆科多年生草本植物,是我国大宗常用药材,主要分布于内蒙古、甘肃、宁夏、新疆等地,常以其根及根茎入药,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药等功效[1]。在新冠疫情防治中,甘草是主要的免疫调节药物[2]。此外,甘草在食品制造业、畜牧业养殖、环境保护中均有应用。近年来,随着我国及向外出口的甘草需求量逐年增大,甘草人工栽培的规模不断扩大,已经成为一种广泛种植的药材。病害,特别是真菌病害是影响甘草生产的限制性因素之一,也是导致甘草产量减少、品质下降的因素。土壤微生物防治在药用植物绿色生态栽培方面表现出了巨大潜力,特别是植物根际促生菌被证实在促进植物生长、提高植物生长品质及缓解病害等方面具有重要作用[3]。因此,从甘草根际筛选拮抗微生物可为甘草的生物防治提供微生物资源,对甘草产业的可持续发展具有重要意义。目前,对甘草根际微生物的研究多集中在丛枝菌根真菌,对细菌的研究尚处在初级阶段,且主要集中在根部内生细菌的研究上,例如郎多勇等发现,宁夏产甘草中含有丰富的内生细菌,且以根中居多,这类内生细菌中对多种病原菌有拮抗效果的菌种为芽孢杆菌属[4]。饶小莉对乌拉尔甘草内生细菌的多样性进行了研究,发现分离到的6株内生细菌对15种植物病原菌均具有较好的拮抗活性,而且与菌根复合回接后能显著促进甘草生长[5]。马文彬等利用从甘草与苜蓿根际分离获得的5株优良促生细菌制成的接种剂接种甘草幼苗,发现可显著促进苗期幼苗生长[6]。
本研究前期在分离甘草根际固氮菌的过程中筛选到1株对甘草根腐病病原菌及常见植物病原菌具有明显抑制作用的节杆菌,通过形态学、生理生化特征及16S rRNA基因序列分析进行鉴定,并对其发酵液的抑菌活性、菌株促生性能进行研究,以期为抑菌促生菌剂的开发和应用提供理论基础。
1" 材料与方法
1.1" 土壤样品
于2022年6月在甘肃省武威市民勤县西渠镇东容村(39°04′N,103°61′E)2年生健康乌拉尔甘草根际取样,采集距离根部0~10 cm的土壤,将土壤装入无菌自封袋中,运回实验室进行分离。采样区0~20 cm土层土壤的全氮含量为 0.61 g/kg,速效磷含量为19.11 mg/kg,速效钾含量为47.71 mg/kg,有机质含量为9.36 g/kg,pH值为8.14,全盐量为1.40 g/kg。
盆栽试验用土取自甘肃省兰州新区农投集团皋兰县西岔镇园区(36°42′N,103°79′E) 0~20 cm土层土壤,全氮含量为4.08 g/kg,速效磷含量为36.64 mg/kg,速效钾含量为186.38 mg/kg,有机质含量为3.84 g/kg,pH值为7.80,全盐量为4.08 g/kg。去除落叶、小石块等杂质,并将土样过 5 mm 筛,高压灭菌后晾干备用。
1.2" 供试菌株与病原菌
圆褐固氮菌[Azotobacter chroococcum(Ac)]1.178由中国工业微生物菌种保藏管理中心甘肃分中心提供;立枯丝核菌[Rhizoctonia solani Kuhn(Rs)]、尖孢镰刀菌[Fusarium oxysporum Schlecht (Fo)]、腐皮镰孢菌[Fusarium solani (Martius) Sacco(Fs)]、灰霉菌[Botrytis cinerea Persoon(Bc)]、瓜亡革菌[Thanatephorus cucumeris(Tc)]、核盘菌Sclerotinia sclertiorum(Ss)、大斑凸脐蠕孢菌[Exserohilum tucicum(Et)]、茄链格孢[Alternaria solani (Elliset G. Martin) Sorauer(As)]由甘肃省农业科学研究院植保所提供。
1.3" 供试玉米品种
甜糯182(审定编号:国审玉2016004)购自北京华耐农业发展有限公司,为无包衣种子。
1.4" 菌株的分离纯化与筛选
本研究菌株是在分离甘草根际固氮促生菌的过程中发现的。取10 g土样,与无菌水充分混合制成混悬液,再将混悬液置于固氮Ashby液体培养基中,于28 ℃、180 r/min富集培养72 h后,用常规稀释平板涂布法在Ashby培养基上进行凃布分离,28 ℃ 恒温培养2~3 d。待分离的菌落长出后,挑取单菌落,用平板划线法继续在Ashby培养基上进行纯化。将纯化好的菌株接入LB斜面上,培养2~3 d后于4 ℃冰箱保藏并编号。
将分离得到的菌株分别接种于LB液体培养基中,180 r/min、28 ℃恒温振荡培养至对数期。采用平板对峙法,在马铃薯葡萄糖琼脂(PDA)平板中心放置植物病原菌菌饼(直径6 mm),取4张无菌滤纸片,呈十字交叉状放在菌饼四周,每张滤纸片距平板外缘2 cm。在每张滤纸片上各滴5 μL各菌株菌悬液。以无菌水为对照,每个处理设置3次重复。在28 ℃培养3~5 d后,采用十字交叉法测定菌落生长直径,按照以下公式计算菌丝生长抑制率:
菌丝生长抑制率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%。
1.5" 菌株GCG3的鉴定
1.5.1" 形态及生理生化特征分析" 观察并描述菌株GCG3在LB培养基上于28 ℃培养48 h后的单菌落特征,主要包括菌落的生长速度、大小、颜色、透明度、表面状态(是否平坦、凸起、褶皱或凹陷等)和边缘状态(是否整齐、不规则或放射状等)及后期生长状态。并按照细菌鉴定常规方法对菌株GCG3进行革兰氏染色及生理生化鉴定试验[7]。
1.5.2" 16S rDNA序列的同源性分析" 根据细菌基因组DNA提取试剂盒(北京索莱宝科技有限公司)说明提取单菌落基因组DNA,送至生工生物工程(上海)股份有限公司进行16S rDNA测序,结果与NCBI(美国国家生物技术信息中心)GenBank中的已知序列进行同源性比对后,判断细菌种类并划分到属。应用MEGA 7.0软件,采用邻接法聚类分析构建系统发育树,Bootstrap值为1 000。
1.6" 菌株GCG3发酵液对植物病原菌的抑制作用
1.6.1" 不同浓度GCG3发酵菌液对病原菌的抑制作用" 将菌株GCG3接种于LB液体培养基中,于180 r/min、28 ℃恒温振荡培养48 h,待PDA培养基冷却至50 ℃左右时加入发酵菌液,使菌液浓度体积占比分别为0.2%、0.5%、1.0%、2.0%、5.0%、10.0%、20.0%时,混合均匀后制成平板,每个比例设3次重复;以不含菌液的PDA平板作为对照。取直径为 0.6 cm 的病原菌菌饼放置于PDA平板中心,于 28 ℃ 培养5~7 d。采用十字交叉法测定菌落生长直径,按照“1.4”节中的公式计算菌丝生长抑制率。
1.6.2" 不同浓度GCG3发酵液无细胞滤液对病原菌的抑制作用" 用“1.6.1”节的方法制作的菌悬液在4 ℃、12 000 r/min离心4 min,取上清液,经 0.22 μm 孔径的滤膜过滤,得到无细胞滤液。待PDA培养基冷却至50 ℃左右时加入无细胞滤液,使菌液体积分数分别为5%、10%、20%,后续步骤同“1.6.1”节,计算菌丝生长抑制率。以不含无细胞滤液的PDA平板作为对照。
1.6.3" 不同发酵时长GCG3发酵菌液对病原菌的抑制作用" 将菌株GCG3接种于LB液体培养基中,于180 r/min、28 ℃恒温振荡培养24、48、72、96、120 h,菌液浓度按照0.5%的体积分数加入培养基中后,检测不同时长发酵液对病原菌生长的抑制率。
1.7" 促生性能研究
1.7.1" 促生性能检测" 固氮酶活性参照微生物固氮酶(NITS)ELISA试剂盒(江苏酶免实业有限公司)说明书操作测定,对照菌株为GCG1(Agrobacterium sp.)、GCG2(Arthrobacter sp.)和圆褐固氮菌1.178。用定性溶磷圈法测定溶磷能力[8];用定性显色法和Salkowski定量比色法测定菌株分泌IAA的能力[9];用苯酚-硫酸法测定产胞外多糖(EPS)的能力[10];用CAS培养基平板接种法进行铁载体的定性检测[11],对照菌株为GCG1、GCG2。
1.7.2" 菌株GCG3对玉米的促生效应
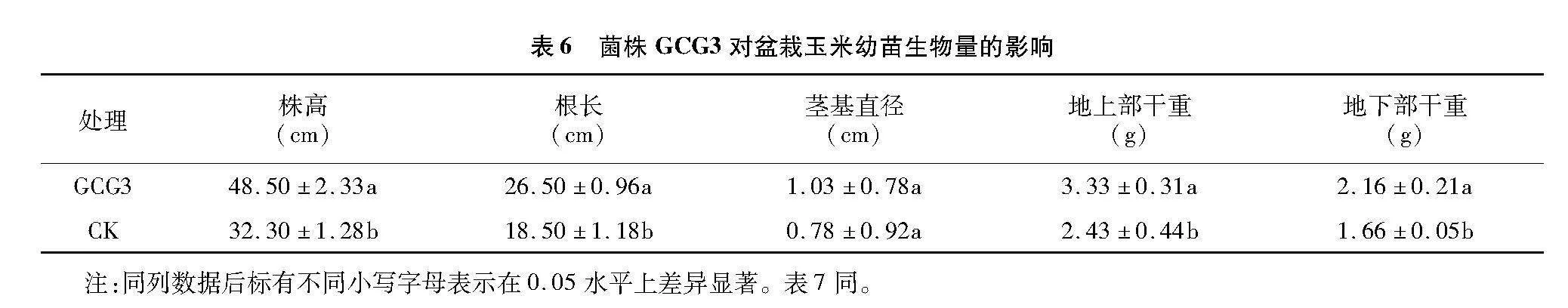
1.7.2.1" 盆栽试验" 该试验在甘肃省科学院生物研究所人工气候室内进行,挑取大小相似、颗粒饱满的玉米种子,在75%乙醇中浸泡30 s后,放入2%次氯酸钠溶液中浸泡2 min,再用自来水冲洗 20 min,最后用无菌水洗涤3~5次,晾干备用。将菌株GCG3接种于LB液体培养基中,180 r/min、28 ℃ 恒温振荡培养48 h后,离心并收集菌体,离心后将菌体重悬于无菌水中,使菌悬液的浓度达到 1×107 CFU/mL,再按照1 ∶2的体积比与灭菌土壤混合,制成泥浆,使用该泥浆对处理过的玉米种子进行拌种,确保每粒种子表面均匀裹满泥浆。晾干后,将玉米种子播种于花盆中,每个花盆装3 L灭菌土,每盆放置1粒种子,共设6次重复,待幼苗破土后,每隔7 d用稀释100倍的50 mL菌悬液均匀浇灌幼苗根部,累计浇灌3次。对照组为无菌水处理。30 d后测定玉米的株高、茎基直径、根长、地上部干重和地下部干重。
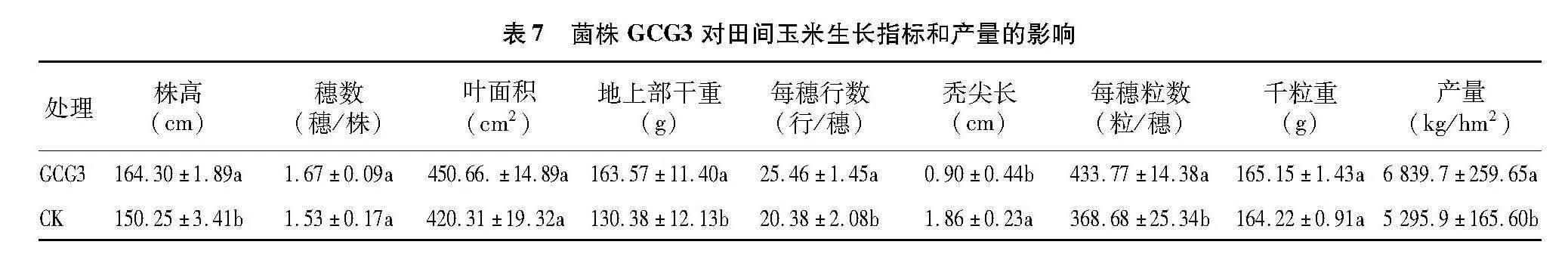
1.7.2.2" 田间试验" 该试验在甘肃省兰州新区农投集团皋兰县西岔镇园区试验田进行。将玉米种子按照“1.7.2.1”节中的方法拌种后备用。采用随机区组试验,每个小区试验地面积为16.8 m2,长×宽=12 m×1.4 m,共设3次重复,按照株距×行距为 25 cm×70 cm播种,每个小区四周设有保护行。在拔节期、大喇叭口期、抽雄期、灌浆期按照 30 L/hm2 菌悬液用灌溉水稀释100倍后对玉米进行灌根处理。对照组为灌溉水处理。在玉米成熟期,每个小区随机选取5株玉米,测定株高、每株穗数、叶面积(长宽系数法[12])、地上部分干重、每穗行数、秃尖长、每穗粒数、千粒重、单位面积产量。单位面积产量按照如下公式计算:
单位面积产量=(穗粒数×穗数×667 m2株数×0.066 7×千粒重)/1 000。
2" 结果与分析
2.1" 菌株GCG3对植物病原菌的抑制作用
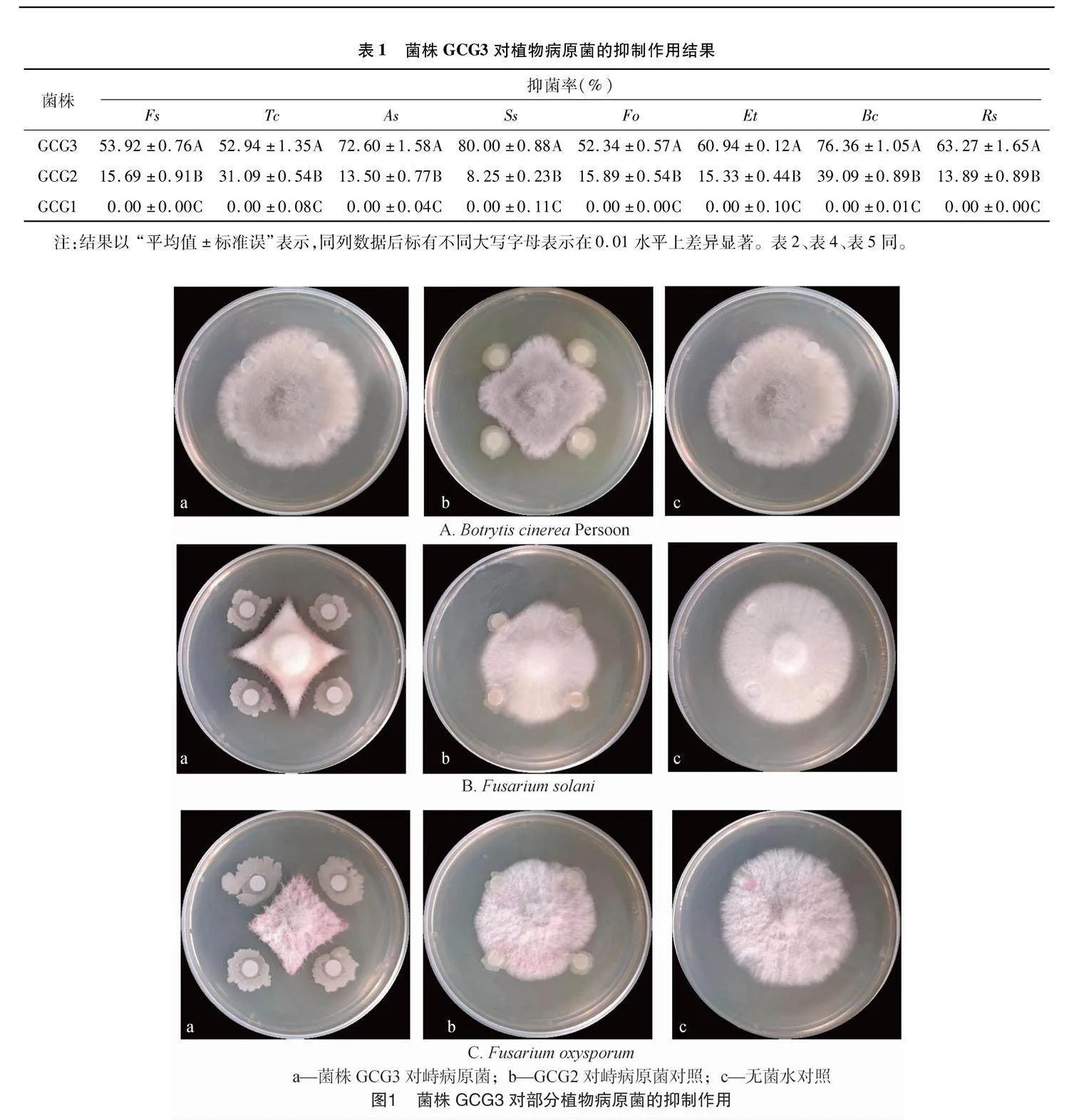
从甘草根际土壤中共分离得到3株固氮细菌,分别编号为GCG1、GCG2、GCG3。通过对供试植物病原菌的抑制测试发现,只有GCG3表现出明显的抑制病原菌的作用(表1、图1),且抑制率均在50%以上。
2.2" 菌株的鉴定
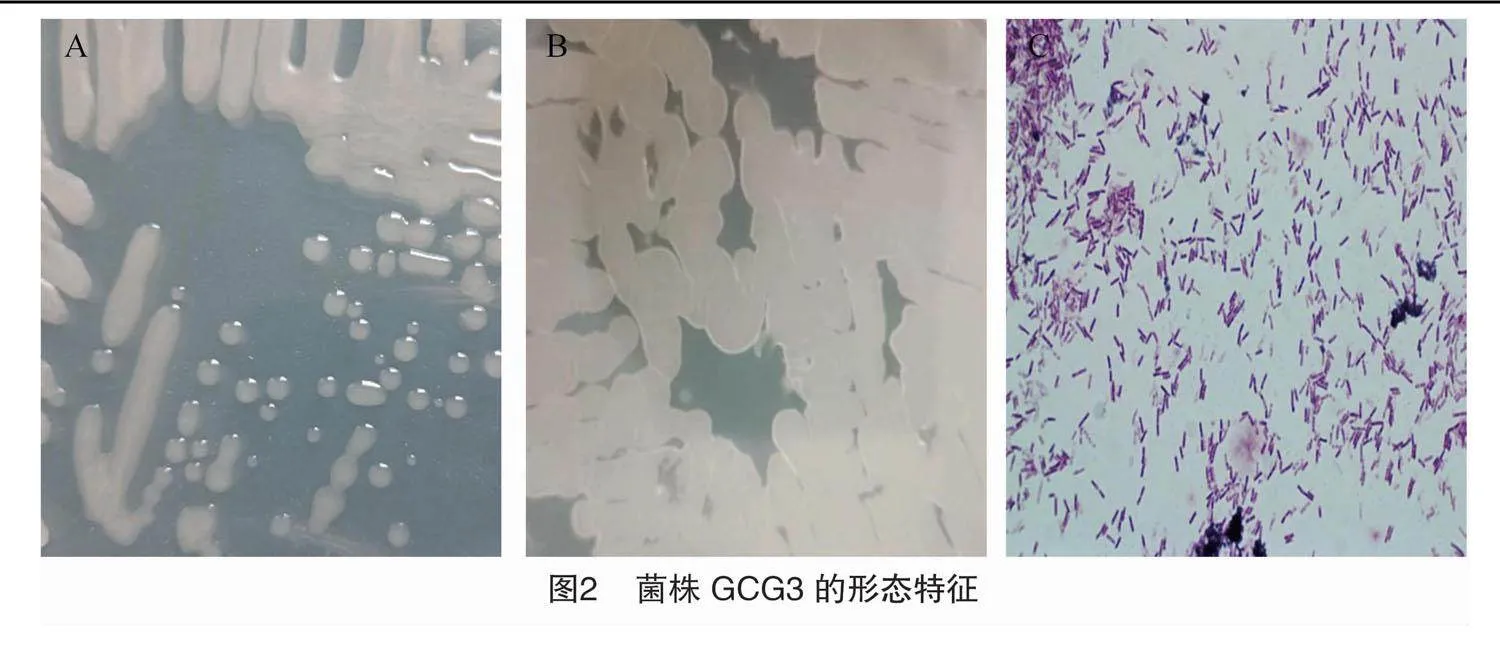
2.2.1" 形态及生理生化特征" 在LB培养基上的GCG3菌株菌落生长速度较快,16 h后观察单一菌落为圆形,边缘整齐,表面光滑且湿润,呈半透明水珠状(图2-A),后期变为浅白色、扁平状且边缘有凸起(图2-B)。菌株GCG3在LB液体培养基中为淡黄色,部分菌体有絮凝现象。镜检结果为革兰氏阳性菌,短杆菌,无芽孢(图2-C)。
生理生化检测结果表明,菌株GCG3能够耐受8%以下浓度的NaCl,在含盐量为5%、2%培养基上的生长速度较快,能够适应15~45 ℃的温度范围,28 ℃ 为菌株GCG3的最适生长温度。但是,该菌株在pH值为9.0及以上的培养基上不能生长。菌株GCG3对麦芽糖、蔗糖、乳糖、葡萄糖、甘露糖、果糖、半乳糖、鼠李糖、丙氨酸、精氨酸、天冬氨酸、谷氨酸、甘露醇、山梨醇、肌醇、柠檬酸、乙酸、硝酸盐呈阳性反应,对过氧化氢酶、丝氨酸、阿拉伯醇、苹果酸呈阴性反应。
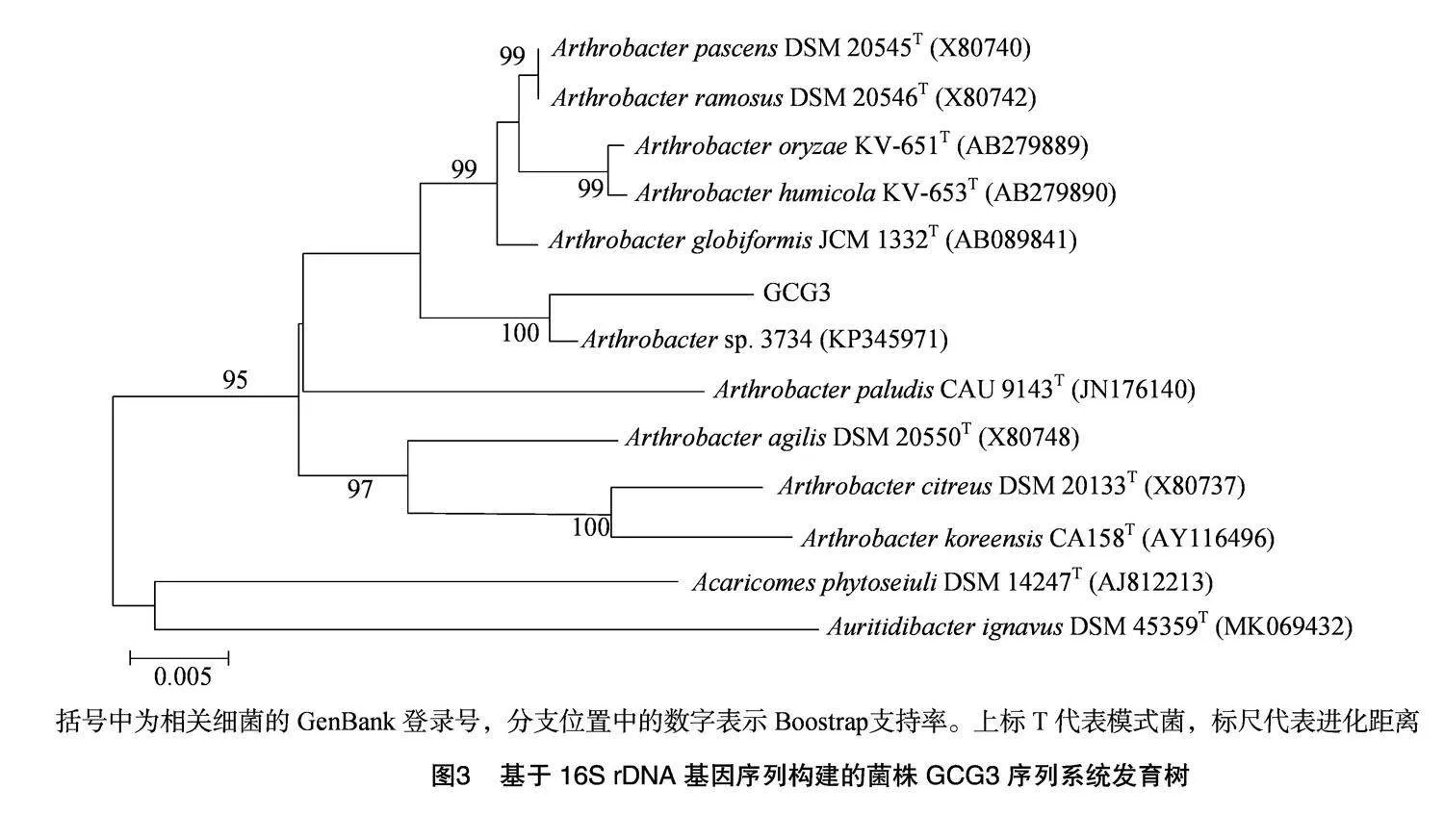
2.2.2" 16S rDNA序列同源性分析" 经16S rDNA测序比对,得到同源性较高的菌株,并与相似及近缘种模式菌株的16SrDNA基因序列构建系统发育
树。图3显示,菌株GCG3与节杆菌(Arthrobacter sp.)3734(KP345971)聚为一支,亲缘关系较近,同源相似性达到99.16%,初步将菌株GCG3归属于节杆菌属(Arthrobacter)。
2.3" 菌株GCG3发酵液对植物病原菌的抑制作用
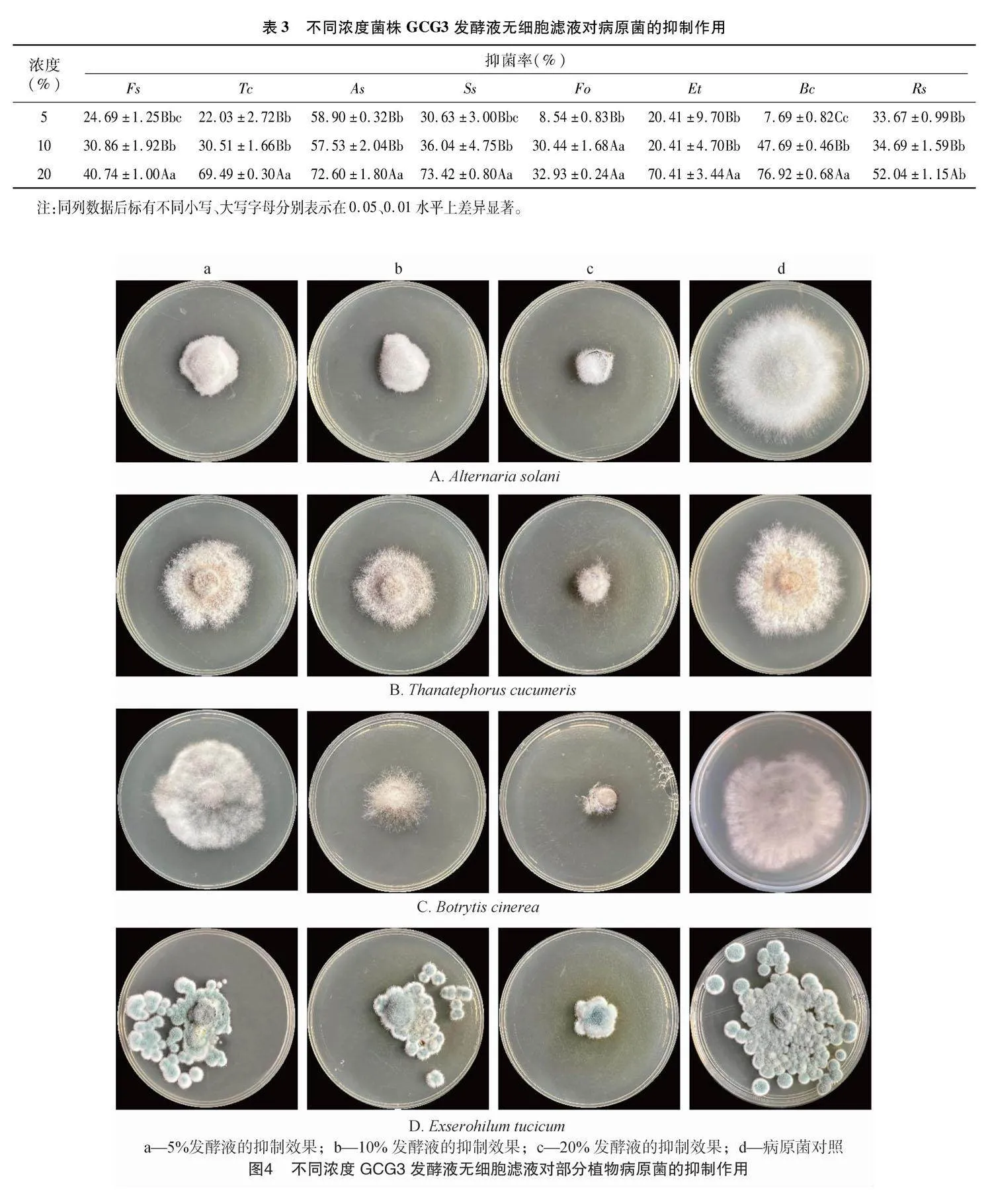
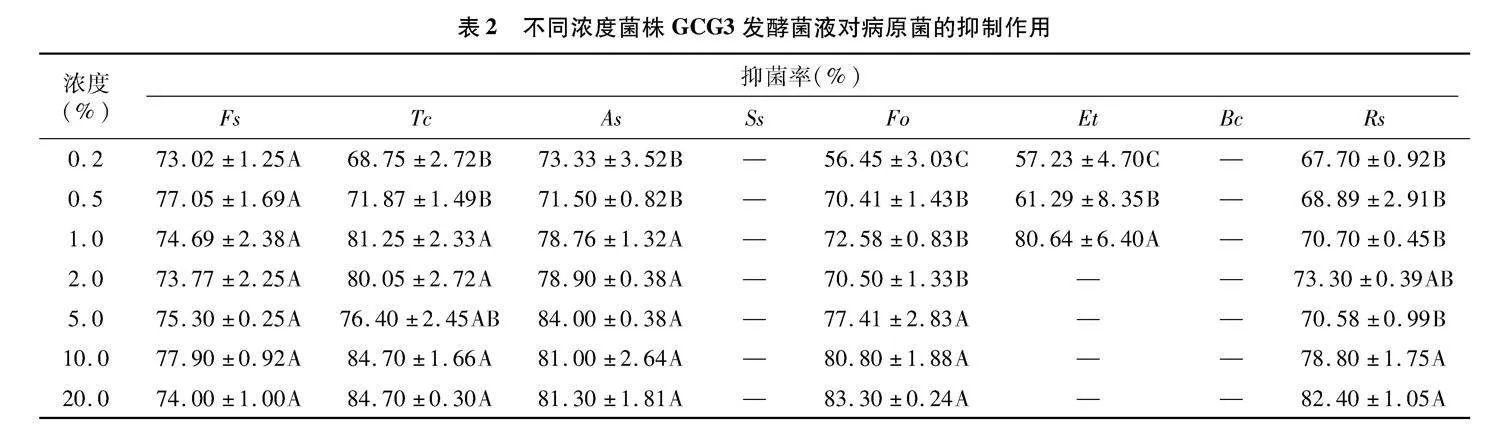
2.3.1" 不同浓度GCG3发酵菌液对病原菌的抑制作用" 不同浓度GCG3发酵菌液对供试病原菌均具有较好的抑制作用(表2),其中Bc、Ss在含有不同浓度发酵菌液中,以及Et在含有2.0%~20.0%发酵菌液培养基上均未见明显生长,抑制率可视为100%。当发酵菌液浓度为1.0%以上时,GCG3对各个病原菌的抑制率均能达到70%以上。
2.3.2" 不同浓度GCG3发酵液无细胞滤液对病原菌的抑制作用" 不同浓度菌株GCG3无细胞滤液对供试病原菌的抑制作用不同(表3、图4),整体表现为浓度越大,抑制作用越强,即20%gt;10%gt;5%,且浓度20%与浓度10%相比,除Fo外对病原菌的抑制均呈极显著差异,与5%浓度相比,10%浓度处理除Fo、Bc有极显著差异外,其他均无显著差异。当无细胞滤液浓度为20%时,对Bc、Ss、As、Et具有较强的抑制作用,抑制率均在70%以上,其中对Bc的抑制率最高,为76.92%。当无细胞滤液浓度为5%时,对病原菌均有一定的抑制作用,但对Fo、Bc的抑制作用较弱,而对As的抑制率仍在50%以上。
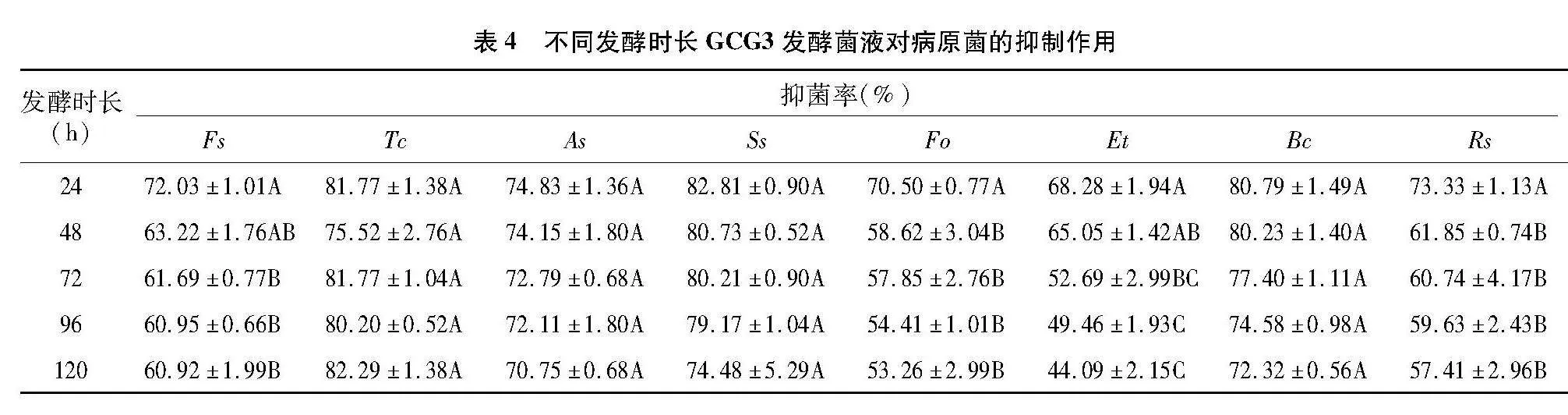
2.3.3" 不同发酵时长GCG3发酵菌液对病原菌的抑制作用" 不同发酵时长GCG3发酵菌液对病原菌的抑制作用不同(表4),发酵24 h的菌液对供试病原菌的抑制作用最强。随着发酵时间的延长,虽整体的抑制力呈现下降趋势,但对Tc、Ss、As、Bc的抑制作用无显著差异。发酵120 h后的菌液对上述病原菌的抑制率仍在70%以上。当发酵时长分别为48、72 h时,菌液对Fo、Rs和Fs、Et的抑制作用有显著减弱,但之后的抑制力下降趋势减缓,并且无显著差异。
2.4" 促生性能研究
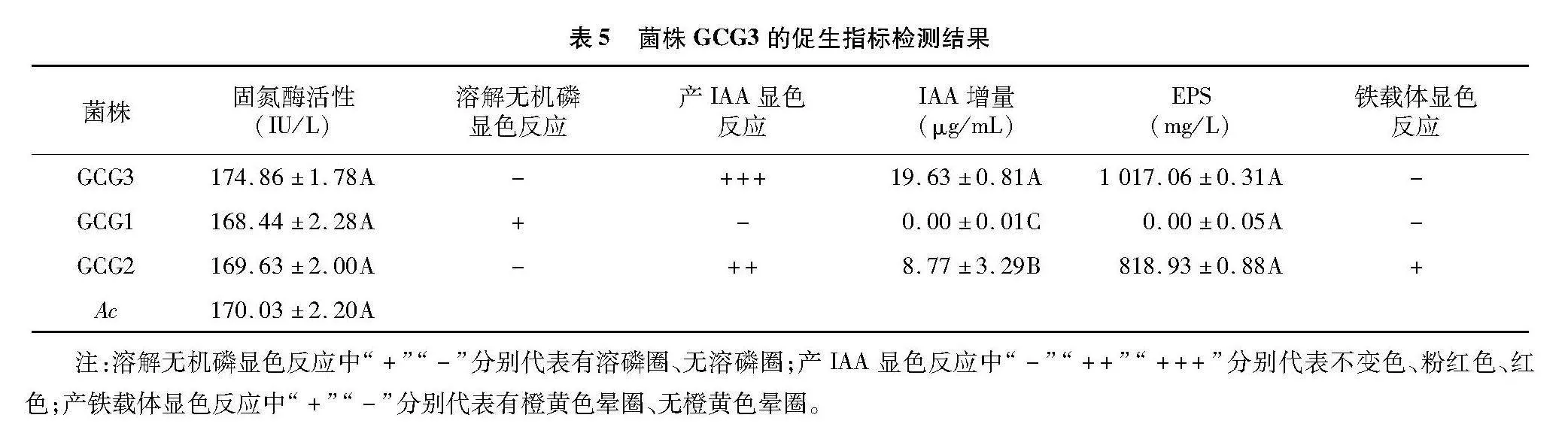
2.4.1" 促生性能检测结果" 菌株GCG3能够固氮、分泌生长激素IAA、产胞外多糖(EPS),但不具备溶磷、产铁载体的能力(表5)。与固氮模式菌圆褐固氮菌(Ac)相比,菌株GCG3的固氮酶活性无显著差异,固氮性能较强,产IAA显色反应明显,EPS产量可达1 000 mg/L以上,具有较强的产EPS能力。
2.4.2" 菌株GCG3对盆栽玉米幼苗生长指标和生物量的影响" 整体上看,接种GCG3可显著促进盆栽玉米幼苗的生长;与对照相比,接种菌株GCG3的玉米幼苗株高、根长、地上部干重、地下部干重分别较对照增加50.15%、43.24%、37.04%、30.12%(表6)。
2.4.3" 菌株GCG3在田间条件下对玉米生长指标和产量的影响" 在大田条件下,接种菌株GCG3对玉米的每株穗数、叶面积、千粒重无显著影响,但可显著促进玉米株高生长、增加每穗行数和粒数及地上部干重,缩短秃尖长度,较大程度地提高玉米产量(表7)。与对照相比,株高、穗行数、穗粒数、地上部干重、产量分别提高9.35%、24.93%、17.65%、25.46%、29.13%,秃尖长缩短了51.61%。
3" 结论与讨论
由于植物根际土壤中存在着大量拮抗促生细菌,因此筛选拮抗促生细菌并对其进行鉴定是开发微生物资源的重要途径。本研究前期在分离甘草根际固氮菌的过程中筛选得到1株兼具防病促生的
细菌GCG3,经形态学、生理生化特征及16S rRNA基因序列分析后,鉴定为节杆菌属(Arthrobacter)菌株。节杆菌是自然界中最常分离到的土壤细菌种类之一,常作为生物除污修复工具被广泛关注[13]。目前,国内外将节杆菌作为一种具有防病促生潜力的多功能植物根际促生菌的研究尚不多见。Ramlawi等研究发现,从堆肥中分离得到的腐殖质节杆菌(Arthrobacter humicola)M9-1A、M9-2、M9-8 及嗜冷节杆菌M9-17菌株及细胞细菌无细胞滤液对9种植物病原菌均表现出不同的体外抑菌活性,除了M9-2外均能抑制番茄果实黑霉病[14]。Geeta等从韩国水稻根际分离得到的节杆菌(Arthrobacter sp.)GN70能够分泌生长激素IAA,该菌能够成功定殖至水稻根际并促进水稻植株、侧根生长和重量增加,同时对十字花科黑腐病病原菌(Xanthomonas campestris)、水稻叶枯病病原菌(Pantoea agglomerans)、水稻穗腐病病原菌镰刀菌(Fusarium proliferatum)和金黄色葡萄球菌均表现出较好的抗菌活性[15]。Platamone等从杜鹃叶片中分离得到节杆菌(Arthrobacter sp. strain CD),将其接种于意大利抗旱作物梨果仙人掌种植土壤中后,能显著促进植株早发芽和结果,同时改善果实品质[16]。郭丽丽等从稷山牡丹根际分离获得的球形节杆菌PJ45具有显著降解有机磷的能力。目前,尚未见从药用植物甘草根际分离获得具有抑菌促生特性节杆菌的报道[17]。
立枯丝核菌(Rs)、尖孢镰刀菌(Fo)和腐皮镰孢菌(Fs)、灰霉菌(Bc)分别是引起甘草丝核菌根腐病、镰孢根腐病、葡萄孢灰霉病的主要病原菌[18],核盘菌(Ss)、大斑凸脐蠕孢菌(Et)、茄链格孢(As)分别是引起油菜菌核病、玉米大斑病、番茄早疫病的主要病原菌。本研究结果表明,节杆菌GCG3菌体、不同浓度菌株发酵液和20%无细胞滤液对以上病原菌均具有不同程度的抑制作用,抑制率分别在52%、56%、40%以上,抑菌活性强度以油菜菌核病病原、甘草灰霉病病原最为明显,抑制率均在70%以上,可认为节杆菌GCG3是潜在的生防菌株。
菌体、发酵菌液和无细胞滤液的抑制活性强度整体表现为发酵菌液gt;菌体gt;无细胞滤液。当浓度为5%、10%时,与菌液相比,无细胞滤液的抑制强度有较明显的下降,特别是对引起甘草根腐病的2种病原菌Fo、Fs而言,20%菌液的抑制率为70%以上,而20%无细胞滤液的最高抑制率仅为40.74%,推测GCG3对上述病原菌的抑制作用是菌体及其产生的拮抗物质共同作用的结果。对尖孢镰刀菌、腐皮镰孢菌而言,菌体的作用要大于拮抗物质的作用。因此,在实际生产中,可优先考虑将GCG3菌液用于上述植物病原菌的生物防治。
节杆菌GCG3的生长速度快,当发酵时间为 24 h 时,菌液对上述病原的抑制作用最强,之后随着发酵时间的延长,抑制作用整体呈现缓慢下降的趋势。原因可能是随着发酵时间的延长,细菌自溶,从而引起菌体细胞壁结构不稳定及相关拮抗物质数量的变化。从目前的实际情况看,发酵24 h的菌液即可实际应用,后续可考察24 h前对数期与调整期抑菌活性的差异,从而进一步缩短发酵时长,节约发酵成本。
植物根际益生菌可通过多种促生机制来刺激植物生长,包括固氮、溶磷、分泌植物激素(IAA)和铁载体的产生[19]。在本研究的盆栽与大田促生试验中,土壤盐度属中度盐渍土[20],盆栽与大田试验结果均表明,接种GCG3可显著促进玉米生长,这可能与GCG3能够耐受较高盐碱、具有较强的固氮能力与分泌IAA的能力密切相关。研究发现,在非生物胁迫(干旱、温度、盐)下接种EPS产生菌,能够显著提高植物根部土壤团聚体的稳定性[21]。李慧芬等从海滨盐碱植物根际筛选出1株高产EPS的芽孢杆菌,可在中度盐碱土壤中促进番茄生长,并显著降低土壤pH值、全盐含量和土壤容重[22]。在本研究中,节杆菌GCG3兼具高产胞外多糖的能力,除了可用于抑菌促生外,其具有修复盐碱土壤的潜力。
而另有研究推测,植物根际的微生物拮抗性可能与产胞外多糖性能有关[23],胞外多糖能够促进根部生物膜的形成[24],产胞外多糖的芽孢杆菌能够通过竞争、拮抗和提高植物抗病性等方式抵御病原菌的入侵[25],该菌株拮抗性与胞外多糖的相关性和作用机制有待进一步研究和验证。
综上,从甘草根际分离的节杆菌GCG3具有广谱抑菌活性,应用于玉米种植可取得良好的促生效果,在生物防治、促生及盐碱地改良中具有潜在应用价值,可为复合功能菌剂与菌肥的研发和产业化应用提供候选菌种资源和理论支撑。
参考文献:
[1]国家药典委员会. 中华人民共和国药典:四部[M]. 2015版. 北京:中国医药科技出版社,2015:89.
[2]曲雪洁,王" 晨,刘长利. 近十年甘草栽培研究进展[J]. 天津中医药大学学报,2021,40(1):5-14.
[3]肖艳红,李" 菁,刘祝祥,等. 药用植物根际微生物研究进展[J]. 中草药,2013,44(4):497-504.
[4]郎多勇,张文晋,解植彩,等. 宁夏产甘草内生细菌分离纯化、拮抗植物病原菌菌株的筛选及鉴定[J]. 时珍国医国药,2017,28(9):2226-2228.
[5]饶小莉,沈德龙,李" 俊,等. 甘草内生细菌的分离及拮抗菌株鉴定[J]. 微生物学通报,2007,34(4):700-704.
[6]马文彬,王占军,姚" 拓,等. 植物促生菌剂对甘草生长影响的研究[J]. 草原与草坪,2014,34(1):13-17.
[7]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:353-398.
[8]狄义宁,刘鲁峰,谢林艳,等. 一株甘蔗内生菌鉴定及其溶磷能力的研究[J]. 作物杂志,2018(6):68-75.
[9]杨" 豆,王清海,万松泽,等. 2株毛竹枯梢病抑制细菌筛选及其促生功能[J]. 林业科学研究,2020,33(6):139-147.
[10]陈" 靖,周佳豪,毛琪琪,等. 产胞外多糖乳酸菌的筛选及鉴定[J]. 食品与机械,2023,39(4):26-31,169.
[11]陈" 伟,舒健虹,陈" 莹,等. 黑麦草根际铁载体产生菌WN-H3的分离鉴定及其产铁载体培养条件的优化[J]. 生物技术通报,2016,32(10):219-226.
[12]赵经华,杨庭瑞,周和平,等. 渗灌对玉米生长指标及产量的影响[J]. 甘肃农业大学学报,2020,55(6):58-66,76.
[13]Sharma M,Mishra V,Rau N,et al. Increased iron-stress resilience of maize through inoculation of siderophore-producing Arthrobacter globiformis from mine[J]. Journal of Basic Microbiology,2016,56(7):719-735.
[14]Ramlawi S,Abusharkh S,Carroll A,et al. Biological and chemical characterization of antimicrobial activity in Arthrobacter spp.isolated from disease-suppressive compost[J]. Journal of Basic Microbiology,2021,61(8):745-756.
[15]Geeta C,Inhyup K,Minchung K,et al. An isolated Arthrobacter sp. enhances rice (Oryza sativa L.) plant growth[J]. Microorganisms,2022,10(6):1187-1187.
[16]Platamone G,Procacci S,Maccioni O,et al. Arthrobacter sp. inoculation improves Cactus pear growth,quality of fruits,and nutraceutical properties of Cladodes[J]. Current Microbiology,2023,80(8):266.
[17]郭丽丽,侯小改,郭大龙,等. 一种球形节杆菌PJ45及其应用:CN113106038A[P]. 2021-07-13.
[18]吕" 卉.甘肃省甘草病害及其对品质和产量的影响[D]. 兰州:兰州大学,2020:32-37.
[19]Delaporte-Quintana P,Lovaisa N C,Rapisarda V A,et al. The plant growth promoting bacteria Gluconacetobacter diazotrophicus and Azospirillum brasilense contribute to the iron nutrition of strawberry plants through siderophores production[J]. Plant Growth Regulation,2020,91(2):185-199.
[20]陈丽娟,冯" 起,成爱芳. 民勤绿洲土壤水盐空间分布特征及盐渍化成因分析[J]. 干旱区资源与环境,2013,27(11):99-105.
[21]Sandhya V,Ali S Z.The production of exopolysaccharide by Pseudomonas putida GAP-P45 under various abiotic stress conditions and its role in soil aggregation[J]. Microbiology,2015,84(4):512-519.
[22]李慧芬,方安然,冯海霞,等. 胞外多糖产生菌的筛选鉴定及其促生改土作用[J]. 微生物学通报,2023,50(5):1941-1957.
[23]茹素龙,赵永龙,王紫薇,等. 产胞外多糖菌株的分离鉴定及其功能研究[J]. 微生物学报,2023,63(11):4315-4329.
[24]董奎奎,刘" 地,李绕勇,等. 芽孢杆菌DZY6715生物膜形成对其抗油茶炭疽病的影响[J]. 经济林研究,2023,41(2):91-101.
[25]马" 佳,李" 颖,胡" 栋,等. 芽孢杆菌生物防治作用机理与应用研究进展[J]. 中国生物防治学报,2018,34(4):639-648.

