褪黑素和硝态氮配施对镉胁迫下烟草渗透调节及氮代谢的影响

摘要:为探究褪黑素和硝态氮配施对镉胁迫下烟草早期生长、渗透调节及氮代谢的影响,采用水培试验,在镉胁迫(20 μmol/L)下设置3个N水平,即10、5、0.1 mmol/L硝态氮,并对K326烟草品种喷施 100 μmol/L 褪黑素。结果表明,镉胁迫下褪黑素的施用提高了烟苗生物量,与Cd处理相比,高氮水平下外施褪黑素地上部和根系生物量分别增加了70.45%、275.00%,低氮水平下分别增加了65.22%、200.00%,其中地上部生物量随硝态氮浓度的降低而降低,分别为0.75、0.58、0.38 g。镉胁迫下烟苗叶绿素合成受到抑制,褪黑素和硝态氮的配施可有效促进叶绿素合成。与Cd处理相比,高氮处理下外施褪黑素进一步激活了脯氨酸、可溶性糖、可溶性蛋白的渗透调节系统,分别提高了14.84%、10.41%、6.70%。此外,褪黑素可显著降低烟叶硝酸盐的积累,显著增加总氮和氮素积累量,促进氮代谢,高氮处理可提高植物对硝态氮的吸收,促进总氮和叶片氮素的积累。与Cd处理相比,褪黑素的喷施可提高氮代谢酶活性,高氮水平下外施褪黑素NR、NiR、GS、GOGAT活性分别显著提高了20.61%、16.47%、29.60%、28.88%,低氮水平下外施褪黑素NR、GS、GOGAT分别提高了11.46%、15.32%、22.79%。褪黑素和硝态氮的配施上调了氮代谢相关基因的表达,与N5处理相比,高氮水平下外施褪黑素上调了氮代谢相关基因NtNIA1和NtGDH1的相对表达,低氮水平外施褪黑素下调了NtNIA1、NtGOGAT1、NtGDH1的相对表达。综上,在胁迫条件下,短期高氮处理可有效提高烟苗早生快发,褪黑素也能加速烟草幼苗的生长,并进一步提高烟草幼苗的氮代谢能力。
关键词:烟草;硝态氮;褪黑素;镉胁迫;氮代谢
中图分类号:S572.01;S572.06" 文献标志码:A
文章编号:1002-1302(2024)23-0100-08
江静兰,郑" 聪,丹冬淳,等. 褪黑素和硝态氮配施对镉胁迫下烟草渗透调节及氮代谢的影响[J]. 江苏农业科学,2024,52(23):100-107.
doi:10.15889/j.issn.1002-1302.2024.23.014
收稿日期:2023-12-02
基金项目:河南省科技攻关项目(编号:212102110066)。
作者简介:江静兰(1996—),女,广西来宾人,硕士研究生,主要从事烟草生理生态研究。E-mail:JJL7375@126.com。
通信作者:邵惠芳,博士,教授,主要从事烟草加工工程与工艺、烟草质量评价研究。E-mail:shf.email@163.com。
烟草作为镉富集植物,在生长过程中极易富集镉(Cd)等重金属,进而对其产质量造成不良影响[1]。植物暴露在过量的Cd2+环境下,有可能引发一系列严重的形态、生理和代谢紊乱,例如抑制光合作用和蒸腾作用、碳水化合物代谢紊乱、蛋白质降解和脂质过氧化[2-4]。
褪黑素(MT)作为植物体中的一种吲哚类衍生物质,还起到了生长素调节剂的作用,促进植物生长发育,参与调控种子萌发、根长和不定根的生成、成熟衰老和细胞保护反应等生物学进程[5]。适宜浓度的褪黑素可有效改善植物氧化损伤[6-7]。此外,褪黑素还可以清除过量自由基,保护植物免受多种生物和非生物的胁迫,如病原菌侵染、盐碱胁迫、极端温度、辐射和重金属污染等[8-14],同时可以通过增加细胞内的酶和非酶类抗氧化剂水平清除ROS,从而维持细胞体内的氧化还原稳态[8]。研究表明,干旱胁迫下外源褪黑素通过增强PSⅡ光化学活性来提高叶片光合效率,提高烟苗的耐受性[15]。对烤烟内源激素的数据分析发现,叶片喷施外源褪黑素能通过调节植物内源激素的代谢水平,缓解胁迫对植物的光抑制程度,促进光合作用,增强光合碳同化能力,改善光合性能,从而增强烟草幼苗的抗旱能力[16]。
氮元素是作物必需的营养物质之一,是构成氨基酸、蛋白质、叶绿素、植物激素等物质的重要成分。硝态氮作为植物的主要吸收氮源,不仅参与了自身运输和同化,还是植物生长发育过程中的重要信号分子,能够调控侧根与叶片发育,调节开花时间[17-19]。有研究表明,硝态氮可通过平衡土壤酸碱度来降低土壤中Cd的有效性,从而降低植物对镉的吸收[20]。另有研究表明,Cd胁迫下小白菜施用硝态氮可减少光合抑制和氧化胁迫,从而降低Cd毒害,并有利于降低作物体内Cd的含量[21]。
目前,已有较多关于烟草Cd胁迫的研究,但有关氮素水平对褪黑素提高植物镉耐受性的影响的研究鲜见。因此本试验采用水培方法,研究在不同硝态氮水平与镉胁迫处理条件下,外源喷施褪黑素对烟草幼苗渗透调节及氮代谢的影响,旨在探究硝态氮在外源MT缓解Cd胁迫过程中的作用,以期进一步探明外源褪黑素调控烟草对Cd的耐受生理机制,为进一步揭示烟草耐Cd机理提供理论依据。
1" 材料与方法
1.1" 试验设计
试验于2022年4月在河南农业大学国家烟草栽培生理生化实验室进行。供试烟草品种为由河南农业大学烟草学院育种实验室提供的K326品种。褪黑素为99.9%分析纯试剂,购于北京索莱宝科技有限公司。改良Hoagland营养液中试剂均购于国药化学试剂集团有限公司。
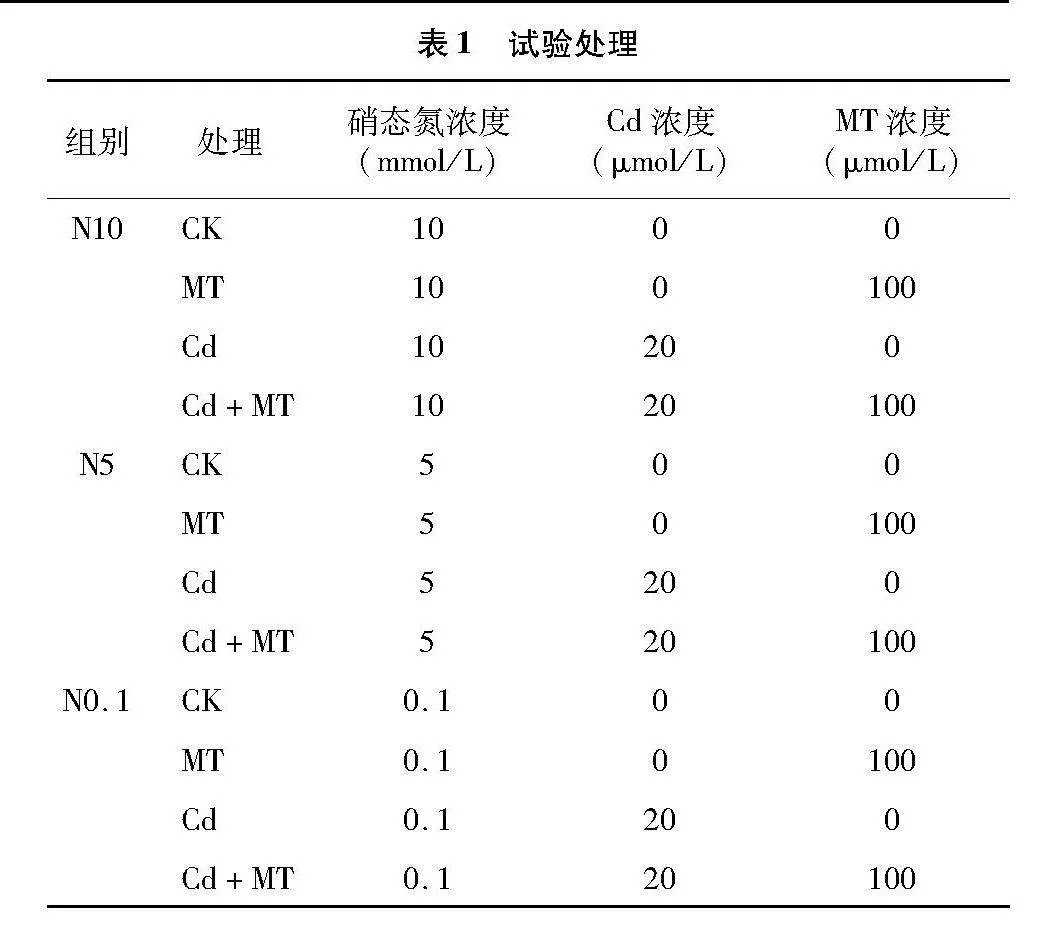
本试验全程采用无土栽培育苗。将烟草种子消毒后用无菌水清洗3次,后点至育苗盘,并放置在人工智能培养箱中培养 30 d[昼/夜温度 28 ℃/ 25 ℃,昼/夜时长14 h/10 h,湿度(70±5)%],出苗2周后移到盛有1/2改良Hoagland营养液的蛭石盆中,待烟苗长至4叶1心时,挑选生长状况一致且健壮的烟苗移栽至5 L水培盒中,驯化3 d后同时进行 20 μmol/L Cd处理和100 μmol/L褪黑素喷施处理。本试验以CdCl2·2.5H2O作为镉源,加入去离子水溶解并配制成1 mmol/L母液,试验过程中加入改良Hoagland营养液稀释至目标浓度,营养液的更换频率为3 d更换1次。同时连续喷施褪黑素14 d,每株喷10 mL,在9:00进行,喷至叶片正反两面均匀布满水珠为宜,喷施后进行黑暗处理1 h,喷施间隔为24 h。试验共设置3个营养条件处理组,分别为高氮(N10,10 mmol/L)、正常氮(N5,5 mmol/L)、低氮(N0.1,0.1 mmol/L)营养条件处理组,共设12个处理(表1),分别为N10-CK、N10-MT、N10-Cd、N10-Cd+MT、N5-CK、N5-MT、N5-Cd、N5-Cd+MT、N0.1-CK、N0.1-MT、N0.1-Cd、N0.1-Cd+MT,每个处理3次重复,处理14 d后记录表型并取样检测。
1.2" 测定项目与方法
1.2.1" 烟草幼苗生物量的测定
烟样生物量由电子天平测得。最大叶长、最大叶宽、最大根长均由直尺测得,最大叶面积=最大叶长×最大叶宽×0.634 5。
1.2.2" 烟叶色素含量、SPAD值的测定
叶绿素含量采用95%乙醇法测定,使用SPAD-502型仪器测定烟叶主脉对称两侧的叶尖、叶中和叶基6个点的SPAD值,并计算平均值。
1.2.3" 氮代谢酶活及渗透调节物质的测定
硝酸还原酶(NR)、谷氨酸脱氢酶(GDH)、谷氨酸合成酶(GOGAT)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)活性及脯氨酸、可溶性糖、可溶性蛋白含量均采用北京索莱宝科技有限公司生产的试剂盒测定。
1.2.4" 硝酸盐、总氮含量的测定及氮素积累量计算
采用水杨酸-浓硫酸比色法测定各处理烟叶中的硝酸盐含量[22]。
参照YC/T 161—2002《烟草及烟草制品" 总氮的测定" 连续流动法》,使用连续流动分析仪检测烟苗地上部、地下部的总氮含量[23]。
烟株叶片的氮素积累量参照李玉静等的方法[24]计算:氮素积累量(mg/株)=总氮含量(%)×干重(g/株)×10。
1.2.5" 氮代谢相关基因表达的测定
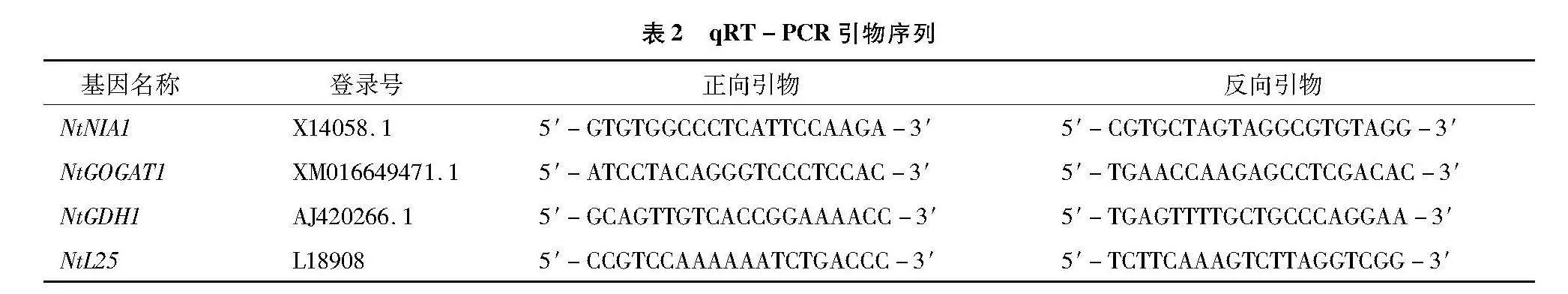
对烟苗进行取样,根据GenBank发布的烟草氮吸收代谢相关基因的序列设计扩增引物,以NtL25为内参基因,引物信息见表2。采用Trizol法提取烟苗根部总RNA,反转录合成cDNA。按照Vazyme公司的qPCR Master Mix (Taq Pro Universal SYBR) 试剂盒说明书进行实时定量RT-PCR,每个样品3次重复。实时定量的结果采用2-ΔΔCT方法进行分析[25]。
1.3" 数据处理
采用Excel 2021和Origin 2021对试验结果进行数据整理计算和作图,各指标间的显著性差异采用Duncans新复极差法进行检验。
2" 结果与分析
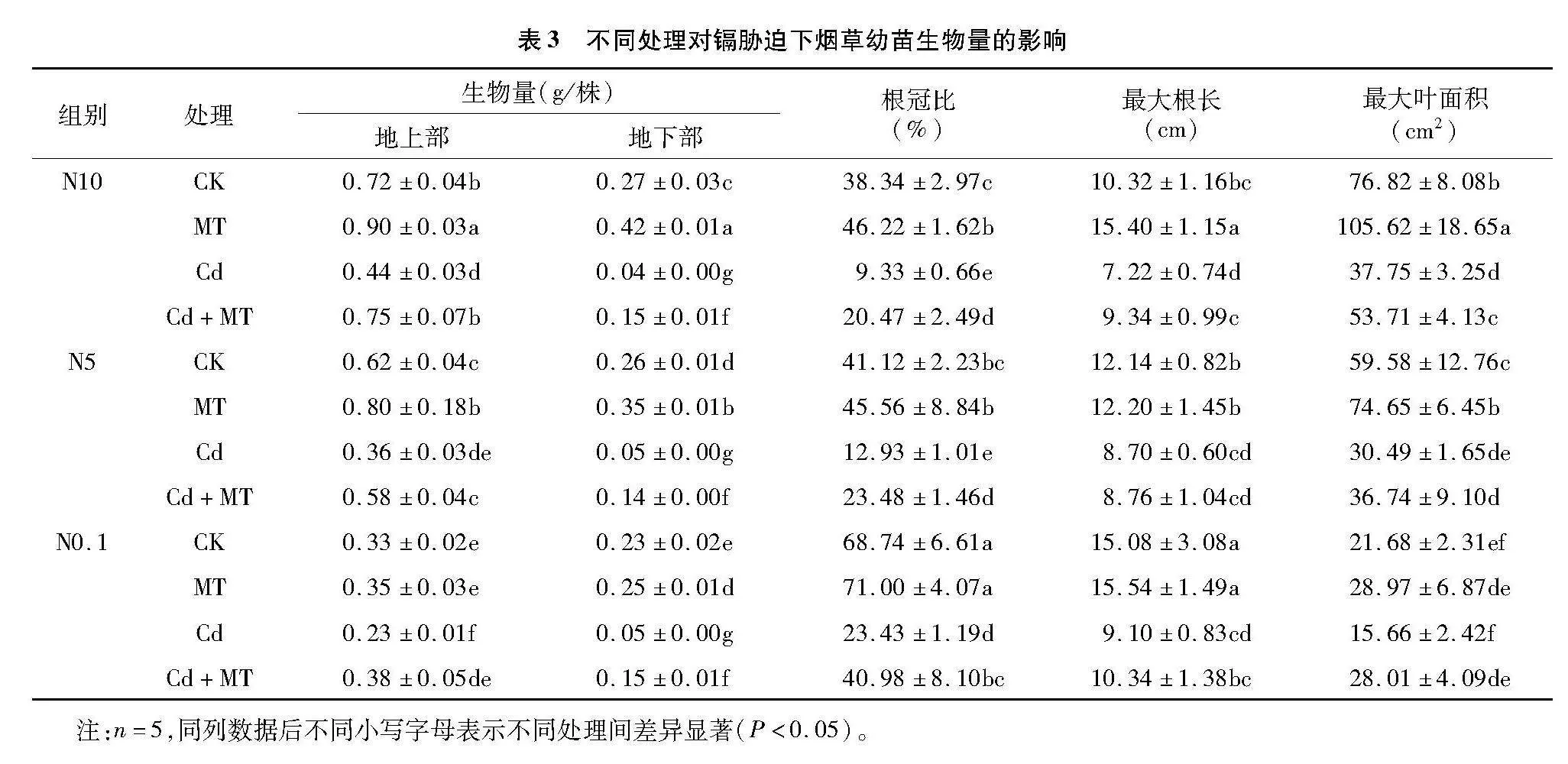
2.1" 不同处理对镉胁迫下烟草幼苗生物量的影响
由表3可知,与空白对照组相比,Cd胁迫下烟草幼苗生物量、根冠比、最大根长、最大叶面积均显著下降,其中地上部生物量与最大叶面积随硝态氮浓度的增加而增加。喷施MT后生物量和根系表型得到显著缓解,且地上部生物量随硝态氮浓度的降低而降低,其中,地上部和根系生物量与Cd处理相比分别显著提高了70.45%、61.11%、65.22%和275.00%、180.00%、200.00%,总生物量与Cd处理相比分别提高了87.50%、75.61%、89.28%,根冠比与Cd处理相比分别显著提高了119.40%、81.59%、74.90%,最大叶面积与Cd处理相比分别提高了42.28%、20.50%、78.86%,表明硝态氮和外源MT的增施可提高烟草幼苗生物量,促进烟草幼苗生长,有效缓解镉对烟草幼苗的毒害作用。
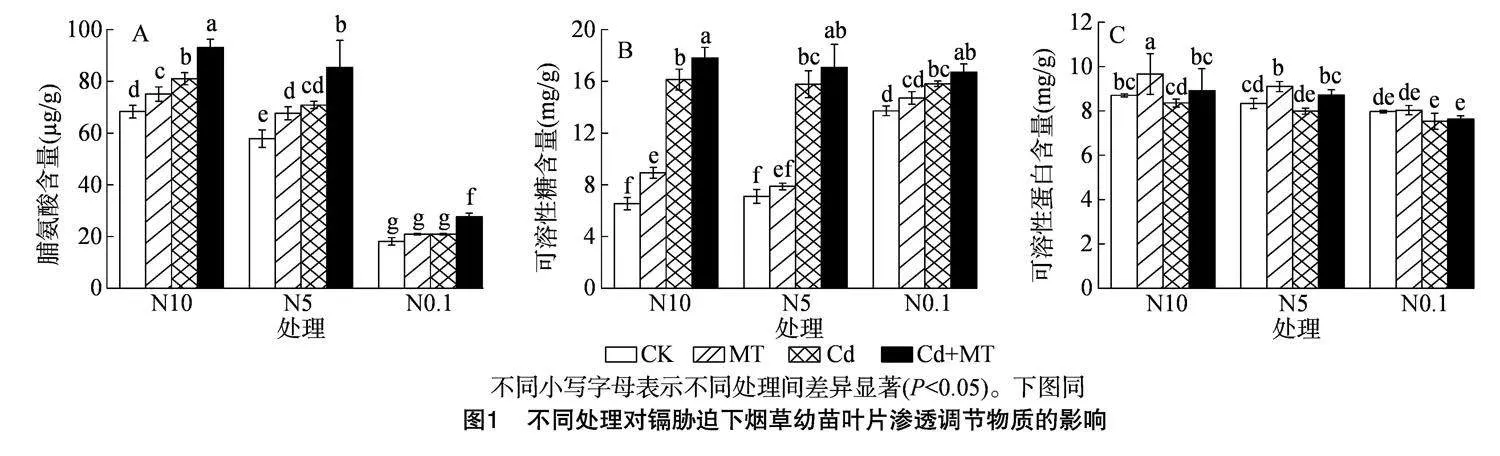
2.2" 不同处理对镉胁迫下烟草幼苗叶片渗透调节物质含量的影响
由图1可知,与空白对照相比,除N0.1处理的脯氨酸外,Cd胁迫下烟草幼苗叶片脯氨酸和可溶性糖含量均显著提高,可溶性蛋白含量下降不显著,其中脯氨酸与可溶性蛋白含量随着硝态氮浓度的增加而增加。与Cd处理相比,外施MT后各渗透调节物质含量出现不同程度的增加,其含量也随硝态氮浓度的增加而增加,其中脯氨酸含量显著增加,可溶性糖含量的增长幅度随着硝态氮浓度的增加而增加,N0.1、N5、N10的可溶性糖含量涨幅分别为5.69%、8.24%、10.41%,说明硝态氮与外源MT互作可促进烟苗渗透调节物质的生成,增强烟苗抗逆性,缓解Cd胁迫。
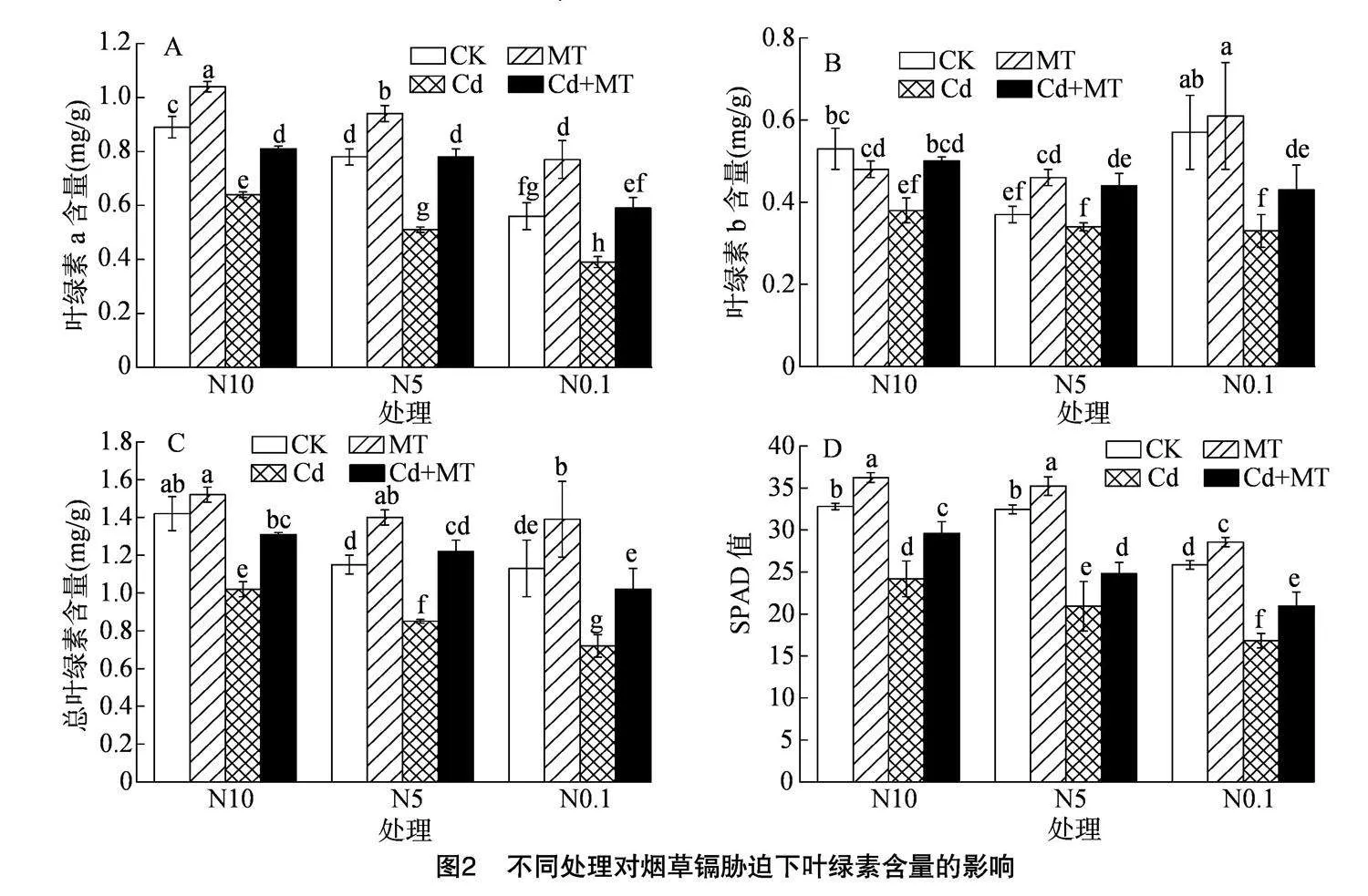
2.3" 不同处理对烟草镉胁迫下叶绿素含量的影响
由图2可知,Cd胁迫下,除N5处理的叶绿素b含量外,烟苗叶绿素a、叶绿素b、总叶绿素含量和SPAD值均显著下降,其中叶绿素a、总叶绿素、SPAD
值在各硝态氮水平间差异显著,与CK相比,Cd胁迫下N10、N5、N0.1处理间叶绿素a含量降幅分别为28.09%、34.62%、30.36%,叶绿素b含量降幅分别为28.30%、8.11%、42.11%,总叶绿素含量降幅分别为28.17%、26.09%、36.28%,SPAD值降幅分别为26.28%、35.55%、34.91%。喷施 100 μmol/L MT后各处理间叶绿素a含量、叶绿素b含量、总叶绿素含量和SPAD值均显著提高,其中,总叶绿素含量随硝态氮浓度的增加而增加,说明硝态氮的增施可有效促进外源MT在烟草镉胁迫中的缓解作用,促进烟苗生长。
2.4" 不同处理对镉胁迫下烟草幼苗叶片硝酸盐含量的影响
由图3可知,不同硝态氮水平及外源MT的喷施会在不同程度上影响Cd胁迫下烟叶的硝酸盐含量。与CK相比,Cd胁迫下,硝酸盐含量随硝态氮浓度的下降而显著下降,含量分别为147.04、119.82、60.05 μg/g;外源喷施MT后,各处理硝酸盐含量呈现不同程度的降低,其降幅分别为42.08%、34.63%、12.89%,其中N10和N5处理下硝酸盐含量显著降低,说明外源喷施MT可有效降低硝酸盐含量,N10处理下外源MT对烟叶硝酸盐含量的降低效果最明显,结合烟叶氮代谢酶活性的表现情况推测,可能是由于硝态氮与外源MT互作在促进氮同化作用的同时也促进了氮素吸收作用。
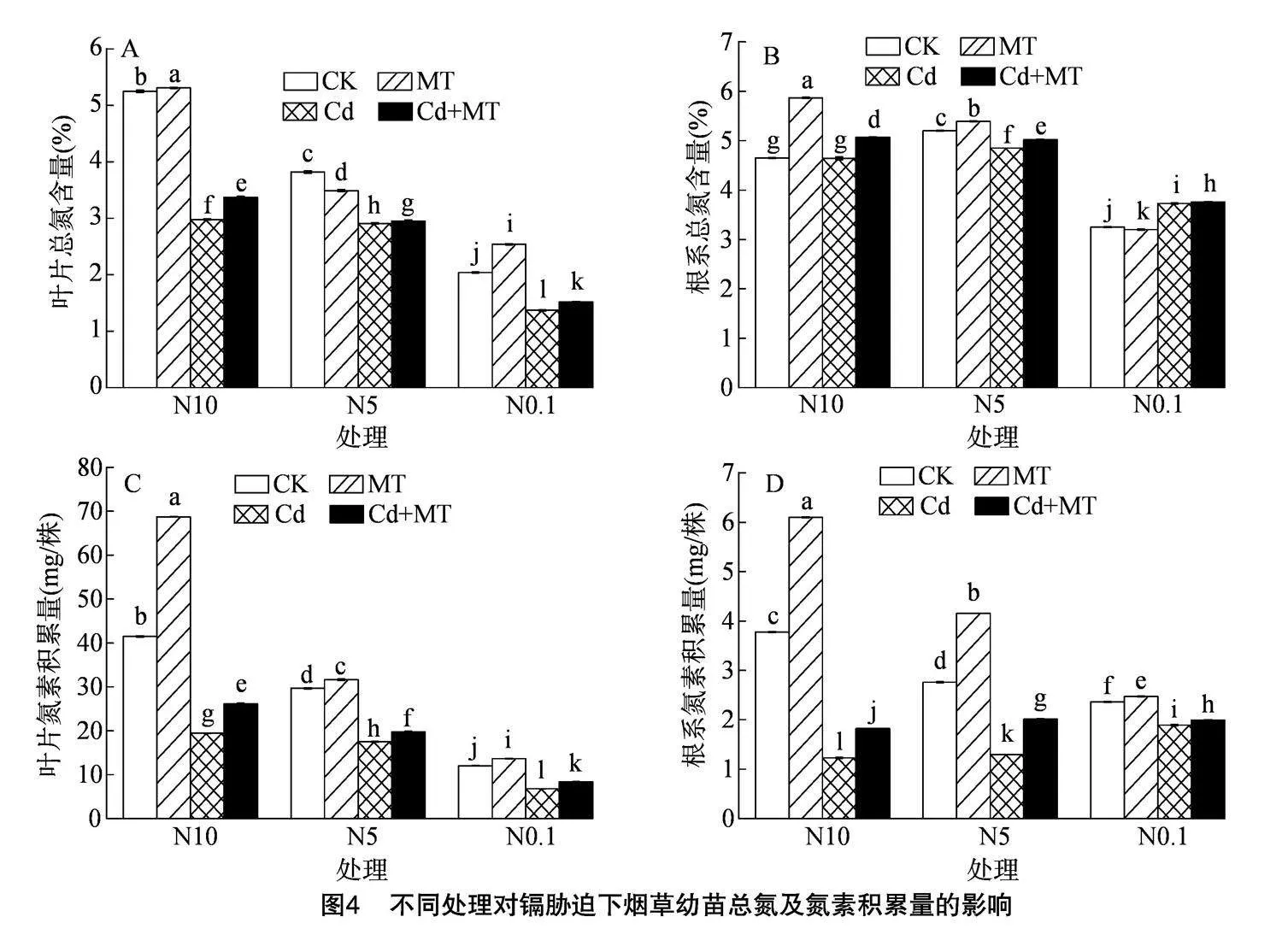
2.5" 不同处理对镉胁迫下烟草幼苗总氮含量和氮素积累量的影响
由图4可知,在不同硝态氮水平下,20 μmol/L镉胁迫对烟叶和烟苗根系的总氮含量和氮素积累量的影响不同。其中,在N10和N0.1处理中,镉胁迫15 d后,与CK相比,烟叶总氮含量和氮素积累量
均呈下降趋势,根系总氮含量随硝态氮含量的减少呈先上升后下降的变化趋势,而氮素积累量呈上升的变化趋势。外源喷施100 μmol/L MT后,各处理的总氮含量和氮素积累量均显著提高,烟叶和根系总氮含量和烟叶氮素积累量随硝态氮浓度的增加而增加,其中N10处理的烟叶和根系的总氮含量分别增加了13.09%、9.27%,氮素积累量分别增加了34.35%、47.97%%;N0.1处理的烟叶和根系的总氮含量分别增加了10.94%、0.80%,氮素积累量分别增加了23.01%、5.29%。
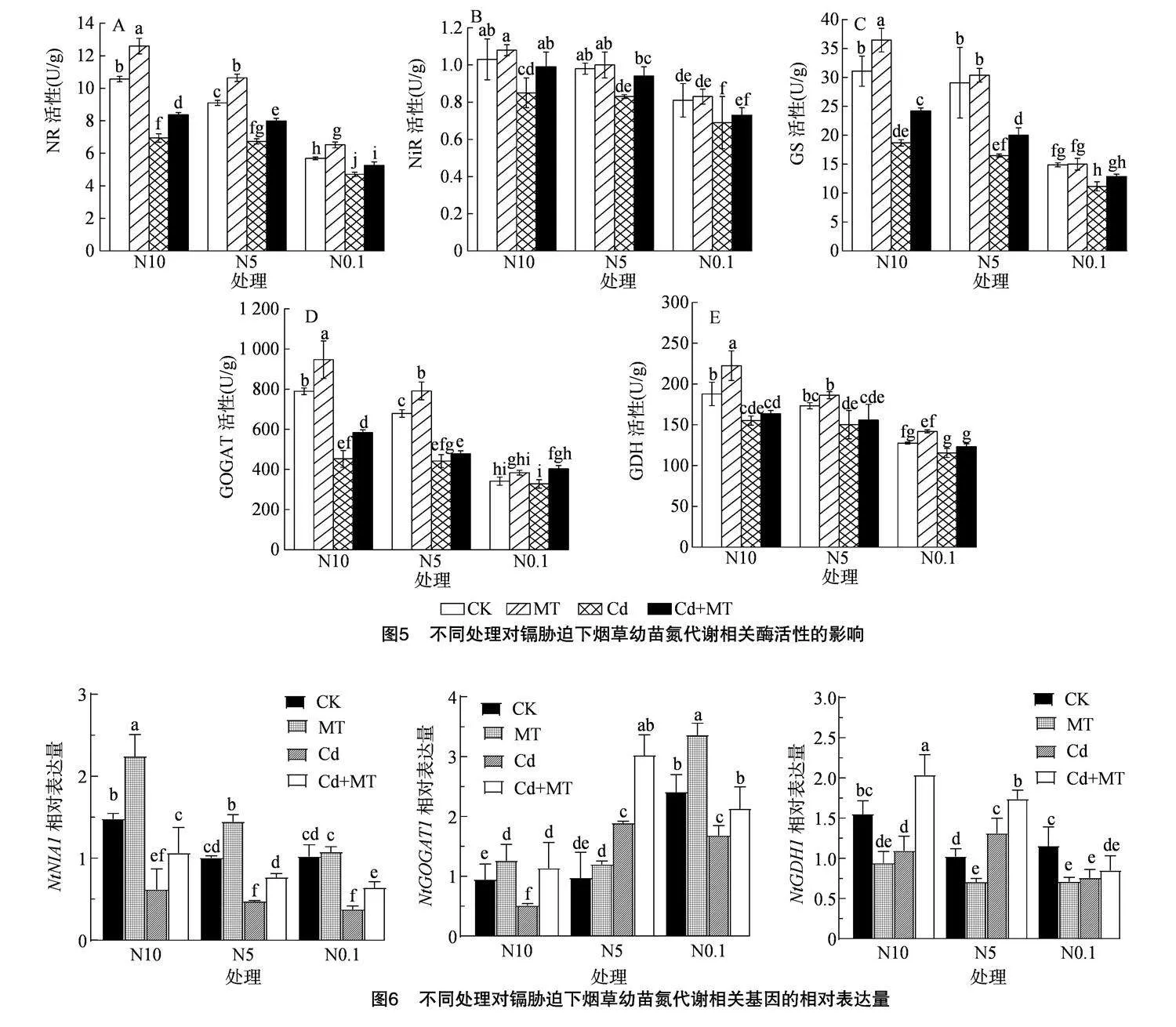
2.6" 不同处理对镉胁迫下烟草幼苗叶片氮代谢酶活的影响
由图5可知,Cd胁迫在不同程度上抑制了烟叶中NR、NiR、GS、GOGAT、GDH活性,与N5处理相比,N10处理的NR、NiR、GS、GOGAT、GDH活性有所增加,N0.1处理的酶活性显著降低;Cd胁迫下,外源MT处理后,各氮代谢酶活性在不同程度上有所增加,其中N10处理中NR、NiR、GS、GOGAT活性分别显著增加了20.61%、16.47%、29.60%、28.88%,N0.1 处理中NR、GS、GOGAT分别增加了11.46%、15.32%、22.79%,各氮代谢酶活性随硝态氮浓度的增加而增加,说明Cd胁迫下,硝态氮与外源MT互作可有效提高烟苗氮代谢相关酶活性,促进氮的吸收,促进烟苗生长,从而缓解镉毒害。
2.7" 不同处理对镉胁迫下烟草幼苗氮代谢相关基因表达的影响
对烟苗氮代谢相关基因表达进行分析,结果如图6所示,与CK相比,Cd胁迫下N10和N0.1处理显著下调了NtNIA1、NtGOGAT1、NtGDH1的表达。Cd胁迫下外施MT可促进氮代谢相关基因的表达,与Cd处理相比,N10水平下Cd+MT处理分别显著提高了72.58%、119.23%、68.18%,N0.1水平下Cd+MT处理分别提高了68.42%、26.04%、11.84%。与N5处理相比,N10正反馈调节了烟苗中的NtNIA1、NtGDH1的表达,N0.1下调了烟苗中NtNIA1、NtGOGAT1、NtGDH1表达,说明了在Cd胁迫下,硝态氮可促进MT上调烟草幼苗氮代谢基因的表达,MT和硝态氮可促进烟苗氮代谢的进行。
3" 讨论与结论
随着工业化及城市化的迅速发展,我国的土壤环境安全日益严重,镉作为烟草非必需的重金属元素,具有毒性强、环境移动性大的特点,对植物发育相关的代谢过程有负面影响,例如抑制植物生物量、阻断叶绿素生物合成、破坏叶绿体超微结构和抑制光合作用活性[26-28]。
植物生物量可直观地展现出植株的表观特征。本研究发现,Cd胁迫下烟草幼苗生长受到严重抑制,生物量积累显著降低,根系形态收到严重抑制。褪黑素可通过调节烟草幼苗的生物量和最大叶面积,来影响烟苗的形态特性。硝态氮和外源MT的增施可提高烟草幼苗生物量,促进烟草幼苗生长。高氮处理下外施MT可有效促进外源MT缓解镉对烟草幼苗根系的毒害作用。本研究发现,外施褪黑素后根系生物量和根冠比的增长量随硝态氮的增加而增加。此外,与正常氮(N5)处理相比,高硝态氮(N10)处理提高了烟草幼苗的生物量和最大叶面积。结果表明,褪黑素可显著增加烟苗生物量的积累,硝态氮处理显著影响了镉胁迫下烟草幼苗的农艺性状,这与王金香等的研究结果[29-31]一致。
硝态氮是叶绿素和蛋白质的组成成分[32]。本研究中,各处理叶绿素含量随硝态氮浓度的增加而增加。已有研究表明,水分胁迫下增施硝态氮可促进葡萄幼苗光合色素的合成,提高光合色素含量[33]。陈海宁等发现,配施不同硝态氮含量的硝基复合肥时玉米幼苗叶绿素含量、生物量随着硝态氮含量的增加而增加,这说明硝态氮可促进植物色素的合成[25]。本研究中,Cd胁迫下烟草叶片叶绿素含量显著下降,表明重金属Cd阻碍了光合色素的形成,破坏了光合系统。外源MT处理后叶绿素a、叶绿素b、总叶绿素含量和SPAD值显著增加,喷施MT对Cd胁迫下叶绿素含量有一定的积极作用,这与Tang等的研究结果[33]一致。其中,叶绿素a、叶绿素b、总叶绿素含量和SPAD值随硝态氮浓度的增加呈上升趋势,这说明硝态氮可促进叶绿素的合成,促进光合效率。
硝酸盐一旦储藏便很难被利用,植物对硝态氮吸收能力大于还原能力是造成硝酸盐积累的主要原因[34]。硝态氮进入植株体内后,一部分会被储存于液泡中暂时不被同化[35]。与王美华的研究结果[36]相似,本试验中,N10和N5水平下外源MT的喷施均会显著降低Cd胁迫下烟叶的硝酸盐含量,且随着硝态氮浓度的下降,烟叶硝酸盐含量降低,低氮条件下硝酸盐含量最少。根据烟叶和根系中的总氮含量与氮素积累量进行分析发现,除低氮(N0.1)处理的根系总氮含量外,镉胁迫15 d后,烟苗总氮和氮素积累量均呈下降趋势。在添加MT后,各处理的总氮和氮素积累量均显著提高,其中叶片及根系总氮和烟叶氮素积累量随硝态氮浓度的增加而增加。一方面说明,硝态氮和外源MT的增施可增加烟叶生物量积累,从而使烟叶氮素积累量呈现增加趋势;另一方面表明,硝态氮和外源MT的增施能提高氮同化能力,促进烟株氮代谢,对增加生物量积累和烟苗素质有积极作用。
NR、NiR、GS、GOGAT和GDH酶在氮代谢中起重要作用[37]。NR是植物中氮获取的主要来源,并调节NO(被认为是植物中的中心信号分子)的合成,此外GS在植物氮代谢中也起着重要作用[38],在本研究中,MT和硝态氮处理对烟苗中的氮代谢酶活性有显著影响,外源添加褪黑素后与N5处理相比,N10处理对NR、NiR、GS、GOGAT、GDH均有正向影响,本研究结果与之前的报告[39]一致。说明MT和N10处理可有效促进这5种氮代谢酶的活性,促进氮代谢。烟草硝酸还原酶基因NtNIA1的高表达可增加种子蛋白质的积累量,从而影响烟草的品质[40]。NtGOGAT1和NtGDH1基因表达量与氮素形态有关,铵态氮的增加会增加NtGOGAT1和NtGDH1基因的表达量[41]。本研究中,外源MT的增施可上调NtNIA1、NtGOGAT1、NtGDH1的表达,与N5处理相比,N10处理正反馈调节了烟苗中的NtNIA1、NtGDH1的表达;N0.1下调了烟苗中NtNIA1、NtGOGAT1、NtGDH1表达,说明Cd胁迫下增施MT和硝态氮可促进氮代谢相关基因的表达。另外,研究发现,重金属胁迫下植物体内脯氨酸、可溶性蛋白和可溶性糖含量增加,从而保护细胞膜结构和调节细胞质的渗透平衡[42]。本研究结果与之相似,本试验中,镉胁迫下N10和N5处理的脯氨酸和可溶性糖含量显著增加,而外源褪黑素的施用则进一步促进了脯氨酸、可溶性蛋白和可溶性糖含量的提高,且含量随硝态氮浓度的增加而增加,说明高硝态氮与外源MT的增施可促进烟苗渗透调节物质的生成,增强烟苗抗逆性,缓解Cd胁迫。
综上所述,本研究结果表明,以100 μmol/L褪黑素和高硝态氮(10 mmol/L)配施对Cd胁迫下的烟草幼苗渗透调节及氮代谢的正向调控效果最佳。短期高氮条件下,配施褪黑素能通过降低烟叶中硝酸盐含量并提高氮代谢相关酶活性来提高烟草氮代谢水平,促进烟草幼苗对氮的吸收,进而提高烟苗对Cd胁迫的耐受性。同时,褪黑素还可以增加烟苗体内渗透调节物质含量来维持体内的渗透平衡。
参考文献:
[1]邓小鹏,何" 莲,夏" 妍,等. 不同固化剂对土壤Cd的固化及烟草地上部Cd含量的影响[J]. 江苏农业科学,2017,45(3):246-249.
[2]吕怡颖,郑元仙,王继明,等. 外源褪黑素对镉胁迫烟草幼苗的缓解效应[J]. 中国烟草科学,2023,44(4):25-32.
[3]冯文静,高" 巍,孙苗苗,等. 茉莉酸甲酯对小麦幼苗生长及镉积累的影响[J]. 农业环境科学学报,2022,41(5):933-942.
[4]李小雪,汪" 毅,许" 超,等. 氮素抑制剂对水稻吸收转运镉的影响[J]. 中国环境科学,2023,43(6):3034-3041.
[5]Arnao M B,Hernández-Ruiz J. Melatonin:a new plant hormone and/or a plant master regulator?[J]. Trends in Plant Science,2019,24(1):38-48.
[6]Arnao M B,Hernández-Ruiz J. Melatonin:plant growth regulator and/or biostimulator during stress?[J]. Trends in Plant Science,2014,19(12):789-797.
[7]向" 君,樊利华,张楠楠,等. 施磷对干旱胁迫下箭竹根际土壤养分及微生物群落的影响[J]. 生态学报,2021,41(23):9422-9431.
[8]Janas K M,Posmyk M M. Melatonin,an underestimated natural substance with great potential for agricultural application[J]. Acta Physiologiae Plantarum,2013,35(12):3285-3292.
[9]Li X,Ahammed G J,Zhang X N,et al. Melatonin-mediated regulation of anthocyanin biosynthesis and antioxidant defense confer tolerance to arsenic stress in Camellia sinensis L.[J]. Journal of Hazardous Materials,2021,403:123922.
[10]Gong X Q,Shi S T,Dou F F,et al. Exogenous melatonin alleviates alkaline stress in Malus hupehensis Rehd. by regulating the biosynthesis of polyamines[J]. Molecules,2017,22(9):1542.
[11]Meng J F,Xu T F,Wang Z Z,et al. The ameliorative effects of exogenous melatonin on grape cuttings under water-deficient stress:antioxidant metabolites,leaf anatomy,and chloroplast morphology[J]. Journal of Pineal Research,2014,57(2):200-212.
[12]Siddiqui M H,Alamri S,Al-Khaishany M Y,et al. Exogenous melatonin counteracts NaCl-induced damage by regulating the antioxidant system,proline and carbohydrates metabolism in tomato seedlings[J]. International Journal of Molecular Sciences,2019,20(2):353.
[13]Yamamoto H A,Mohanan P V. Effects of melatonin on paraquat or ultraviolet light exposure-induced DNA damage[J]. Journal of Pineal Research,2001,31(4):308-313.
[14]Siddiqui M H,Alamri S,Nasir Khan M,et al. Melatonin and calcium function synergistically to promote the resilience through ROS metabolism under arsenic-induced stress[J]. Journal of Hazardous Materials,2020,398:122882.
[15]Wang P,Sun X,Li C,et al. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research,2013,54(3):292-302.
[16]Wang P,Yin L H,Liang D,et al. Delayed senescence of apple leaves by exogenous melatonin treatment:toward regulating the ascorbate-glutathione cycle[J]. Journal of Pineal Research,2012,53(1):11-20.
[17]Chu L C,Offenborn J N,Steinhorst L,et al. Plasma membrane calcineurin B-like calcium-ion sensor proteins function in regulating primary root growth and nitrate uptake by affecting global phosphorylation patterns and microdomain protein distribution[J]. New Phytologist,2021,229(4):2223-2237.
[18]Trevisan S,Botton A,Vaccaro S,et al. Humic substances affect Arabidopsis physiology by altering the expression of genes involved in primary metabolism,growth and development[J]. Environmental and Experimental Botany,2011,74:45-55.
[19]Castro Marín I,Loef I,Bartetzko L,et al. Nitrate regulates floral induction in Arabidopsis,acting independently of light,gibberellin and autonomous pathways[J]. Planta,2011,233(3):539-552.
[20]Liu W X,Zhang C J,Hu P J,et al. Influence of nitrogen form on the phytoextraction of cadmium by a newly discovered hyperaccumulator Carpobrotus rossii[J]. Environmental Science and Pollution Research International,2016,23(2):1246-1253.
[21]潘" 维,徐茜茹,卢" 琪,等. 不同氮形态对镉胁迫下小白菜生长及镉含量的影响[J]. 植物营养与肥料学报,2017,23(4):973-982.
[22]Cataldo D A,Maroon M,Schrader L E,et al. Rapid colorimetric determination of nitrate in plant tissue by nitration of salicylic acid[J]. Communications in Soil Science and Plant Analysis,1975,6(1):71-80.
[23]全国烟草标准化技术委员会. 烟草及烟草制品" 水溶性糖的测定" 连续流动法:YC/T 159—2002[S]. 北京:中国标准出版社,2004.
[24]李玉静,冯雨晴,赵园园,等. 硝态铵态氮比例对不同氮效率烟草苗期氮素吸收及利用的影响[J]. 中国烟草学报,2023,29(1):23-35.
[25]陈海宁,胡兆平,李新柱,等. 不同硝态氮含量的硝基复合肥对玉米苗期生长及光合特性的影响[J]. 中国农学通报,2014,30(9):129-132.
[26]郭" 晖. 镉胁迫对小麦光合特性和根际土壤酶活性的影响[J]. 农业与技术,2022,42(16):14-17.
[27]刘金秀,张松彦,周" 建. 镉胁迫对刺槐幼苗生长与光合生理特性的影响[J]. 林业科学研究,2023,36(3):168-178.
[28]杨晓锋,姜永雷,蔺璟煜,等. 不同裂解温度生物炭对镉胁迫下烤烟生长特性和镉积累的影响[J]. 江苏农业科学,2023,51(9):227-233.
[29]王金香,张阿良,秦" 敏,等. 镉胁迫对玉米幼苗光合特性及活性氧代谢的影响[J]. 天津农业科学,2023,29(1):1-6.
[30]Luo B F,Du S T,Lu K X,et al. Iron uptake system mediates nitrate-facilitated cadmium accumulation in tomato (Solanum lycopersicum) plants[J]. Journal of Experimental Botany,2012,63(8):3127-3136.
[31]Asif M,Zora S,Ceylan Y,et al. Nitrogen supply in combination of nitrate and ammonium enhances harnessing of elevated atmospheric CO2 through improved nitrogen and carbon metabolism in wheat (Triticum aestivum)[J]. Crop and Pasture Science,2020,71(2):101.
[32]杨" 夕. 水分胁迫下施加硝态氮对葡萄幼苗氮素代谢及相关酶的影响[D]. 石河子:石河子大学,2018:35-46.
[33]Tang W,Liang L,Li R L,et al. Effects of exogenous melatonin on the growth and cadmium accumulation of lettuce under cadmium-stress conditions[J]. Environmental Progress amp; Sustainable Energy,2023,42(2):e14014.
[34]艾绍英,姚建武,黄小红,等. 蔬菜硝酸盐的还原转化特性研究[J]. 植物营养与肥料学报,2002,8(1):40-43.
[35]李晨阳,孔祥强,董合忠. 植物吸收转运硝态氮及其信号调控研究进展[J]. 核农学报,2020,34(5):982-993.
[36]王华美. 不同氮水平下外源褪黑素对大豆生长及氮同化能力的影响[D]. 大庆:黑龙江八一农垦大学,2021:59-63.
[37]谭玉娇,郭翠莲,王" 可,等. 不同铵硝比对烟株碳氮代谢酶活性及总糖、总氮含量的影响[J]. 江西农业学报,2022,34(4):21-27.
[38]沈" 丽,石" 磊,王" 曼,等. 不同氮素形态对延边烤烟几种关键酶活性的影响[J]. 延边大学农学学报,2011,33(1):25-29.
[39]王伟香,张锐敏,孙" 艳,等. 外源褪黑素对硝酸盐胁迫条件下黄瓜幼苗抗氧化系统的影响[J]. 园艺学报,2016,43(4):695-703.
[40]梁喜欢. 烟草低氮胁迫下与氮相关的生理机制及基因表达量研究[D]. 南昌:江西农业大学,2020:34-48.
[41]周" 炎,杨惠娟,史宏志,等. 烟草硝酸还原酶基因NIA1启动子互作蛋白的筛选[J]. 中国烟草学报,2019,25(1):116-121.
[42]张" 云. 吲哚乙酸及褪黑素对菊芋铝毒响应的调控作用[D]. 金华:浙江师范大学,2021:66-73.

