青檀内生和附生真菌群落多样性的季节性变化





摘要: 【目的】了解青檀(Pteroceltis tatarinowii) 内生和附生真菌的群落结构及其季节性特征,并探讨群落间的关系及多样性形成的可能原因。【方法】在不同季节分别采集野生青檀当季生长的健康枝条,采用组织分离和振荡清洗涂布平板法分离内生和附生真菌,并对其进行培养、鉴定以及群落多样性分析。【结果】青檀的内生和附生真菌群落主要由子囊菌门(Ascomycota) 构成,分别占94.78% 和87.62%。内生真菌主要包括拟茎点霉属(Phomopsis)、交链孢属(Alternaria) 和曲霉属(Aspergillus),三者合计占比为76.10%;拟茎点霉属和刺盘孢属(Colletotrichum) 在每个季节均出现;拟茎点霉属为第1 优势菌属,春、夏、秋、冬季占比分别为89.65%、43.51%、35.51% 和75.35%。附生真菌则主要由青霉属(Penicillium)、茎点霉属(Phoma) 和拟茎点霉属构成,三者合计占比为55.05%;每个季节均出现交链孢属、拟茎点霉属和刺盘孢属。春季时,内生真菌的多样性、丰富度和均匀度均低于附生真菌,而在夏、秋季则相反;冬季时,内生真菌的多样性和均匀度较低,但丰富度较高。2 个群落组成的相似度较高(Cs=0.76),无显著性差异(Pgt;0.05)。【结论】青檀的内生与附生真菌群落丰富且相似度高,存在明显的季节差异。季节更替导致青檀内外生态因子变化,从而驱动内生和附生真菌群落多样性的变化。
关键词: 青檀;内生真菌;附生真菌;群落多样性;季节变化
中图分类号: S718.81 文献标志码: A 文章编号: 1004–390X (2024) 05−0125−09
植物内生和附生真菌群落在生态系统功能中扮演着重要角色,能够促进植物凋落物的分解,推动生物地球化学循环[1-5]。内生真菌可增强宿主植物的生长、产量和抗逆性(如干旱、盐碱、病虫害等)[6-8]。因此,植物内生和附生真菌一直被视为植物健康和生产力的关键因素,研究其群落结构及动态关系对于理解真菌多样性、群落稳定性和生态系统功能具有重要意义[9]。尽管内生和附生真菌群落之间的距离小于1 mm,但其栖息地的生态环境却截然不同。附生真菌暴露在温度、湿度、紫外线等外部压力下,而内生真菌在宿主植物内部承受植物防御、营养和生物竞争等压力的筛选。季节更替是导致植物内外生态环境变化的主要原因,因此,研究植物附生和内生真菌群落结构及其季节性变化特征,对深入了解2 个群落间的关系具有重要意义。
目前,关于木本植物上真菌群落形成的驱动因素尚未明确。尽管已有一些关于植物内生和附生真菌的研究[10-13],但由于研究区域、植物种类和气候特点的差异,尚未形成共识性的预测模式或结论。青檀(Pteroceltis tatarinowii) 是中国特有的古老榆科(Ulmaceae) 植物,是石灰岩及钙质土壤植物群落中的先锋树种,主要生长于干旱、贫瘠、微碱性的山地。青檀具有饲用、药用、材用、生态防护等多种用途[14]。研究表明:青檀的枝条、叶片和果实中分布着丰富的内生真菌,且其菌群组成具有一定的组织特异性[15-16]。然而,关于青檀枝条内生和附生真菌群落结构的特征及其随季节变化的规律,以及2 个群落之间的动态关系,尚无相关文献报道。因此,本研究以野生青檀为试验对象,分别在不同季节采集当季生长的健康枝条,对其内生和附生真菌进行分离、培养和鉴定,并分析2 个群落结构随季节变化的特征,旨在了解内生和附生真菌群落的结构及其季节性变化特征,分析内生真菌与附生真菌之间的动态关系,探讨内生和附生真菌群落多样性形成的可能原因。研究结果可为植物内生和附生真菌的生理生态学功能、菌植协同进化、多样性维持机制等研究提供参考。
1 材料与方法
1.1 材料
分离培养基:青檀枝条100 g (煮汁)、马铃薯200 g (煮汁)、葡萄糖20 g、琼脂20 g、水1 000 mL,pH 为自然。诱导产孢培养基:青檀枝条100 g (煮汁)、麦芽浸粉10 g、酵母膏2 g、琼脂粉20 g、水1 000 mL,pH 5.8~6.2。
1.2 方法。
1.2.1 植物采集
2021 年春季(4 月)、夏季(7 月)、秋季(10 月)、冬季(12 月) 分别在安徽琅琊山野生青檀居群中,随机选取树龄和生长势基本一致的10 棵青檀植株并编号,用无菌剪刀从每株上剪取当季生长的健康枝条5 根,置于灭菌袋内,编号并低温保存。每个季节采集的植物样本均来源于上述编号植株。
1.2.2 附生真菌分离
在超净工作台上用无菌镊子小心取出枝条样本,用无菌剪刀剪取长约2 cm 的枝段,每个枝条各取1 段。将枝段放入装有50 mL 无菌磷酸钾缓冲液的锥形瓶中,在200 r/min 的摇床上振荡120 min,得到附生菌悬液。用无菌移液管吸取菌悬液0.5 mL 至分离培养基平板上,并用无菌玻璃涂棒均匀涂布;然后将平板置于28 ℃ 恒温培养箱中培养。在上述操作过程中,打开一空白平板作为对照,以检测工作环境的无菌状况。
1.2.3 内生真菌分离
取出上述用于分离附生真菌的枝段,用无菌水冲洗2~3 次;将其置于70% 酒精中浸泡2 min,再用无菌水冲洗2~3 次;将其置于2% 次氯酸钠溶液中浸泡1 min,随后用无菌水冲洗2~3 次。将枝段剪成0.1~0.2 cm 的组织块,并将其接入分离培养基平板上,将平板置于28 ℃ 恒温培养箱中培养。在上述操作过程中,取最后1 次冲洗的无菌水作为对照涂布平板。
1.2.4 诱导产孢
制备诱导产孢培养基薄层平板,挑选上述试验中未产孢的真菌菌株,在无菌条件下接种于薄层平板上。将平板置于近紫外光下照射12 h,随后在黑暗中培养12 h,交替进行14 d。挑取培养物进行染色、制片,镜检是否有分生孢子产生。
1.2.5 真菌鉴定
无性型真菌种类的鉴定参考文献[17],有性型子囊菌种类的鉴定参考《真菌鉴定手册》[18]。参考国际权威分类网站(http://www.indexfungorum.org) 最新资料及《安·贝氏菌物词典(第10版)》[19],追踪真菌属的变动,最终确定真菌的分类地位。
1.2.6 真菌群落多样性分析
(1) 分离频率:指某个属的菌株数占所分离菌株总数的百分比,用于评价优势菌群的组成情况。
(2) Shannon-Wiener 多样性指数(H′ ):用于分析枝条内生及其附生真菌群落组成的多样性。计算公式为:H′= -ΣSi=1Pi lnPi;Pi=Ni/N。式中:Pi 为第i 个物种的相对丰度;S 为物种数; Ni 为第i 个物种的个体数,i=1,2,3,4…S;N 为个体总数。
(3) Margalef 丰富度指数(R):用于分析内生和附生真菌群落组成的丰富度。计算公式为:R=(S-1)/log2N。
(4) 均匀度指数(E):用于分析内生和附生真菌群落分布的均匀程度。计算公式为:E=H′/lnS。
(5) Sorenson 相似性指数(Cs):用于分析内生和附生真菌群落组成的相似性程度。计算公式为:Cs=2j/(a+b)。式中:j 为不同季节内生或附生真菌的共有属数;a 为某一季节内生或附生真菌的属数;b 为另一季节内生或附生真菌的属数。
(6) 优势度曲线:根据分离频率的大小进行排序,通过累积百分数绘制优势度曲线,用于直观展示内生和附生真菌群落分布的丰富度和均匀度。
采用SPSS 16.0 进行费舍尔检验,以判断和分析内生和附生真菌群落组成的差异程度。
2 结果与分析
2.1 真菌群落结构的特征
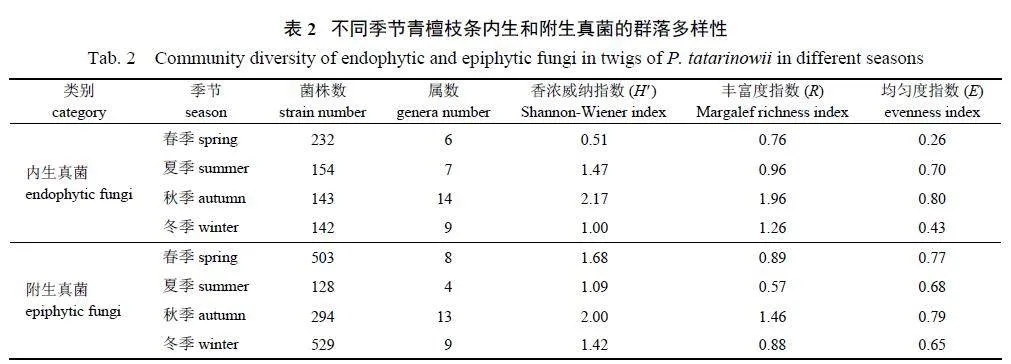
由表1 可知:4 个季节共分离内生真菌671株、附生真菌1 454 株,其中,内生真菌隶属于2门7 纲16 目18 科20 属,附生真菌隶属于2 门6纲10 目13 科14 属。
在门水平上,青檀内生真菌和附生真菌均主要由子囊菌门(Ascomycota) 组成,分别占94.78%和87.62%;其次为毛霉菌门(Mucoromycota),分别占3.43% 和2.96%。此外,经诱导产孢后,仍分别存在1.79% 和9.42% 的未产孢菌群。
在纲水平上,数量排名前3 的内生真菌为粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)和散囊菌纲(Eurotiomycetes),分别占76.00%、11.23% 和5.61%,合计占比为92.84%;附生真菌则以座囊菌纲、散囊菌纲和粪壳菌纲为主,分别占32.43%、28.36% 和26.76%,合计占比为87.55%。
在目水平上,数量排名前3 的内生真菌为间座壳菌目(Diaporthales)、格孢腔菌目(Pleosporales)和散囊菌目(Eurotiales),分别占64.23%、8.80%和5.61%,合计占比为78.64%;附生真菌则主要由散囊菌目、格孢腔菌目和间座壳菌目构成,分别占28.36%、19.88% 和12.59%,合计占比为60.83%。
在科水平上,数量排名前3 的内生真菌为间座壳科(Diaporthacea)、多孢菌科(Pleosporaceae) 和小丛壳科(Glomerellaceae),分别占64.23%、6.86%和3.87%,合计占比为74.96%;附生真菌则主要由曲霉科(Aspergillaceae)、亚隔孢壳科(Didymellaceae)和间座壳科组成,分别占28.36%、18.71%和12.59%,合计占比为59.66%。
在属水平上,数量排名前3 的内生真菌为拟茎点霉属(Phomopsis)、交链孢属(Alternaria) 和曲霉属(Aspergillus),分别占64.23%、6.86% 和5.01%,合计占比为76.10%;附生真菌则以青霉属(Penicillium)、茎点霉属(Phoma) 和拟茎点霉属为主,分别占23.75%、18.71% 和12.59%,合计占比为55.05%。
2.2 真菌群落组成随季节更替的变化特征
由表2 可知:春、夏、秋、冬季分别分离内生真菌232、154、143 和142 株,分别分离附生真菌503、128、294 和529 株。每个季节均出现的内生真菌包括拟茎点霉属和刺盘孢属(Colletotrichum),且均以拟茎点霉属为第1 优势菌群,其在4 个季节的分离频率分别为89.65%、43.51%、35.51% 和75.35% (表1)。内生真菌的组成存在季节特异性,例如,仅在春季出现大茎点霉属(Macrophoma),夏季出现壳二孢属(Ascochyta) 和痂圆孢属(Sphaceloma),秋季则出现枝孢霉属(Glomerella)、腐质霉属(Humicola) 和阜孢属(Papularia),而冬季则出现壳针孢属(Septoria) 和双珠霉属(Dimargaris)。每个季节中均出现的附生真菌包括交链孢属、拟茎点霉属和刺盘孢属。附生真菌的组成也存在季节特异性,如双珠霉属仅在春季出现,叶点霉属(Phyllosticta)、盘多毛孢属(Pestalotia)和粉孢属(Oidium) 等仅在秋季出现。
2.3 真菌群落的多样性
由表2 还可知:青檀内生真菌群落的多样性、丰富度和均匀度均以秋季最高,而以春季最低;附生真菌群落的多样性、丰富度和均匀度也以秋季最高,但其在夏季的多样性和丰富度最低,冬季的均匀度最低。由表3 可知:青檀枝条内生真菌群落的丰富度指数高于附生真菌,而多样性指数和均匀度指数均低于附生真菌。
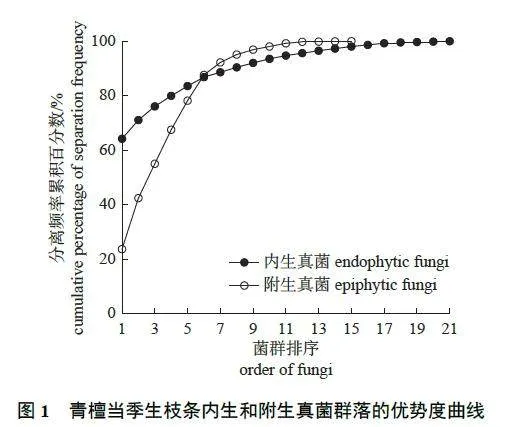
由图1 可知:青檀内生真菌的菌群数量多于附生真菌的菌群数量,且内生真菌群落中的第1 优势菌群占比高于附生真菌群落的第1 优势菌群占比。青檀内生真菌的优势度曲线变化相对平缓,而附生真菌的优势度曲线在早期上升较快,随后逐渐趋于平缓,这表明内生真菌主要受到植物特性调节,相对变化较为稳定;而附生真菌则主要受到外界环境影响,变化相对不稳定。
2.4 真菌群落多样性随季节更替的变化特征
由图2 可知:在秋季,青檀内生真菌的第1 优势菌群相对较低(35.51%),曲线变化平缓;而春季内生真菌群落的第1 优势菌群占比较高(89.65%);夏季的优势度曲线在早期上升较为迅速,随后逐步趋于平缓。虽然附生真菌群落的多样性、丰富度和均匀度均在秋季达到最高,但其第1 优势菌群占比相对较低(26.53%),曲线变化较为平缓;虽然夏季附生真菌群落的多样性和丰富度最低,但其第1 优势菌群占比较高(46.09%),曲线上升迅速。结合表2 可知:内生和附生真菌之间随着季节更替存在一定的演化关系。春季,附生真菌群落的多样性、丰富度和均匀度均大于内生真菌群落;夏季和秋季则与春季相反;冬季,附生真菌群落的多样性和均匀度大于内生真菌群落,但其丰富度小于内生真菌群落。
2.5 内生和附生真菌群落的相似性
由表1 和表4 可知:除未产孢菌群外,青檀内生和附生真菌2 个群落的共有属为13 个,相似性指数(Cs) 为0.76。春季,青檀内生和附生真菌群落的共有属为6 个,Cs 为0.86;夏季,2 个群落的共有属为4 个,Cs 为0.73;秋季,2 个群落的共有属为10 个,Cs 为0.77;冬季,2 个群落的共有属为4 个,Cs 为0.44。
费舍尔精确检验结果(表5) 表明:青檀内生真菌的群落组成在春季与秋季之间存在极显著差异(Plt;0.01),夏季与秋季之间存在显著差异(Plt;0.05),在其余季节之间无显著差异(Pgt;0.05)。青檀附生真菌的群落组成在夏季与秋季之间存在极显著差异(Plt;0.01),夏季与冬季之间存在显著差异(Plt;0.05),而在其余季节之间无显著差异(Pgt;0.05)。春季内生真菌的群落组成与秋季附生真菌的群落组成存在显著差异(Plt;0.05);秋季内生真菌的群落组成与春季附生真菌的群落组成存在显著差异(Plt;0.05),与夏季附生真菌的群落组成存在极显著差异(Plt;0.01);冬季内生真菌的群落组成与夏季附生真菌的群落组成存在显著差异(Plt;0.05);其余内生真菌与附生真菌的群落组成之间无明显的季节差异(Pgt;0.05)。
3 讨论
3.1 季节性变化对内生真菌群落的影响
植物体内外广泛存在种类丰富、结构多样、功能复杂的真菌群落,且与宿主植物密切相关[20-25]。OSONO[11]在研究山茶叶片内生真菌群落组成随季节性变化时发现:随着春、夏、秋、冬的更替,内生真菌的侵染率和数量逐渐增加,且随着时间的推移,内生真菌种类的丰富度也逐渐增加。在本研究中,随着春、夏、秋、冬的演化更替,野生青檀枝条内生真菌的数量逐渐减少,秋季的属数最多,而春季的属数最少。GUO 等[22]在研究北京油松枝条的内生真菌时发现:春季内生真菌的分离频率最高,且4 个季节分布的常见种类包括交链孢属、半壳孢属、拟盘多毛孢属、茎点霉属和拟茎点霉属5 个菌群,而不同季节的内生真菌群落组成没有显著差异。此外,MARTINS 等[26]对橄榄树内生真菌群落的研究发现:春季内生真菌的多样性高于秋季,且不同季节群落组成的相似性较低,常见种类包括拟茎点霉属、镰刀菌属和木霉属3 个菌群。本研究发现:在青檀枝条的内生真菌中,拟茎点霉属和刺盘孢属2个菌群在4 个季节中均有分布,春季与秋季的内生真菌群落组成存在极显著差异(Plt;0.01),夏季与秋季的内生真菌群落组成存在显著差异(Plt;0.05)。以上研究结果存在差异的原因,除了植物内生真菌群落组成和分布受宿主植物种类、地理分布、组织部位等因素的影响外,可能还与研究样本自身的差异有关。本研究选取野生青檀当季生嫩枝为样本,有助于探究季节性环境因素变化与相应季节枝条内生真菌群落之间的相关性。
不同季节青檀内生真菌的菌群结构具有一定的共性和季节特异性。例如春、夏、秋、冬4 个季节均出现了拟茎点霉属和刺盘孢属,其中拟茎点霉属分别占89.65%、43.51%、35.51% 和75.35%,刺盘孢属分别占0.86%、0.49%、9.42% 和0.70%;但仅在春季出现大茎点霉属,夏季出现壳二孢属和痂圆孢属,秋季出现枝孢霉属、腐质霉属和阜孢属,而冬季则出现壳针孢属和双珠霉属。研究表明:植物内生真菌中的一些种类能产生具有抗其他真菌的次级代谢活性物质,从而抑制其他真菌生长,使自身成为优势菌群,进而改变植物内生真菌的群落结构和功能[27-28]。此外,随着季节的更替,植物体内各种营养成分(如矿物质、糖类、蛋白质、粗脂肪等) 也在发生不同程度的变化。因此,推测植物营养物质成分的季节性变化会对其内生真菌产生影响,这可以在一定程度上解释青檀枝条中内生真菌群落多样性的季节性变化规律。
3.2 季节性变化对附生真菌群落的影响
在春季,日本京都大原野森林公园内山茶附生真菌的数量最多,而夏季最少[11];在本研究中,青檀附生真菌的数量在冬季最多,春季次之,夏季最少。植物附生真菌分布于植物表面,其主要受自然温度、湿度、降水、紫外线等气候环境因素的影响,也受植物表面结构、质地、营养等多种因素的影响。随着季节的变化,影响植物附生真菌种类和数量的诸多因素会发生规律性的变化,因此,植物附生真菌群落也会表现出相应的变化规律。例如,在秋季,青檀附生真菌群落的多样性、丰富度和均匀度最高,而在夏季的多样性和丰富度最低,冬季的均匀度最低;夏季与秋季的附生真菌群落组成存在极显著差异(Plt;0.01),而夏季与冬季的附生真菌群落组成存在显著差异(Plt;0.05),在其余季节之间则无显著差异(Pgt;0.05)。本次采集的青檀样本来自安徽省琅琊山森林公园,该地区的气候环境特征为夏季降水次数和降水量均高于其他季节,降水易冲刷植株枝条表面,从而降低附着在植物表面的灰尘和微生物数量。此外,夏季环境温度较高、湿度较低且干燥,紫外线辐射强度明显高于冬季。因此,青檀附生真菌群落的种类和数量均在夏季最少。
3.3 内生与附生真菌群落之间的季节性联系
本研究表明:附生真菌的数量多于内生真菌,但内生真菌的种类多于附生真菌。这一结果与对小果咖啡(Coffea arabica)、山茶(Camellia japonica)、山茱萸(Cornus stolonifera) 等植物的真菌研究结果[10-12]相似,但与对青檀叶片、油橄榄(Olea europaea)、圆叶菝葜(Smilax rotundifolia)等植物的真菌研究结果[15, 20-21]存在一定差异。这种差异可能主要来自选用的植物组织材料不同。本研究以当季生健康枝条为样本,而其他研究则使用了植物的叶、根或多年生枝条等。青檀内生和附生真菌群落的组成随着季节更替而发生规律性变化,且两者之间的关系密切。2 个群落的组成相似性程度较高, 且无显著性差异(Pgt;0.05)。在春季,青檀枝条内生和附生真菌群落的共有属为6 个,Cs 为0.86;在夏季,两者的共有属为4个,Cs 为0.73;在秋季,两者的共有属为10 个,Cs 为0.77;在冬季,两者的共有属为4 个,Cs 为0.44。因此,推测青檀枝条内生真菌群落中有较大一部分真菌来自青檀枝条表面的附生真菌。
青檀枝条内生和附生真菌群落受植物内外生态环境变化的影响,而季节更替是推动这种变化的根本原因。附生真菌主要受制于外界环境,而内生真菌则主要受控于宿主植物。外部是否具有能够入侵植物并成为内生真菌的附生真菌种类,取决于2 个方面。(1) 附生真菌能否承受外部环境中各种变化因素的考验,如紫外线、温度、降水等。在对木本植物油橄榄、木麻黄(Casuarinaequisetifolia)、可可树(Theobroma cacao) 的研究中,证实了一些内生真菌是来自空气或降雨传播的真菌定殖[20, 23-24]。(2) 附生真菌能否承受来自宿主植物内部的多种压力,如植物防御、营养和生物竞争等。研究表明:青檀枝条的内生和附生真菌中包括一些被认为是潜在植物病原菌的种类,如拟茎点霉属、刺盘孢属、交链孢属等,这些类群一般具有较强的侵染能力,一旦接触枝条表面,就能附着并侵入植物组织[25-26]。
宿主植物为内生真菌的生长代谢提供所需的营养物质,而分泌到植物组织表面的营养物是附生真菌的主要营养来源。有研究表明:植物的各种营养成分随着季节更替而发生变化[29-30],而真菌生长与营养成分之间存在密切联系[31]。因此,推测季节更替引发宿主植物营养成分种类和含量的变化,进而导致植物内生和附生真菌种类和数量的变化,最终形成植物内生和附生真菌群落结构的季节性变化。此外,紫外线强度在夏季最高,春季次之,秋季和冬季最低[32],紫外线对空气中或枝条表面真菌具有一定的杀伤作用,导致能够入侵植物组织的真菌种类和数量随季节更替而变化,从而影响真菌在植物中的定殖和生态分布。可见,营养物质和紫外线强度的季节性变化是驱动真菌群落多样性的重要因素。
4 结论
青檀枝条的内生与附生真菌群落关系密切,群落组成的相似性程度较高。季节更替引发植物内外生态环境因素的变化,从而驱动青檀内生和附生真菌群落多样性的规律性变化。研究结果为利用植物微生物群落生态调控手段调节植物健康生长提供了科学依据。
[ 参考文献 ]
[1]CLAY K, SCHARDL C. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses[J]. American Naturalist, 2002, 160(Sup.4): 99. DOI:10.1086/342161.
[2]OMACINI M, CHANETON E J, GHERSA C M, et al.Symbiotic fungal endophytes control insect host-parasite"interaction webs[J]. Nature, 2001, 409(6816): 78. DOI: 10.1038/35051070.
[3]AZIZ L, HAMAYUN M, RAUF M, et al. Endophytic"Aspergillus niger reprograms the physicochemical traitsof tomato under cadmium and chromium stress[J]. Environmental"and Experimental Botany, 2021, 186: 104456.DOI: 10.1016/j.envexpbot.2021.104456.
[4]FUKASAWA Y, OSONO T, TAKEDA H. Effects of attack of saprobic fungi on twig litter decomposition by endophytic"fungi[J]. Ecological Research, 2009, 24(5): 1067.DOI: 10.1007/s11284-009-0582-9.
[5]宋梅玲, 王玉琴, 王宏生, 等. 内生真菌对高寒草地紫花针茅凋落物分解的影响[J]. 草业学报, 2021, 30(9):150. DOI: 10.11686/cyxb2020462.
[6]谢佳伟, 彭小祠, 陈小巧, 等. 云烟87内生真菌多样性及其促生作用评估[J]. 云南农业大学学报(自然科学),2021, 36(6): 1000. DOI: 10.12101/j.issn.1004-390X(n).202102024.
[7]YOU Y H, YOON H, KANG S M, et al. Fungal diversity"and plant growth promotion of endophytic fungi"from six halophytes in suncheon bay[J]. Journal of Microbiology"and Biotechnology, 2012, 22(11): 1549. DOI:10.4014/jmb.1205.05010.
[8]ARNOLD A E, MEJIA L C, KYLLO D, et al. Fungal"endophytes limit pathogen damage in a tropical tree[J].Proceedings of the National Academy of Sciences of the"United States of America, 2003, 100(26): 15649. DOI:10.1073/pnas.2533483100.
[9]BERG G, GRUBE M, SCHLOTER M, et al. Unraveling"the plant microbiome: looking back and future perspectives[J]. Frontiers in Microbiology, 2014, 5: 148. DOI:10.3389/fmicb.2014.00148.
[10]JOHANNA S, PAUL B. Fungal epiphytes and endophytes"of coffee leaves (Coffea arabica)[J]. Microbial Ecology,2005, 50(1): 1. DOI: 10.1007/s00248-004-0002-1.
[11]OSONO T. Endophytic and epiphytic phyllosphere fungi"of Camellia japonica: seasonal and leaf age-dependent"variations[J]. Mycologia, 2008, 100(3): 387. DOI: 10.3852/07-110R1.
[12]OOSONO T. Endophytic and epiphytic phyllosphere fungi"of red-osier dogwood (Cornus stolonifera) in British"Columbia[J]. Mycoscience, 2007, 48: 47. DOI: 10.1007/s10267-006-0329-1.
[13]YAO H, SUN X, HE C, et al. Phyllosphere epiphytic and"endophytic fungal community and network structures differ"in a tropical mangrove ecosystem[J]. Microbiome,2019, 7(1): 57. DOI: 10.1186/s40168-019-0671-0.
[14]FANG S Z, LI G Y, FU X X. Biomass production and"bark yield in the plantations of Pteroceltis tatarinowii[J].Biomass amp; Bioenergy, 2004, 26(4): 319. DOI: 10.1016/j.biombioe.2003.08.005.
[15]柴新义, 柴钢青, 向玉勇, 等. 青檀叶片内生和附生真菌组成及生态分布[J]. 生态学报, 2016, 36(16): 5163.DOI: 10.5846/stxb201501290233.
[16]柴新义, 钟媛媛. 青檀果内生真菌菌群的组成及多样性[J]. 应用生态学报, 2017, 28(2): 636. DOI: 10.13287/j.1001-9332.201702.016.
[17]BARNETT H L, HUNTER B B. Illustrated genera of imperfect"fungi[M]. 4th ed. Saint Paul: The American Phytopatological"Society, 1998.
[18]"魏景超. 真菌鉴定手册[M]. 上海: 上海科学出版社,1979.
[19]KIRK P, CANNON P, MINTER D, et al. Ainsworth amp;Bisby’s dictionary of the fungi[M]. 10th ed. Wallingford:CABI Publishing, 2008.
[20]GOMES T, PEREIRA J A, BENHADI J, et al. Endophytic"and epiphytic phyllosphere fungal communities are"shapedby different environmental factors in a Mediterranean"ecosystem[J]. Microbial Ecology, 2018, 76: 668.DOI: 10.1007/s00248-018-1161-9.
[21]ZAMBELL C B, WHITE J F. In the forest vine Smilax"rotundifolia, fungal epiphytes show site-wide spatial correlation,while endophytes show evidence of niche partitioning[J]. Fungal Diversity, 2014, 75: 279. DOI: 10.1007/s13225-014-0316-3.
[22]GUO L D, HUANG G R, WANG Y. Seasonal and tissue"age influences on endophytic fungi of Pinus tabulaeformis"(Pinaceae) in the Dongling Mountains, Beijing[J].Journal of Integrative Plant Biology, 2008, 50(8): 997.DOI: 10.1111/j.1744-7909.2008.00394.x.
[23]ARNOLD A E, HERRE E A. Canopy cover and leaf age"affect colonization by tropical fungal endophytes: ecological"pattern and process in Theobroma cacao (Malvaceae)[J]. Mycologia, 2003, 95(3): 388. DOI: 10.1080/15572536.2004.11833083.
[24]BAYMAN P, ANGULO-SANDOVAL P, BAEZ-ORTIZ"Z, et al. Distribution and dispersal of Xylaria endophytes"in two tree species in Puerto Rico[J]. Mycological Research, 1998, 102(8): 944. DOI: 10.1017/S095375629700590X.
[25]臧威, 孙翔, 孙剑秋, 等. 南方红豆杉内生真菌的多样性与群落结构[J]. 应用生态学报, 2014, 25(7): 2071. DOI:10.13287/j.1001-9332.20140430.001.
[26]MARTINS F, PEREIRA J A, BOTA P, et al. Fungal endophyte"communities in above- and belowground olive"tree organs and the effect of season and geographic location"on their structures[J]. Fungal Ecology, 2016, 20: 193.DOI: 10.1016/j.funeco.2016.01.005.
[27]武艳霜, 陆悦, 朱作斌, 等. 药用植物中具有抗真菌活性的内生真菌及其次级代谢产物的研究[J]. 国外医药(抗生素分册), 2019, 40(4): 309. DOI: 10.3969/j.issn.1001-8751.2019.04.003.
[28]牛源. 植物内生真菌来源的抗真菌活性物质研究[D].长春: 吉林大学, 2017.
[29]邹薛, 扈嘉鑫, 袁虎威, 等. 代茶冬青不同季节叶片营养成分分析[J]. 天然产物研究与开发, 2023, 35(10): 1747.DOI: 10.16333/j.1001-6880.2023.10.011.
[30]崔璐瑶, 邱开阳, 李静尧, 等. 贺兰山岩羊可食植物营养成分沿海拔梯度变化及季节动态[J]. 生态学杂志,2023, 42(5): 1167. DOI: 10.13292/j.1000-4890.202304.032.
[31]杨丽萍. 外生菌根真菌土生空团菌液体培养条件及其营养生理的研究[D]. 呼和浩特: 内蒙古农业大学,2002.
[32]罗燕萍. 中国地表紫外线指数时空分布变化特征及影响因素分析[D]. 北京: 中国地质大学, 2018.
责任编辑:何承刚
基金项目:安徽省自然科学基金面上项目(2108085MC87);安徽省教育厅重点资助项目(KJ2020A0714);安徽省科技厅中央引导地方科技发展资助项目(202107d06020018)。

