胸腔镜肺段切除术后病人合并肺不张的危险因素及预测模型构建



Risk factors and construction of risk prediction model for patients with atelectasis after thoracoscopic segmental resection
CHEN Qianqian, PENG Jifang*, LIU Han
Jiangsu Provincial People's Hospital/The First Affiliated Hospital of Nanjing Medical University, Jiangsu 210029 China
*Corresponding Author PENG Jifang, E⁃mail: 39336003@qq.com
Abstract Objective:To analyze the risk factors of lung cancer complicated with atelectasis after thoracoscopic segmental resection,and to construct a prediction model.Methods:585 patients with lung cancer who underwent thoracoscopic segmental resection in our hospital from February 2021 to February 2023 were retrospectively selected as the study objects,and they were divided into atelectasis group and non⁃atelectasis group according to whether they developed atelectasis after surgery. Clinical data of patients with lung cancer were collected,and multi⁃factor Logistic regression was used to screen the risk factors affecting atelectasis after thoracoscopic segmental resection of lung cancer.R software was used to establish a random forest model for predicting atelectasis,and the effectiveness of the model was verified.Results:The incidence of atelectasis was 8.55% in 585 patients with lung cancer after thoracoscopic segmental resection. Multivariate results showed that BMI≥24 kg/m2,smoking history,underlying diseases,poor preoperative pulmonary function,operative time ≥2 h and adenocarcinoma were independent risk factors for atatasis after thoracoscopic lung resection (<0.05). The relative important predictors of lung atatasis after thoracoscopic segmental resection in random forest were preoperative lung function,BMI,smoking history,operation time,underlying disease,and pathological type of tumor. ROC results showed that the AUC of random forest algorithm in predicting the occurrence of atatasis was slightly higher than that of multivariate Logistic regression model(0.841 0.834).Conclusion:BMI ≥24 kg/m2,smoking history,underlying diseases,poor preoperative pulmonary function,operative time ≥2 h,and adenocarcarcinoma are independent risk factors for atectasis after thoracoscopic segmental resection. Based on these factors,the random forest model for predicting atectasis has good risk prediction efficacy.
Keywordslung cancer;thoracoscopic segmentectomy;atelectasis;risk factors;prediction model;investigation research
摘要目的:分析肺癌胸腔镜肺段切除术后合并肺不张的危险因素,并构建预测模型。方法:回顾性分析2021年2月—2023年2月在我院行胸腔镜肺段切除手术治疗的585例肺癌病人临床资料,根据术后是否发生肺不张将其分为肺不张组和非肺不张组。采用多因素Logistic回归筛选影响肺癌胸腔镜肺段切除术后合并肺不张的危险因素,运用R软件建立预测肺癌胸腔镜肺段切除术后合并肺不张的随机森林模型,并检测模型效能。结果:585例肺癌病人,术后肺不张发生率为8.55%;多因素结果显示,体质指数≥24 kg/m2、吸烟史、基础疾病、术前肺功能较差、手术时间≥2 h、腺癌均是胸腔镜肺段切除术后发生肺不张的独立危险因素(<0.05);随机森林预测肺癌胸腔镜肺段切除术后肺不张发生的预测因子重要性排序为术前肺功能、体质指数、吸烟史、手术时间、基础疾病、肿瘤病理类型;受试者工作特征(ROC)曲线分析显示,随机森林算法预测肺不张发生的ROC曲线下面积(0.841)高于多因素Logistic回归模型(0.834)。结论:体质指数≥24 kg/m2、吸烟史、基础疾病、术前肺功能较差、手术时间≥2 h、腺癌均是胸腔镜肺段切除术后病人发生肺不张的独立危险因素,基于上述因素构建的随机森林模型具有良好的预测效能。
关键词肺癌;胸腔镜肺段切除术;肺不张;危险因素;预测模型;调查研究
doi:10.12102/j.issn.1009-6493.2024.21.008
肺癌是起源于肺部组织恶性细胞,是临床较为常见的恶性肿瘤疾病[1]。据相关文献报道,肺癌的发病率和病死率均居全球癌症疾病之首,约占所有因肿瘤致死者的30%[2]。手术切除术是目前唯一可以治愈该病的治疗方法。近年来,随着全民体检意识的不断提升及影像学检查的普及,越来越多的肺癌早期病人得到及时诊治,加之免疫、靶向等辅助治疗策略的不断发展,晚期甚至中期肺癌病人获得了手术治疗的机会[3⁃4]。而胸腔镜肺段切除术是肺癌病人的常用术式之一,相比传统开胸手术,其具有创伤小、恢复快等优势[5⁃6]。虽然该术式可让多数病人从中获益,但术后仍有部分病人合并肺不张[7]。术后肺不张是指术后肺部出现部分或全部塌陷,继而导致肺泡内的气体无法正常排出[8]。这种情况不仅可能导致病人出现呼吸困难、感染等问题,严重者亦会危及生命[9]。因而,早期明确肺癌胸腔镜肺段切除术后合并肺不张的相关因素,对临床制定科学、合理的防治策略尤为重要[10]。目前已有肺癌胸腔镜肺段切除术后合并肺不张的相关研究报道,但尚未形成预测肺癌胸腔镜肺段切除术后肺不张发生风险的可靠预测模型。随机森林是一种基于决策树的集成学习算法,通过构建多个决策树并综合它们的结果来进行预测,其不仅能够处理高维数据,亦可根据数据特征对其重要性进行排序,帮助决策者了解数据中不同特征对预测结果的贡献程度并做出相应决策[11⁃12]。本研究回顾性分析585例肺癌病人的病例资料,建立肺癌胸腔镜肺段切除术后合并肺不张的风险预测模型,以期为肺癌胸腔镜肺段切除术后肺不张的早期诊治提供参考。
1 对象与方法
1.1 研究对象
以2021年2月—2023年2月在我院行胸腔镜肺段切除手术治疗的585例肺癌病人为研究对象,根据病人术后是否发生肺不张将其分为肺不张组和非肺不张组。纳入标准:行胸腔镜肺段切除手术治疗,符合手术指征,顺利完成手术者;年龄≥18岁;知情同意自愿参与本研究者;术后通过影像学检查确诊为肺不张者。排除标准:既往存在胸腔手术史者;合并慢性疾病或严重器质性疾病者;伴有精神类疾病或无法与医务人员有效沟通者。本研究已通过我院伦理委员会批准(审批号:23112670)。
1.2 肺不张判定标准
胸部CT或胸部X线片显示未见肺门、纵隔或膈肌向受累区域移动的肺混浊影,邻近非肺不张肺的代偿性过度膨胀,即可判定为肺不张[13]。
1.3 调查内容
采用一般资料调查表收集病人临床资料,包括性别、年龄、居住地、体质指数、婚姻状态、文化程度、职业类型、饮酒史、吸烟史、基础疾病、肿瘤病理类型、肿瘤部位、肿瘤分期、术前肺功能、手术时间、新辅助治疗、凝血酶原时间、纤维蛋白原、白蛋白、血小板计数、白细胞计数等临床资料。
1.4 统计学方法
采用SPSS 24.0软件分析数据,采用多因素Logistic回归模型和随机森林模型分析肺癌胸腔镜肺段切除术后合并肺不张的危险因素,应用R3.5.3软件构建随机森林模型,采用MedCalc绘制受试者工作特征(ROC)曲线。以<0.05为差异有统计学意义。
2 结果
2.1 胸腔镜肺段切除术后肺不张发生情况
585例肺癌病人中,有50例病人术后发生肺不张,肺不张发生率为8.55%。
2.2 影响病人肺不张发生的单因素分析
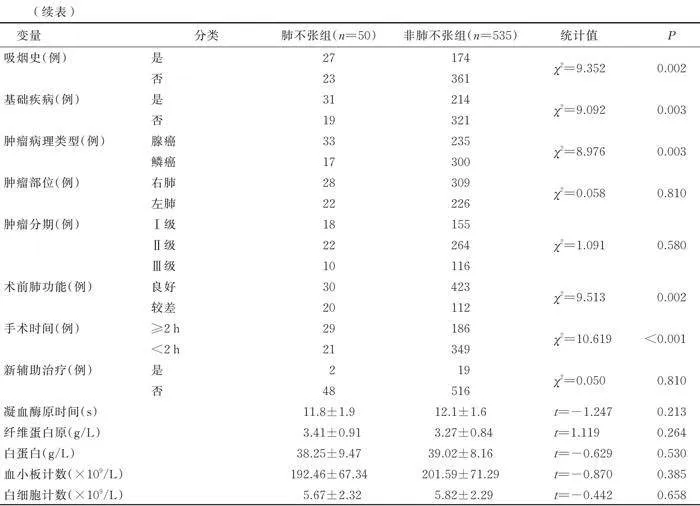
肺不张组和非肺不张组病人性别、年龄、居住地、婚姻状态、文化程度、职业类型、饮酒史、肿瘤部位、肿瘤分期、新辅助治疗、凝血酶原时间、纤维蛋白原、白蛋白、血小板计数、白细胞计数等资料比较,差异均无统计学意义(>0.05);体质指数、吸烟史、基础疾病、肿瘤病理类型、术前肺功能、手术时间比较,差异均有统计学意义(0.05)。见表1。
2.3 肺癌胸腔镜肺段切除术后肺不张发生的多因素Logistic回归分析
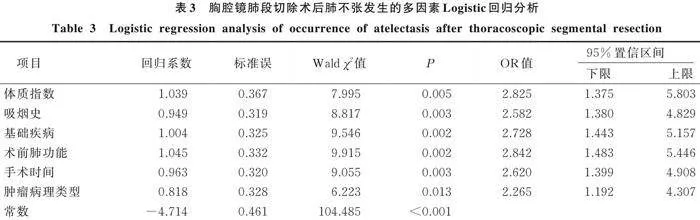
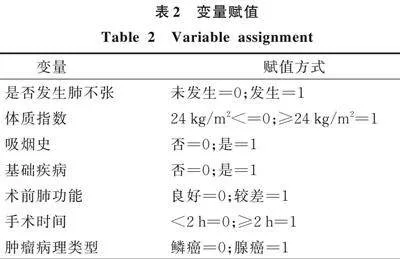
将单因素分析具有统计学意义的项目(体质指数、吸烟史、基础疾病、术前肺功能、手术时间、肿瘤病理类型)作为自变量,以肺癌病人胸腔镜肺段切除术后是否发生肺不张作为因变量,进行多因素Logistic回归分析,结果显示:体质指数≥24 kg/m2、吸烟史、基础疾病、术前肺功能较差、手术时间≥2 h、腺癌均是胸腔镜肺段切除术后发生肺不张的独立危险因素(<0.05)。变量赋值见表2,回归分析结果见表3。
2.4 肺癌胸腔镜肺段切除术后肺不张发生的重要性评分及排序
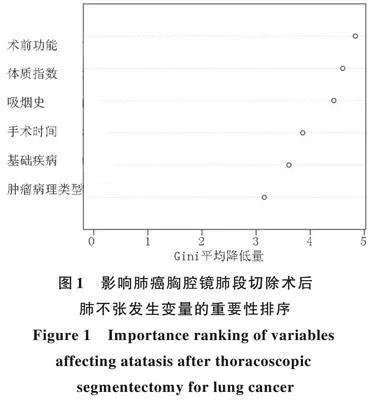
以胸腔镜肺段切除术后是否发生肺不张为因变量,以单因素分析(<0.05)的项目作为自变量(变量赋值见表3)构建随机森林模型。本模型预测肺癌胸腔镜肺段切除术后肺不张发生的相对重要预测因子依次排序为术前肺功能、体质指数、吸烟史、手术时间、基础疾病、肿瘤病理类型,变量Gini值的平均降低量与其在模型的重要性成正比。见图1。
2.5 2种预测模型对肺癌胸腔镜肺段切除术后肺不张发生的效能
随机森林算法预测肺癌胸腔镜肺段切除术后肺不张发生的ROC曲线下面积(AUC)为0.841[95%CI(0.809,0.870)],稍高于多因素Logistic回归模型[AUC=0.834,95%CI(0.802,0.863)]。见图2和表4。
3 讨论
3.1 肺癌胸腔镜肺段切除术后肺不张发生现状
近年来,随着人们饮食习惯和生活方式的不断改变,肺癌发病率呈逐年增高趋势[14]。而胸腔镜肺段切除术作为治疗肺癌和其他肺部疾病的可靠微创术式之一,随着该术式的广泛应用,肺癌术后肺不张的发生率也逐渐增加[15]。若未及时采取治疗措施,不仅会引起通气/血流比例失调、肺功能下降等呼吸、循环系统功能障碍,严重时亦可导致低氧血症、肺感染等并发症,继而延长病人的住院时间,影响病人术后恢复甚至危及生命[16]。因此,了解影响肺癌胸腔镜肺段切除术后肺不张的相关因素并构建风险预测模型对术后肺不张的早期防治就显得尤为重要。本研究585例行胸腔镜肺段切除术的肺癌中,术后肺不张发生率为8.55%。稍低于其他研究[17]报道的肺切除术后肺不张发生率(16.3%)。分析原因可能与纳入对象、研究设计等因素相关,但由此说明,术后肺不张不仅在其他肺部疾病术后具有较高的发生率,在肺癌胸腔镜肺段切除术后同样具有较高的发生率,提醒医务人员需加强对肺癌行胸腔镜肺段切除术病人的重视并给予术后肺不张病人重点关注。
3.2 肺癌胸腔镜肺段切除术后肺不张的危险因素分析
本研究通过单因素及多因素分析585例肺癌胸腔镜肺段切除术病人的临床资料发现,体质指数≥24 kg/m2、吸烟史、基础疾病、术前肺功能较差、手术时间≥2 h、腺癌均是胸腔镜肺段切除术后发生肺不张的独立危险因素。既往研究报道,基础疾病是肺部分切除术后肺不张发生的危险因素,伴有基础疾病的病人术后肺不张的发生风险相对更高[17]。本研究结果显示,肺不张组病人伴有基础疾病者占比高于非肺不张组,通过多因素Logistic回归分析发现,伴有基础疾病者术后肺不张发生风险高于未伴有基础疾病者,结果与上述报道相符。基础疾病指的是在行手术治疗前已经存在的呼吸道基础疾病,包括间质性肺疾病、慢性阻塞性肺疾病以及哮喘等,伴有该类疾病的病人均可能出现气道和/或肺泡异常,并伴有不同程度的生理或解剖结构改变,因而术后更易发生肺不张。王斌等[18]研究发现,手术时间是肝切除术后肺不张发生的影响因素,随着手术时间不断增加,术后肺不张发生风险明显增高。本研究结果与其一致,手术时间≥2 h的肺癌胸腔镜肺段切除术病人发生肺不张风险高于手术时间<2 h者。手术时间延长则提示术中膈肌部位的操作时间随之延长,加剧肺组织创伤,从而增加术后肺不张的发生率,同时长时间的手术过程也会导致病人术后需要更长时间保持体位不动,这可能会导致肺部通气不畅,进而引起术后肺不张。研究表明,体质指数是胸腔镜下肺癌根治术后持续性肺不张发生的危险因素,体质指数越高的病人术后更易发生肺不张[19]。本研究结果与其相符。体重增加引起腹部脂肪堆积和躯干重量增加可使横膈向上抬高并压迫肺部,从而限制了肺的膨胀和通气。当病人处于仰卧位时,躯干和腹部的重量会进一步使横膈向头侧移动,导致肺的功能残气量减少,气道更易闭合,从而增加了肺不张的发生风险。闫付庆[20]研究发现,术前肺功能是肺癌病人术后并发持续性肺不张的因素,术前肺功能越差的病人术后肺不张发生风险越高。肺功能差意味着肺部的通气能力受限,病人往往存在气道狭窄、肺泡破坏或弹性减弱等问题,导致肺膨胀和肺通气受到限制,而术中有创伤操作和麻醉药物也会加重呼吸困难,使病人无法有效地扩张肺部,继而导致术后肺不张的发生风险更高。肿瘤病理类型也是肺癌胸腔镜肺段切除术后肺不张发生的影响因素,腺癌病人术后更易发生肺不张。腺癌通常位于肺部周边,手术切除范围较大、剩余肺组织容量减少,加之腺癌的组织结构特点也会对肺的弹性和通气能力产生影响,因而术后更易发生肺不张。此外,本研究结果显示,长期吸烟也会增加术后肺不张的发生风险。烟草中含有多种有害化学物质,香烟进入呼吸道后可增加气管内分泌物并导致呼吸道阻塞,损伤肺部组织,引起肺组织塌陷,进而影响肺部气体交换,增加肺不张发生率。
3.3 预测肺癌胸腔镜肺段切除术后肺不张的随机森林模型
随机森林预测模型是通过集成多个决策树来进行预测的机器学习模型,其中每个决策树均是基于不同的随机样本和特征子集构建,并通过投票或平均的方式得出最终预测结果。在预测过程中,随机森林会根据输入的特征值,经过每个决策树的判断,最终综合每个决策树的预测结果,得出最终预测结果[21]。随机森林预测模型具有较高的准确性和泛化能力,不仅能够处理复杂的数据关系和非线性关系,亦适用于各种预测任务。同时,随机森林亦可评估不同特征的重要性,帮助理解预测结果的影响因素,提供决策支持[22]。相较于传统的多因素Logistic回归模型,随机森林预测模型具有更好的特征处理能力、泛化能力、解释性和决策支持能力[23]。本研究构建的肺癌胸腔镜肺段切除术后肺不张的随机森林模型,其中每项危险因素均有其相对应的预测重要性排序,医务人员可通过该模型根据肺癌病人的临床资料进行评估,判断病人是否为肺不张高危人群,制定相应的干预方案。此外,本研究预测肺癌胸腔镜肺段切除术后肺不张发生的相对重要预测因子依次排序为术前肺功能、体质指数、吸烟史、手术时间、基础疾病、肿瘤病理类型,且变量Gini值的平均降低量与其在模型的重要性成正比。此外,随机森林模型预测肺癌胸腔镜肺段切除术后肺不张发生的AUC值稍高于多因素Logistic回归模型,提示随机森林算法模型对肺癌胸腔镜肺段切除术后肺不张发生的预测效能更好。
4 小结
本研究对肺癌胸腔镜肺段切除术后肺不张发生现状及其危险因素进行探讨,并构建了术后肺不张发生的风险预测模型,构建的预测模型具有良好的风险预测效果,可为临床早期识别肺不张高危病人和相关干预措施的制定提供依据。但本研究为回顾性研究,存在变量纳入不全、未长期随访等不足,后续将考虑进行多中心、大样本及纳入更多的变量进行深入研究。
参考文献:
[1] 董仙英,徐琪纹,钟娟.肺癌患者术后并发慢性咳嗽的危险因素分析[J].护士进修杂志,2022,37(9):783-786.
DONG X Y,XU Q W,ZHONG J.Analysis of the risk factors of postoperative chronic cough in the patients with lung cancer[J].Journal of Nurses Training,2022,37(9):783-786.
[2] AHUJA J,DE GROOT P M,SHROFF G S,.The postoperative chest in lung cancer[J].Clinical Radiology,2022,77(1):6-18.
[3] 洪子强,苟文曦,盛燕楠,等.达芬奇机器人与电视辅助胸腔镜手术治疗肺癌短期疗效及术后炎性细胞因子变化比较[J].肿瘤防治研究,2023,50(4):378-383.
HONG Z Q,GOU W X,SHENG Y N,.Short-term efficacy and postoperative inflammatory cytokine changes in lung cancer treated with Da Vinci robot-assisted versus video-assisted thoracoscopic surgery[J].Cancer Research on Prevention and Treatment,2023,50(4):378-383.
[4] 郭洪拨,喻本桐.机器人与胸腔镜肺叶切除术在治疗早期非小细胞肺癌的安全性与疗效对比[J].实用医学杂志,2019,35(4):541-545.
GUO H B,YU B T.Safety and efficacy of robotic and thoracoscopic lobectomy in the treatment of early non-small cell lung cancer[J].The Journal of Practical Medicine,2019,35(4):541-545.
[5] 张亚年,张璐,范心庭.胸腔镜肺段切除术治疗非小细胞肺癌的临床效果及其对血清LDH、ProGRP、NSE的影响[J].临床和实验医学杂志,2022,21(19):2062-2066.
ZHANG Y N,ZHANG L,FAN X T.Clinical effect of thoracoscopic segmentectomy in the treatment of non-small cell lung cancer and its effect on serum LDH,ProGRP and NSE[J].Journal of Clinical and Experimental Medicine,2022,21(19):2062-2066.
[6] 曾敏,徐利强.单孔胸腔镜下肺段切除术治疗非小细胞肺癌的疗效观察[J].现代肿瘤医学,2020,28(20):3560-3564.
ZENG M,XU L Q.Observation of curative effect of single-hole thoracoscopic segmentectomy for non-small cell lung cancer[J].Journal of Modern Oncology,2020,28(20):3560-3564.
[7] 张五星.胸腔镜下肺段切除与肺叶切除治疗Ⅰ期非小细胞肺癌:系统回顾与荟萃分析[D].南昌:南昌大学,2019.
ZHANG W X.Thoracoscopic segmentectomy versus lobectomy for stage Ⅰ non-small cell lung cancer:a systematic review and meta-analysis[D].Nanchang:Nanchang University,2019.
[8] LAGIER D,ZENG C L,FERNANDEZ-BUSTAMANTE A,.Perioperative pulmonary atelectasis:part Ⅱ.clinical implications[J].Anesthesiology,2022,136(1):206-236.
[9] MORADIAN S T,HEYDARI A A,MAHMOUDI H.What is the role of preoperative breathing exercises in reducing postoperative atelectasis after CABG?[J].Reviews on Recent Clinical Trials,2019,14(4):275-279.
[10] SWEITY E M,ALKAISSI A A,OTHMAN W,.Preoperative incentive spirometry for preventing postoperative pulmonary complications in patients undergoing coronary artery bypass graft surgery:a prospective,randomized controlled trial[J].Journal of Cardiothoracic Surgery,2021,16(1):241.
[11] WANG W,LI L N,GU H J,.Random forest-based prediction of acute respiratory distress syndrome in patients undergoing cardiac surgery[J].The Heart Surgery Forum,2022,25(6):E854-E859.
[12] 文天才,刘保延,张艳宁.缺血性脑卒中患者31天内非计划性再入院风险因素研究:随机森林模型[J].中国循证医学杂志,2019,19(5):532-538.
xnnAMGVNwJqxh+kWd5nJsKxWY72AL8llUNm/p4TDQ8E=WEN T C,LIU B Y,ZHANG Y N.Risk factors for unplanned readmission in ischemic stroke patients within 31 days:a random forest algorithm research[J].Chinese Journal of Evidence-Based Medicine,2019,19(5):532-538.
[13] JAMMER I,WICKBOLDT N,SANDER M,.Standards for definitions and use of outcome measures for clinical effectiveness research in perioperative medicine:European Perioperative Clinical Outcome(EPCO) definitions:a statement from the ESA-ESICM joint taskforce on perioperative outcome measures[J].European Journal of Anaesthesiology,2015,32(2):88-105.
[14] 吴俊平,崔盼,席芳,等.肺癌患者术后发生VTE的相关影响因素[J].实用癌症杂志,2023,38(4):615-617;621.
WU J P,CUI P,XI F,.Related influencing factors of VTE in postoperative patients with lung cancer[J].The Practical Journal of Cancer,2023,38(4):615-617;621.
[15] 王建平,高杰,薛恒川,等.胸腔镜肺段切除术和肺叶切除术治疗老年早期非小细胞肺癌患者的疗效比较[J].实用临床医药杂志,2020,24(11):97-100.
WANG J P,GAO J,XUE H C,.Thoracoscopic pulmonary segmentectomy versus lobectomy in the treatment of early non-small cell lung cancer in elderly patients[J].Journal of Clinical Medicine in Practice,2020,24(11):97-100.
[16] 付群,郭迪,赵文飞.重组人血管内皮抑制素联合顺铂化疗方案在非小细胞肺癌合并肺不张中的疗效观察[J].癌症进展,2021,19(14):1470-1473.
FU Q,GUO D,ZHAO W F.Effect of recombinant human endostatin combined with cisplatin chemotherapy in treating non-small cell lung cancer patients with atelectasis[J].Oncology Progress,2021,19(14):1470-1473.
[17] 许舜,姚锋锋,于奇,等.肺切除术后并发肺不张的危险因素Logistics分析[J].临床肺科杂志,2018,23(1):46-49.
XU S,YAO F F,YU Q,.Logistics analysis of related factors of atelectasis after pneumoresection[J].Journal of Clinical Pulmonary Medicine,2018,23(1):46-49.
[18] 王斌,沈佳伟,安友仲.肝切除术后重症患者发生肺不张的影响因素分析[J].解放军医学杂志,2022,47(3):264-268.
WANG B,SHEN J W,AN Y Z.Analysis of the related factors of atelectasis in ICU patients after hepatectomy[J].Medical Journal of Chinese PLA,2022,47(3):264-268.
[19] 严晓霞,刘虹婷,周春娟,等.胸腔镜下肺癌根治术后持续性肺不张发生的影响因素分析及预测模型构建[J].中华现代护理杂志,2022,28(1):27-31.
YAN X X,LIU H T,ZHOU C J,.Analysis of influencing factors and predictive model construction of persistent atelectasis after thoracoscopic radical resection of lung cancer[J].Chinese Journal of Modern Nursing,2022,28(1):27-31.
[20] 闫付庆.肺癌患者术后并发持续性肺不张的影响因素[J].河南医学研究,2023,32(2):286-289.
YAN F Q.Related factors of postoperative persistent atelectasis in patients with lung cancer[J].Henan Medical Research,2023,32(2):286-289.
[21] ZHOU C,XU C L,YANG B,.Preoperative US integrated random forest model for predicting Delphian lymph node metastasis in patients with papillary thyroid cancer[J].Current Medical Imaging,2023,19(9):1031-1040.
[22] DUAN X Z,YANG B,ZHAO C B,.Prognostic value of preoperative hematological markers in patients with glioblastoma multiforme and construction of random survival forest model[J].BMC Cancer,2023,23(1):432.
[23] 桑祎莹,黄仕鑫,易静,等.Logistic回归模型和随机森林模型诊断糖尿病周围神经病变效能的比较[J].广西医学,2022,44(5):511-515.
SANG Y Y,HUANG S X,YI J,.Diagnostic efficacy of Logistic regression model versus random forest model for diabetic peripheral neuropathy:a comparative study[J].Guangxi Medical Journal,2022,44(5):511-515.
(本文编辑崔晓芳)
作者简介陈倩倩,护师,本科
*通讯作者彭纪芳,E⁃mail:39336003@qq.com
引用信息陈倩倩,彭纪芳,刘晗.胸腔镜肺段切除术后病人合并肺不张的危险因素及预测模型构建[J].护理研究,2024,38(21):3812⁃3817.

