两种微塑料对生菜生长及生理特性的影响



摘要:为探究聚乙烯(PE)和聚丙烯(PP)两种微塑料对生菜生长及生理特性的影响,以生菜(意大利生菜333)为供试材料进行水培试验,设置对照(CK)、3个PE水平(0.1、0.5、1.0 g·L-1)、3个PP水平(0.1、0.5、1.0g·L-1)共7个处理,PE和PP粒径均为13 μm,测定了生菜生物量、根系形态参数、光合参数、叶片和根系超微结构以及抗氧化能力等相关指标。试验结果表明:微塑料胁迫下,生菜的干质量显著降低了9.6%-65.4%,根体积显著减少了18.3%- 50.2%,光合参数先升高了20.5%后降低40.4%,叶绿素a和类胡萝卜素含量也显著降低了26.1%和29.9%。从叶片和根系的超微结构来看,生菜叶片叶绿体及根系细胞膜、细胞壁均遭受到两种微塑料不同程度的破坏。与CK相比,生菜超氧化物歧化酶(SOD)、过氧化物酶(POD),过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性分别增加了3.0-15.0倍、24.8%-1 64.0%、2.8-12.0倍和3.5-8.1倍,丙二醛(MDA)和抗坏血酸(ASA)含量增加了1.2-18.9倍和7.2%-10.1%。微塑料对生菜叶片和根系细胞有明显毒害作用,其可破坏叶肉细胞叶绿体,导致生菜叶片的光合参数及光合色素含量降低,同时也抑制了根系的生长发育,降低了其生物量。另外,试验表明生菜抗氧化系统对两种微塑料均产生了响应。
关键词:生菜;微塑料;根系形态;光合色素;抗氧化系统;超微结构
中图分类号:X173;X53;S636.2 文献标志码:A 文章编号:1672-2043(2024)08-1698-12 doi:10.11654/jaes.2023-0872
塑料因具有化学性质稳定、制造工艺简单、成本较低等特点,在社会生活的各个领域被广泛应用,例如化工、农业、医疗等行业。由于塑料的大量制造和相对落后的处理机制,大量塑料进入到环境中。进入环境中的塑料经过物理、化学等分解过程,形成不同粒径的塑料碎片和颗粒,造成环境污染,影响人体健康。其中,微塑料(Micropiastics,MPs),即粒径小于5 mm的塑料碎片或颗粒,作为土壤中一种新型污染物,受到社会广泛的关注。微塑料分布极广且难以降解,可能会在土壤环境中稳定存在几个世纪,对土壤环境构成了极大的威胁。我国作为塑料产品的生产和应用大国,不同类型的土壤中均已检测到微塑料,且形态各异,来源广泛。土壤微塑料含量为0.1%被确定为微塑料污染上限问;土壤微塑料主要来源于农用塑料薄膜残留物、污泥和污水灌溉、城市垃圾以及大气沉降等。
微塑料颗粒可以被植物根系吸收,进而改变植物的根系性状、养分吸收过程,影响植物的生长发育。研究表明,微塑料能够通过影响作物根系发育、抑制光合速率、影响叶绿素含量和抗氧化酶活性等方面,对大豆、花生、番茄、小麦、玉米等作物产生毒害效应,影响根系发育和幼苗生长,并降低其产量和品质。但是,现有研究多关注于微塑料对作物根系发育、光合特性、抗氧化系统等单一方面的影响,对微塑料产生的生理毒害效应缺乏系统的研究。而且,微塑料的植物毒害效果受其浓度、粒径和种类的综合影响,其毒害机理尚不完全清楚,尤其是从植物微观结构角度解释微塑料的毒害机理尚少有报道。
聚乙烯(PE)和聚丙烯(PP)是土壤微塑料的常见聚合物类型,在环境中广泛存在。生菜作为菊科莴苣属一年或两年生的草本植物,是世界上食用最广泛的蔬菜作物之一。本试验通过营养液培养的方式,测定了不同类型、不同浓度的微塑料对生菜根系形态、光合参数、抗氧化酶活性、抗氧化物质含量及组织超微结构等指标的影响,系统研究了两种微塑料对生菜的生理毒害效应,为深入解析植物对环境微塑料胁迫的响应机理,进一步评价微塑料对人体健康的潜在风险提供了理论依据。
1 材料与方法
1.1 供试材料
供试生菜品种为意大利生菜333,购自河南省郑州市郑东花卉市场。
供试营养液为改良的霍格兰营养液,其配方为:6.0 mmol· L-1 KNO3,4.0 mmol·L-1 Ca (NO3)2·4H2O, 2.0 mmol·L-1 MgSO4·7H2O,1.0 mmol·L-1NaH2PO4·2H2O, 100 μmol·L-1 EDTA-Fe, 46 μmol·L-1H3BO3,9.0 μmol·L-1 MnCl2·4H2O, 0.8 μmol·L-1 ZnSO4·7H2O,0.3 μmol·L-1 CuSO4·5H2O和0.09 μmol·L-1Na2MoO4·2H2O。
1.2 试验设计
参考Hasan等的塑料试验水平设置,本试验设对照(CK)、3个PE水平(0.1、0.5、1.0 g·L-1)和3个PP水平(0.1、0.5、1.0 g·L-1)共7个处理,即CK,PE0.1、PE0.5、PE10,PP0.1、PP0.5、PP1.0,每个处理3次重复。PE和PP粒径均为13 μm,且均为纯聚合物,购于东莞市华创塑化有限公司。参考连家攀等的方法进行微塑料悬浮液制备,称取100 g微塑料于烧杯中,加入去离子水,并添加1 mL吐温20(即聚氧乙烯失水山梨醇单月桂酸酯)加速溶解,用铝箔纸覆盖烧杯口,最后定容于1 L容量瓶,在室温下超声(400 w,40 KHz)30 min,使微塑料均匀悬浮,分散于水溶液备用。每次使用前需超声10 min。
将生菜种子用20%的H2O2消毒30 min后,用去离子水多次冲洗以去除种子表面残留的H2O2,然后将种子均匀播撒在育苗盘上,置于恒温箱(温度25℃,湿度70%)进行避光培养。当生菜第二片真叶完全展开后,选择大小一致的6株生菜转移到2L营养液中进行培养。生菜在1/4营养液中培养两周,然后在1/2营养液中培养一周,最后在含有微塑料的全营养液中培养直至收获。培养期间每3d更换1次营养液。试验于光照培养室进行,其温度为25-28℃,光照时间12 h,湿度60%,光照强度419 μmol·m-2·s-1。
1.3 测定项目与方法
1.3.1 样品前处理
生菜生长28 d后,将2株生菜根部置于2 mmol·L-1 MES溶液中浸泡30 min;然后将根系和叶片置于烘箱,105℃杀青30 min后65℃烘至恒质量,测定干质量。另取1株生菜测定根系形态参数,剩余3株生菜样品立即用液氮冷冻,储存于-80℃冰箱,用于各项生理指标测定。
1.3.2 根系形态参数的测定
参照Nie等的方法,采用根系扫描仪(V700PHOTO,Epson,日本)测定根长、根表面积和根体积。
1.3.3 光合参数的测定
参照Shi等的方法,选择生菜第3片完全展开的叶片,采用便携式光合速率测定仪(LI-6400,Li-Cor,美国)测定净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr),测定时间为上午9:00-11:00。
1.3.4 叶绿素含量的测定
参照Jing等的方法,称取新鲜叶片0.100 0 g放入研钵中,加入少量石英砂及2 mL 80%丙酮,研磨匀浆,再加5 mL 80%丙酮,继续研磨,最终全部转移至25 mL棕色容量瓶中,用80%丙酮定容至25 mL,摇匀,过滤。分别在波长663、646 nm和470 nm处测定吸光值。
1.3.5 叶片和根系的超微结构
基于生菜生长发育情况,选取CK以及PE和P1处理下长势最差(1.0 g·L-1浓度水平)的生菜各1株,用去离子水将生菜第3片叶和根系冲洗干净,从距离主根根尖2 cm处取0.5 cm长度的根,叶片取中上部,避开叶脉,将其切成约2 mm×2 mm的方形薄片。将取好的组织快速放入2.5%戊二醛固定液中,用脱脂棉将组织塞进固定液内,防止漂浮。室温放置2h后转入4℃冰箱保存。测定时依次进行脱水、渗透、包埋、烘干、切片和染色,最后在透射电子显微镜(HT7700,Hitachi,日本)下进行观察。
1.3.6 抗氧化酶活性的测定
称取叶片和根系0.100 0 g放入4℃预冷的研钵中,加入预冷的1 mL提取液,研磨至匀浆,在4℃下,8 000 g离心10 min,上清液即酶液,采用试剂盒(苏州科铭生物技术公司)和自动分析酶标记仪(Spectra.Max.Molecular Devices,美国)测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)的活件。
1.3.7 丙二醛和抗坏血酸含量的测定
丙二醛(MDA)采用硫代巴比妥酸法测定:称取鲜样0.500 0 g放人预冷的研钵中,加入5 mL 5%的三氯乙酸,研磨后转移至10 mL离心管,3 000 r·min-1离心20 min。取2 mL上清液加入等体积0.6%(m/V)的硫代巴比妥酸(TBA)溶液,沸水浴上反应30 min,冷却后3 000 r·min-1离心10 min,上清液分别于450、532 nm及600 nm波长下读取吸光值。
抗坏血酸(ASA)含量采用2,2-二联吡啶法测定:称取鲜样0.500 0 g放入预冷研钵,加入7 mL 10%的三氯乙酸研磨至匀浆,10 000 g离心10 min。取0.2 mL上清液,依次加入0.4 mL 75 mmol·L-1的NaH2PO4溶液、0.4 mL 10%的偏磷酸、0.4 mL 4%的2,2-二联吡啶以及0.2 mL 3%的FeCl3。37℃反应th,测定525 nm处的吸光值,根据标准曲线得到样品ASA的含量。
1.4 数据分析
所有数据均采用SPSS 26.0和Excel 2022软件进行处理和统计分析,采用LSD法进行多重比较,采用Origin 2021软件绘图。
2 结果与分析
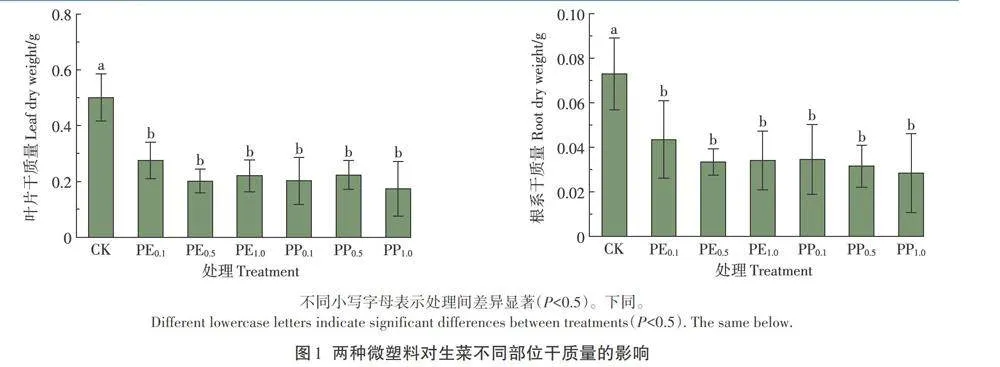
2.1 两种微塑料对生菜不同部位干质量的影响
如图1所示,与CK相比,3个浓度的PE显著降低生菜叶片和根系干质量,其降幅分别为45.0%-56.1%和40.2%- 53.1%,且在PE0.5处理下达到最低值;3个浓度的PP显著降低生菜叶片和根系干质量,其降幅分别为9.6%-65.4%和52.5%-60.9%,且在PP1.0处理下达到最低值。生菜叶片和根系干质量在PE和PP不同浓度处理之间以及相同浓度PE和PP处理之间均无显著差异。
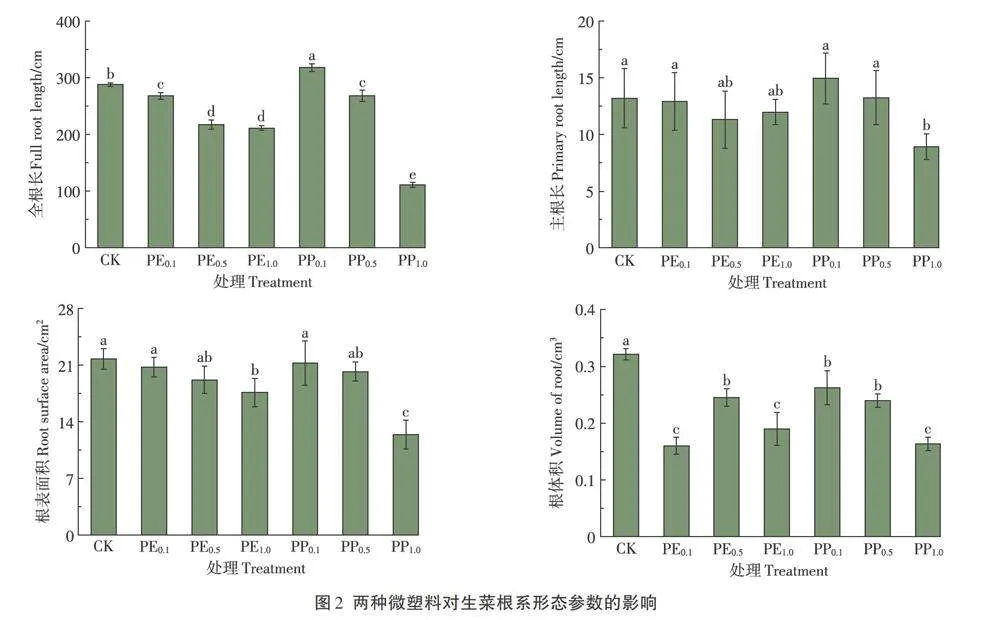
2.2 两种微塑料对生菜根系形态参数的影响
从图2分析可知,与CK处理相比,PP0.1处理显著升高生菜全根长,其增幅为10.5%,其余各处理显著降低生菜全根长,其降幅为6.8% -61.4%;在0.1 g·L-1和0.5 g·L-1水平下,PP处理下的全根长显著高于PE处理,但在1.0 g·L-1水平下,PP处理下的全根长显著低于PE处理。PE处理对生菜主根长无显著影响,PP1.0处理显著降低生菜主根长,其降幅为32.4%。PE1.0处理生菜根表面积显著降低,降幅为4.7%-19.1%;PP1.0处理生菜根表面积显著降低,降幅为2.3%-42.9%;在1.0 g·L-1水平下,PP处理下的生菜根表面积显著低于PE处理。3个浓度的PE均显著降低生菜根体积,降幅为23.6% - 50.2%,且在PE0.1处理下达到最低值;3个浓度的PP处理均显著降低生菜根体积,降幅为18.3%-49.1%,在PP1.0处理下达到最低值;在0.1 g·L-1水平下,PE处理下生菜根体积显著低于PP处理。
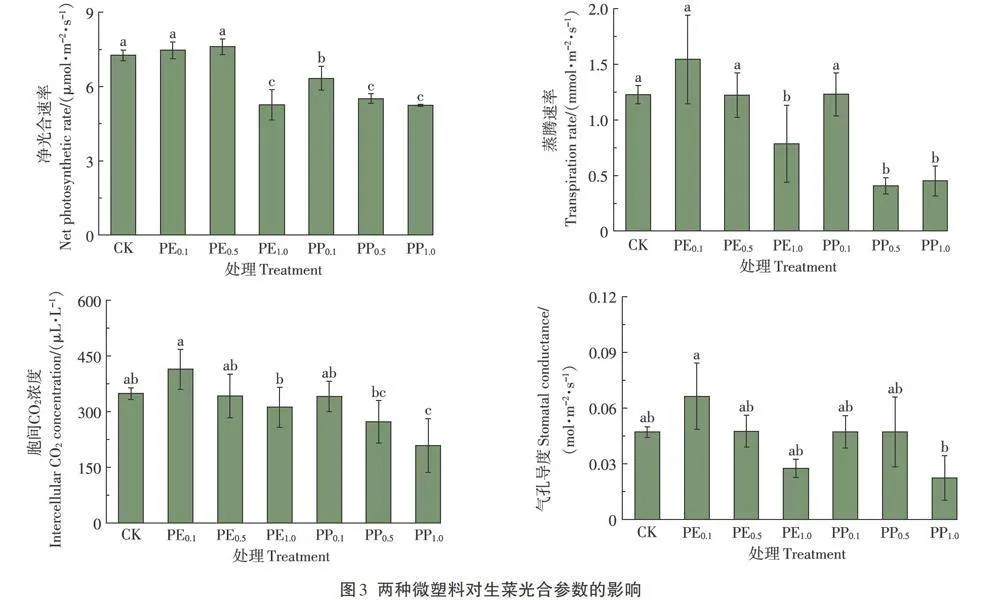
2.3 两种微塑料对生菜光合参数的影响
由图3分析可知,与CK相比,PE1.0处理下,生菜净光合速率显著降低了27.5%。而3个浓度的PP处理均显著降低了生菜净光合速率,降幅为12.8%-27.9%。在0.1 g·L-1和0.5 g.L-1水平下,PP处理的生菜净光合速率显著低于PE处理。PE0.1处理下,生菜蒸腾速率提高了20.5%,PE1.0处理下,生菜蒸腾速率显著降低了3 6.0%;PP0.5和PP1.0处理显著降低了生菜蒸腾速率;在0.5 g·L-1水平下,PP处理的生菜蒸腾速率显著低于PE处理。
PE处理对生菜胞间CO2浓度无显著影响。PP1.0处理下生菜胞间CO2浓度显著降低了40.1%;在1.0g·L-1水平下,PP处理下生菜胞间CO2浓度显著低于PE处理。PE0.1处理下,生菜气孔导度最高,较CK提高了40.4%,PE和PP处理对生菜气孔导度无显著影响。
PE处理下,生菜净光合速率、蒸腾速率、胞间CO2浓度和气孔导度均呈现先升高后降低的趋势。
2.4 两种微塑料对生菜光合色素的影响
由图4分析可知,与CK相比,PE处理下生菜叶绿素。含量有所下降,但未达到显著水平;PP1.0处理显著降低了生菜叶片叶绿素。含量,降幅为26.1%。PE和PP处理对生菜叶片叶绿素b含量和叶绿素总量无显著影响。PE0.1、PP0.1和PP1.0处理显著降低了生菜叶片类胡萝卜素含量,降幅为22.3%-29.9%。在1.0 g·L-1水平下,PP处理下的类胡萝卜素含量显著低于PE处理。
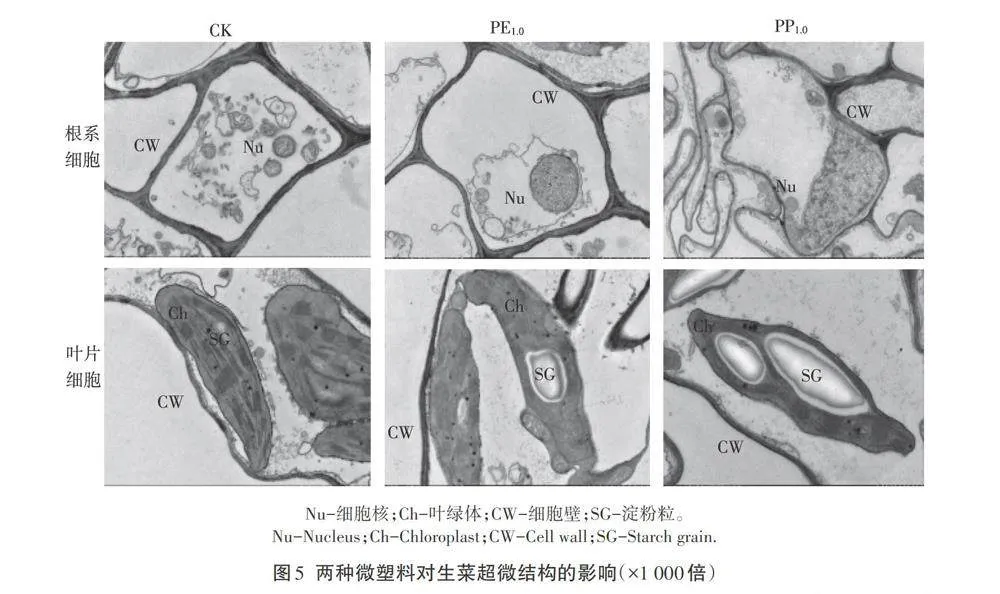
2.5 两种微塑料对生菜超微结构的影响
从图5分析可知,CK处理下的生菜根系细胞的细胞壁、细胞膜光滑,无质壁分离现象,细胞核完整,核内染色质分布均匀,各细胞器排列整齐;PE1.0处理下的根系细胞壁出现皱缩,细胞核增大,细胞器破碎;PP1.0处理下的根系细胞膜出现破裂,细胞壁粗糙,核质溢出,细胞内出现较多沉积物。CK处理下的生菜叶片细胞叶绿体结构清晰,呈现长椭圆形状,分布于细胞边缘,紧贴细胞壁,其内部基质分布均匀,几乎不含淀粉粒;PE1.0处理下的叶片细胞壁增厚,叶绿体严重变形,边缘不平整,其内部基质变浅,出现淀粉粒;PP1.0处理下的叶片细胞壁粗糙,出现质壁分离的现象,叶绿体呈现梭形,其中的淀粉粒数量增多且体积变大。
2.6 两种微塑料对生菜抗氧化酶的影响
从图6分析可知,与CK相比,PE1.0处理下,生菜叶片SOD活性显著提高了6.9倍;PP1.0处理下,生菜叶片SOD活性显著提高了15.0倍;在1.0 g·L-1水平下,PP处理下生菜叶片SOD活性显著高于PE处理。PE0.5处理下,生菜根系SOD活性显著降低了79.7%;PP0.1处理下,生菜根系SOD活性显著降低了95.6%;而PP1.0处理下,生菜根系SOD活性显著提高了3.0倍;在1.0 g·L-1水平下,PP处理下生菜根系SOD活性显著高于PE处理。
PE0.1处理下,生菜叶片POD活性显著降低了43.6%;而PE0.5和PE1.0处理显著提高了生菜叶片POD活性,增幅为62.7%-112.0%;PP0.1处理下,生菜叶片POD活性显著降低了29.2%;而PP0.5和PP1.0处理显著提高了生菜叶片POD活性,增幅为162.0%-164.0%。PE0.1和PE1.0处理显著提高了生菜根系POD活性,增幅为24.8%-36.8%:PP0.5处理下,生菜根系POD活性显著提高了52.7%;在0.5 g·L-1水平下,PP处理下生菜根系POD活性显著高于PE处理。
PE1.0处理下,生菜叶片CAT活性显著提高7.3倍;PP0.5和PP1.0处理显著提高生菜叶片CAT活性,增幅为3.8-5.0倍;在0.5 g·L-1水平下,PP处理下生菜叶片CAT活性显著高于PE处理;在1.0 g·L-1水平下,PE处理下生菜叶片CAT活性显著高于PP处理。PE0.5和PE1.0处理显著提高生菜根系CAT活性,增幅为3.0-12.7倍;PP0.1和PP1.0处理显著提高生菜根系CAT活性,增幅为2.8-12.0倍。在0.5 g·L-1水平下,PE处理下生菜根系CAT活性显著高于PP处理。
PE0.5和PE1.0处理显著降低了生菜叶片APX活性,降幅为5 7.9%- 73.5%;3个浓度的PP处理均显著降低生菜叶片APX活性,降幅为18.2%-46.2%;在0.5g·L-1和1.0 g·L水平下,PP处理下生菜叶片APX活性均高于PE处理。3个浓度的PE处理均显著提高生菜根系APX活性,增幅为3.5-5.1倍;PP0.5和PP1.0处理显著提高生菜根系APX活性,增幅为4.1- 8.1倍;在0.1 g·L-1水平下,PE处理下生菜根系APX活性显著低于PP处理;在1.0 g·L-1水平下,PP处理下生菜根系APX活性显著高于PE处理。
2.7 两种微塑料对生菜MDA、ASA的影响
从图7分析可知,与CK相比,PE0.1和PE1.0处理显著增加了生菜叶片MDA含量,增幅为1.70-18.9倍;3个浓度的PP处理均显著提高了生菜叶片MDA含量,增幅为5.0-21.0倍。PE和PP处理下,生菜根系MDA含量均显著提高,增幅为1.2-8.3倍。3个相同浓度水平下,PP处理下生菜叶片MDA含量均显著高于PE处理;而PP处理下生菜根系MDA含量均显著低于PE处理。
PE0.5和PP0.5处理生菜叶片ASA含量均显著提高,增加了9.7%- 12.3%;PP0.1和PP1.0处理显著降低生菜叶片ASA含量,降低了6.9%-21.2%;在0.1 g·L-1和1.0 g·L-1水平下,PP处理下生菜叶片ASA含量显著低于PE处理。PE0.1处理下,生菜根系ASA含量显著提高了7.2%;PP0.5处理下,生菜根系ASA含量显著提高了10.1%;而PP1.0处理下,生菜根系ASA含量显著降低了9.1%。在0.5 g·L-1水平下,PE处理下生菜根系ASA含量显著低于PP处理。
3 讨论
3.1 两种微塑料抑制了生菜的生长发育
根系是植物适应环境条件的重要器官,外界环境的改变可直接影响根系生长,进而改变植物体内的养分运输和物质合成。微塑料可被植物根系直接吸收进入植物体,对植物生长产生影响,直接体现为根系和地上部的生长发育受到抑制。微塑料会降低植物根系水通道蛋白活性,从而降低根系生物量。本试验结果表明,PE和PP在1.0 g·L-1水平下显著降低生菜根系全根长、根表面积和根体积(图2),这与刘玲等的研究结果一致。而本试验中,0.5 g·L-1 PE处理下生菜叶片和根系干质量最低,这与Wang等的研究结果相似,推测可能是由于生菜对微塑料的种类和浓度的敏感度不同,导致生菜干质量对0.5 g·L-1PE处理敏感性更高,毒害作用更强。崔远远等的研究指出,在塑料胁迫下,植物会通过构建不同的根系构型来适应环境。同时微塑料可诱导根系分泌物的形成,加速根系活性氧的积累,改变根表皮细胞的形态,导致根尖成熟区膨胀,根系损伤加剧。另外,微塑料颗粒会附着在植物根系上,阻塞其细胞壁上的空隙,进而影响根系对水分和矿质养分的吸收,导致植物地上部生长发育受到抑制。研究表明,聚乙烯微塑料会抑制玉米幼苗生长。栗敏等指出不同浓度的微塑料胁迫下,西红柿和辣椒的幼苗生长均受到不同程度的影响。本试验结果表明,PE和PP 3个浓度均显著降低生菜叶片干质量(图1),说明两种微塑料抑制了生菜叶片的生长发育。
3.2 两种微塑料破坏生菜叶肉细胞结构进而抑制叶片光合作用
完整的细胞结构对于完成正常的生理功能至关重要。逆境条件下,植物叶片的伸展和结构组分会受到影响,从而严重影响新叶的展开速度,造成叶片功能受损;植物的细胞器会出现不同程度的损伤。本试验中,CK处理下生长的生菜叶肉细胞叶绿体结构完整,叶绿素分布均匀(图3),因此生菜能够完成正常的光合作用,高效地将光能转化为化学能,积累在生菜体内。而1.0 g·L-1微塑料条件下的生菜叶片叶绿体形状不规则,这可能是由于细胞內渗透压的改变和细胞内H2O2过量积累,导致膜蛋白结构和功能遭到破坏。当微塑料不断在细胞膜积累时,生菜叶绿体会脱离细胞膜以缓解微塑料胁迫对其造成的损伤。同时,微塑料胁迫下叶肉细胞内部淀粉粒明显变大且数量增多,主要由于淀粉的水解和向外运输受到阻碍。另外,在微塑料胁迫下,生菜根系细胞的细胞壁、细胞膜、细胞核等细胞器出现明显的毒害症状,且PP处理比PE处理的毒害效果更强(图5)。这可能是由于根尖顶端分生组织高度多孔,PE和PP均会被吸附于根尖;但是由于不同的物理作用力,如颗粒表面效应、布朗运动、范德华力等,PP在根表聚集程度更大,且化学稳定性更强。植物在遭受外界胁迫时,根尖细胞膜表面积扩大,根表皮细胞吸收和储存物质的能力增强,甚至具备传递细胞的特性,从而降低了外界胁迫对其吸收和运输能力的影响。
植物通过光合作用进行有机物的合成,进而为植物生长提供能量,光合色素能反映光合作用的强弱。研究表明,外界环境胁迫会降低植物叶绿素含量,因为叶片水分运输障碍造成叶绿素合成受阻,并导致叶绿素加速分解。类胡萝卜素在光合作用的中心有着非常重要的作用,参与光合作用的能量传递过程。研究表明,微塑料会堵塞植物的毛孔,阻碍叶绿素的合成。本试验结果表明,1.0 g·L-1的微塑料处理降低生菜叶绿素。和类胡萝卜素含量(图4);同时,也能显著降低生菜净光合速率、蒸腾速率、胞间CO2浓度和气孔导度(图3)。植物受到外界胁迫时,叶片水分散失和水势下降,导致蒸腾速率下降,气孔导度的降低也会导致叶片对CO2的捕获能力下降,同时,细胞内光合作用相关的酶活性降低而导致物质转化受阻,最终引起光合速率降低。因此,1.0 g·L-1的微塑料处理会抑制生菜的光合作用(图3),进而造成生菜叶片的光合参数和光合色素含量显著降低。
3.3 生菜抗氧化系统对两种微塑料的响应
植物在遭受逆境胁迫时,体内的代谢活动出现紊乱,并且会产生大量的活性氧(ROS),引起脂质过氧化。植物体内抗氧化机制分为两种:一种是酶促系统,包括SOD、POD、CAT、APX等抗氧化酶类;另一种是通过非酶促物质MDA、ASA等抑制ROS的产生。本试验结果表明,1.0 g·L-1的微塑料处理下,生菜叶片SOD、POD和CAT活性及根系CAT和APX活性显著提高(图6),叶片和根系MDA含量也显著提高(图7),而生菜叶片中APX活性和ASA含量显著降低,表明生菜的抗氧化系统对两种微塑料胁迫产生了响应。Li等的研究报道指出,1%的聚氯乙烯微塑料能够显著提高生菜体内SOD的活性,这与本研究结果一致。郭冰林等指出小白菜叶片抗氧化酶活性随着聚苯乙烯微塑料浓度升高,呈现先升高后降低的变化趋势。而Xu等的研究显示,不同粒径的聚苯乙烯微塑料可以显著提高大豆根系的SOD活性。关于微塑料对植物体内抗氧化指标的影响各不相同,其主要与微塑料的类型、粒径、浓度、供试作物品种和栽培方式等有关。
4 结论
(1)PE在0.5 g·L-1水平下和PP在1.0 g·L-1水平下,抑制生菜根系正常的生长发育,进而降低其生物量。
(2)PE和PP在1.0 g·L-1水平下对生菜叶片和根系均产生毒害效应,完整的根系细胞结构遭受破坏,同时叶肉细胞的叶绿体也遭到破坏,造成生菜光合作用受阻,降低了生菜叶片的光合参数及光合色素含量。此外,为缓解微塑料的毒害作用,生菜体内抗氧化系统均产生应激响应。
基金项目:国家重点研发计划项目(202IYFD1700900);河南省自然科学基金面上项目(222300420464);河南省高等学校重点科研项目(24A210010)

