肠肾虫感染的黑斑蛙外周血血细胞指标变化

摘要:黑斑蛙具有极高生态价值和经济价值,也是我国近年来养殖蛙类的主要品种之一。肠肾虫是蛙类肠道内常见的寄生虫之一,本研究采用显微镜细胞计数、常规瑞氏染色的方法,对肠肾虫感染的黑斑蛙外周血细胞的形态计量学、显微结构进行了研究。瑞氏染色显示,寄生虫感染对黑斑蛙血细胞形态结构无显著影响。细胞计数显示,感染组黑斑蛙红细胞数量极显著下降(P < 0.01),白细胞数量、血栓细胞数量显著上升(P < 0.05)。白细胞分类计数表明,感染组与未感染组相比,淋巴细胞、嗜中性粒细胞、嗜酸性粒细胞数量极显著上升(P < 0.01),单核细胞和嗜碱性粒细胞数量变化无统计学差异。根据本研究结果和已有的文献报道,本研究认为嗜酸性粒细胞数量的变化可以作为黑斑蛙肠肾虫感染检测的重要指标。
关键词:黑斑蛙;肠肾虫;血细胞;白细胞比例
中图分类号:Q958.9 文献标志码:A 文章编号:1001-2443(2024)04-0333-07
引言
外周血血液学参数常用于评价人和动物的健康及营养状况,血液学检查是一种低创伤的检测技术[1]。红细胞的数目变化可反映动物的营养和贫血状况[2]。白细胞的数目及各种白细胞比例的变化常涉及机体在不同环境下的免疫反应,诸如应激[3]、炎症反应[4]、寄生虫感染[5]和细菌性感染性疾病[6]。血栓细胞在止血和凝血中起重要作用[ 7],研究表明血栓细胞数量的变化与病原菌感染[6]、寄生虫类感染[8]、环境状况[9]等密切相关。
目前,有关寄生虫引起的低等脊椎动物血细胞变化的病理学研究主要集中于鱼类,如奥尼罗非鱼(Oreochromis aureus×Oreochromis niloticus)、草鱼(Ctenopharyngodon idellus)、黄鳝(Monopterusalbus)等[10-12]。对两栖动物肠道中寄生虫感染所致病变时其血液学参数变化的研究甚少,李朝波等对寄生虫感染后黑斑蛙肠道组织的病理变化进行了观察[13],但未涉及外周血血细胞指标的检测。
黑斑蛙(Rana nigromaculate)是蛙科、侧褶蛙属的两栖动物,在我国分布很广,是农田蛙类的优势种,因其肉质细嫩、脂肪少、糖分低、蛋白质含量高等优点而深受消费者喜爱[14]。目前,黑斑蛙养殖已成为水产养殖业中快速兴起的一个养殖项目,然而各种疾病尤其是寄生虫病严重阻碍着蛙养殖业的发展,肠肾虫是黑斑蛙肠道内常见的寄生虫之一[15],本研究采用瑞氏染色、细胞计数对上述寄生虫感染的黑斑蛙外周血细胞显微结构特征和数量变化进行了研究,以探索寄生虫对黑斑蛙外周血细胞数目和比例的影响,为黑斑蛙养殖中寄生虫病的诊断和防治提供参考资料。
1 材料与方法
1.1 实验动物的采集
本实验所用黑斑蛙均购买自芜湖县朗田黑斑蛙养殖专业合作社,选用了20只成年黑斑蛙(10只肠道寄生虫感染和10只健康蛙),健康成年黑斑蛙平均体重为37.33±10.93g,平均体长为7.74±0.93 cm,寄生虫感染黑斑蛙平均体重为24.28±2.14 g,平均体长为6.61±0.17 cm。购买后,在实验室的水箱中静养一天,排除黑斑蛙的应激反应(水箱长宽高分别是52 cm、37 cm和32 cm)。
1.2 血涂片的制备
首先对正常蛙进行外形观察,确定实验所用正常蛙表面无伤且活跃,外观上看(体型较小且消瘦)可能被寄生虫感染的黑斑蛙毁髓后取其靠近肛门处1 cm的直肠制片,并在基恩士VHX-5000显微镜下镜检,确定寄生虫的存在(主要是肠肾虫)。用干净纱布将蛙体表擦干,用双毁髓法致瘫,立即测量体长并称重,随即打开黑斑蛙心腔,使用无菌的5 ml注射器和22 G针头抽取血液样本,避免凝血,需采用K2-EDTA作为抗凝剂,采血后立即制备血涂片,晾干备用。
1.3 瑞氏染色
将干燥后的血涂片水平放在湿盒中,滴加600 μL的瑞氏染液至完全覆盖血涂片,等待30 s,再滴加等量的磷酸盐缓冲液与瑞氏染液混合,并用洗耳球吹匀覆盖整个血涂片,等待10 min。10 min后染色完成,将血涂片上的染液在流动的蒸馏水下冲洗干净,注意流速缓慢,防止血细胞脱落,最后在室温下再次风干,滴加香柏油在Olympus BX61显微镜下进行镜检拍照。
1.4 血细胞计数
用移液枪吸取995 μL的血细胞稀释液放入EP管中,将5 μL的黑斑蛙血液样本加入其中并打匀,使黑斑蛙血液样本稀释200倍,便于细胞计数。取干燥洁净的血球计数板平放于实验台上,盖上20 mm*20 mm的盖玻片,在盖玻片边缘一角滴加刚混匀的血液样本。待血液样本扩散到整个血球计数板时,拿到显微镜下观察计数。每个黑斑蛙样本数三次,按照公式即得血细胞总数TBC(个/mL)=N×25×104×200(N为血球计数板五个中方格里血细胞的平均数目)。
在Olympus BX61显微镜下随机拍摄20张细胞照片,计算出红细胞、白细胞和血栓细胞的比例,再根据上述得到的血细胞总数计算出红细胞数目(RBC)、白细胞数目(WBC)和血栓细胞数目(TC)。每只黑斑蛙的血液样品在显微镜下随机选取1000个白细胞,根据白细胞形态及着色差异区分不同类型的白细胞并统计出各种白细胞的百分比。
1.5 统计分析
使用IBM SPSS Statistics 26.0统计软件对数据进行T检验,得到的数据用平均值(Mean)±标准差(SD)表示,P < 0.05表示感染蛙与未感染蛙存在显著差异(*),P < 0.01表示感染蛙与未感染蛙存在极显著差异(**)。
2 结果与分析
2.1 黑斑蛙肠肾虫感染情况
感染蛙(图1 A)食欲下降,体形消瘦,与正常蛙(图1 B)相比平均体重轻34.96%,体长比正常蛙短14.60%。
取蛙靠近肛门处1 cm的直肠进行镜检,将直肠黏膜制成活体铺片显微镜下计数,计数结果发现肠肾虫感染的黑斑蛙在200倍下一个视野内虫体达4~6只(图1 C),正常蛙直肠中未见肠肾虫感染(图1 D)。
2.2 黑斑蛙外周血血细胞的显微结构
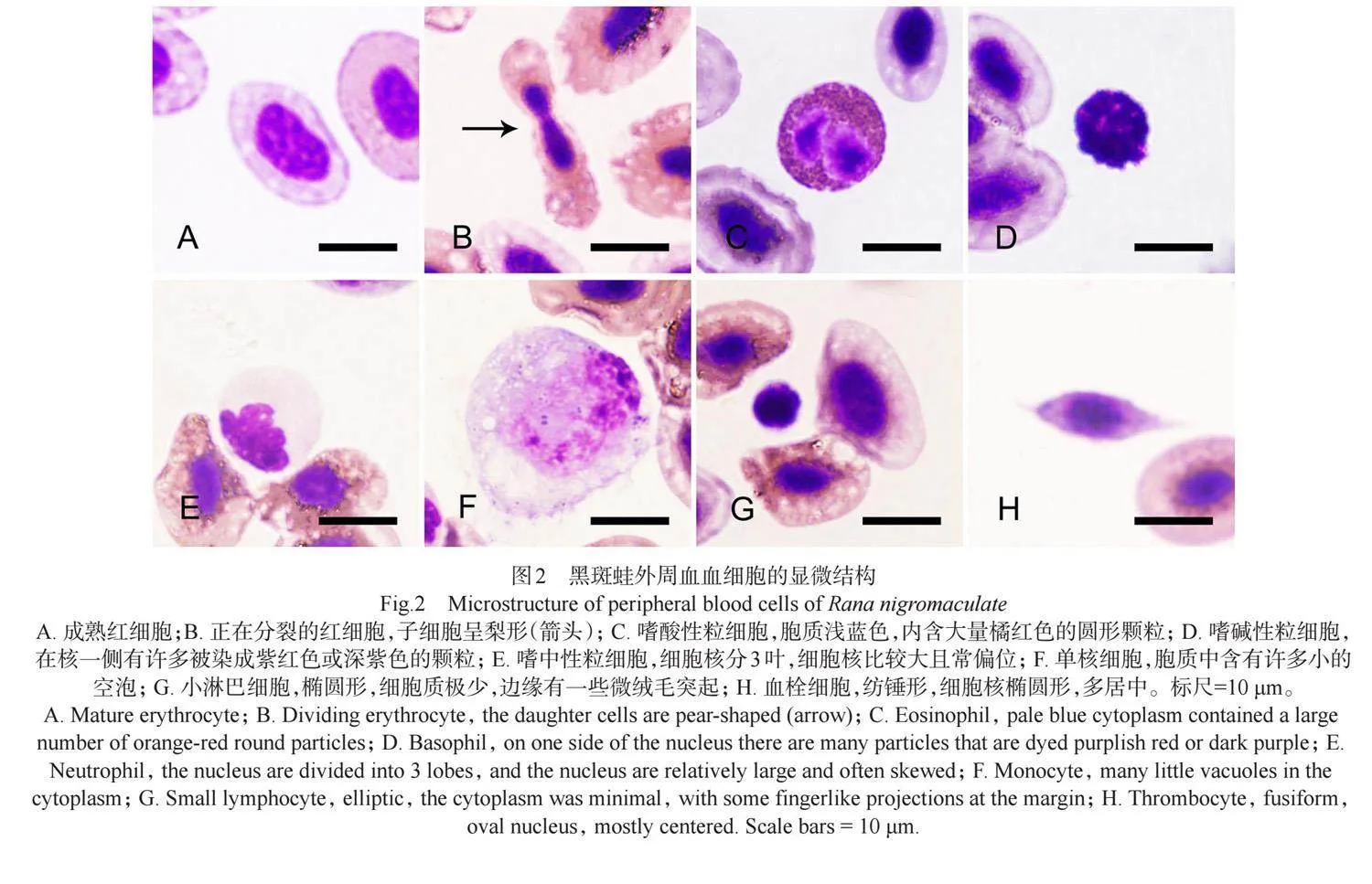
2.2.1 红细胞 在光镜下,红细胞表面比较光滑,成熟红细胞多为椭圆形,细胞核为椭圆形,位于细胞的中央,染色质致密,被染成紫红色,细胞质被染成粉红色(图2A)。还能观察到梨形红细胞,可能是刚经过无丝分裂形成的,核质的比例较大(图2B)。
2.2.2 白细胞 显微镜下白细胞可分为嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞、单核细胞和淋巴细胞。嗜酸性粒细胞胞质内有橘红色的圆形颗粒,且颗粒较大,常遮盖住核,核常呈哑铃型或眼镜形(图2C)。嗜碱性粒细胞胞核较大,常偏位,在核一侧有许多被染成紫红色或深紫色的颗粒(图2D)。嗜中性粒细胞胞质呈蓝色,染色均匀较浅,核有单叶核和多叶核之分,多叶核一般分两到三叶,各叶的大小和形状常不规则(图2E)。单核细胞细胞核呈肾形或马蹄形,细胞质被染成浅蓝色,内有大小不等的空泡(图2F)。淋巴细胞可分为大淋巴细胞和小淋巴细胞,并且小淋巴占多数。小淋巴细胞胞体较小,胞质极少,被染成蓝色,部分胞质边缘伸出许多微绒毛突起(图2G)。
2.2.3 血栓细胞 血栓细胞数量较少,表面较光滑,多呈纺锤形或长梭形,核染色质密集,呈深紫红色,胞质接近无色(图2H)。
通过显微结构观察发现,肠肾虫感染对黑斑蛙血细胞形态结构无显著影响。
2.3 黑斑蛙血细胞指标变化
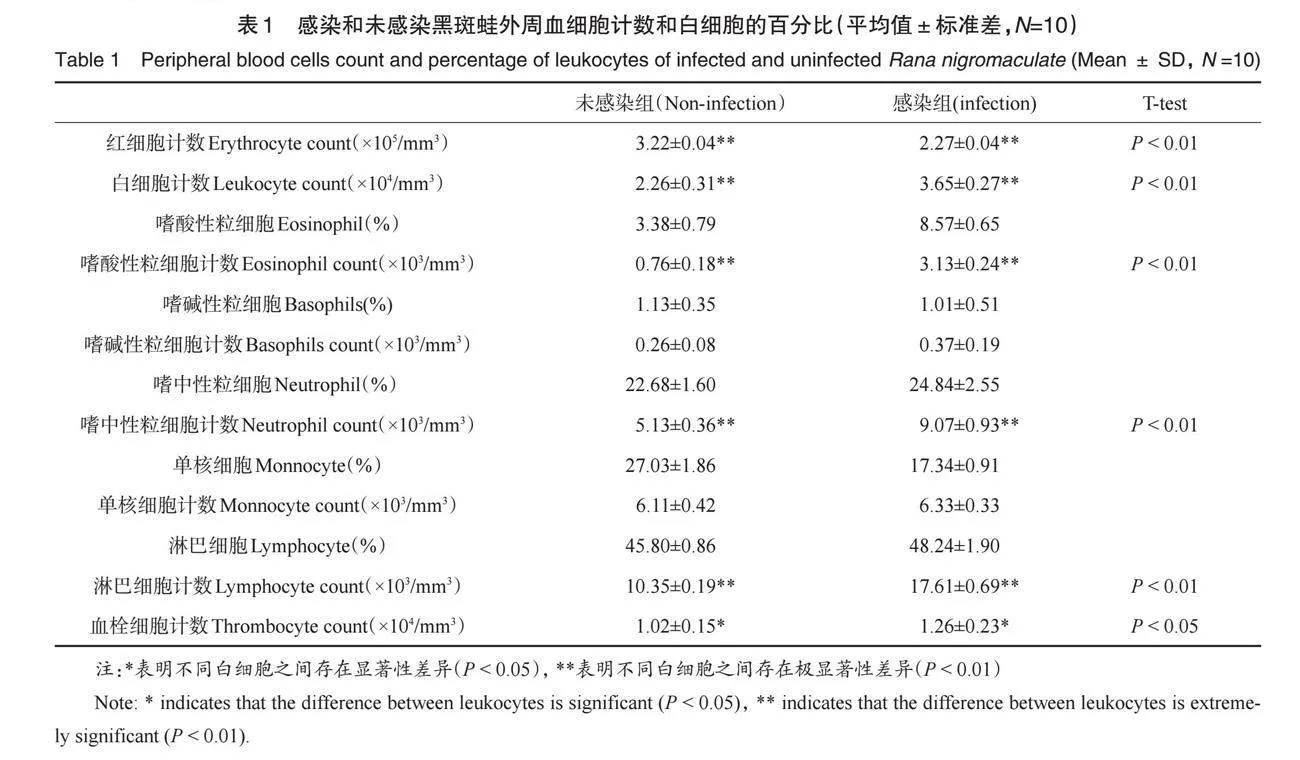
通过细胞计数和统计,感染组和未感染组黑斑蛙红细胞数、各种白细胞数、血栓细胞数列入表1,感染组红细胞数量与未感染组相比极显著下降(P < 0.01),感染组白细胞数量与未感染组相比极显著上升(P < 0.01),感染组血栓细胞数量与未感染组相比显著上升(P < 0.05)。不同白细胞所占的百分比及数量如表1所示,黑斑蛙中最丰富的白细胞是淋巴细胞,依次是单核细胞、嗜中性粒细胞和噬酸性粒细胞,嗜碱性粒细胞最少。对白细胞的分类计数表明,感染组嗜酸性粒细胞、嗜中性粒细胞、淋巴细胞数量极显著增加(P < 0.01),单核细胞、嗜碱性粒细胞数量无显著变化。
3 讨论
3.1 红细胞数量变化
红细胞的主要功能是通过细胞内的血红蛋白来运输氧气和二氧化碳,它是外周血最主要的细胞类型[16-17],红细胞数量也会因生理病理条件及生态环境的改变而变化[6,9] 。两栖动物对环境的变化较为敏感,能通过生理改变来适应环境[2] 。本研究结果显示,寄生虫感染对黑斑蛙外周血血细胞形态结构无显著影响,而感染组红细胞计数极显著小于未感染组(P < 0.01)。Azevedo等研究发现车轮虫感染的尼罗罗非鱼(Oreochromis niloticus)红细胞数量有轻微下降,但差异不显著[5];Martins等发现被线虫感染的大头兔脂鲤(Leporinus macrocephalus)红细胞计数无明显变化[18]。此外,Tavares-Dias 等发现多子小瓜虫感染的尼罗罗非鱼( Oreochromis niloticus)红细胞数量极显著降低[19]。本研究显示的结果与Tavares-Dias 等的发现一致,这可能是因为部分寄生虫感染会引起动物贫血[8,18-19]。
3.2 白细胞数量变化
白细胞的主要功能是杀灭病原体、清除过敏原,参与机体特异性和非特异性免疫防御反应[7]。蛙类外周血中一般可观察到5种白细胞:嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞和淋巴细胞[2]。影响全血中白细胞计数水平的因素有环境状况[9]、营养条件[20]、病原菌感染[6]和寄生虫感染[10]。在本研究中,寄生虫感染的黑斑蛙的白细胞计数极显著高于未感染组,这与一些报道鱼类寄生虫感染后白细胞变化的结果相一致[8,12]。
嗜酸性粒细胞是外周血白细胞的一种,两栖动物的嗜酸性粒细胞可观察到伪足或绒毛状突起,表明其具有运动和变形能力,具有对异物等病原体进行吞噬或吞饮的作用[7]。报道显示,在寄生虫感染时,嗜酸性粒细胞对小型寄生虫具有吞噬作用,对大型寄生虫的杀伤作用主要是通过嗜酸性粒细胞颗粒中的离子蛋白参与细胞毒作用[21],另有研究表明:在寄生虫感染尤其是蠕虫感染时,宿主体内嗜酸性粒细胞生成增加并迁移至感染部位杀伤蠕虫,嗜酸性粒细胞还可调节宿主的免疫环境,参与蠕虫所致的免疫损伤及组织修复[22]。Wiedemann等观察到蠕虫感染的小鼠血液中嗜酸性粒细胞的生成增多[23],Martins等发现被线虫感染的大头兔脂鲤嗜酸性粒细胞百分比显著升高[18],这样的结果在鱊头槽縧虫寄生的鲤鱼(C. carpio) [24]和感染委内瑞拉类圆线虫的小鼠[25]中同样被报道了,而本研究结果也显示感染组与未感染组相比嗜酸性粒细胞的数目极显著上升(P < 0.01),因此我们认为蛙类对抗寄生虫感染时,嗜酸性粒细胞同样发挥了重要作用。
嗜中性粒细胞具有明显的运动和吞噬能力,因而具有较强的免疫抗病能力[8]。有报道表明在寄生虫感染的过程中,嗜中性粒细胞一般是最活跃的白细胞之一, 例如感染隐藏新棘虫和胃瘤线虫的黄鳝, 随着寄生虫感染数量的增加, 其嗜中性粒细胞数量也随之增加[12]。Azevedo等研究发现车轮虫感染的尼罗罗非鱼血液中嗜中性粒细胞百分比与对照组相比无显著变化[5],蔡心星等对多子小瓜虫感染的草鱼白细胞分类计数发现中性粒细胞分类计数极显著下降,并认为可能由于淋巴细胞增殖太快造成中性粒细胞比例相对减少[11],另有李利等研究表明车轮虫感染的奥尼罗非鱼血液中嗜中性粒细胞百分比极显著高于未感染组,说明嗜中性粒细胞可能在抵御车轮虫入侵中起着重要作用[10],我们的结果与李利等一致,寄生虫感染后,嗜中性粒细胞数量的增加可能与其在非特异免疫中参与机体的炎症反应,大量吞噬异物,提高免疫力有关。
单核细胞有活跃的变形运动,明显的趋化性和一定的吞噬功能[10]。在本研究中,黑斑蛙的单核细胞和淋巴细胞在白细胞中含量最高,这可能使其有较强的防御机制和免疫能力以更好地适应外界环境[8]。李利等研究了车轮虫感染奥尼罗非鱼的白细胞分类百分比变化,结果显示单核细胞百分比比例减少[10]。Azevedo等对感染车轮虫的尼罗罗非鱼的血液学研究,结果表明患病鱼的单核细胞百分比与对照组无显著差异[5]。而本研究结果表明感染组单核细胞数量与未感染组相比无显著差异,这与Azevedo等的研究结果一致,表明单核细胞在蛙类抗寄生虫感染的过程中作用不明显。
淋巴细胞属于白细胞中的无粒细胞,在特异性免疫和非特异性免疫中都发挥着非常关键的作用,且其表面的突起可能与其免疫功能即抗原结合受体分子有关[26]。本研究显示淋巴细胞是黑斑蛙白细胞数量中最多的,感染组淋巴细胞数量与未感染组相比极显著上升(P < 0.01)。与我们的研究结果相反,Tavares-Dias 等对感染多子小瓜虫的尼罗罗非鱼的血液学研究,结果表明患病鱼的淋巴细胞百分比减少[19]。Azevedo等研究发现车轮虫感染的尼罗罗非鱼血液中淋巴细胞百分比与对照组相比无显著变化[5]。另有李利等研究了车轮虫感染奥尼罗非鱼的白细胞分类百分比变化,结果显示感染组该鱼血液中的淋巴细胞百分比极显著升高[10]。我们的研究结果与李利等一致,造成这种结果的原因可能是感染蛙淋巴细胞受到抗原刺激作用参与机体的特异性免疫,表明淋巴细胞在蛙类抵御寄生虫感染中占有重要地位。
两栖动物的血栓细胞生理功能相当于哺乳动物的血小板,主要发挥止血凝血的作用[8],有报道称哺乳动物的血小板通过其表面膜上低亲和力的特异性IgE的受体与IgE相互作用,这种IgE依赖的血小板活性可导致寄生虫杀伤[27]。Omonona 和 Ekpenko对椎虫寄生的欧洲林蛙(Rana temporaria)进行血液学计数,结果表明两个地区的林蛙血栓细胞数量感染组与未感染组无显著性差异[28]。李振伟等对咽碘泡虫感染后患病中期的异育银鲫(Carassius auratus gibelio)血栓细胞数量计数,结果表明病鱼的血栓细胞数量极著低于健康鱼[8]。Abdel-Hafez等对感染多子小瓜虫的圆鳍雅罗鱼(Leuciscus cephalus)的血液学研究结果表明,感染鱼内血栓细胞的数量有所增加[29]。在本实验中,感染组血栓细胞数量与未感染组相比显著上升(P < 0.05),这可能与寄生虫感染时血栓细胞的免疫功能有关,随着寄生虫侵染程度的加深,为了抵御肠肾虫的胁迫,大量产生血栓细胞,提高免疫力。另有研究表明,黑斑蛙小肠中的寄生虫对小肠壁造成严重的机械损伤,寄生虫侵害部位周围结缔组织增生形成包囊[13],这些病理反应也可能造成血栓细胞增多从而及时凝血减轻虫体对肠道造成的损伤。
综上所述,本研究首次对肠肾虫感染的黑斑蛙外周血细胞数量、显微结构特征进行了研究。观察外周血血细胞的显微结构发现肠肾虫感染对黑斑蛙血细胞形态结构无显著影响。
血液学计数结果表明,感染组黑斑蛙红细胞数量极显著下降,白细胞数量、血栓细胞数量显著上升,白细胞分类计数表明,感染组与未感染组相比,嗜酸性粒细胞、嗜中性粒细胞和淋巴细胞数量极显著上升,单核细胞和嗜碱性粒细胞数量变化无统计学差异,根据本研究结果和已有的文献报道,我们认为嗜酸性粒细胞数量的变化可以作为黑斑蛙寄生虫感染检测的重要指标。
参考文献:
[1] ETIM N A N, WILLIAMS M E, AKAPABIO U, et al. Haematological parameters and factors affecting their values[J]. Agricultural Science, 2014, 2(1): 37-47.
[2] FEI P , RRI Z , XUE Z , et al. Hematology and serum biochemistry of farmed bullfrog, Lithobates catesbeianus during the active and hibernating periods[J]. Journal of Veterinary Medicine & Animal Health, 2016, 8(11):176-182.
[3] SILVEIRA-COFFIGNY R , PRIETO-TRUJILLO A , ASCENCIO-VALLE F. Effects of different stressors in haematological variables in cultured Oreochromis aureus S[J]. Comparative Biochemistry and Physiology Part C Toxicology & Pharmacology, 2004, 139(4):245-250.
[4] MARTINS M L, MORAES F R, YUDI FUJIMOTO R, et al. Carrageenin induced inflammation in Piaractus mesopotamicus (Osteichthyes: Characidae) cultured in Brazil[J]. B. Inst. Pesca, 2006, 32(1): 31-39.
[5] AZEVEDO T M P, MARTINS M L, BOZZO F R, et al. Haematological and gill responses in parasitized tilapia from Valley of Tijucas River, SC, Brazil[J]. Scientia Agricola, 2006, 63(2): 115-120.
[6] 范慧慧, 张呈念, 安钦, 等. 香鱼嗜水气单胞菌人工染病后血液生理生化指标变化[J]. 水产科学, 2012, 31(5):280-282.
[7] 胡知渊, 来雅萍, 陈文静. 棘胸蛙、虎纹蛙、黑斑蛙血细胞的比较[J]. 四川动物, 2005 (1):5-8+122.
[8] 李振伟, 陆宏达, 操艮萍, 等. 异育银鲫咽碘泡虫病组织病理与病理生理[J]. 中国水产科学, 2016, 23(6):1339-1350.
[9] 任培丽, 张迎梅, 耿广琴, 等. 污染水域鲫鱼外周血细胞形态和数量的变化[J]. 动物学杂志, 2008 (2):37-42.
[10] 李利, 张其中. 车轮虫感染奥尼罗非鱼的白细胞分类百分比变化[J]. 生态科学, 2007 (5):452-455.
[11] 蔡心星, 张其中, 张妍. 草鱼外周血白细胞组成及其受胁迫和感染的影响[J]. 广东农业科学, 2014, 41(4):148-151.
[12] 罗宇良, 刘小玲, 张桂荣, 等. 2种寄生虫感染黄鳝引起的血细胞变化[J]. 水利渔业, 1999 (5):41-43.
[13] 李朝波, 高登慧. 黑斑蛙肠道寄生虫感染的病理观察[J]. 山地农业生物学报, 2013, 32(2):184-186.
[14] 张盛周, 朱联九, 朱升学, 等. 黑斑蛙消化道淀粉酶的活力[J]. 安徽师范大学学报(自然科学版), 2009, 32(2):153-156.
[15] 汪建国, 李连祥, 肖武汉. 中国无尾两栖类寄生肠肾虫的考种依据及其讨论[J]. 水生生物学报, 2002(5):543-549.
[16] MINASYAN H A. Erythrocyte and Leukocyte: two partners in bacteria killing[J]. Growth Factors, 2014, 32(1/6):490-497.
[17] SATHEESHKUMAR P, ANANTHAN G, SENTHILKUMAR D, et al. Comparative investigation on haematological and biochemical studies on wild marine teleost fishes from Vellar estuary, southeast coast of India[J]. Comparative Clinical Pathology, 2012, 21(3): 275-281.
[18] MARTINS M L, TAVARES-DIAS M, FUJIMOTO R Y, et al. Haematological alterations of Leporinus macrocephalus (Osteichtyes: Anostomidae) naturally infected by Goezia leporini (Nematoda: Anisakidae) in fish pond[J]. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 2004, 56(5): 640-646.
[19] TAVARES-DIAS M, MORAES F R, MARTINS M L,et al. Haematological changes in Oreochromis niloticus (Osteichthyes: Cichlidae) with gill ichthyophthiriasis and saprolegniosis[J]. Boletim Do Instituto De Pesca, 2002, 28(1):1-9.
[20] BARROS M M, PEZZATO L E, KLEEMANN G K, et al. Níveis de vitamina C e ferro para tilápia do Nilo (Oreochromis niloticus)[J]. Revista Brasileira de Zootecnia, 2002, 31(6): 2149-2156.
[21] 刘影. 嗜酸性粒细胞与寄生虫感染[J]. 国外医学(寄生虫病分册), 1999 (6):249-252.
[22] RAVIN K A, LOY M. The eosinophil in infection[J]. Clinical Reviews in Allergy & Immunology, 2016, 50(2): 214-227.
[23] WIEDEMANN M, VOEHRINGER D. Immunomodulation and immune escape strategies of gastrointestinal helminths and schistosomes[J]. Frontiers in Immunology, 2020, 11:572865.
[24] SOPINSKA A. Effects of physiological factors, stress, and disease on hematologic parameters of carp, with a particular reference to the leukocyte patterns. III. Changes in blood accompanying branchionecrosis and bothriocephalosis[J]. Acta Ichthyologica et Piscatoria, 1985, 15(2): 141-170.
[25] MACHADO E R, UETA M T, LOURENCO E V, et al. Comparison of immune responses in mice infected with different strains of Strongyloides venezuelensis[J]. Parasite Immunology, 2007, 29 (11): 549-557.
[26] SCAPIGLIATI G. Functional aspects of fish lymphocytes[J]. Developmental & Comparative Immunology, 2013, 41(2): 200-208.
[27] 陈小彬,袁加琪,王志鑫,等.系统免疫炎症指数与肝泡型包虫病患者预后的相关性分析[J].临床肝胆病杂志, 2021, 37(2):375-379.
[28] AO O, EKPENKO V. Haematology and prevalence of blood parasites of the common frog (Rana temporaria) in the tropical environment[J]. Journal of Veterinary Medicine and Animal Health, 2011, 3(2): 14-20.
[29] ABDEL-HAFEZ G, LAHNSTEINER F, MANSOUR N, et al. Pathophysiology of Ichthyophthirius multifiliis infection in rainbow trout (Oncorhynchus mykiss) and chub (Leuciscus cephalus)[J]. Journal of Comparative Pathology, 2014, 151(4): 394-399.
Changes of Hematological Parameters in Peripheral Blood of Rana Nigromaculata Infected with Nyctotherans
WANG Qin1, SU Jie-jie2, LI Li3,ZHANG Sheng-zhou2
(1. Osaka College of Medical Engineering, Ma'anshan University, Ma'anshan 243000, China; 2. Key Laboratory for Conservation and Use of Important Biological Resources of Anhui Province, College of Life Science, Anhui Normal University, Wuhu 241000, China)
Abstract: Rana nigromaculate is one of the most important species of frog raised in China in recent years, which has high ecological and economic value. Nyctotheran is one of the common parasites in the intestinal tract of frogs. The morphometrics and microstructure of peripheral blood cells of Rana nigromaculate infected by Nyctortherans were studied by means of microscopic cell counting and routine wright's staining. Wright's staining showed that parasite infection had no significant effect on blood cell morphology and structures. Cell counts showed that the number of erythrocytes in the infected group was extremely significantly decreased (P < 0.01), and the number of leukocytes and thrombocytes was significantly increased (P < 0.05). The classified count in leukocytes indicated that the number of lymphocytes, neutrophils and eosinophils increased extremely significantly in the infected group compared with the uninfected group (P < 0.01), while there was no significant difference in the number of monocytes and basophils. According to the results of this study and existing literature reports, the changes in the number of erythrocytes and eosinophils can be used as important indicators for the detection of parasitic infection.
Key words: Rana nigromaculate; Nyctotherans; blood cells; percentage of leucocytes
(责任编辑:巩 劼)

