超声靶向微泡破坏介导的整合素亚基α3转染对乳腺癌生长和上皮间质转化的影响


摘" " 要" " 目的" " 探讨超声靶向微泡破坏(UTMD)介导的整合素亚基α3(ITGA3)过表达质粒转染对乳腺癌生长和上皮间质转化(EMT)的影响。方法" " 基于GEPIA平台分析TCGA数据库中乳腺癌样本的ITGA3表达情况,绘制生存曲线评估ITGA3表达水平对乳腺癌患者生存的影响。将乳腺癌BT-549细胞分为LIP-NC组(脂质体介导的阴性对照质粒转染细胞)、LIP-ITGA3组(脂质体介导的ITGA3过表达质粒转染细胞)、UTMD-NC组(UTMD介导的阴性对照质粒转染细胞)和UTMD-ITGA3组(UTMD介导的ITGA3过表达质粒转染细胞),UTMD-NC组和UTMD-ITGA3组细胞在转染过程中均接受超声辐照(频率1 MHz,声强0.75 W/cm2,时间45 s)。于扫描电子显微镜下观察LIP-NC组、UTMD-NC组细胞形态;分别应用MTT法、划痕实验、Transwell实验检测各组细胞活力、迁移能力、侵袭能力;应用Western blot法分析BT-549细胞中ITGA3和EMT、STAT3通路相关基因蛋白的表达情况。通过裸鼠皮下肿瘤细胞注射法建立裸鼠乳腺癌异种移植瘤模型,移植35 d后处死裸鼠剥离异种移植瘤并称重;应用免疫组化检测各组异种移植瘤组织中ITGA3、N-cadherin和PCNA的表达情况。结果" " 生物信息学分析显示,乳腺癌样本中ITGA3蛋白相对表达量明显低于正常乳腺样本,差异有统计学意义(Plt;0.05);ITGA3低表达与乳腺癌患者不良预后相关(HR=0.81,P=0.000 72)。体外实验结果显示,扫描电子显微镜下LIP-NC组细胞呈球形,细胞膜表面无明显的凹坑或孔隙;UTMD-NC组细胞形态未见改变,但细胞膜表面可见粗糙区域和小凹坑。UTMD-ITGA3组、LIP-ITGA3组细胞活力、迁移能力、侵袭能力均分别较各自对照组(UTMD-NC组、LIP-NC组)降低,差异均有统计学意义(均Plt;0.05);且UTMD-ITGA3组细胞活力、迁移能力、侵袭能力均较LIP-ITGA3组更低(均Plt;0.05)。LIP-ITGA3组ITGA3蛋白相对表达量较LIP-NC组增高,UTMD-ITGA3组ITGA3蛋白相对表达量较UTMD-NC组、LIP-ITGA3组均增高,差异均有统计学意义(均Plt;0.01)。LIP-ITGA3组、UTMD-ITGA3组细胞Vimentin、N-cadherin、p-STAT3、c-Myc、CyclinD1和PCNA蛋白相对表达量均分别较UTMD-NC组、LIP-NC组降低,E-cadherin蛋白相对表达量均分别较UTMD-NC组、LIP-NC组增高,差异均有统计学意义(均Plt;0.01);且UTMD-ITGA3组细胞Vimentin、N-cadherin、p-STAT3、c-Myc、CyclinD1和PCNA蛋白相对表达量均较LIP-ITGA3组更低,E-cadherin蛋白相对表达量较LIP-ITGA3组更高(均Plt;0.05)。体内实验结果显示,UTMD-ITGA3组、LIP-ITGA3组裸鼠异种移植瘤质量均分别较UTMD-NC组、LIP-NC组降低,差异均有统计学意义(均Plt;0.01);且UTMD-ITGA3组裸鼠异种移植瘤质量较LIP-ITGA3组更低(Plt;0.01)。UTMD-ITGA3裸鼠异种移植瘤组织中ITGA3蛋白相对表达量较LIP-ITGA3组增高,差异有统计学意义(Plt;0.01);UTMD-ITGA3组、LIP-ITGA3组裸鼠异种移植瘤组织中N-cadherin、PCNA蛋白相对表达量均分别较UTMD-NC组、LIP-NC组降低,差异均有统计学意义(均Plt;0.01);且UTMD-ITGA3组N-cadherin、PCNA蛋白相对表达量较LIP-ITGA3组更低(均Plt;0.01)。结论" " UTMD介导的ITGA3过表达质粒转染可有效抑制乳腺癌生长和EMT,有望为今后乳腺癌治疗提供新的策略。
关键词" " 超声靶向微泡破坏;乳腺癌;脂质体;整合素亚基α3
[中图法分类号]R445.1;R737.9" " " "[文献标识码]A
Influence of the growth and epithelial-mesenchymal transformation of breast cancer mediated by integrin subunit α3 transfection with
ultrasound targeted microbubble destruction
QIAN Zhaogao,LI Zaili
Department of Ultrasound,the People’s Hospital of Pingyang,Zhejiang 325400,China
ABSTRACT" " Objective" " To investigate the influence on the growth and epithelial-mesenchymal transformation(EMT) of breast cancer by integrin subunit α3(ITGA3) transfection mediated with ultrasound targeted microbubble destruction(UTMD).Methods" " The expression of ITGA3 in breast cancer samples from the TCGA database was analyzed based on the GEPIA platform,and survival curves were drawn to evaluate the impact of ITGA3 expression on the survive of breast cancer patients.Breast cancer BT-549 cells were divided into LIP-NC group(liposome mediated negative control plasmid),LIP-ITGA3 group(liposome mediated ITGA3 overexpression plasmid transfected cells),UTMD-NC group(UTMD-mediated negative control plasmid transfected cells) and UTMD-ITGA3 group(UTMD-mediated ITGA3 overexpressed plasmid transfected cells).Cells in UTMD-NC and UTMD-ITGA3 groups were accepted ultrasonic irradiation(frequency 1 MHz,sound intensity 0.75 W/cm2,duration 45 s) during transfection.Cell morphology of UTMD-NC and UTMD-ITGA3 groups was observed by scanning electron microscopy.Cell viability was detected by MTT assay.Cell migration ability was detected by scratch assay,and cell invasion ability was detected by Transwell assay.Western blot analysis was performed to quantify the expression of ITGA3 and EMT- and STAT3 pathway-related proteins in BT-549 cells.A xenograft tumor model of breast cancer was established by subcutaneously injecting tumor cells into nude mice.After 35 d of transplantation,the nude mice were sacrificed and the xenograft tumors were harvested and weighed.Immunohistochemistry was used to detect the expression of ITGA3,N-cadherin and PCNA of xenograft tumor tissues in each group.Results" " Bioinformatics analysis showed that the expression of ITGA3 in breast cancer samples was significantly lower than that in normal breast samples(Plt;0.05).The low expression of ITGA3 was associated with the poor prognosis in breast cancer patients(HR=0.81,P=0.000 72).In vitro experiment showed that cells in the LIP-NC group were spherical under scanning electron microscopy,with no obvious pits or pores on the surface of the cell membrane.The cells in the UTMD-NC group showed no change in morphology,while with rough areas and small pits on the cell membrane.The cell viability,migration ability and invasion ability of UTMD-ITGA3 and LIP-ITGA3 groups were decreased compared with the control groups(UTMD-NC group and LIP-NC group),and the differences were statistically significant(all Plt;0.05).The cell viability,migration ability and invasion ability of UTMD-ITGA3 group were lower than those of LIP-ITGA3 group(all Plt;0.05).The relative expression of ITGA3 protein in the LIP-ITGA3 group cells was higher than in the LIP-NC group.The relative expression of ITGA3 protein in the UTMD-ITGA3 group was higher than in the UTMD-NC and LIP-ITGA3 groups,with statistically significant differences(all Plt;0.01).The relative expression levels of Vimentin,N-Cadherin,p-STAT3,c-Myc,CyclinD1 and PCNA proteins in the LIP-ITGA3 group and UTMD-ITGA3 group were significantly lower than those in the UTMD-NC group and LIP-NC group,while the relative expression level of E-Cadherin protein was significantly higher than that in the UTMD-NC group and LIP-NC group(all Plt;0.01).Additionally,the relative expression levels of Vimentin,N-Cadherin,p-STAT3,c-Myc,CyclinD1 and PCNA proteins in the UTMD-ITGA3 group were significantly lower than those in the LIP-ITGA3 group,and the relative expression level of E-Cadherin protein was significantly higher than that in the LIP-ITGA3 group(all Plt;0.05).In vivo experiment showed that the weight of nude mice xenograft tumors in the UTMD-ITGA3 group and LIP-ITGA3 group was significantly decreased compared with the UTMD-NC and LIP-NC groups,respectively,with statistically significant differences(all Plt;0.01).Moreover,the weight of nude mice xenograft tumors in the UTMD-ITGA3 group was significantly decreased compared with the LIP-ITGA3 group(Plt;0.01).The relative expression level of ITGA3 protein in the xenograft tumor tissues of nude mice in the UTMD-ITGA3 group was significantly higher than that in the LIP-ITGA3 group(Plt;0.01). The relative expression levels of N-cadherin and PCNA proteins in the xenograft tumor tissues of nude mice in both the UTMD-ITGA3 and LIP-ITGA3 groups were significantly lower than those in the UTMD-NC and LIP-NC groups(all Plt;0.01).Additionally,the relative expression levels of N-cadherin and PCNA proteins in the UTMD-ITGA3 group were significantly lower than those in the LIP-ITGA3 group(all Plt;0.01).Conclusion" " UTMD mediated ITGA3 overexpression plasmid transfection can effectively inhibit the growth and EMT of breast cancer,providing a new strategy for breast cancer treatment.
KEY WORDS" " Ultrasound targeted microbubble destruction;Breast cancer;Liposome;Integrin subunit α3
乳腺癌是女性最常见的恶性肿瘤,占所有癌症相关死亡的11.6%[1]。目前全球乳腺癌的发病率以每年3%的速度递增,且其在年轻人群中越来越普遍[2]。由于乳腺癌发生发展的机制尚未明确,尽管约30%的乳腺癌患者进行了早期治疗,但仍会复发和转移[3]。目前已知的信息不足以解释乳腺癌的具体生物学特性和涉及的分子信号通路[4]。因此,深入研究乳腺癌发生发展的相关机制,为乳腺癌的靶向治疗提供新的思路和方法具有重要意义。整合素亚基α3(integrin subunit α3,ITGA3)是α整合素家族成员之一,其在正常生物体中广泛表达,在介导细胞间黏附中发挥了重要作用[5]。ITGA3在多种恶性肿瘤中表达下调,同时可作为胰腺癌[6]、头颈部癌[7]和甲状腺癌[8]的预后因素,但其在乳腺癌生长和上皮间质转化(epithelial-mesenchymal transformation,EMT)中的作用鲜有报道。超声靶向微泡破坏(ultrasound targeted microbubble destruction,UTMD)作为一种新型基因递送方式和靶向给药系统,结合了RNA干扰技术和声脉冲超声,可明显提高转染基因进入细胞的效率和靶向性[9]。在UTMD过程中,靶点基因被整合到一个微泡中,通过超声触发微泡在目标组织中局部释放[10],且超声对微泡的破坏可增加毛细血管通透性,并诱导目标细胞的细胞膜产生不可逆的孔洞,从而有助于靶点基因的转染和表达[11]。此外,UTMD在癌症免疫治疗中也显示出巨大的潜力[12],有望成为一种高效、安全、靶向的基因转染和基因治疗方法。本实验旨在探讨UTMD介导的ITGA3过表达质粒转染对乳腺癌生长和EMT的影响。
材料与方法
一、主要实验材料、仪器和动物
1.主要实验材料:乳腺癌BT-549细胞株(美国菌种保藏中心);ITGA3过表达质粒及其阴性对照(NC)质粒(上海吉玛制药技术有限公司);SonoVue(意大利Bracco公司);LipofectamineTM 2000(美国Invitrogen公司);RPMI培养基、胎牛血清(浙江天杭生物科技股份有限公司);MTT试剂盒(大连美仑生物技术有限公司);ECMatrix胶、Transwell小室(美国BD公司);BCA蛋白检测试剂盒、RIPA裂解液(美国Abcam公司);抗ITGA3、E-cadherin、N-cadherin、Vimentin、STAT3、c-Myc、CyclinD1、PCNA、β-actin抗体(美国Abcam公司)。
2.主要实验仪器:超声治疗仪(UT1021,山东弘旭医疗设备有限公司);扫描电子显微镜(JSM-6360LV,日本JEOL公司);酶联免疫检测仪(Multiskan FC,美国赛默飞公司);凝胶成像仪(美国Bio-Rad公司);光学显微镜(LV100ND,日本尼康公司)。
3.实验动物:雌性BALB/c裸鼠24只,均购自北京维通利华实验动物技术有限公司,周龄7~8周,体质量18~22 g。本实验经我院动物医学伦理委员会批准(批准号:20220047),所有实验程序均遵循《赫尔辛基宣言》。
二、实验方法
(一)ITGA3在乳腺癌中的表达及其与预后的关系
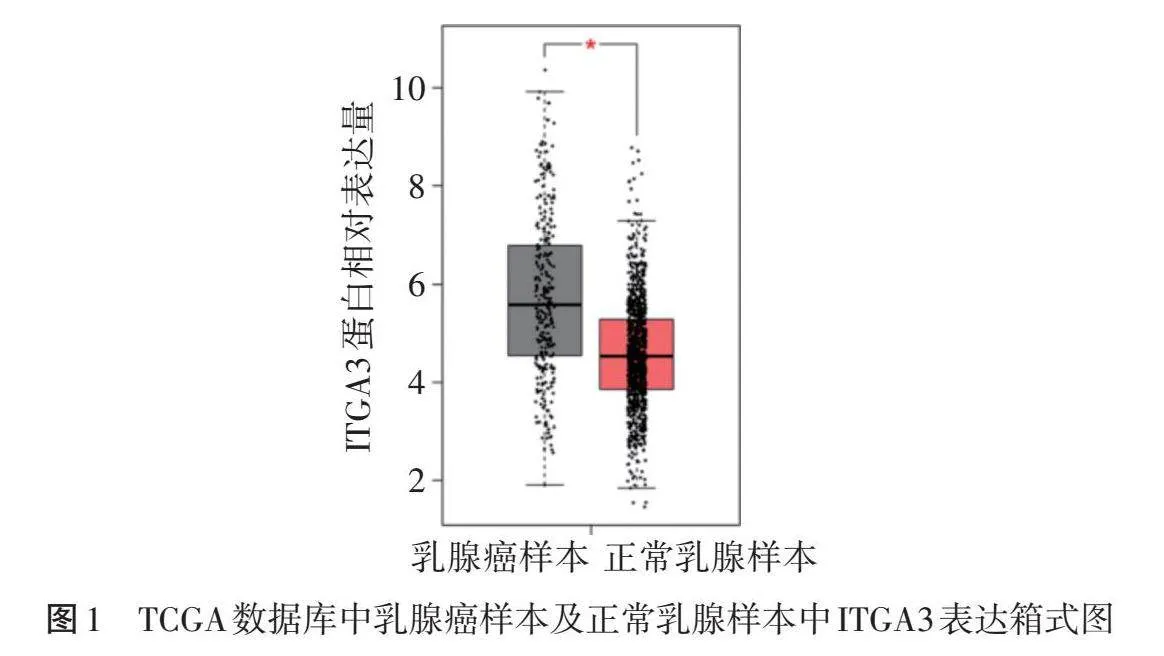
于TCGA数据库(https://www.cancer.gov/)获取1085个乳腺癌样本和291个正常乳腺样本中ITGA3的表达数据,基于GEPIA平台(http://gepia.cancer-pku.cn/index.html)对数据进行分析及比较,并根据ITGA3的中位表达水平将乳腺癌样本分为ITGA3高表达组和ITGA3低表达组,绘制生存曲线分析ITGA3表达水平对乳腺癌患者生存的影响。
(二)细胞培养及分组
使用完全培养基(RPMI培养基中添加10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素)于37℃的CO2培养箱中孵育BT-549细胞,2 d传代1次。将BT-549细胞接种于96孔板中,每孔2×104个细胞,并将其均分为4组,具体为:①LIP-NC组,即脂质体介导的NC质粒(1 μg质粒+2 μl LipofectamineTM 2000)转染细胞;②LIP-ITGA3组,即脂质体介导的ITGA3过表达质粒转染细胞;③UTMD-NC组,即UTMD介导的NC质粒转染细胞;④UTMD-ITGA3组,即UTMD介导的ITGA3过表达质粒转染细胞。其中UTMD-NC组和UTMD-ITGA3组细胞在转染过程中均接受超声辐照,具体为:根据SonoVue使用说明书制备微泡混悬液,以1 μg质粒+50 μl微泡混悬液的比例制备成质粒+微泡混合物;然后使用超声治疗仪进行辐照(频率1 MHz,声强0.75 W/cm2,时间45 s)。
(三)脂质体或UTMD转染ITGA3对体外乳腺癌细胞生物学特性的影响
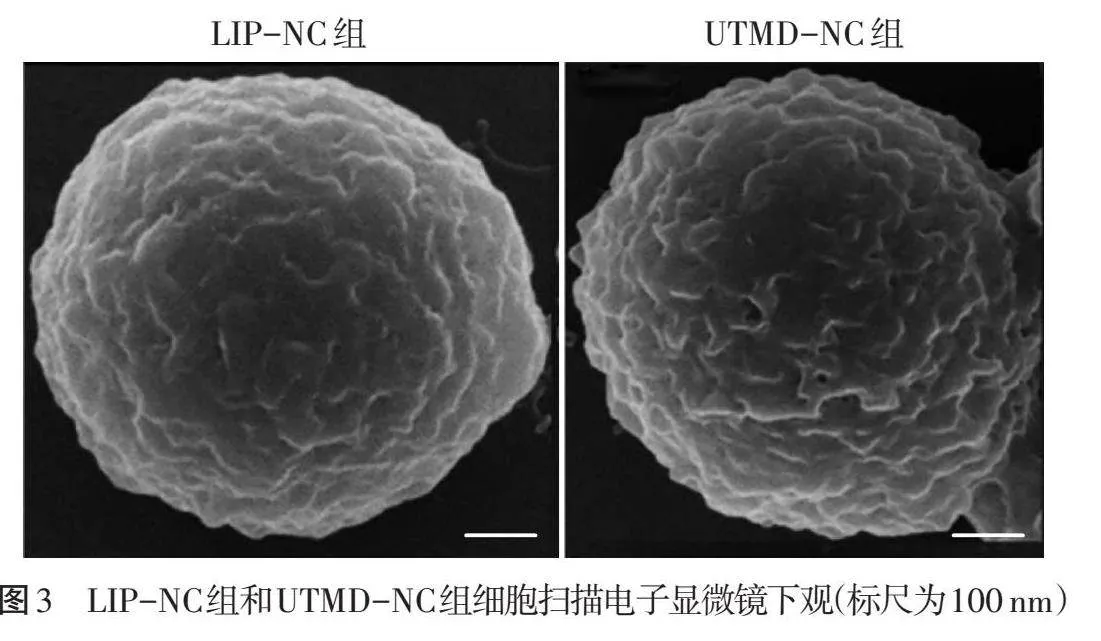
1.观察细胞形态:将LIP-NC组和UTMD-NC组细胞固定、脱水,于扫描电子显微镜下观察细胞形态。
2.MTT法检测细胞活力:于37℃和5% CO2条件下,采用96孔板以每孔5×103的密度培养对数生长期的BT-549细胞24 h,去除培养基并替换为150 μl新鲜培养基和50 μl MTT溶液。孵育4 h后去除培养基,加入200 μl 二甲基亚砜溶液溶解形成的甲臜晶体。然后将培养板摇动15 min,使用酶联免疫检测仪于570 nm处检测吸光度以评估各组细胞活力。
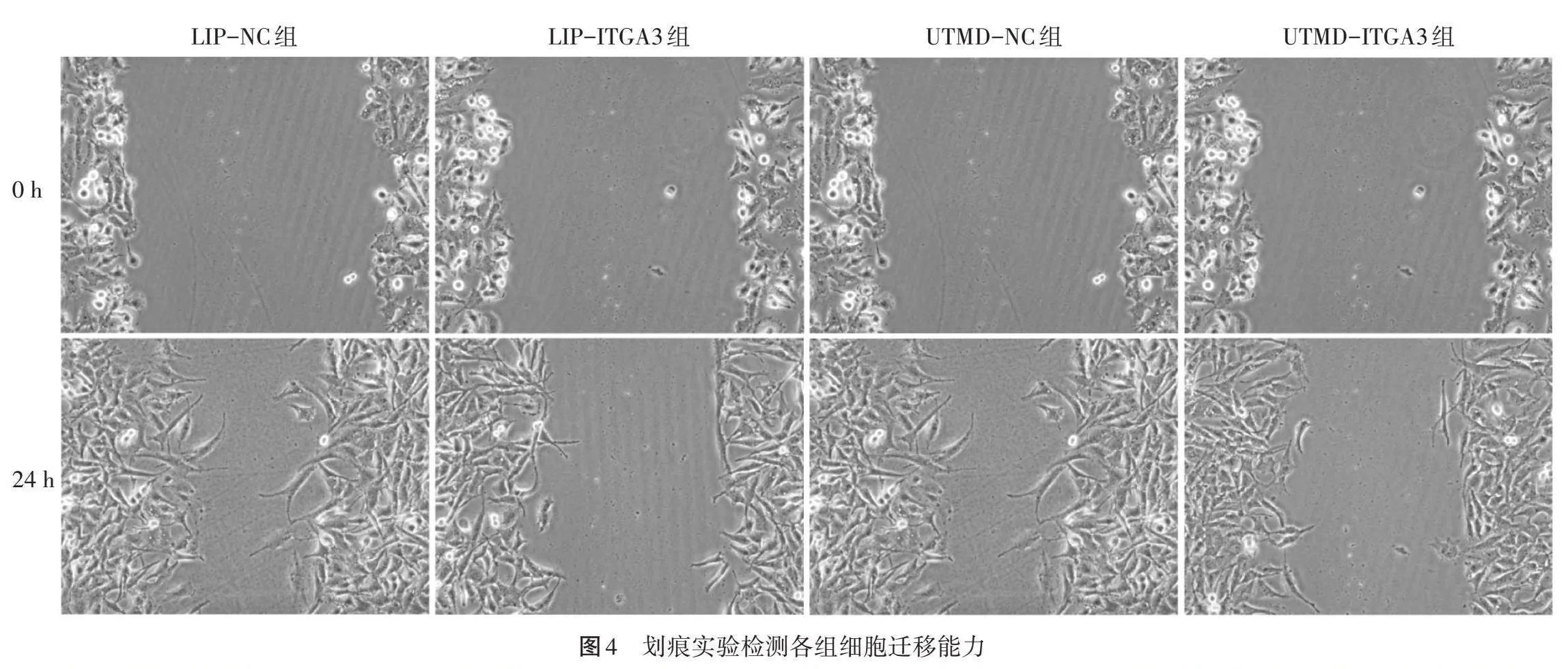
3.划痕实验检测细胞迁移能力:将各组BT-549细胞悬液以每孔1×105的密度接种于6孔板中培养,细胞达到90%汇合后,采用200 μl移液器吸头于细胞层上划痕以形成伤口间隙,培养24 h后对细胞的划痕间隙进行拍照,计算各组细胞迁移率。
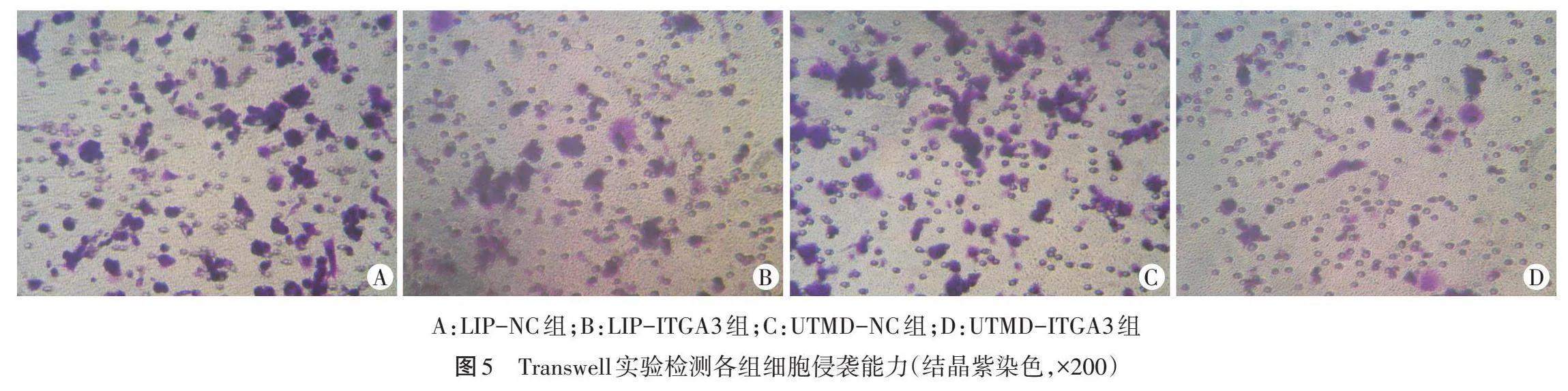
4.Transwell实验检测细胞侵袭能力:于每个Transwell上室铺一层ECMatrix胶模拟体内环境,收集各组BT-549细胞悬液,使用PBS缓冲液洗涤3次,调节细胞密度至2×105/ml,于Transwell上室加入20 μl该细胞悬液,于Transwell下室加入500 μl完全培养基,将Transwell小室置于37℃环境下孵育过夜,加入1~2滴结晶紫试剂,待反应15 min后于光学显微镜下观察转移至Transwell小室背侧的细胞,于200倍镜下随机计数5个视野的蓝染细胞,重复计数3次取平均值。
5.Western blot法分析蛋白表达:使用RIPA裂解液提取各组细胞中的总蛋白,经匀浆、离心和变性等操作后,使用凝胶电泳分离后转移至硝酸纤维素膜上,通过脱脂奶粉进行封闭操作,整体实验环境为4℃,维持12 h,于硝酸纤维素膜上加入对应一抗(ITGA3、E-cadherin、N-cadherin、Vimentin、STAT3、c-Myc、CyclinD1、PCNA和β-actin),继续在4℃环境下封闭过夜,TBST洗涤3次后,加入二抗(稀释度为1∶10 000)室温处理2 h,加入DAB显色剂显色,使用凝胶成像仪记录蛋白条带灰度并拍照,以β-actin为内参照,对各组细胞ITGA3和EMT、STAT3通路相关基因蛋白进行相对定量分析。
(四)脂质体或UTMD介导的ITGA3转染对体内乳腺癌生长的影响
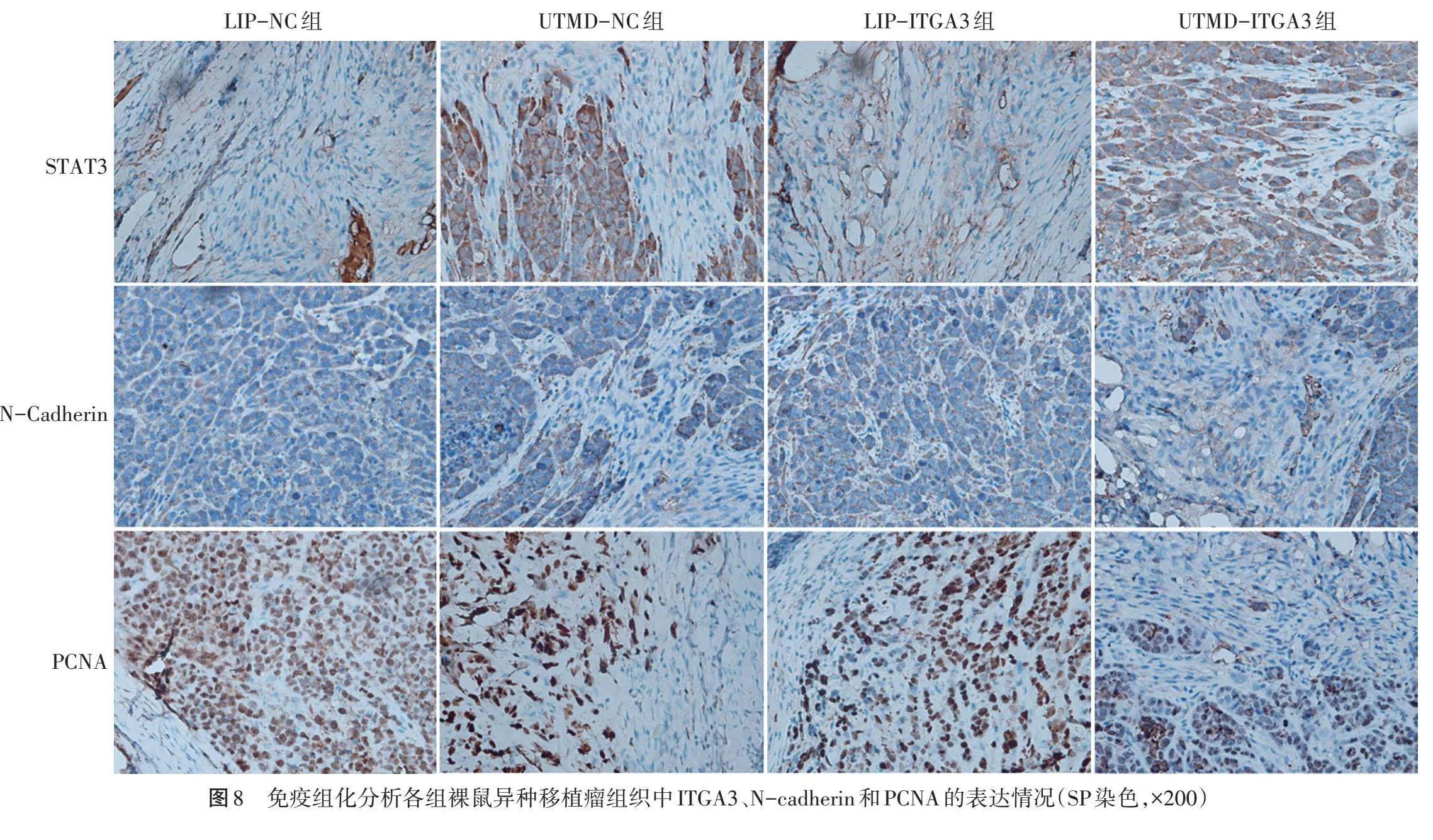
转染后收集各组BT-549细胞,分别制成密度为2×105/ml的细胞悬液。将24只BALB/c裸鼠随机分为4组,每组6只,分别于其右后肢皮下组织缓慢注射细胞悬液200 μl。隔日观察裸鼠异种移植瘤的成瘤情况;35 d后使用戊巴比妥钠(50 mg/kg)麻醉裸鼠,脱颈法处死后小心剥离异种移植瘤并称重记录。将裸鼠移植瘤组织用5%甲醛固定过夜,采用梯度乙醇脱水法将肿瘤组织脱水,石蜡包埋、切片。采用SP染色法进行免疫组化染色,于200倍光学显微镜下随机选择20个视野拍照,采用Image-Pro Plus 6.0图像处理软件分析ITGA3、N-cadherin和PCNA在肿瘤组织中的积分光密度值。
三、统计学处理
应用GraphPad Prism 8.0统计软件,计数资料以x±s表示,采用Kolmogorov-Smirnov检验验证其正态性,组间比较采用单因素方差分析或双因素方差分析,多重比较采用Tukey法。Plt;0.05为差异有统计学意义。
结" 果
一、ITGA3在乳腺癌中的表达及其与预后的关系
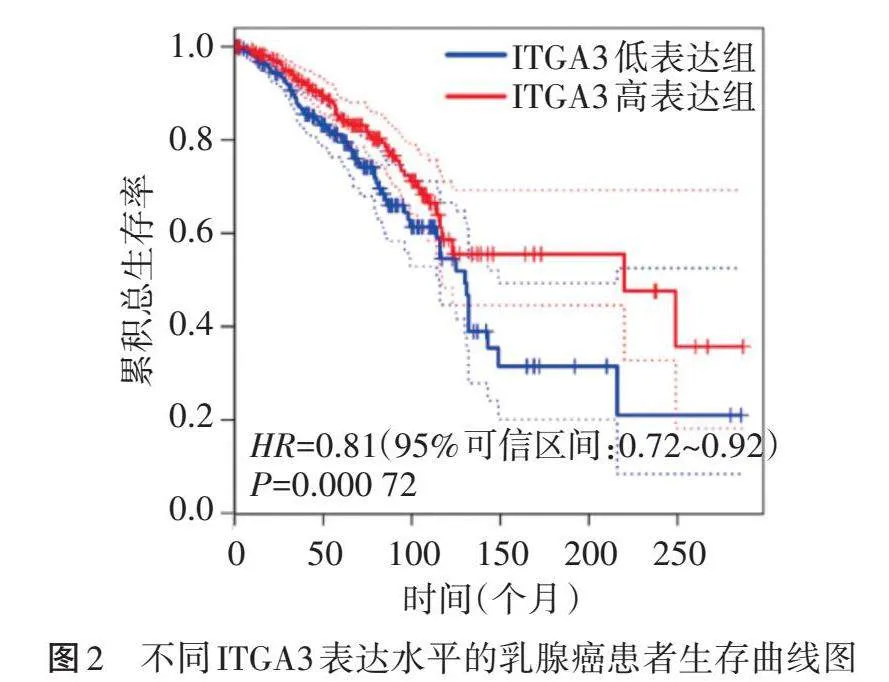
生物信息学分析显示,与正常乳腺样本比较,乳腺癌样本中ITGA3蛋白相对表达量明显降低,差异有统计学意义(Plt;0.05)。见图1。生存曲线显示,ITGA3低表达与乳腺癌患者不良预后相关(HR=0.81,P=0.000 72)。见图2。
二、脂质体或UTMD转染ITGA3对体外乳腺癌细胞生物学特性的影响
1.细胞形态:扫描电子显微镜下LIP-NC组细胞呈球形,细胞膜表面无明显的凹坑或孔隙;UTMD-NC组细胞形态未见改变,但细胞膜表面可见粗糙区域和小凹坑。见图3。
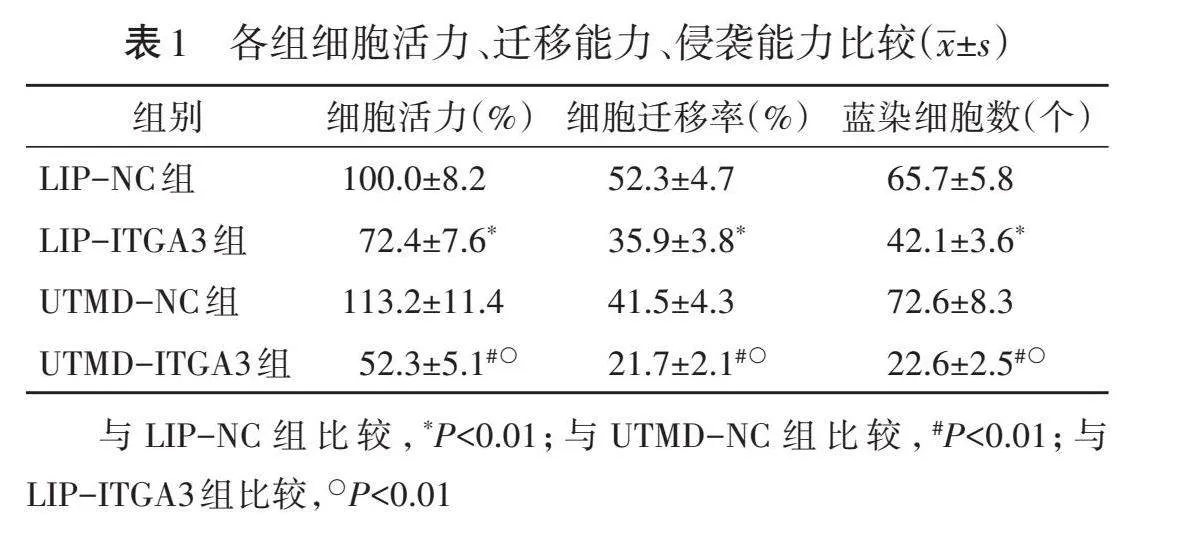
2.细胞活力、迁移能力、侵袭能力比较:UTMD-ITGA3组、LIP-ITGA3组细胞活力、迁移能力、侵袭能力均分别较各自对照组(UTMD-NC组、LIP-NC组)降低,差异均有统计学意义(均Plt;0.05);且UTMD-ITGA3组细胞活力、迁移能力、侵袭能力均较LIP-ITGA3组更低(均Plt;0.05)。见表1和图4,5。
3.细胞ITGA3蛋白相对表达量比较:与LIP-NC组比较,LIP-ITGA3组细胞ITGA3蛋白相对表达量增高,差异有统计学意义(Plt;0.001);与UTMD-NC组、LIP-ITGA3组比较,UTMD-ITGA3组ITGA3蛋白相对表达量增高,差异均有统计学意义(均Plt;0.01)。见图6。
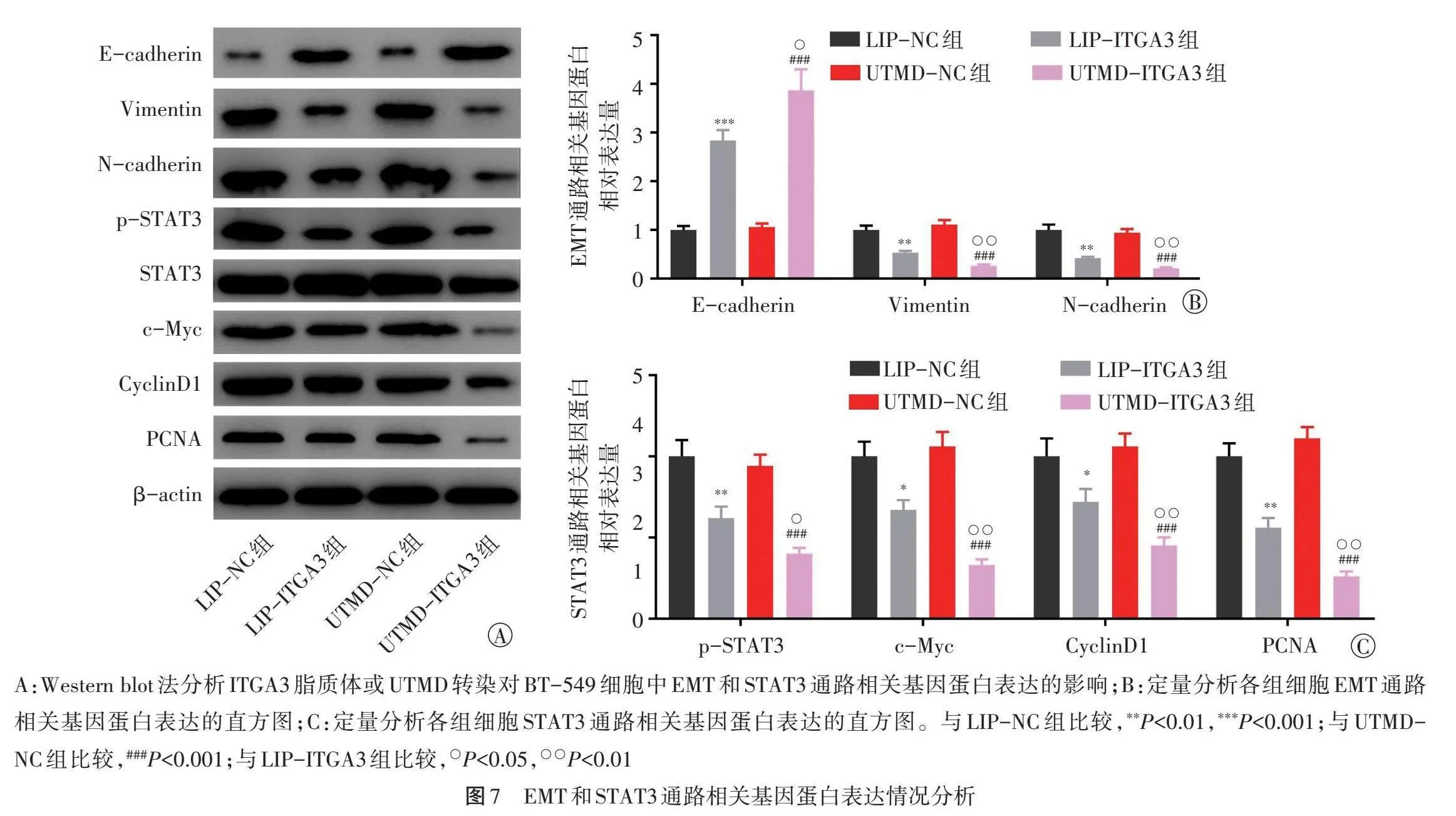
4.细胞EMT和STAT3通路相关基因蛋白表达比较:分别与各自对照组(LIP-NC组、UTMD-NC组)比较,LIP-ITGA3组、UTMD-ITGA3组细胞Vimentin、N-cadherin、p-STAT3、c-Myc、CyclinD1和PCNA蛋白相对表达量均降低,E-cadherin蛋白相对表达量增高(均Plt;0.01);与LIP-ITGA3组比较,UTMD-ITGA3组细胞Vimentin、N-cadherin、p-STAT3、c-Myc、CyclinD1和PCNA蛋白相对表达量均降低,E-cadherin蛋白相对表达量增高(均Plt;0.05)。见图7。
三、脂质体或UTMD介导的ITGA3转染对体内乳腺癌生长的影响
LIP-NC组、LIP-ITGA3组、UTMD-NC组、UTMD-ITGA3组裸鼠异种移植瘤质量分别为(1.24±0.16)g、(0.73±0.07)g、(1.16±0.14)g、(0.34±0.03)g。与各自对照组(UTMD-NC组、LIP-NC组)比较,UTMD-ITGA3组、LIP-ITGA3组裸鼠异种移植瘤质量均明显减低,差异均有统计学意义(均Plt;0.01);且UTMD-ITGA3组裸鼠异种移植瘤质量较LIP-ITGA3组减低更明显,差异有统计学意义(Plt;0.01)。免疫组化分析显示,UTMD-ITGA3裸鼠异种移植瘤组织中ITGA3蛋白相对表达量较LIP-ITGA3组增高,差异有统计学意义(Plt;0.01);UTMD-ITGA3组、LIP-ITGA3组裸鼠异种移植瘤组织中N-cadherin、PCNA蛋白相对表达量均分别较UTMD-NC组、LIP-NC组降低,差异均有统计学意义(均Plt;0.01);且UTMD-ITGA3组N-cadherin、PCNA蛋白相对表达量较LIP-ITGA3组更低(均Plt;0.01)。见图8,9。
讨 论
EMT是一种自然发生的分化过程,是胚胎发育(如原肠胚形成神经嵴)的基础,恶性肿瘤细胞通常通过自体分子变化或肿瘤微环境的刺激发生EMT,从而自原发灶脱落并侵入基底膜[13]。由于EMT与恶性肿瘤的发生、侵袭转移、复发及治疗后耐药密切相关,研究者逐渐致力于探寻抑制EMT的可行方法并了解其相关生物学特性。研究[14]发现FUT2通过靶向调控生长因子2、4的表达,同时负性调控EMT过程从而削弱结肠癌细胞的转移性和耐药性;Li等[15]研究表明下调PLAGL2的表达可以逆转恶性肿瘤细胞EMT,并抑制肿瘤干细胞的生成,从而减少小鼠的肿瘤发生。目前已有研究[16-17]证实ITGA3在乳腺癌生长中的作用,同时UTMD已被应用于乳腺癌基础研究[18]。本研究通过TCGA数据库分析了ITGA3在乳腺癌中生长机制中的表达情况,结果表明乳腺癌样本中ITGA3蛋白相对表达量明显低于正常乳腺样本(Plt;0.05);且ITGA3低表达与乳腺癌患者不良预后显著相关(HR=0.81,P=0.000 72)。提示了ITGA3在乳腺癌恶性生物学行为中的作用价值,但目前尚无应用UTMD研究ITGA3在乳腺癌中作用的相关报道。本研究首次报道了UTMD介导的ITGA3过表达质粒转染可能通过抑制STAT3通路从而对体内外乳腺癌生长和EMT过程产生抑制作用。
质粒转染是肿瘤基因研究中的有效工具,如何将质粒高效地转染到靶细胞或组织中一直是提高治疗效果的技术难点。常用的基因转染方法有病毒、脂质体介导转染等,但病毒介导的基因转染具有潜在的副作用,体内脂质体等效基因转染的效率较低[17-18],均不适用于体内基因转染。UTMD是目前最有前景的非病毒基因转染方法之一,其作用原理是利用特定频率的超声照射特定部位,使到达该部位的微泡破裂,诱发空化效应和空穴效应,扩大周围靶细胞间隙,在细胞表面产生可逆声孔,从而增加细胞膜的通透性[12];同时微泡破裂产生的冲击波和高速微射流可作为一种驱动力,驱动微泡释放的药物或基因进入靶组织,从而达到基因治疗或药物治疗的目的[11]。Liao等[19]研究发现UTMD介导的HIF-1α shRNA转染可以显著沉默HIF-1α,并成功抑制肝癌细胞生长;Zhao等[20]研究发现UTMD增强了FOXA1在乳腺癌细胞中的局部积累,对ER阳性乳腺癌显示出极好的治疗效果。微泡的磷脂涂层可与ITGA3过表达质粒通过静电吸附结合,当UTMD到达癌细胞表面时,微泡在超声引导下破裂,释放出过表达质粒,增加细胞膜的通透性,从而有利于过表达质粒进入细胞[21-22]。本实验结果显示,分别与各自对照组(UTMD-NC组、LIP-NC组)比较,UTMD-ITGA3组、LIP-ITGA3组细胞活力、迁移能力、侵袭能力均明显降低,差异均有统计学意义(均Plt;0.05);且UTMD-ITGA3组细胞活力、迁移能力、侵袭能力均较LIP-ITGA3组更低(均Plt;0.05)。提示UTMD介导的ITGA3过表达质粒转染效率显著高于脂质体,且其对乳腺癌恶性生物学行为的抑制作用明显增强。
ITGA3是调节体内多种细胞因子信号的重要调节分子,在多种生理调节过程中发挥着重要作用[5-6]。ITGA3可抑制胆囊癌异种移植瘤生长,并抑制体外胆囊癌细胞增殖和恶性转化[23]。高表达的ITGA3可诱导胰腺癌细胞凋亡和抑制细胞增殖[6]。本实验结果与上述文献相似,ITGA3在乳腺癌中表达较低,提示高表达的ITGA3不但抑制乳腺癌生长,还可抑制乳腺癌EMT,但ITGA3抑制乳腺癌恶性生物学行为的作用机制尚未十分明确。
ITGA3由STAT诱导,而ITGA3可反向抑制JAK/STAT信号通路[24]。研究[25]表明ITGA3过表达可抑制结肠癌细胞JAK-STAT3信号通路的活性,抑制细胞增殖,提高对化疗药物诱导细胞凋亡的敏感性;Miskin等[26]研究发现通过靶向ITGA3和下游FAK/PI3K/AKT信号通路,可有效抑制乳腺癌细胞迁移和侵袭能力;Wang等[27]研究也发现过表达ITGA3可显著抑制头颈部癌细胞迁移和侵袭能力。本实验结果证实ITGA3的过表达抑制了乳腺癌细胞中STAT3通路的激活,提示ITGA3可能通过STAT3通路从而参与乳腺癌细胞恶性生物学行为。分析ITGA3的作用机制可能与SH2结构域的功能有关,STAT中也存在类似的SH2结构域,ITGA3可竞争结合细胞因子受体的细胞质区域的磷酸化Tyr位点,从而阻止STAT的激活[28]。
综上所述,UTMD介导的ITGA3过表达质粒转染可有效抑制乳腺癌生长和EMT,有望为今后乳腺癌治疗提供新的策略。
参考文献
[1] Bianchini G,De Angelis C,Licata L,et al.Treatment landscape of triple-negative breast cancer-expanded options,evolving needs[J].Nat Rev Clin Oncol,2022,19(2):91-113.
[2] Bou Zerdan M,Ghorayeb T,Saliba F,et al.Triple negative breast cancer:updates on classification and treatment in 2021[J].Cancers(Basel),2022,14(5):1253.
[3] Li Y,Zhang H,Merkher Y,et al.Recent advances in therapeutic strategies for triple-negative breast cancer[J].J Hematol Oncol,2022,15(1):121.
[4] Agostinetto E,Losurdo A,Nader-Marta G,et al.Progress and pitfalls in the use of immunotherapy for patients with triplenegative breast cancer[J].Expert Opin Investig Drugs,2022,31(6):567-591.
[5] Sondermann W,Büscher R,Forster H,et al.Skin fragility,renal malformation and interstitial lung disease due to compound heterozygous ITGA3 mutations[J].J Dtsch Dermatol Ges,2021,19(6):899-901.
[6] Jiao Y,Li Y,Liu S,et al.ITGA3 serves as a diagnostic and prognostic biomarker for pancreatic cancer[J].Onco Targets Ther,2019,12(1):4141-4152.
[7] Feng C,Jin X,Han Y,et al.Expression and prognostic analyses of ITGA3,ITGA5,and ITGA6 in head and neck squamous cell carcinoma[J].Med Sci Monit,2020,26(1):e926800.
[8] Zhang J,Zhong Y,Sang Y,et al.miRNA-144-5p/ITGA3 suppressed the tumor-promoting behaviors of thyroid cancer cells by downregulating ITGA3[J].Comput Math Methods Med,2021,2021(1):9181941.
[9] Lin L,Du Y,Hao J,et al.UTMD inhibits pancreatic cancer growth and metastasis by inducing macrophage polarization and vessel normalization[J].Biomed Pharmacother,2023,160(1):114322.
[10] Zhao Y,Shi D,Guo L,et al.Ultrasound targeted microbubble destruction triggered nitric oxide release via nanoscale ultrasound contrast agent for sensitizing chemoimmunotherapy[J].Nanobiotechnology,2023,21(1):35.
[11] Wu Y,Deng C,Xu J,et al.Enhanced local delivery of microRNA-145a-5P into mouse aorta via ultrasound-targeted microbubble destruction inhibits atherosclerotic plaque formation[J].Mol Pharm,2023,20(2):1086-1095.
[12] Liu S,Zhang Y,Liu Y,et al.Ultrasound-targeted microbubble destruction remodels tumour microenvironment to improve immunotherapeutic effect[J].Br J Cancer,2023,128(5):715-725.
[13] Yang X,Xu G,Liu X,et al.Carbon nanomaterial-involved EMT and CSC in cancer[J].Rev Environ Health,2021,38(1):1-13.
[14] He L,Guo Z,Wang W,et al.FUT2 inhibits the EMT and metastasis of colorectal cancer by increasing LRP1 fucosylation[J].Cell Commun Signal,2023,21(1):63.
[15] Li Y,Liu R,Han X,et al.PLAGL2 increases adriamycin resistance and EMT in breast cancer cells by activating the Wnt pathway[J].Genes Genomics,2023,45(1):49-57.
[16] Li Y,Li F,Bai X,et al.ITGA3 is associated with immune cell infiltration and serves as a favorable prognostic biomarker for breast cancer[J]. Front Oncol,2021,11(1):658547.
[17] Zhang H,Cui X,Cao A,et al.ITGA3 interacts with VASP to regulate stemness and epithelial-mesenchymal transition of breast cancer cells[J].Gene,2020,734(1):144396.
[18] Tang X,Hao N,Zhou Y,et al.Ultrasound targeted microbubble destruction mediated ITGA3 attenuates biological characteristics and epithelial-mesenchymal transition(EMT) of breastcancer stem cells[J].Bioengineered,2022,13(2):3896-3910.
[19] Liao Y,Luo H,He Z,et al.A combination of UTMD-mediated HIF-1α shRNA transfection and TAE in the treatment of hepatic cancer[J].Biomed Res Int,2019,2019(1):1937460.
[20] Zhao R,Liang X,Zhao B,et al.Ultrasound assisted and photodynamic synergistic therapy with multifunctional FOXA1-siRNA loaded porphyrin microbubbles for enhancing therapeutic efficacy for breast cancer[J].Biomaterials,2018,173(1):58-70.
[21] Islam MK,Syed P,Dhondt B,et al.Detection of bladder cancer with aberrantly fucosylated ITGA3[J].Anal Biochem,2021,628(1):114283.
[22] Xin P,Xu X,Deng C,et al.The role of JAK/STAT signaling pathway and its inhibitors in diseases[J].Int Immunopharmacol,2020,80(1):106210.
[23] Tian L,Chen M,He Q,et al.MicroRNA-199a-5p suppresses cell proliferation,migration and invasion by targeting ITGA3 in colorectal cancer[J].Mol Med Rep,2020,22(3):2307-2317.
[24] Subramani R,Nandy SB,Pedroza DA,et al.Role of growth hormone in breast cancer[J].Endocrinology,2017,158(6):1543-1555.
[25] Liu M,Zhang Y,Yang J,et al.ZIP4 increases expression of transcription factor ZEB1 to promote integrin α3β1 signaling and inhibit expression of the gemcitabine transporter ENT1 in pancreatic cancer cells[J].Gastroenterology,2020,58(3):679-692.
[26] Miskin RP,Warren JSA,Ndoye A,et al.Integrin α3β1 promotes invasive and metastatic properties of breast cancer cells through induction of the Brn-2 transcription factor[J].Cancers(Basel),2021,13(3):480.
[27] Wang J,Sun Z,Wang J,et al.Expression and prognostic potential of PLEK2 in head and neck squamous cell carcinoma based on bioinformatics analysis[J].Cancer Med,2021,10(18):6515-6533.
[28] Alqutami F,Hachim M,Hodgman C,et al.Transcriptomic analysis identifies four novel receptors potentially linking endometrial cancer with polycystic ovary syndrome and generates a transcriptomic atlas[J].Oncotarget,2023,14(9):825-835.
(收稿日期:2023-09-02)

