肌骨超声在附着点炎评估中的应用进展
摘" " 要" " 附着点炎在健康成人及风湿免疫性疾病人群中发病率均较高,且其与部分风湿免疫性疾病患者的疾病活动度、生活质量均有一定的关系。目前已有较多共识建议关注风湿免疫性疾病患者附着点炎,并进一步强调了附着点的临床作用。肌骨超声作为目前评估外周附着点的首选影像学检查方法,为研究附着点炎开发了较多超声评分系统,但均存在一定不足。本文就附着点炎的评估方法、肌骨超声评估附着点炎的应用现状等进行综述,并对未来附着点炎超声评估研究进行了合理的展望。
关键词" " 肌骨超声;附着点炎;风湿免疫性疾病
[中图法分类号]R445.1" " " [文献标识码]A
Application progress of musculoskeletal ultrasound in the evaluation of enthesitis
ZHONG Lin,MA Rong,LI Qingyin,YANG Yujia
Department of Ultrasound,West China Hospital,Sichuan University,Chengdu 610041,China
ABSTRACT" " The incidence of enthesitis is high in healthy adults and patients with rheumatic immune diseases,and it is associated with disease activity and life quality of the patients.Currently,there are many consensus recommendations to focus on enthesitis,and further emphasize the clinical role of enthesitis.Musculoskeletal ultrasound is a preferred imaging method for evaluating of peripheral enthesis,many ultrasound scoring systems have been developed for evaluating enthesitis,but they have certain limitations.This article reviews the assessment methods of enthesitis,the application status of musculoskeletal ultrasound in the evaluation of enthesitis,and makes a reasonable prospect for future study of ultrasound evaluation.
KEY WORDS" " Musculoskeletal ultrasound;Enthesitis;Rheumatic immune diseases
附着点在人体肌骨系统中发挥着固定、稳定、力传导、力分散等功能[1],是过度使用损伤最常发生的部位,也是肌腱韧带重建手术需要重点关注的部位。附着点的概念存在较长时间的争议,部分学者认为附着点即附着部位,为肌腱、韧带、筋膜、关节囊等结构附着于骨皮质的部位,另有学者则认为附着点应当被视作一个“器官”,包括附着点本身及其相关的骨小梁、纤维软骨、滑囊、脂肪垫、深层筋膜等结构[2]。2018年风湿病预后评估组织(Outcome Measures in Rheumatology,OMERACT)明确了附着点的定义,即附着点为肌腱、韧带、筋膜、关节囊等软组织结构附着于骨皮质、距离骨皮质小于2 mm的区域[3]。人体有超过1000个附着点[4],根据解剖部位可将其分为中轴型和外周型[5]。附着点发生的炎症反应称为附着点炎。风湿免疫学领域对附着点炎和附着点病做了较为明确的界定,认为附着点病的概念更广,涵盖了附着点各种病变,包括创伤性、退行性、炎性或代谢性疾病[6]。但在超声领域则多认为附着点病、附着点炎系同一病变的不同名称。Mascarenhas和Couette[7]认为应将附着点的炎性改变与退行性改变进行区分,以便能够精确诊断和更好地进行患者管理,并提出附着点的炎性改变用“Enthesitis”描述,附着点的退行性改变则用“Enthesosis表示”。总之,附着点炎与附着点病为同一疾病还是侧重不同的疾病谱,尚待进一步的研究证实,也亟须权威国际组织制定统一的标准。本文就附着点炎的评估方法、肌骨超声评估附着点炎的应用现状等进行综述。
一、附着点炎的临床意义及流行病学
附着点炎可在健康人群经常受力的部位出现,亦可在风湿免疫性疾病患者中发生。其在银屑病关节炎(psoriatic arthritis,PsA)和脊柱关节炎(spondyloarthritis,SpA)中常见,是该病标志性病变,约35%~50%的PsA患者和40%~50%的SpA患者合并附着点炎[8-10]。研究[8]认为附着点炎在部分情况下甚至是贯通SpA全病程的唯一病理表现,是寻常型银屑病发展为PsA亚临床阶段的重要表现。此外,附着点炎在类风湿关节炎(rheumatoid arthritis,RA)中亦有较高的发病率[9]。2009年附着点炎被纳入国际脊柱关节炎评估协会分类标准;2022年我国发布的《脊柱关节炎患者附着点炎筛查与评估临床实践指南》[10]强调了附着点炎在SpA疾病管理中的重要性;PsA分类标准[11]和银屑病及银屑病关节炎研究和评估小组(Group for Research and Assessment of Psoriasis and Psoriatic Arthritis,GRAPPA)治疗建议[12]均强调附着点炎在PsA的早期预测、识别及诊断中具有重要作用。
二、附着点炎的评估方法
附着点炎的评估方法包括临床评估、影像学检查和组织学检查等。其中组织学检查是诊断附着点炎的金标准,但由于具有侵入性且并发症较多,临床应用受限。附着点炎的主要临床表现为附着部位自发性疼痛、肿胀、施加约3~4 kg/cm2压力时出现压痛及相应的活动功能受限情况。临床评估简单易行,但影响因素众多,如评估者较难控制施加压力大小、患者的痛觉感受可能受邻近关节和软组织炎症影响等,这些因素均可能导致其评估结果与实际情况存在较大偏差。欧洲抗风湿病联盟建议应用肌骨超声和MRI检查附着点。由于附着点处纤维成分较为致密,含水量较少,超声较MRI能更敏感地检出膝、踝关节附着点纤维结构的早期改变[13]。随着肌骨超声的发展和普及,除交叉韧带、盆腔及脊柱附着点等超声无法探查部位外,其在外周关节附着点炎的诊断及评估中较临床评估和MRI更敏感,逐渐成为评估外周附着点炎的首选影像学方法[14]。
三、肌骨超声评估附着点炎的应用现状
1.肌骨超声评估附着点炎的临床意义
健康成人好发运动相关性附着点炎,常累及的解剖部位包括肩袖、肱骨外上髁、髌骨下极、跟腱插入和足底筋膜,机械应力与运动相关的附着点炎有关。应用肌骨超声评估附着点炎有助于对肌骨系统疾病进行精确诊断。附着点炎超声评分与风湿免疫性疾病患者的疾病活动度、生活质量均有关,即评分越高,患者生活质量越差,更易出现临床症状,如银屑病甲损害、附着点炎邻近关节的损害等[15-17]。Smerilli等[15]对104例PsA患者的关节情况与附着点超声表现的关系进行分析,发现附着点的血流情况与关节损伤有关;研究[16]表明超声所测附着点厚度可用于鉴别PsA与银屑病。肌骨超声可以早期敏感地检测附着点亚临床病变,在评估附着点炎以预测银屑病患者疾病进展方面具有重要价值。目前已有较多研究[12,15-16]证实及早关注并对附着点炎进行超声评估有助于SpA、PsA等疾病的早期诊断及鉴别诊断、进展预测、治疗方案优化(如减少免疫抑制剂的使用以减少并发症的可能)。随着附着点的临床作用逐渐被强化,肌骨超声作为检查附着点的一线影像学方法,其评估附着点炎的意义也逐渐凸显。
2.附着点炎的肌骨超声表现及评估标准
目前临床广泛接受的附着点炎超声表现[17]主要包括:①附着点回声减低,即在避免各向异性伪像后,附着点回声减低,可见肌腱失去正常的纤维排列结构;②附着点增厚,即附着结构厚度增加,边缘模糊或清晰;③附着点钙化/骨赘,即附着点在2个垂直切面上可见点状、斑片状高回声,有或无声影(即钙化),或附着点骨皮质形成高回声突起(即骨赘);④骨侵蚀,即在2个垂直切面上附着点肌腱插入处的骨皮质不光滑,可见连续性中断;⑤滑囊炎,即滑囊增厚,体积增大,内可见呈无回声的积液和/或呈低回声的增厚滑膜组织,探头压之可变扁,有或无血流信号;⑥附着点血流(能量多普勒条件下更明显),即正常情况下附着点一般无血流信号,附着点炎时可探及血流信号,但需注意识别彩色多普勒伪像及鉴别滋养血管血流信号。
Aydin等[18]提出了骨侵蚀、附着点厚度的定量评估标准。其中骨侵蚀根据其最大径进行定量分级:1级,侵蚀最大径lt;2 mm;2级,2 mm≤侵蚀最大径lt;3 mm;3级,侵蚀最大径≥3 mm。附着点厚度为在肌腱插入处测量附着点2个切缘的厚度,并与正常成人的区间范围进行比较:1级,超出正常成人区间范围lt;1 mm;2级,1 mm≤超出正常成人区间范围lt;2 mm;3级,超出正常成人区间范围≥2 mm。其余指标如低回声/回声紊乱、滑囊炎等均采用半定量分级,1级为轻度,2级为中度,3级为重度。OMERACT于2019年发布了附着点炎血流的半定量评分标准[19]:0分,无血流信号;1分,lt;2个点状血流信号,无融合的血流信号;2分,2~4个点状血流信号或1个融合的血流信号;3分,gt;4个点状血流信号或gt;1个融合的血流信号。
3.附着点炎超声评分系统的优缺点及其研究现状
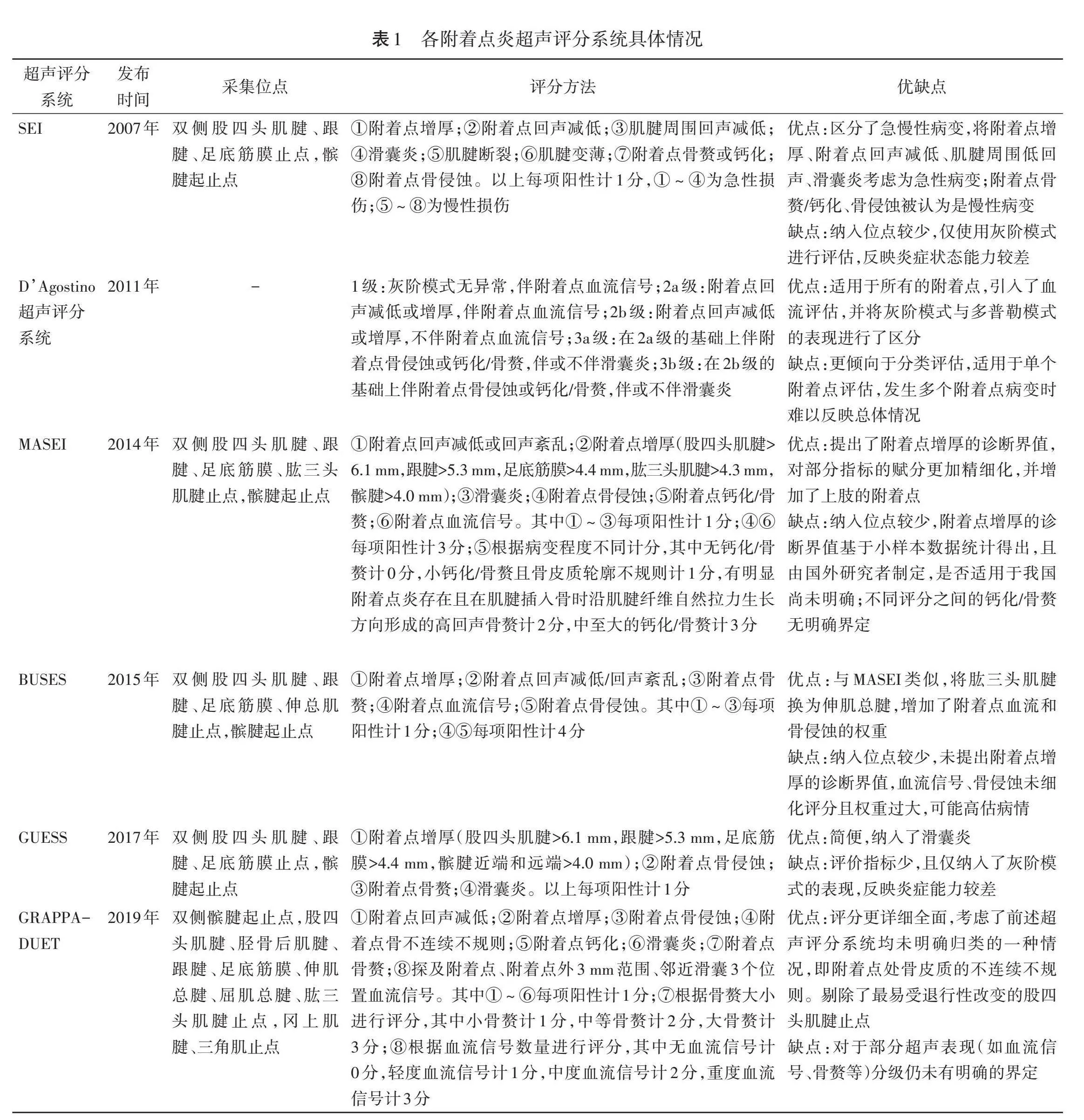
早期附着点炎超声评分系统主要基于灰阶模式进行评估,后期则增加了多普勒模式,评分也从判断有无异常表现逐渐深入到对异常表现严重程度的细化评估。目前超声检查附着点主要采用灰阶模式与多普勒模式结合,大多超声评分系统基于附着点的异常超声表现进行相应赋分和统计,已发布的附着点炎超声评分系统主要有超声附着点炎指数(Spanish enthesitis index,SEI)[20]、D’Agostino超声评分系统[21]、马德里超声附着点炎指数(Madrid sonographic enthesitis index,MASEI)[22]、贝尔格莱德超声附着点炎评分(Belgrade ultrasound enthesitis score,BUSES)[23]、格拉斯哥超声附着点炎评分系统(Glasgow ultrasound enthesitis scoring system,GUESS)[24]、附着点炎超声诊断工具(GRAPPA-DUET)[25]等。各附着点炎超声评分系统具体情况见表1。
尽管附着点炎相关超声评分系统较多,且在不断修订,但各有优劣,目前临床尚无全面普适的附着点炎超声评分系统。主要原因为:①不同型号超声仪器的成像质量及其对血流信号的敏感度有一定差异,而各超声评分系统并未规范超声仪器设置、探头频率选择、仪器调节标准等。超声是一门经验学科,有很强的操作者依赖性,而附着点易存在各向异性伪像,其处于放松与紧张位的血流显示亦存在差异,加之附着点周围常存在正常滋养血管,经验不足者难以将之与附着点炎血流相鉴别。上述因素均可能导致不同操作者间的诊断结果差异较大,而现有的超声评分系统均未制定相应的标准和规范以尽可能同质化超声图像。②由于附着点及附着点炎的定义及位置均存在争议,因此各超声评分系统具体采用哪种评判标准并未统一。现有的超声评分系统描述的附着点炎超声表现主要有附着点增厚、回声减低、钙化、骨赘、骨侵蚀、有血流信号及附着点周围滑囊炎等。近期研究[26]对OMERACT关于附着点炎的定义进行了可靠性评估,发现根据现有定义,附着点增厚和回声减低的可靠性均较低,而其他超声表现的可靠性较高。OMERACT认为附着点炎不包括滑囊炎,而Benjamin等[27]认为应把滑囊炎纳入附着点炎。滑囊炎可能独立于附着点炎发病,也可能是严重的附着点炎累及周围滑囊所致,因此未来需对与附着点炎无关和有关的滑囊炎进行大样本的观察和分类总结,明确二者是否具有差异并准确鉴别,以验证是否将滑囊炎纳入附着点炎的超声评分系统。③各超声评分系统均缺乏基于大样本的各部位附着点厚度的诊断界值。OMERACT对附着点增厚的定义为:与肌腱腱体相比,肌腱插入骨皮质2 mm内的厚度增加,但对其是否同样适用于筋膜和韧带并无明确表示,且附着点处的肌腱常较体部稍增厚,故这一判定标准仍有待进一步验证。此外,由于附着点的厚度尤其是肌腱附着点的厚度可因性别、年龄、体质量指数等不同导致差异[28],因此判定附着点增厚的具体标准目前仍未统一,易导致诊断结果出现假阳性或假阴性。研究[29]提出应用健康人群附着点厚度数据均值±2个标准差作为诊断界值,但该方法亦需要大样本的研究证实。GUESS、MASEI等超声评分系统虽然提供了部分附着点增厚的诊断界值,但亦均由小样本的数据统计得出,能否在临床推广应用有待进一步验证。尽管有多项研究[24,30]表明GUESS、MASEI诊断附着点炎的灵敏度和特异度均较高,但由于其包含其他指标(如附着点骨赘、骨侵蚀、附着点血流等),其灵敏度和特异度是这些指标综合研判的结果,故并不能证实附着点增厚诊断界值的合理性。④各超声评分系统本身结构及赋分规则存在不足。包括各超声评分系统采集位点数目不一、测量附着点厚度的位置未统一、附着点部分异常超声表现的定义不够清晰及是否纳入超声评分系统存在争议、部分异常超声表现缺乏明确的界定、附着点血流这一超声表现的缺乏或赋分权重较大,以及附着点钙化、骨赘、骨侵蚀等超声表现尚无统一且具体的定量或半定量评估标准等。研究[30]认为Genc等[31]研究显示患者MASEI与疾病活动度并未表现出较好的相关性的原因可能为其对血流信号赋分跨度太大,加上12个位点的累计,极易导致该指标过度影响结果。
此外,虽然目前研究尚未证实附着点钙化、骨赘及骨侵蚀的数量和大小与附着点炎严重程度间存在必然关系,但根据附着点炎的发病机制及既往对关节炎症评分分级标准,可以推测多发骨侵蚀、大侵蚀可能反映了更严重的疾病状态,因此对附着点钙化、骨赘及骨侵蚀进行定量或半定量评估十分必要。
四、总结与展望
肌骨超声对附着点的评估未来可能将不仅限于二维和多普勒等常规模式,综合应用超声新技术如超微血流成像、超声造影、超声弹性成像等将成为未来附着点炎的研究趋势。无论退行性改变还是风湿免疫性疾病所致的附着点炎,其超声表现均相似。附着点炎的定义、附着点增厚的诊断界值、纳入超声评分系统的具体指标确定均需大样本研究和多维度考证。由于退行性改变、不同类型的风湿性疾病易累及关节不同,评估其累及的附着点位点也应有所差异。如何解决纳入位点过多、检查时间过长与纳入位点过少、病情反映能力不足之间的矛盾是亟须解决的问题。筛选、精简出有评估意义的位点,规划基于不同疾病谱的简便、易行的评估方案是未来研究的方向和重点。因此,后续超声评分系统应当“个性化”,即根据不同的疾病开发不同的超声评分系统。
附着点血流信号与附着点炎炎症活动度有关,是附着点炎性病变区别于退行性病变的关键指标,因此对血流信号的评估在附着点炎超声评分系统中的赋分权重占比较大似乎是合理的。附着点钙化和骨赘更偏向于慢性、劳损性损伤的病理特征,并非附着点炎存在的必要特征[12],因此减小其赋分权重亦是合理的,但应赋予多少权重以更精确地反映附着点炎为风湿免疫性疾病或退行性改变所致仍尚未清楚,后续需进一步研究探索。
综上所述,肌骨超声在附着点炎的应用已受到越来越多的关注,评估附着点炎在风湿免疫性疾病中有较大的临床意义,尽管目前已开发出较多的附着点炎超声评分系统,但各有优劣,尚未达成共识,今后亟待开发更普适、更合理的超声评分系统。
参考文献
[1] Greif DN,Emerson CP,Jose J,et al.Enthesopathy——an underappreciated role in osteoarthritis?[J].Curr Sports Med Rep,2020,19(11):495-497.
[2] Benjamin M,Mcgonagle D.The enthesis organ concept and its relevance to the spondyloarthropathies[J].Adv Exp Med Biol,2009,649(1):57-70.
[3] Balint PV,Terslev L,Aegerter P,et al.Reliability of a consensus-based ultrasound definition and scoring for enthesitis in spondyloarthritis and psoriatic arthritis:an OMERACT US initiative[J].Ann Rheum Dis,2018,77(12):1730-1735.
[4] Yang KL,Lejeune A,Chang G,et al.Microbial-derived antigens and metabolites in spondyloarthritis[J].Semin Immunopathol,2021,43(2):163-172.
[5] 张奕楠,冀肖健,胡嘉文,等.强直性脊柱炎患者合并附着点炎的临床特征分析[J].解放军医学院学报,2022,43(3):264-269.
[6] Alvarez A,Tiu TK.Enthesopathies[M].Treasure Island(FL):StatPearls Publishing,2023:1-11.
[7] Mascarenhas S,Couette N.A systematic review of the inclusion of non-inflammatory ultrasonographic enthesopathy findings in enthesitis scoring indices[J].Diagnostic(Basel),2021,11(4):669.
[8] Raposo I,Torres T.Nail psoriasis as a predictor of the development of psoriaticarthritis[J].Actas Dermosifiliogr,2015,106(6):452-457.
[9] Ebstein E,Coustet B,Masson-Behar V,et al.Enthesopathy in rheumatoid arthritis and spondyloarthritis:an ultrasound study[J].Joint Bone Spine,2017,85(5):577-581.
[10] Wu X,Liu D,Li Y,et al.A clinical practice guideline for the screening and assessment of enthesitis in patients with spondyloarthritis[J].Front Immunol,2022,13(1):978504.
[11] Yamamoto T.Psoriatic arthritis:from a dermatological perspective[J].Eur J Dermatol,2011,21(5):660-666.
[12] Coates LC,Kavanaugh A,Mease PJ,et al.Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis[J].Arthritis Rheumatol,2016,68(5):1060-1071.
[13] Kaeley GS,Eder L,Aydin SZ,et al.Enthesitis:a hallmark of psoriatic arthritis[J].Semin Arthritis Rheum,2018,48(1):35-43.
[14] Bandinelli F,Denaro V,Prignano F,et al.Ultrasonographic wrist and hand abnormalities in early psoriatic arthritis patients:correlation with clinical,dermatological,serological and genetic indices[J].Clin Exp Rheumatol,2015,33(3):330-335.
[15] Smerilli G,Cipolletta E,Castaniti GMD,et al.Doppler signal and bone erosions at the enthesis are independently associated with ultrasound joint erosive damage in psoriatic arthritis[J].J Rheumatol,2023,50(1):70-75.
[16] Graceffa D,Bonifati C,Lora V,et al.Ultrasound assessment of enthesis thickness in psoriasis and psoriatic arthritis:a cross-sectional study[J].Indian J Dermatol Venereol Leprol,2019,85(2):175-181.
[17] 中国医师协会风湿免疫科医师分会影像学组.影像学技术在脊柱关节炎中应用的中国专家共识(2021年版)[J].中华风湿病学杂志,2021,25(9):577-583.
[18] Aydin SZ,Ash ZR,Tinazzi I,et al.The link between enthesitis and arthritis in psoriatic arthritis:a switch to a vascular phenotype at insertions may play a role in arthritis development[J].Ann Rheum Dis,2013,72(6):992-995.
[19] Bruyn GA,Iagnocco A,Naredo E,et al.OMERACT definitions for ultrasonographic pathologies and elementary lesions of rheumatic disorders 15 years on[J].J Rheumatol,2019,46(10):1388-1393.
[20] Alcalde M,Acebes JC,Cruz M,et al.A sonographic enthesitic index of lower limbs is a valuable tool in the assessment of ankylosing spondylitis[J].Ann Rheum Dis,2007,66(8):1015-1019.
[21] TD’Agostino MA,Said-Nahal R,Hacquard-Bouder U,et al.Assessment of peripheral enthesitis in the spondylarthropathies by ultrasonography combined with power Doppler:a cross-sectional study[J].Arthritis Rheum,2003,48(2):523-533.
[22] Eder L,Jayakar J,Thavaneswaran A,et al.Is the Madrid sonographic enthesitis index useful for differentiating psoriatic arthritis from psoriasis alone and healthy controls?[J].J Rheumatol,2014,41(3):466-472.
[23] Milutinovic S,Radunovic G,Veljkovic K,et al.Construct validity and sensitivity to change of Belgrade ultrasound enthesitis score in patients with spondyloarthritis:a pilot study[J].Rheumatol Int,2018,38(3):383-391.
[24] Okur SC,Dogan YP,Mert M,et al.Ultrasonographic evaluation of lower extremity entheseal sites in diabetic patients using Glasgow ultrasound enthesitis scoring system score[J].J Med Ultrasound,2017,25(3):150-156.
[25] Tom S,Zhong Y,Cook R,et al.Development of a preliminary ultrasonographic enthesitis score in psoriatic arthritis——GRAPPA ultrasound working group[J].J Rheumatol,2019,46(6):659.
[26] Di Matteo A,Cipolletta E,Destro Castaniti GM,et al.Reliability assessment of the definition of ultrasound enthesitis in SpA:results of a large,multicentre,international,web-based study[J].Rheumatology(Oxford),2022,61(12):4863-4874.
[27] Benjamin M,Moriggl B,Brenner E,et al.The “enthesis organ” concept:why enthesopathies may not present as focal insertional disorders[J]. Arthritis Rheum,2004,50(10):3306-3313.
[28] Almeida DE,Wakefield RJ.Assessing enthesitis using ultrasound:unfinished business[J].Rheumatology(Oxford),2022,61(12):4581-4582.
[29] Hatemi G,Fresko I,Tascilar K,et al.Increased enthesopathy among Behçet’s syndrome patients with acne and arthritis:an ultrasonography study[J].Arthritis Rheum,2008,58(5):1539-1545.
[30] Süleyman E,Nas K,Harman H,et al.Clinical and ultrasonographic enthesopathy in inflammatory rheumatic diseases:is MASEI or only calcaneal enthesitis sufficient?[J].Z Rheumatol,2018,77(8):719-726.
[31] Genc H,Cakit BD,Tuncbilek I,et al.Ultrasonographic evaluation of tendons and enthesal sites in rheumatoid arthritis:comparison with ankylosing spondylitis and healthy subjects[J].Clin Rheumatol,2005,24(3):272-277.
(收稿日期:2024-01-06)

