基于KAPPA统计量评价奶牛布鲁氏菌病不同血清学检测方法的比较研究

摘要:本研究采用虎红平板凝集试验(RBT)、乳牛全乳环状试验(MRT)、试管凝聚试验(SAT)、免疫胶体金层析法(GICA)、竞争酶联免疫吸附试验(cELISA)检测方法对327份奶牛血清和327份全乳进行奶牛布鲁氏菌病检测,以SAT为金标准,基于Kappa统计量评价不同检测方法的灵敏度、特异度、符合率、一致性等相关指标。结果显示,cELISA灵敏度、特异度、符合率、Kappa值最高,分别为100.00%、99.37%、99.39%、0.898,MRT各项指标最差,但符合率在95%以上。研究表明5种检测方法在灵敏度、特异度等方面各有优缺点,但对于奶牛布鲁氏杆菌病检测均有重要应用推广价值。因此,要结合检测需要采取多种方法综合运用,以提高检测准确性,建议采用MRT、RBT和GICA初步筛选,对疑似患病奶牛再运用cELISA、SAT确诊。研究为奶牛布鲁氏杆菌病检测方法应用和净化提供了技术参考。
关键词:布鲁氏杆菌病;血清学;检测;Kappa
布鲁氏菌病(Brucellosis)是由布鲁氏菌(Brucella)引起的一种可威胁公共卫生安全和食品安全的严重人畜共患传染病[1]。动物感染布鲁氏菌后呈现急性或慢性经过,通常表现母畜繁殖障碍和乳腺炎、公畜睾丸炎、关节炎等症状,造成严重经济损失。人感染布鲁氏菌病会引起流感样症候群及长期虚弱,严重危害人类健康和食品卫生安全,是世界动物卫生组织(WOAH)列为法定通报的疾病,被我国列为二类动物传染病[2-3]。
奶牛布鲁氏菌病是奶牛养殖生产中重点防控的疫病。加强监测对于及时全面准确了解奶牛布鲁氏菌病流行趋势,制定防控和净化方案具有重要意义。动物布鲁氏菌病实验室检测分为病原学鉴定、血清学检测和分子生物技术。病原学鉴定是检测布鲁氏菌病的金标准[4],但病原学鉴定操作较烦琐、费时,且检测环境生物安全要求较高。分子生物技术虽然灵敏度和特异性好,但试验仪器昂贵,成本高,操作复杂,检测人员专业要求,也难以在基层动物疫病防治中大面积推广。血清学检测方法快捷方便,操作比较简单,灵敏度和特异性也较高,是目前动物布病检测最常规的方法。我国《动物布鲁氏菌病诊断技术(GB/T 18646—2018)》[5]重点规定了血清学检测方法,其中包括虎红平板凝集试验(RBT)、乳牛全乳环状试验(MRT)、试管凝聚试验(SAT)、补体结合试验(CFT)、间接酶联免疫吸附试验(iELISA)、竞争酶联免疫吸附试验(cELISA)。这些方法各有优缺点和局限性,具体选择何种方法,值得探讨。本研究采用RBT、MRT、SAT、免疫胶体金层析法(GICA)、竞争酶联免疫吸附试验(cELISA)分别对奶牛布鲁氏菌病检测,并运用Kappa统计量检验5种方法一致性,以丰富奶牛布鲁氏菌病检测技术资料。
1 试验材料与检测方法
1.1 待检样本
2022年7月,选择无乳房疾病健康泌乳奶牛327头(受检奶牛均未布鲁氏菌疫苗免疫),每头牛分别采集血清327份血清和全乳327份,对应编号,牛血清样本-20 ℃保存待检,全乳室温保存以备MRT检测。
1.2 检测试剂
RBT抗原,MRT抗原,SAT抗原,GICA检测试纸,cELISA试剂盒,布鲁氏菌标准阳性血清、标准阴性血清,均为上海快灵生物科技有限公司产品。所有检测试剂在有效期内使用。
1.3 检测方法
按照《动物布鲁氏菌病诊断技术(GB/T 18646—2018)》规定进行RBT、MRT、SAT、cELISA检测和结果判定;其中,327份全乳用于MRT检测,且当日进行检测,弃用腐败、发酸全乳。GICA检测试纸检测按照试纸条说明书操作。
1.4 KAPPA统计量评价
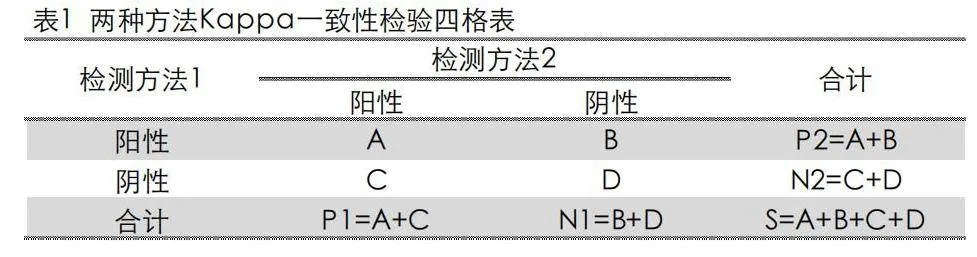
Kappa是描述和评价诊断一致性比较理想的测量指标,用来比较两个或多个观测者对同一事物,或者观测者对同一事物的两次或多次观测结果是否一致,以由于机遇机会造成的一致性和实际观测的一致性之间的差别大小作为评价基础的统计指标[6]。本研究采用SPSS 20.0统计软件计算4种检测方法的Kappa统计量进行一致性检验,评价指标和结果判断采用配对设计的四表格列表。见表1。
灵敏度为评价检测方法正确判定阳性结果一致性的指标,以sen=A/P1×100%表示;特异度为反映检测方法正确判定阴性结果一致性的指标,以spe=D/N1×100%表示;漏诊率为反映实际错判为阴性的指标,也称为假阴性率,以p-=C/P1×100%表示;误诊率反映实际错判为阳性的指标,也称为假阳性率,以p+=B/N1×100%表示;符合率反映总样本结果的一致性,以coin=(A+D)/S×100%表示。Kappa=(PA-PE)/(1-PE),式中PA=(A+D)/S,PE=[(A+B)(A+C)+(B+D)(C+D)]/S2 。Kappa值介于﹣1~+1之间,一般说来,若Kappa≥0.75为一致性良好,0.40<Kappa<0.75为一致性中等,Kappa<0.4为缺乏一致性[7]。
2 结果
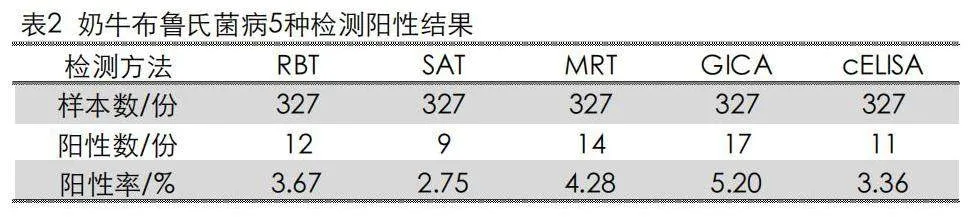
2.1 奶牛布鲁氏菌病5种检测阳性结果
MRT检测327份全乳和RBT、SAT、GICA、cELISA分别检测327份血清,阳性率介于2.75%~5.20%,SAT阳性率最低,GICA阳性率最高。见表2。
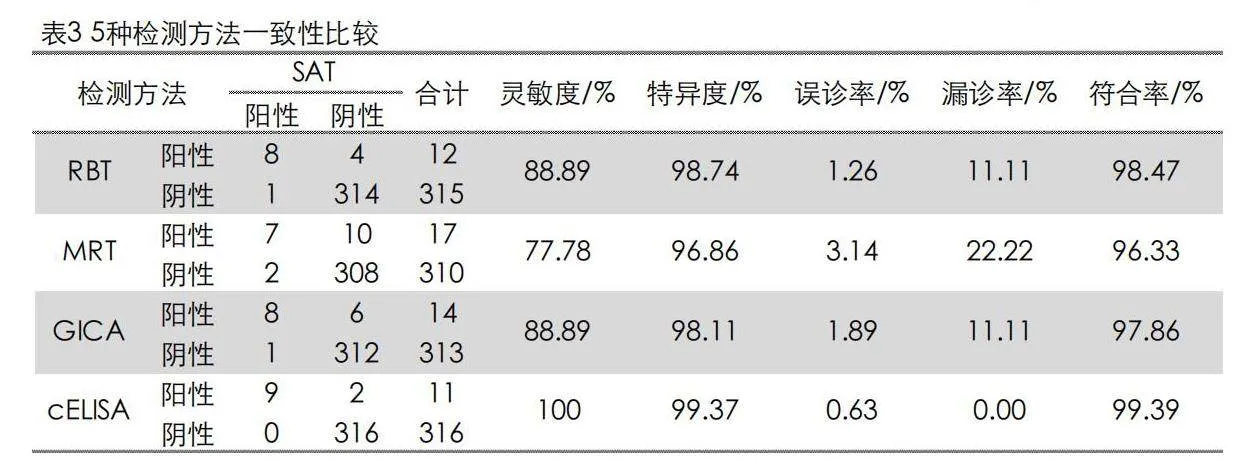
2.2 5种检测方法一致性和相关性比较
《动物布鲁氏菌病诊断技术》GB/T 18646—2018规定SAT、cELISA和CFT用于确诊,未规定布鲁氏菌病血清学检测金标准,因此,本研究中选取SAT作为金标准,利用Kappa检验RBT、MRT、GICA、cELISA检测方法与SAT一致性,同时评价它们相关性(灵敏度、特异度、误诊率、漏诊率和符合率)。见表3。SAT与RBT、MRT、GICA、cELISA的符合率分别为98.47%、96.33%、97.86%、99.39%;cELISA灵敏度最高,为100%,漏诊率最低,为0,对SAT检出的9份阳性样本,全部检出,MRT灵敏度最低,为77.78%,漏诊率最高,为22.22%,对SAT检出的9份阳性样本检出7份;cELISA特异度最高,为99.37%,误诊率最低,为0.63%,对SAT检测出318份阴性样本,检出316份;MRT特异度最低,为96.86%,误诊率最高为3.14%,对SAT检测出318份阴性样本,检出310份。
利用Kappa统计量检验其他RBT、MRT、GICA、cELISA检测方法与SAT方法的一致性,结果见表4。按照Kappa判断标准,与SAT比较,RBT、MRT、GICA、cELISA的Kappa值中,MRT、GICA的Kappa值均<0.75,分别为0.519、0.691,而RBT、cELISA的Kappa值均>0.75,以GICA最高,为0.932。
3 讨论
本研究中采用上述5种方法对327份奶牛血清和327份全乳检测,奶牛布鲁氏菌病阳性率结果均不相同,以SAT为最高,为5.20%,GICA最低,为2.75%。表明检测方法、检测者人为因素、其他偶然因素等影响了结果差异。阳性率高低不能说明检测方法灵敏度、特异度,可能存在误诊、漏诊情况,以及我国没有规定检测金标准,缺乏对比性,难以反映真实性。因此,需要对这5种方法运用Kappa检验它们的一致性、相关性。
本研究以SAT为金标准,SAT与RBT、MRT、GICA、cELISA比较,符合率、灵敏度、特异度均以cELISA最高,分别为99.39%、100%、99.37%,表明与SAT检测出的真阳性和真阴性比例最高,存在误诊和漏诊的情况最少。MRT符合率、灵敏度、特异度均最低,分别为96.33%、77.78%、96.86%。从Kappa值看,cELISA最高,为0.898,表明一致性最高,MRT、GICA最低,表明一致性最差。综上分析可以看出,cELISA各项指标最佳。需明确指出,本研究是在SAT为金标准条件下进行Kappa检验一致性,尽管一定程度反映了每种方法的各项指标高低,但研究用不同生产企业甚至不同批次的商品化试剂之间敏感性、特异性、符合率等都存在差异,存在诊断结果的多样性和不确定性[1]。
RBT通过血清样本中的布鲁氏菌抗体与虎红抗原结合,观察是否产生凝集现象,能够快速、简单地诊断动物布病,检测敏感性较高,但是凝集时间、抗原的标准化影响其敏感性,易受到非特异性抗体的干扰,假阳性较多,常被用于基层现场大量样品的布病初筛。SAT检测原理是血清IgM抗体与布鲁氏菌发生凝聚反应,不易受其他干扰因子影响,特异性较强,阳性结果比较准确,GB/T 18646—2018规定SAT可以作为确诊检测方法,但SAT需要大量试管等耗材,且24 h培养,步骤烦琐,结果判断受检测者主观因素影响,需要综合判定检测结果。MRT主要通过检测牛奶样本中的抗体来实现布病检测,仅适用于泌乳母牛,适用范围小,对某一头奶牛的全乳或者多头奶牛的混合牛奶均可以检测,采样方便,避免了血清采样造成的驱赶、保定等应激影响,但是灵敏度较低,本研究中仅为77.78%,容易产生假阳性结果。此外,对样本要求必须是没有产酸、变质或者冻融的全乳,适合大规模现场初筛。GICA是一种简易快速的免疫学检测技术,检测时间短,数分钟判断结果,操作方便,样本无需预处理,专业技术要求低,检测结果易于判定,特异性好,在基层有很强的实用性,但灵敏度较差,高度依赖于抗体的特异性。cELISA灵敏度、特异度均高,借助酶标仪判定结果,克服了肉眼随意性带来的判定结果偏差,数据再现性更高。本研究中cELISA一致性等相关指标最佳,但检测仪器昂贵、检测成本较高等限制了该方法在基层推广应用,可作为实验室检测手段。
因此,对于奶牛布鲁氏菌病要运用多种方法检测方法,结合疫病流行现状、检测技术、田间检测规模及成本等多种因素考虑,一般先用RBT、MRT、GICA进行大面积现场初筛,再运用SAT、cELISA等灵敏度和特异度高的方法确诊,有效提高检测真实性,有利于布鲁氏杆菌病净化。
参考文献:
[1] 白鸽,王国超,陈茹,等.不同血清学方法在奶山羊布鲁氏菌病诊断中的比较分析[J].动物医学进展,2022,43(12):121-124.
[2] 李前勇,张德志,曹立亭,等.重庆三峡库区肉牛结核病布鲁菌病的调查[J].中国兽医杂志,2016,52(4):3-5.
[3] 汪淼,王靖飞,张俊峰,等.黑龙江省某镇肉牛布鲁氏菌感染情况调查[J].中国动物检疫,2014,31(11):48-50+59.
[4] 孔玉方,郑家昊,王慧煜,等.布鲁氏菌病快速检测试纸条的探索[J].中国人兽共患病学报,2019,35(5):460-464.
[5] GB/T 18646-2018, 动物布鲁氏菌病诊断技术[S].
[6] 周柏林.基于Kappa统计量的督导评教与学生评教一致性分析[J].科教导刊(上旬刊),2014(17):3-5.
[7] 王伟.介绍一种评价临床检查结果一致性的新指标-Kappa 值[J].天津医药,1991(10):639-640.

