黄唇鱼致病性哈维氏弧菌的分离与鉴定
摘 要:2023年3—5月,广东省惠州市一方海(广东)海洋牧场有限公司所繁育的黄唇鱼(Bahaba taipingensis)出现发病和死亡的现象,症状主要为食欲下降,凸眼,尾鳍和背鳍出现出血,且腹腔有腹水,内脏部位附近出现充血,此外其他部位均正常,无其他明显病症。为确定其病因,采集死亡病鱼的心脏、脾脏、肝脏、头肾、中肾等组织样品,通过对分离纯化的优势菌株的形态特征、16S rRNA基因序列进行综合分析,大部分组织样品均发现哈维氏弧菌,由此初步确定此次引发黄唇鱼死亡的菌株为哈维氏弧菌。
关键词:黄唇鱼;哈维弧菌;细菌分离鉴定
中图分类号:S943 文献标志码:B 文章编号:2095–3305(2024)07–000-03
黄唇鱼(Bahaba taipingensis),又称白花鱼、金钱鮸、黄甘等,属硬骨鱼纲鲈形目石首鱼科,系近海底层暖温性鱼类,属于我国特有鱼种,其分布地主要在广东省珠江口岸。2021年,黄唇鱼被列为国家一级重点保护水生野生动物[1]。因此,开展黄唇鱼生物学和病害防控等相关研究,对恢复黄唇鱼资源、保护生物多样性及海洋生态环境具有重大意义。
弧菌是海洋环境中常见的细菌种群之一,广泛分布于海湾、近岸、河口等海域[2]。弧菌属种类繁多,主要致病弧菌有哈维氏弧菌、副溶血弧菌、溶藻弧菌、鳗弧菌、霍乱弧菌等[3]。其中,哈维氏弧菌是水产养殖中较为常见的致病菌,其引起的症状主要有肠炎病、溃烂病、出血病、疖疮病、败血病、腹水病、溃烂病等[4]。例如,2015年山东省某地混合养殖的石斑鱼中曾被报道因感染哈维氏弧菌而暴发石斑鱼皮肤溃疡病,出现厌食、眼球突出、体表出血的症状[5]。
随着海水养殖的规模不断扩大和密度的增加,水产养殖疾病频发,甚至整个水产养殖行业疾病发生规模呈逐年上涨的态势。基于此,以广东省惠州市一方海(广东)海洋牧场有限公司为例,研究2023年入夏以来其所繁育的黄唇鱼出现的发病和死亡的情况,发病黄唇鱼的尾鳍和背鳍均有出血的症状,腹腔存在腹水,这与哈维弧菌感染的出血症状极其相似。通过对其进行细菌培养,并利用现代分子学手段进行检测,以期确认具体的致病菌。
1 材料与方法
1.1 材料来源
2023年3—5月,采集发病黄唇鱼样本共20尾,解剖后发现,其鱼体尾鳍和背鳍出现出血症状、腹腔有腹水、内脏部位没有明显病症。并将一小部分鱼组织用95%无水乙醇保存备用。
1.2 实验方法
1.2.1 细菌分离与纯化
首先,将剪刀、镊子、接种环等工具进行消毒灭菌,待病鱼解剖后,使用接种环在其脑、肝、脾、肾等组织内蘸取少量组织液,并将组织液放在固体LB培养基(盐度为2%)中进行划线接种,温度保持在37 ℃,培养12 h。
其次,将培养后的菌落形态进行对比,挑选出不同形态的菌落,且挑选的菌落必须在培养基中数量较多(数量较多的为优势菌落)。然后用接种环蘸取一小部分优势菌落移入至0.9%的生理盐水中稀释10 000倍,并采取三线法进行平板划线,随后继续培养12 h。
最后,用接种环蘸取纯化培养后的细菌,并置于LB液体培养基,摇菌12 h,直至出现明显浑浊。其中一部分用于后续提取DNA,剩余部分用30%甘油进行保种,并置于80 ℃的环境中备用。
1.2.2 细菌DNA提取
用无菌剪刀和镊子分离病鱼组织样品,使用DNA提取试剂盒提取组织样品总DNA。运用聚合酶链式反应(Polymerase Chain Reaction,PCR)检测,采用细菌16S通用引物进行扩增。PCR扩增体系为25 μL,包括1 μL模板DNA,12.5 μL PCR Mix(东盛,广州),上、下游引物各1 μL,灭菌双蒸水9.5 μL。PCR反应程序为35个循环:预变性95 ℃,4 min;变性95 ℃,1 min;退火53 ℃,1 min;延伸72 ℃,1 min;72 ℃延伸7 min。随后对PCR产物进行琼脂糖凝胶电泳进行检测,将有条带的PCR产物进行测序,并将测序结果与NCBI数据库进行对比,进一步确定菌种所属。
2 结果与分析
2.1 疾病病症和病原的形态观察
测量黄唇鱼所生存的水温为29.7 ℃,盐度为3.75 ng/L,pH值为7.35。
受到感染的黄唇鱼表现症状为凸眼、尾鳍和背鳍均出现出血症状并伴有轻微的皮肤溃烂,鱼体表面有轻微褪色,鱼鳞脱落,眼球突出。其腹腔有腹水,内脏部位附近出现充血,肾脏、脾脏有明显出血,肠道内有黄色液体流出。除此之外其他部分均正常,并无其他明显病症。
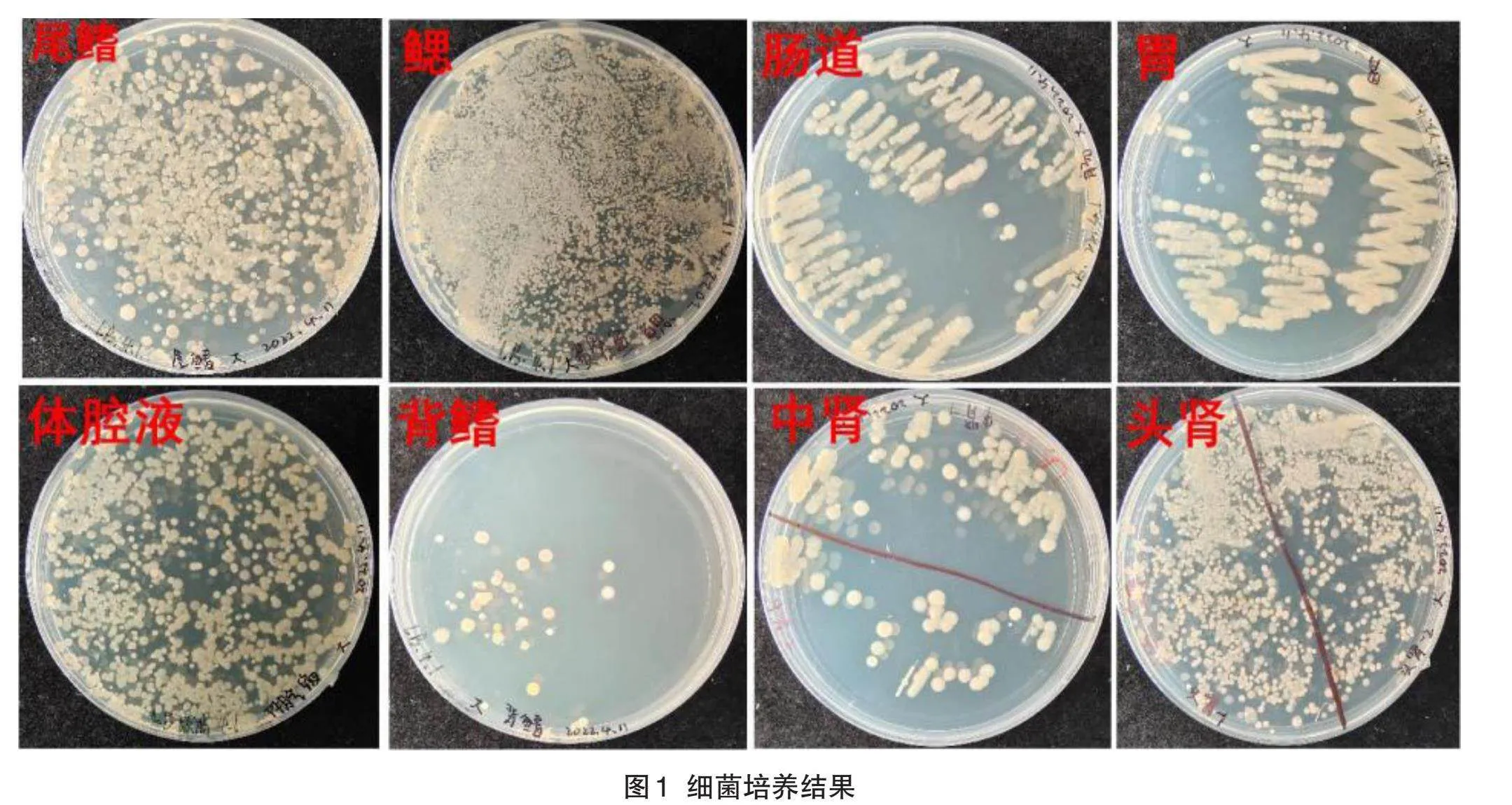
在12 h内,菌株会形成外表圆球形、边缘整齐、表面光滑且略带凸起的白色不透明菌落(图1)。
2.2 细菌的PCR鉴定
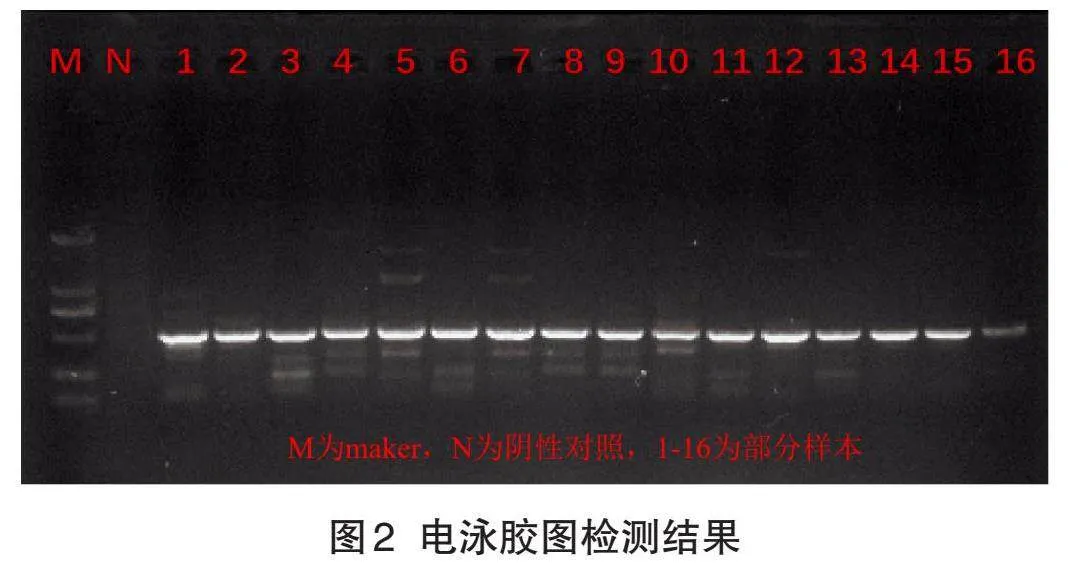
通过16S细菌通用引物对不同菌株进行PCR扩增,其条带片段大小为800 bp左右(图2)。
进行PCR测序后,在NCBI数据库上进行比对,发现ITS序列的相似度高达98%以上,由此来确定具体菌株名称。
2.3 菌株的分子学鉴定
鱼体的优势菌株为玄武岩希瓦氏菌和哈维氏弧菌,感染鳃的优势菌株为哈维氏弧菌,感染胃组织的优势菌株为阿尔法克弧菌,感染肠道组织的优势菌株为黑海弧菌、美人鱼发光弧菌、哈维氏弧菌,感染肝组织的优势菌株为哈维氏弧菌、黑海弧菌,感染脾组织的优势菌株为哈维氏弧菌、美人鱼发光杆菌、黑海弧菌,感染中肾组织的优势菌株为哈维氏弧菌、黑海弧菌,感染头肾组织的优势菌株为哈维氏弧菌。
根据结果可知,此次死亡的黄唇鱼所感染的优势菌株为哈维氏弧菌。
3 讨论
3.1 致病性弧菌
在海水养殖感染的病原菌中,弧菌属细菌占比较大,致病性弧菌被认为是海水鱼类和贝类养殖产业的“灾祸之源”,其主要感染对象为大菱鲆、虹鳟、大西洋鲑、对虾、黑石斑鱼、牙鲆等[6]。弧菌属是一类革兰氏阴性细菌,化能异养、兼性厌氧,细胞呈现短杆状、弯曲状、S形或螺旋形等多形态[7]。鉴于本次检测,可以初步断定此次引起黄唇鱼死亡的主要致病菌为哈维氏弧菌,但为了进一步确定,还需进一步做感染回归实验,再与此次发病的症状进行对照,方可确定此次致病菌的真实性。
哈维弧菌是在自然界广泛存在的弧菌科的重要成员,属于变形细菌门,变形菌纲,弧菌目,弧菌科,弧菌属。同时,该细菌在海洋中分布也广泛,属于革兰氏阴性细菌,在20世纪末才被人们所熟知[8]。
哈维氏弧菌除了具有一定的运动能力,还具有一定的嗜盐性,因此该菌在盐度较高的外海海域或在盐度较高的近岸海域分布十分广泛,其生存的最适温度为25~28 ℃[9]。感染哈维氏弧菌主要集中在夏季,其侵染性极强,致死率也偏高,如果水生动物被该病菌侵染后,会出现如坏死性肠炎、烂鳃烂尾、口腔或皮肤表面局部出血性溃疡、体色发黑、肛门红肿、眼睛浑浊和厌食等现象,一般感染1周后会出现死亡[10-11]。
在不同地区、不同宿主间,哈维氏弧菌的耐药性都存在着差异,有时差异较为明显[12]。相关Shen等[13]研究发现,哈维氏弧菌对17种抗生素表现出明显耐药性,而仅对米诺环素、多西环素和头孢曲松这三种抗生素表现出明显敏感性。鉴于不同情况下得到的哈维氏弧菌的耐药性存在较大差异,对哈维氏弧菌的分离株要进行较广的耐药特性分析,这不仅为疾病(由哈维氏弧菌引发的疾病)提供用药参考,而且可以有效地记录当地用药的种类和剂量,为以后用药方向提供有效参考[13-16]。
3.2 水生动物防治技术
随着社会的不断发展,养殖人员应该积极采用先进的防控手段,在保证水生动物存活率的同时,应注意生态环境的保护。
在水生动物防治方面,养殖人员不能一直采用化学手段。化学药物不仅危害人类健康,还会对养殖环境乃至整个生态系统造成破坏。因此,在水产养殖的病害防治方面,养殖人员应采取更加健康、绿色的手段。
疫苗防治就是一种绿色防治手段,疫苗防治是针对特定的高发病或高致死率病菌,研发相应疫苗,然后注射入宿主体内。该手段可以替代传统的高污染的化学药物,进一步减轻药物对环境的影响,更为有效地抑制弧菌属的侵染。
除了疫苗防治,噬菌体防治也是较为常见的病害防治手段。噬菌体防治针对特定的菌种研发对应噬菌体,这些噬菌体可以有效杀灭细菌,但对宿主本身不会造成危害,最重要的是该噬菌体对环境的影响微乎其微[17-19]。
4 结论
以广东省惠州市一方海(广东)海洋牧场有限公司所繁育的黄唇鱼为研究对象,从病鱼中分离得到菌株,经细菌纯化培养和16S rRNA基因序列分析,确定致病菌为哈维氏弧菌。该菌为海水养殖中常见致病菌,具有较强毒力,一般在夏季为感染高发期。而在感染初期,鱼体颜色会呈褪色状,食欲缺乏,游动缓慢;中度感染时,鱼鳍部、尾部、躯干部等发红甚至会出现出血症状;随着病症的不断发展,鱼的肾、脾、肝等内脏均出现出血或者瘀血的现象,甚至出现血性溃疡。
参考文献
[1] 李敏,叶毅飞,李永福,等.黄唇鱼迟缓爱德华氏菌分离鉴定及药敏分析[J].南方水产科学,2024,20(2):140-149.
[2] 郭少忠.野生黄唇鱼救护与池塘养殖技术[J].中国水产, 2022(5):78-81.
[3] 杨千元,李敏,胡高宇,等.哈维氏弧菌对泥蚶的毒性及半致死浓度研究[J].海洋科学,2023,47(7):130-137.
[4] 郭美玲,庞月,刘芯睿,等.青石斑幼鱼致病病原哈维氏弧菌的分离鉴定及致病性分析[J].安徽农业科学,2023,51 (12):89-93,97.
[5] 滕爽爽,张炯明,张利兵,等.泥蚶致病性哈维氏弧菌的分离与鉴定[J].水产科学,2022,41(4):547-555.
[6] 裴立硕,朱永龙,毛晴,等.点带石斑鱼致病性哈维氏弧菌的分离鉴定及药敏试验[J].天津农学院学报,2021,28(4):35 -40.
[7] 要欣平,周永灿,孙云,等.哈维氏弧菌vgrG基因的原核表达及多克隆抗体的制备[J].海南大学学报(自然科学版), 2023,41(1):30-37.
[8] 何嘉乐,叶仕根,赵小然.哈维氏弧菌生物膜生成的影响因素研究进展[J].水产养殖,2021,42(12):12-17.
[9] 陆丙乾,陆昌胜,黄建强,等.黄唇鱼的生物学初步研究[J].湖北农业科学,2021,60(14):100-103.
[10] 王殿夫,丁宁,刘洪伟,等.致病性弧菌检测新技术研究进展[J].食品安全质量检测学报,2024,15(2):160-167.
[11] 袁丹茅,金建潮.龙岩市不同来源副溶血性弧菌耐药性分析[J].疾病预防控制通报,2024,39(1):82-84.
[12] 李家侨,赵优,谢艳辉,等.肝肠胞虫和致AHPND的副溶血弧菌双重荧光PCR方法的建立及在环境DNA样品中的应用[J].中国兽医科学,2024,54(4):498-503.
[13] 仲瑶,贾惠齐,苏鹏,等.水产品中哈维氏弧菌等温快速检测方法优化及比较[J].食品安全质量检测学报,2023, 14(22):143-151.
[14] 张金金,陈浩川,陈润莉,等.2015—2020年深圳市水产品及养殖水中副溶血弧菌的毒力基因与耐药性分析[J].职业与健康,2023,39(21):3011-3014.
[15] 李辰睿,徐荣亮,张小旭,等.病原哈维氏弧菌(Vibrio harveyi)TS-628菌株基因组分析[J].渔业研究,2023,45 (5):415-426.
[16] 董晓枫,张瑞,邵寒冰,等.2018—2021年沧州市市售水产品及其制品中副溶血性弧菌分子分型及耐药监测调查分析[J].预防医学情报杂志,2023,39(9):1085-1090.
[17] 龙永艳,龙慧,樊国印,等.南昌市市售水产品中副溶血性弧菌的污染状况及耐药性和分子分型[J].中国热带医学,2023,23(9):936-940.
[18] 王筱,梁艳茹,周雨晴,等.2017年—2021年上海市浦东新区水产品中致病性弧菌监测分析[J].中国卫生检验杂志,2023,33(12):1437-1440.
[19] 孙一享,常洪军,杨行鑫,等.水产动物副溶血弧菌病及其噬菌体防治研究进展[J].微生物学通报,2023,50(8): 3620-3634.

