基于杂化轨道理论推导大π键中电子数的计算公式
摘 要:本文以人教版高中化学选择性必修2中价层电子对互斥理论和杂化轨道理论为基础,从中心原子价电子的用途出发,推导演绎出计算大π键中电子数的简单公式。利用基本概念和数学思想解决化学难点问题,培养学生证据推理与模型认知的学科核心素养。
关键词:大π键电子数;简单公式;杂化轨道理论
文章编号:1008-0546(2024)11-0074-02
中图分类号:G632.41
文献标识码:B
人教版高中化学选择性必修2第二章介绍了预测和解释分子或离子构型的“价层电子对互斥模型”和“杂化轨道理论”。[1]其核心关系为中心原子的价层电子对数=σ键电子对数+中心原子上的孤电子对数=中心原子的杂化轨道数。
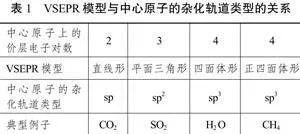
教材中列举了VSEPR模型及中心原子对应的杂化轨道数,如表1所示。
由于形成大π键的原子必须在同一平面上,且要提供未杂化的互相平行的p轨道,所以中心原子一般采用sp或sp2杂化,即价层电子对数n=2或n=3。
一、计算由“中心原子”提供的大π键电子数
根据价层电子对互斥理论,对于ABx型分子或离子,中心原子的价电子共有
以下三种用途:①用于形成σ键;②用于形成孤电子对;③剩余的用于形成π键。其中①和②之和为价层电子对数(n)。如果我们将中心原子的价电子中用于形成σ键的电子数和用于形成孤电子对的电子数减去,那么剩余的电子就存在于大π键中。中心原子提供的大π键电子数=a+x-2n。
基于教材,上述式中a为中心原子的价电子数,x为与中心原子结合的原子数,每个该原子与中心原子形成σ键时,贡献1个单电子;n是中心原子上的价层电子对数,可由杂化方式直接确定,2n为σ键电子数和孤电子数之和。
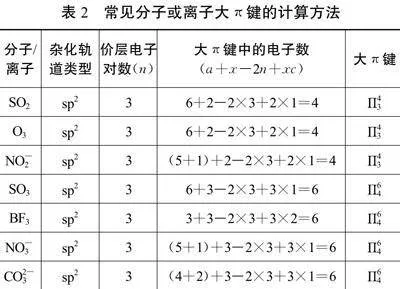
例如,SO2中心原子S采用sp2杂化,中心原子提供的大π键电子数=a+x-2n=6+2-2×3=2。
二、计算由“与中心原子结合的原子”提供的大π键电子数
同一平面内,每个与中心原子结合的原子最多只能提供一个平行的p轨道用于形成大π键,而每个轨道最多容纳2个电子,也就是说,每个与中心原子结合的原子只能提供1个或2个电子用于形成大π键,即c=1或c=2。因此,与中心原子结合的原子仍存在单电子时,c=1;与中心原子结合的原子不存在单电子时,c=2。
例如,基态O原子存在2个单电子,若其中一个与中心原子形成σ键,则还有一个单电子可参与形成大π键,c=1;而基态F原子存在1个单电子,若已经与中心原子形成σ键,则剩余均为孤电子对,c=2。
若与中心原子结合的原子种类不同,将c值分别相加即可。
三、计算大π键中的电子数
综上所述,大π键中的电子数由“中心原子”和“与中心原子结合的原子”提供,即大π键中的电子数=a+x-2n+xc。
如果是ABm+x或ABm-x型的离子,上述公式仍然适用,我们只需要修正上述公式中的a,加上阴离子的电荷数(绝对值)或减去阳离子的电荷数即可。
常见分子或离子大π键的计算方法如表2所示。
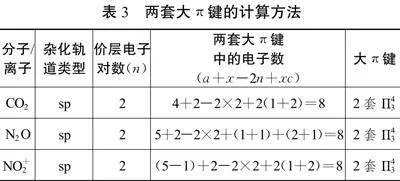
以上分子或离子均采用sp2杂化,若分子或离子采用sp杂化往往存在两套大π键,建议算出两套大π键的总电子数然后平分。
具体计算方法如表3所示。
通过计算不难发现互为等电子体的分子或离子一般具有相同的大π键类型。
四、方法应用
[2023·山东·高考真题(节选)]卤素可形成许多结构和性质特殊的化合物。回答下列问题:ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(Π53)。ClO2中Cl原子的轨道杂化方式 。
[解析]ClO2存在大π键一定采用的是sp或sp2杂化,又因题目信息表明其分子构型为V形,只能是sp2杂化。应用我们的计算公式验证该分子大π键中的电子数为7+2-2×3+2×1=5,符合题目信息Π53。
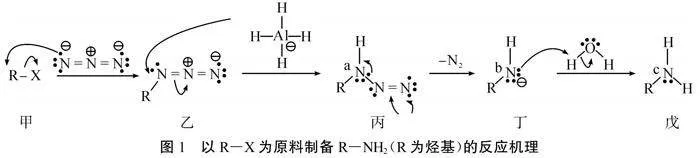
[2024·山东济宁·一模(节选)]以R-X为原料制备R-NH2(R为烃基)的反应机理如图1所示,下列说法错误的是( )。
A. 叠氮酸根N-3中存在两套π43大π键,N-3的中心氮原子采用sp杂化
B. 氮原子a、b、c杂化方式未发生变化
C. R-N3分子中∠CNN=120°
D. 若R为甲基,则戊的碱性比NH3强
[解析]A选项中N-3与CO2互为等电子体,可直接推断存在两套Π43,具体算法是两套大π键中的电子数为a+x-2n+xc=(5+1)+2-2×2+2×(1+1)=8,故A正确;C中R-N3分子中的氮原子上存在1对孤电子对,由于孤电子对对成键电子的斥力使得∠CNN≠120°,C错误。
五、结论
本文基于杂化轨道理论进行公式推导,从宏观上按用途对价电子进行分配,不深究大π键的形成过程,降低了学生理解的难度,对ABx型分子或离子适用度较好。因为公式是基于教材的基本概念推理演绎得出,对特殊物质的解释有局限性,对于有机物以及特殊物质的大π键仍需具体分析。
参考文献
[1]吴国庆,李俊.普通高中教科书 化学 选择性必修2物质结构与性质[M].北京:人民教育出版社,2023.

