二甲双胍对非酒精性脂肪性肝炎小鼠脂肪酸β氧化和炎症的影响
摘要:为探究二甲双胍对非酒精性脂肪性肝炎小鼠肝脏组织脂肪酸β氧化和炎症的影响。本试验将24只健康雄性C57BL/6N小鼠,随机分为正常组、模型组和二甲双胍组,每组8只。正常组小鼠给予维持饲料,其余2组则给予高脂饲料。第10周时模型组和二甲双胍组小鼠皮下注射CCl4(0.1 mL/kg,2次/周),持续6周。第10周时二甲双胍组以二甲双胍(250 mg/kg·d)灌胃,持续6周,第16周时安乐死各组小鼠并取样。酶联免疫吸附法检测各组小鼠血清中甘油三酯(TG)、总胆固醇(TC)以及谷草转氨酶(AST)、谷丙转氨酶(ALT)水平。实时荧光PCR方法测定PGC-1α、CPT-1α、ACOX-1、IL-6、TNF-α mRNA的表达。结果显示,与模型组相比,二甲双胍组小鼠空腹血糖、血清TG、TC、AST和ALT水平均有明显降低(P<0.05),而肝组织中PGC-1α、CPT-1α、ACOX-1 mRNA的表达显著提高(P<0.05),IL-6、TNF-α mRNA的表达显著下降(P<0.05)。结果表明,二甲双胍通过促进脂肪酸β氧化以及减轻炎症反应,能有效改善由高脂饮食和CCl4诱导的非酒精性脂肪性肝炎小鼠症状。
关键词:二甲双胍;非酒精性脂肪性肝炎;脂肪酸β氧化;炎症;小鼠
非酒精性脂肪性肝病(NAFLD)是一种被广泛关注的肝脏疾病,它与许多代谢综合征如肥胖、高血压、糖尿病和高胆固醇等有着密切的关联。非酒精性脂肪性肝炎(NASH)、肝纤维化、肝硬化甚至肝癌等恶性疾病往往是NAFLD的延续,它们的发展会给患者带来更重的生活压力和健康危机[1]。当前,非酒精性脂肪性肝炎的治疗仍然面临着巨大的挑战,尚未找到可以推荐作为特效药物的治疗方式。二甲双胍是口服胰岛素增敏药,一直以来都是治疗高血糖和2型糖尿病的常见药物。有研究报道,二甲双胍可有效降低肝脏脂质的积累[2],但其具体机制不明。为此,本试验拟通过高脂饮食联合CCl4诱导建立非酒精性脂肪肝动物模型,从肝细胞脂肪酸β氧化以及炎症相关因子角度,探讨二甲双胍对NASH的作用及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级C57BL/6N小鼠,雄性,体重20~22 g,购自浙江维通利华实验动物技术有限公司[实验动物生产许可证编号:SCXK(浙)2019-0001]饲养于苏州系统医学研究所SPF级动物实验室内[实验动物使用许可证编号:SYXK(苏)2019-0029],室温24℃,12 h光照昼夜循环,适应性喂养7 d,实验期间自由饮食饮水。试验过程中遵循动物福利相关规定,经苏州系统医学研究所动物伦理委员会批准,批号为ISM-IACUC-0073-R。
1.1.2 药物与试剂
盐酸二甲双胍、CCl4、橄榄油(阿拉丁生化科技股份有限公司);高脂饲料、维持饲料(江苏省协同医药生物工程有限公司);AST、ALT、TG、TC ELISA试剂盒(南京建成生物工程研究所);引物设计与合成(安升达生命科学技术公司);总RNA提取试剂盒、逆转录试剂盒、SYBR Green试剂(湖南艾科瑞生物工程有限公司)。
1.1.3 主要仪器
血糖仪(苏州尔达医疗设备有限公司);基因扩增仪(杭州博日科技股份有限公司);荧光定量PCR仪、紫外分光光度计、全波长酶标仪(美国Thermo Fisher公司);全自动核酸提取仪(杭州奥盛仪器有限公司)。
1.2 试验方法
1.2.1 小鼠分组及干预方法
将24只小鼠采用随机数表法分为正常组、模型组、二甲双胍组,每组8只。正常组喂食维持饲料,模型组和二甲双胍组小鼠参照文献采用高脂饮食联合CCl4诱导建立非酒精性脂肪性肝炎模型[3],喂食高脂饲料。所有小鼠均自由进食和饮水,持续16周,在第10周时模型组和二甲双胍组小鼠开始皮下注射CCl4(0.1 mL/kg,每周2次),持续6周。当小鼠血清中的TG、TC、AST和ALT含量较正常组显著升高表示NASH模型复制成功。在造模第10周开始,二甲双胍组以二甲双胍(250 mg/kg·d)灌胃,正常组和模型组灌胃等体积的灭菌水,持续6周。
1.2.2 样本收集
试验16周结束后,各组小鼠禁食不禁水12 h,采用眼眶取血测量血糖水平,剩余血液室温静置4 h后离心(4℃,3500 r/min,10 min)取上清,-80℃冻存备用。将小鼠CO2安乐处死后,打开腹腔摘取肝脏并使用PBS冲洗血迹后-80℃冻存备用。
1.2.3 实时荧光定量聚合酶链式反应检测肝脏组织中PGC-1α、CPT-1α、ACOX-1、IL-6、TNF-α mRNA表达水平
用总RNA提取试剂盒提取肝组织中总RNA,逆转录为cDNA。使用实时荧光定量PCR检测目的基因。将样本放入实时荧光定量PCR扩增仪中,设置反应条件:步骤一,95℃预变性30 s,步骤二,95℃变性5 s、60℃退火延伸30 s,共40个循环。使用PGC-1α、CPT-1α、ACOX-1、IL-6、TNF-α基因引物和GAPDH内参基因引物进行扩增。同时在60~95℃进行溶解曲线分析利用PCR仪绘出扩增曲线,进行结果分析。
1.2.4 酶联免疫吸附测定法检测小鼠血清中TG、TC、AST和ALT水平
取适量血清,按照ELISA检测试剂盒的操作指南进行操作。使用全波长酶标仪来测量每组小鼠血清样品在450 nm波长处的吸光度。根据标准孔绘制标准曲线,并通过标准曲线公式计算各组小鼠血清中的TG、TC、AST和ALT水平。
1.2.5 统计学方法
采用GraphPad Prism 8版软件进行统计分析,计量资料以“平均数±标准差”表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
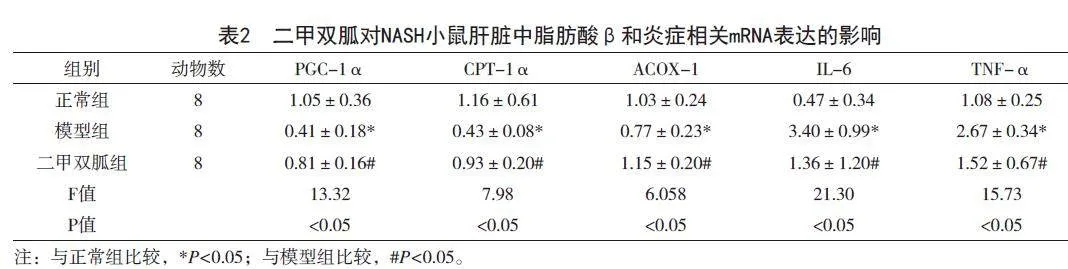
2.1 二甲双胍对NASH小鼠血糖、血脂及肝功能指标的影响
与正常组相比,模型组血糖、TG、TC、AST、ALT均显著上升(P<0.05)。与模型组相比,二甲双胍组血糖、TG、TC、AST、ALT均显著下降(P<0.05)(表1)。
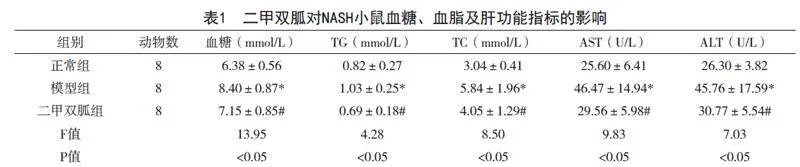
2.2 二甲双胍对NASH小鼠肝脏中脂肪酸β相关基因PGC-1α、CPT-1α、ACOX-1 mRNA表达的影响
与正常组比较,模型组小鼠PGC-1α、CPT-1α、ACOX-1 mRNA表达均显著下降(P<0.05)。与模型组比较,二甲双胍组小鼠PGC-1α、CPT-1α、ACOX-1 mRNA表达均显著上升(P<0.05)(表2)。
2.3 二甲双胍对NASH小鼠肝脏中炎症相关基因IL-6、TNF-α mRNA表达的影响
与正常组比较,模型组小鼠IL-6、TNF-α mRNA水平显著上升(P<0.05)。与模型组比较,二甲双胍组小鼠IL-6、TNF-α mRNA水平显著下降(P<0.05)(表2)。
3 讨论
非酒精性脂肪性肝炎的发病机制常被认为与“二次打击”理论有关[4]。在这一理论中,线粒体和过氧化物酶体功能异常导致脂质过度氧化和损伤,引发肝细胞死亡和星状细胞激化,最终诱发NAFLD。人体脂肪代谢是一个受多种生理因素和机制影响的复杂系统,包括脂肪生成、分解以及脂蛋白合成和分泌等关键过程。这些过程通过协同作用维持脂肪平衡,微小的变化都可能导致脂肪代谢失调,如肥胖或代谢综合征。脂联素调节通路在脂肪代谢中扮演重要角色,通过激活AMPK-ACC信号通路,增加PGC-1α表达,PGC-1α
是线粒体生物合成的关键因素,脂联素对其表达程度的影响,实际上间接影响到了线粒体的生物合成,这种效应对恢复线粒体的正常功能有着重要意义。CPT-1α是由位于线粒体外膜的完全蛋白质组成的酶,它是使脂肪酸进入线粒体的重要调控酶。该酶的主要功能是参与线粒体中脂肪酸β氧化的限速反应,并促进长链脂肪酸由酰基辅酶A转移到肉毒碱,从而促使它们从胞浆内移动到线粒体,并在线粒体的内膜上进行进一步的β氧化[5]。ACOX-1则是过氧化物酶体β氧化系统中引发第一反应的酶,并且是该反应的限速酶。ACOX-1的任务是将极长链脂肪酸降解为中链或长链脂肪酸,然后运输至线粒体进行更进一步的氧化分解[6]。本研究结果发现二甲双胍组PGC-1α、CPT-1α、ACOX-1的表达较模型组有显著升高,说明二甲双胍能够激活AMPKrzhiYHMUNW7woI9ys8RH4kABve9pGTm8ADRFyOP7lw0=-ACC信号通道,上调PCT-1α、CPT-1α、ACOX-1的生成,增强线粒体和过氧化物酶体进行的脂肪酸β氧化过程。非酒精性脂肪性肝病的主要病理特征在于肝细胞中游离脂肪酸积存量的大幅增加,超过了肝脏自身的氧化代谢能力。这种积累引发了线粒体脂肪酸β氧化的增加,从而导致活性氧化物(ROS)的大量生产。这一过量的ROS催生了强烈的氧化应激反应,该反应再进一步激发肝细胞或Kupffer细胞,导致炎症因子如IL-6、TNF-α的产生,导致肝细胞的损伤。本研究显示二甲双胍可降低炎症因子IL-6、TNF-α表达,改善炎症反应。综上所述,二甲双胍可以通过降低血糖、调节脂肪代谢、改善氧化应激和炎症反应,对NASH具有一定的治疗作用,为未来临床治疗提供了新的思路。
参考文献
[1] LEE C,KIM J,JUNG Y.Potential therapeutic application
of estrogen in gender dispari-ty of nonalcoholic fattyliver
disease/nonalcoholic steatohepatitis[J].Cells,2019,8(10):1259.
[2] 钱帅杰,谷劲岳,高锦航,等.非酒精性脂肪性肝炎治疗药物的进展[J].临床肝胆病杂志,2020,36(12):2826-2830.
[3] Norihiro K,Shoichi K,Mitsuyoshi K,et al.A high-
fat diet and multiple administration of carbon tetrachloride induces
liver injury and pathological features associated with non-alcoholic steatohepatitis in mice[J].Clin Exp Pharmacol P,2013(40):422-430.
[4] Perez M,Gonzdles L,Olarte R,et a1.Nonalcoholic fatty liver disease is associated with insulin resistance in a young Hispanic population[J].Prey Med,2011,52(2):174-177.
[5] Tan Z,Xiao L,Tang M,et al.Targeting CPT1A-mediated fatty
acid oxidation sensitizes nasopharyngeal carcinoma to radiation therapy[J].Theranostics,2018,8(9):2329-2347.
[6] Griffin EN,Ackerman SL.Lipid metabolism and axon degeneration:an ACOX1 balancing act[J].Neuron,2020,106(4):551-553.

