芒果60Co-γ、EMS诱变及SC-SSR分子标记遗传多样性分析


关键词:芒果;60Co-γ 射线辐射;EMS 诱变;SC-SSR 分子标记
中图分类号:S667.7 文献标志码:A
芒果果实成熟时,风味浓郁、果肉色泽金黄且多汁,素有“热带水果之王”之美誉。我国芒果种植面积位居世界第二位[1],根据农业农村部南亚办统计数据,2021年全国芒果种植面积约37.46 万hm2,产量395.80 万t[2]。芒果起源于印度和东南亚,目前我国芒果栽培品种如凯特、圣心、澳芒、帕拉英达、金白花主要来源于美国、澳大利亚、缅甸、泰国等国家。自20世纪60年代起,国内芒果育种专家主要通过实生和杂交育种的方式来选种,已筛选出桂香芒、红象牙、台农1号、金煌、贵妃、粤西1号、热农2号、攀西红芒、攀育2号、景东晚芒、云热-5007等新品种[3-5]。由于通过传统的人工杂交授粉方法工作量大,且结实率低,目前芒果新品种的选育仍是通过农家品种筛选和实生选种。自主知识产权的优良品种缺乏是影响我国芒果产业健康发展的主要问题之一,想要选育出能适应多个优势产区大面积推广种植的新品种还需较长时间。
诱变作为一种创造新种质、选育新品种的实用性技术,具有变异类型丰富、变异率高、育种周期短等优势[6],被广泛应用于果树育种改良,常见诱变技术包括γ 射线、中子、离子束、航天、EMS、NaN3诱变,目前成功选育出柑橘、苹果、梨、葡萄、山楂等新品种(系)[7-9]。国外1960年首次报道了芒果诱变育种研究,并且开展了相关诱变剂量筛选研究[10]。RIME 等[11]分析ArkaPuneet 芒果的EMS 诱变群体,筛选出浓度0.8%EMS 诱变芒果矮化效果最好,育成矮化突变体新材料R8P12。SAÚCO等[12]首次发现并报道了Gomera-1 芒果芽变四倍体。国内广西亚热带作物研究所用60Co-γ 射线辐射芒果种子、枝条,均未获得优良变异材料[3]。黄镜浩等[13]用秋水仙碱处理芒果茎尖,发现细胞加倍效果不明显。近年,本课题组分别用浓度0.2% EMS 和秋水仙碱处理凯特芒果胎萌种子,筛选出抗畸形病单株和同源四倍体单株。分子标记具有操作简便、效率高、重复性好等特点,已成为植物基因组DNA 研究的重要手段,其中SSR、AFLP、ISSR、SRAP、SCoT、SNP 等分子标记,已被广泛应用于芒果遗传多样性分析、指纹图谱构建、遗传图谱构建、杂交子代鉴定等研究[14-19]。采用分子标记对诱变材料进行评价,有利于筛选出适合某种植物的最佳诱变育种方法和技术,进一步提高诱变效率。SC-SSR[20]是近年基于SCoT 和ISSR 分子标记技术开发的起始密码子-微卫星扩增多态性分子标记,能将标记位点与表达序列紧密联系,同时具有较高扩增多态性,已被应用于猕猴桃[21]种质资源遗传多样性分析和指纹图谱构建。芒果SC-SSR分子标记反应体系已建立优化[22]。本研究以凯特芒果为材料,通过60Co-γ 射线辐射和EMS 溶液浸泡创制诱变群体材料,再用SC-SSR 分子标记分析诱变群体遗传变异,为芒果诱变育种实践提供理论依据,便于加快创制芒果突变体育种新材料。
1 材料与方法
1.1 材料
选用凯特芒果枝条和种子为试材,供试凯特芒果种植于四川省攀枝花市农林科学研究院芒果科技示范园。
1.2 方法
1.2.1 60Co-γ 射线辐射诱变 2021 年4 月,选取直径为1.5~2.0cm 的2年生芒果枝条10 个,在中部密集芽上1.0 cm 处短截,分别在0、3、6、9、12、15 d 调查剪口饱满芽、裂纹芽数量,确定辐射枝条短截预处理时间。同年5 月,剪取长9 cm的短截预处理辐射接穗,送至云南华源核辐射技术有限公司进行60 Co-γ 射线辐射诱变,辐射剂量设0、10、20、30、40、50、60Gy 共7 个处理,剂量率为1 Gy/min。每处理接穗40 个,重复3次。辐射处理后,所有接穗均嫁接于3 年生缅甸8 号苗砧木,60 d 后调查成活率。相对成活率=(辐射接穗成活率/对照接穗成活率)×100%。根据接穗的不同辐射剂量对应的相对成活率,拟合直线回归方程y=bx+a,确定y=50%的x 值即为半致死剂量(LD),再以半致死剂量辐射处理接穗,培育一批诱变苗。
1.2.2 EMS 溶液浸泡诱变 2021年9月,用0.067 mol/L 的磷酸缓冲液(pH 7.0)配成浓度为0.2% EMS 溶液(含1%二甲基亚砜),浸泡果实生育期120 d 的种子,浸泡时间设0、2、4、6、8 h共5 个处理,每处理种子数50个,重复3 次。每浸泡1 h 轻搅动种子1 min,浸泡后用清水浸泡清洗2~3 次,每次5 min,最后按照株行距20 cm×30 cm 在砂床进行播种育苗。播种10 d 后调查萌发率,30 d 后调查成苗率和株高,拟合处理时间与相对成苗率直线回归方程,计算EMS 溶液浸泡芒果种子半致死时间,再以半致死时间浸泡种子,培育一批诱变苗。
1.2.3 SC-SSR 分子标记检测 2022年9月,取0.1 g凯特芒果及其诱变材料[60Co-γ 射线辐射60株(F1~F60),EMS 溶液浸泡40 株(E1~E40)]的嫩叶,CTAB 法提取DNA,采用1%的琼脂糖凝胶电泳和超微量紫外分光光度计分别检测DNA纯度和浓度,样品检测合格后用于PCR 扩增,并放置于–20 ℃冰箱中保存。选SCoT、ISSR 引物各10 个(表1),用2 种引物组合对研究材料进行多态性引物筛选。PCR 反应体系(20 μL):10 μLTaq PCR Mix,2 μL 引物(1 μmol/L),50 ng DNA模板。PCR 扩增程序参考张安世等[21]的方法,仅将循环数改为32 个。PCR 产物用2%琼脂糖胶电泳分离,再用凝胶成像系统拍照,其中样品扩增条带统计按照有条带记为“1”,无条带记为“0”。
1.3 数据处理
采用Excel 2019软件进行数据处理,采用SAS 9.3 软件进行方差分析,使用单因素方差分析和Duncan’s 法比较处理间的差异显著性。整理形成标记扩增电泳条带(0 ,1) 矩阵数据, 用POPGENE 32 软件计算多态性比率(PPB)、观测等位基因(N)、有效等位基因(N)、Nei’s 遗传多样性指数(H)、Shannon 多样性指数(Hʹ)、多态性信息含量(PIC),计算参照Botstein 公式[23]。利用NTSYSpc 2.1软件计算试验材料的遗传相似系数,使用非加权组平均法(UPGMA)进行聚类分析,以遗传相似系数进行主成分分析(PCA),遗传距离=1-遗传相似系数。使用MEGA 7.0 软件绘制环形遗传聚类图。
2 结果与分析
2.1 60Co-γ 射线辐射对枝条成活率的影响
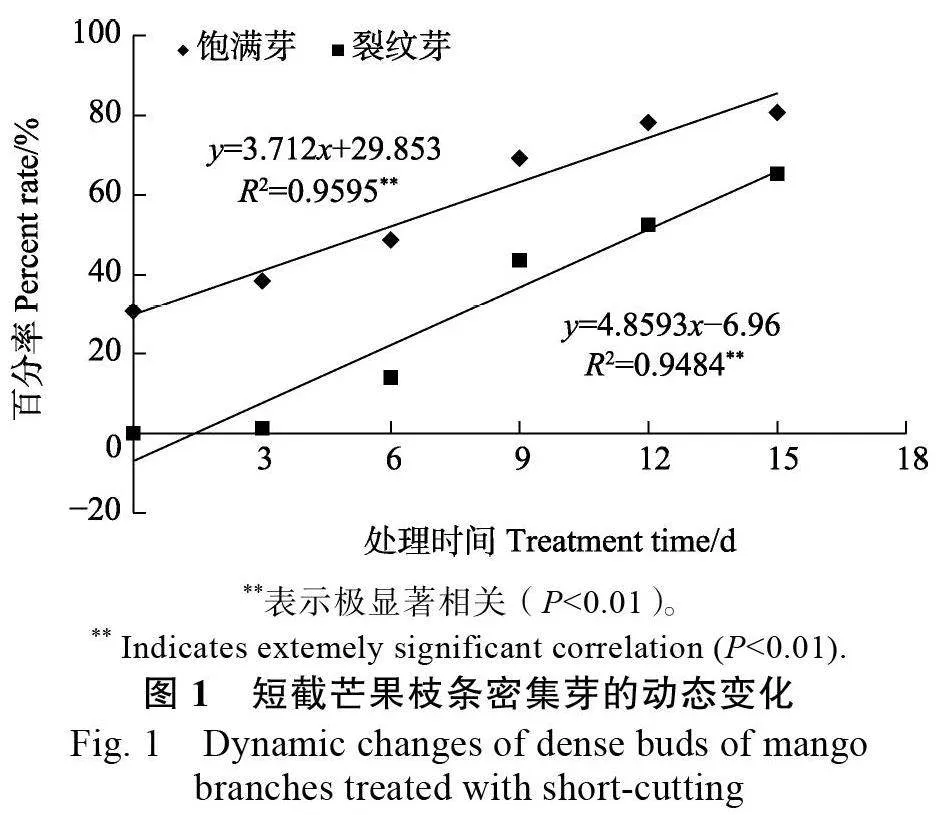
2.1.1 短截芒果枝条密集芽的动态变化 由图1可知,健壮芒果枝条经中部短截处理促进截口密集芽萌动,随处理时间增加,饱满芽、裂纹芽数量逐渐增多,饱满芽率高于裂纹芽率。处理时间与饱满芽率、裂纹芽率的直线拟合方程分别为y=3.712x+29.853 ( R2=0.9595 )、y=4.8593x–6.96(R2=0.9484)。根据拟合方程计算出辐射枝条短截预处理时间为8 d,确保采集的接穗有六成饱满芽(59.55%)和少于四成裂纹芽(31.91%)。
2.1.2 短截芒果枝条辐射半致死剂量 由表2 可知,与对照(0 Gy)相比,接穗经60Co-γ 射线辐射后嫁接成活率和相对成活率均显著降低,随辐射剂量增加成活率和相对成活率降低幅度逐步增加。辐射剂量为60Gy 时,成活率和相对成活率分别比对照降低了67.50%和88.04%。辐射剂量与相对成活率拟合直线方程y=–1.2545x+89.356(R2=0.9312)(图2),相关系数达极显著水平,根据方程计算短截芒果枝条的半致死剂量(LD)为31.37 Gy。
2.2 EMS 浸泡处理对种子萌发和成苗的影响
种子在浓度为0.2% EMS 溶液中经不同浸泡时间处理后,萌发率、成苗率、相对成苗率和株高均显著低于对照(0 h),浸泡时间越长其降低幅度越大(表3)。浸泡2、4 h 的萌发率、成苗率和相对成苗率差异不显著,但株高降低显著。浸泡8 h 后的萌发率、成苗率、相对成苗率和株高最低,分别是20.67%、17.33%、40.62%和10.20 cm,分别比对照降低了60.66%、25.34% 、59.38% 和11.77 cm。不同浸泡时间的成苗率均明显低于萌发率,随浸泡时间的增加,萌发率降低减少,降低幅度为3.34%~38.66%。浸泡时间与相对成苗率拟合直线方程y=–6.794x+90.604(R2=0.8739)(图3),相关系数达极显著水平,根据方程计算芒果种子的半致死时间(LD)为5.9 h。
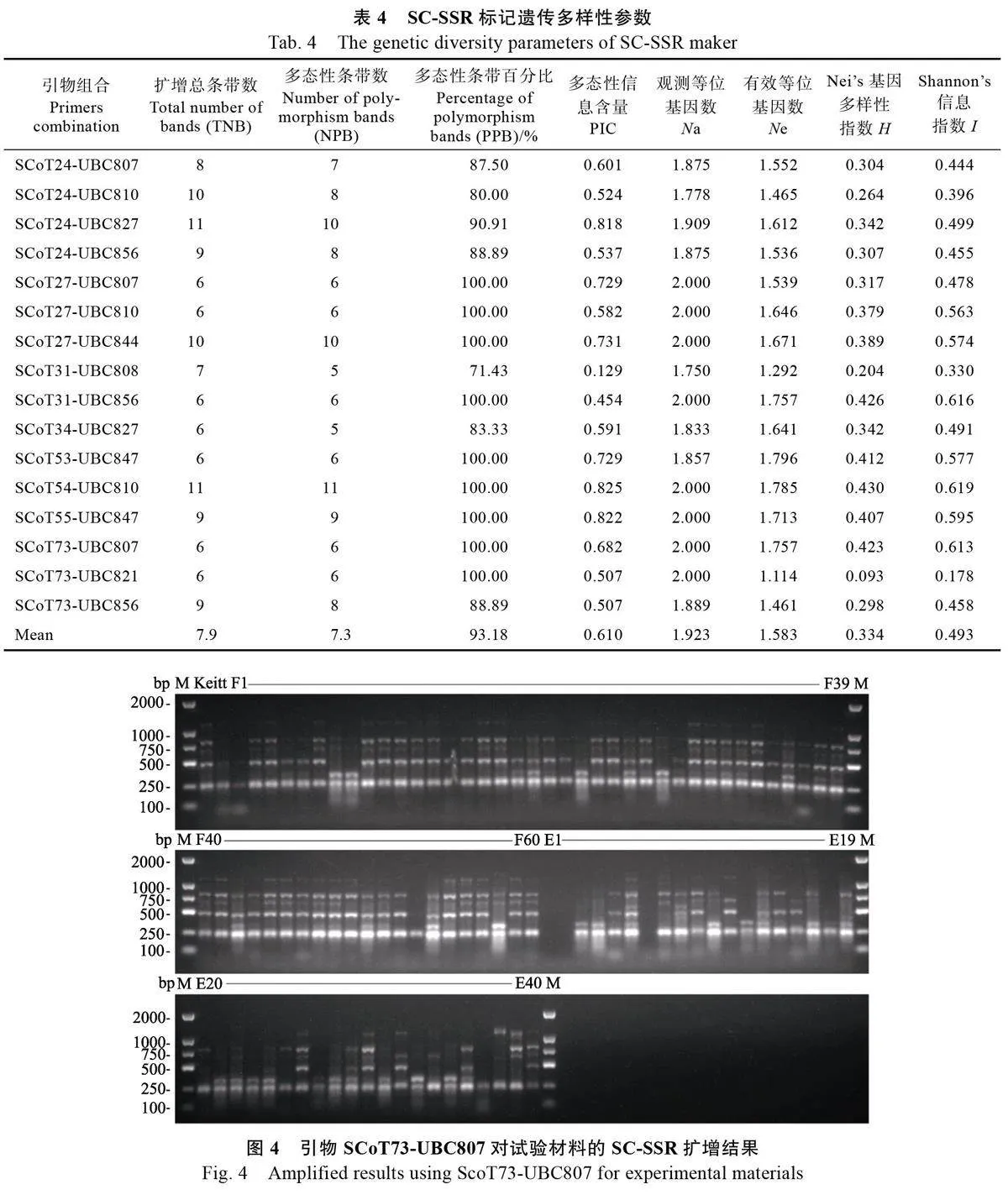
2.3 诱变材料SC-SSR 分子标记分析
2.3.1 引物筛选 选取6 份材料(凯特、F7、F8、F50、E2、E8)DNA 模板用于引物筛选,从100对引物y2YRsMhBlsGLcBGupWNUgg==中筛选出多态性引物16 对(表4),用于试验材料NAD 模板PCR 扩增分析。
2.3.2 多态性分析 基于筛选出的16 对SC-SSR 引物,对101份试验材料进行PCR 扩增,经琼脂糖电泳检测,扩增条带大小主要集中在250~1000 bp 之间,共扩增出126 条带(图4),其中多态性条带117 条,平均多态性条带为7.3 条,平均多态性条带比率为93.18%。结果表明,SC-SSR 引物扩增多态性好。
2.3.3 遗传多样性分析 由表4 可知,16 对引物扩增条带分析显示观测等位基因数范围为1.750~2.00,平均值为1.923;有效等位基因数范围为1.114~1.796,平均值为1.583;Nei’s 基因多样性指数范围为0.093~0.430 , 平均值为0.334 ;Shannon’s 信息指数范围为0.178~0.619,平均值为0.493;多态性信息含量介于0.129~0.825,平均值为0.610。说明芒果诱变试验材料遗传多样性丰富,SC-SSR 分子标记适用于芒果遗传多样性分析。
2.3.4 遗传相似系数分析 基于SC-SSR 分子标记数据,用NTSYSpc 2.1 软件计算获得的101 份试验材料两两间遗传相似系数在0.373~0.984 之间,平均为0.779。将遗传相似系数转换为遗传距离作频数分布直方图(图5),96.69%的遗传距离分布在0.05~0.51 之间,遗传距离小于0.05的有25个(0.50%),遗传距离大于0.51 有142 个(2.81%),说明少数试验材料间的差异性大。100 个诱变材料与对照凯特的遗传距离为0.040~0.556,平均为0.156,F3 遗传距离最小,E2 遗传距离最大;其中60份60Co-γ 射线辐射诱变材料与对照的遗传距离为0.040~0.254,平均为0.103;其中40份EMS浸泡诱变材料与对照的遗传距离在0.095~0.556之间,平均为0.259。结果表明,种子EMS 浸泡比枝条60Co-γ 射线辐射的变异大。
2.3.5 聚类分析 选遗传距离数据,用UPGMA方法对试验材料进行聚类分析,101 份试验材料被分为三大类群(图6)。Ⅰ类群共11 份试验材料,占总数的10.89%,Ⅰ-1 亚群包括E13、E21、E22、E23、E27、E28、E31、E33、E35,Ⅰ-2 亚群包括E3和E4;Ⅱ类群共3 份试验材料,占总数的2.97%,Ⅱ-1 亚群仅有E37,Ⅱ-2 亚群包括E2 和E7;Ⅲ 类群共87 份试验材料,占总数的86.14%,Ⅲ-1 亚群包括E18 和E36,Ⅲ-2 亚群仅有E20,Ⅲ-3 亚群包括23 份EMS诱变、60份60Co-γ射线辐射诱变和凯特。结果表明,不同种子EMS诱变试验材料多数聚类在一起, 部分与枝条60Co-γ 射线辐射诱变和凯特试验材料聚类在一起,表明诱变处理方法基因组DNA 水平变异的差异明显。
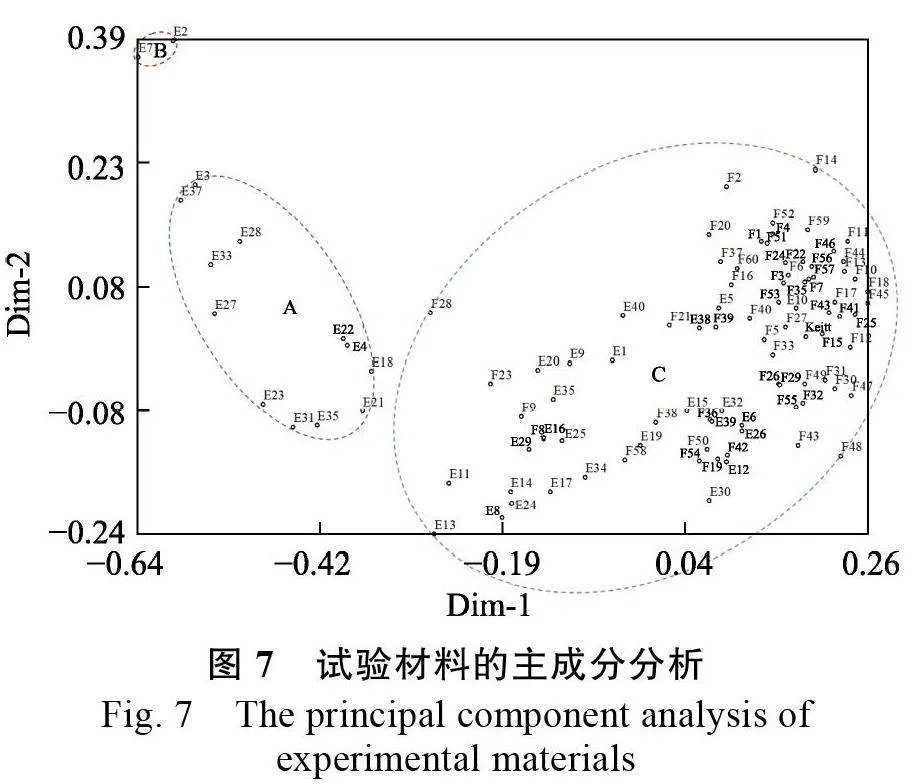
2.3.6 主成分分析 基于SC-SSR 标记获得的试验材料遗传相似系数,用NTSYSpc 2.1 软件进行主成分分析,其中前3 个主成分解释率分别为26.12%、6.75%和5.12%,以第一主成分和第二主成分作二维主成分分析图(图7)。101 份试验材料被划分为3 个类群(A、B 和C 类群),A 类群12 份,B 类群2 份,C 类群87 份。主成分分析与聚类分析结果相比较,A 类群与Ⅰ类群仅有E3、E18 和E37 划分聚类不一致,B 类群与Ⅱ类群仅有E37 划分聚类不一致,C 类群与Ⅲ类群仅有E13和E18 划分聚类不一致。
3 讨论
因我国保存的芒果种质资源主要是从美国和东南亚国家引进,遗传信息狭窄,综合性状优良种质资源数量少,人工杂交结实率低,培育突破性芒果新品种难度较大。研究认为60Co-γ、EMS等诱变是创制水稻、油菜、西瓜、柑橘、菊花等植物育种新材料的重要手段,通过诱变能快速构建植物突变体基因库,获得更多有益的新种质材料,可用于功能基因组学研究和品种选育[24-26]。在诱变过程中增加辐射剂量、EMS浓度或处理时间能提高诱变效率,同时也相应提高诱变材料的致死率[27],目前常以半致死率来确定植物诱变适宜的辐射剂量和EMS 浓度、处理时间。本研究发现, 辐射剂量增加嫁接成活率降低,EMS 处理时间增加萌发率和成苗率降低,与澳洲坚果[28]、白桦[29]、高粱[30]等研究结果相似。通过模拟直线方程计算出的枝条60Co-γ 射线辐射半致死剂量和种子0.2% EMS 溶液浸泡半致死处理时间,可为芒果相关诱变育种提供参考借鉴。
本研究对芒果诱变试验材料进行SC-SSR 分子标记分析, 16 对引物扩增条带的PPB 为93.18%。高于罗聪等[16]应用SCoT 标记分析的73份芒果资源(PPB 为73.63%)和余贤美等[31]利用ISSR 标记分析的芒果野生居群(PPB 为87.25%)。PIC 值能反应基因变异程度高低,研究材料群体的PIC 值越大,该基因座杂合子比例就越大,提供的遗传信息越高[32]。本研究所选的SC-SSR 标记获得的PIC 为0.610,高于SSR、CDDP、SRAP标记在芒果上的应用[33-35],参考BOTSEIN 等[36]提出的PIC 指标判别方法,获得14 个SC-SSR 基因座为高度多态位点(PIC>0.50),能较好地提供遗传信息。综合认为,SC-SSR 标记扩展检测多态位点效率高,在芒果遗传多样性分析、指纹图谱构建、变异材料鉴定等方面研究应用前景广。
芒果为高度杂合的多年生果树,种质资源遗传多样性丰富。报道基于SSR 荧光标记分析国内145 份芒果品种及其近缘野生种的遗传相似系数在0.50~0.78 之间[15],SSR 标记分析国内116 份芒果实生资源的遗传相似系数在0.60~1.00 之间[33],SRAP 标记分析芒果品种贵妃、金煌及其98 株杂交F1 代群体的相似系数在0.52~0.92 之间[18],相比较发现,本研究选用SC-SSR 标记分析凯特及其100 份诱变试验材料的遗传相似系数在0.37~0.98 之间,遗传多样性更丰富,认为在可利用种质资源有限的情况下诱变优于实生、杂交对芒果遗传变异的影响。进一步分析发现,芒果种子EMS 浸泡比枝条60Co-γ 射线辐射诱变变异大,与常媚瑕等[27]研究不同诱变方法对朝天椒种子诱变效应和邓仁菊等[37]诱变筛选火龙果抗寒突变体结果一致,原因可能是受2 种诱变机理差异影响所致,EMS 诱变多是碱基点突变,辐射诱变多是大片缺失或者颠换。已有研究表明不同萌发状态的草莓种子对EMS 的敏感程度不同[38],推测不同生育期芒果种子对EMS 的敏感程度同样会存在差异,还需开展相关研究提高芒果种子EMS 诱变效率。
聚类分析和主成分分析结果基本一致,101份试验材料被划分为三大类群,Ⅰ、Ⅱ类群全部为EMS 浸泡诱变试验材料,Ⅲ类群为凯特、部分EMS 浸泡和全部60Co-γ 射线辐射诱变试验材料。多数EMS 诱变试验材料聚集在一起,离凯特较远,而多数60Co-γ 射线辐射诱变聚集在一起,离凯特较近。可见不同诱变方法在同种植物上诱变差异明显,同时也可能在基因组同位点产生相近变异,需进一步研究探讨其他诱变方法在芒果上的应用,优化芒果高效诱变育种技术,加快芒果突变体基因库构建。
4 结论
60Co-γ 射线辐射短截预处理8d,凯特芒果枝条的半致死剂量为31.37 Gy。0.2%EMS 溶液浸泡处理果实生育期120d,凯特芒果种子的半致死时间为5.9 h。EMS 浸泡种子比60Co-γ 射线辐射枝条更易获得丰富的遗传变异。

