从枝菌根真菌对青山杨生长及其物质代谢的影响
摘要: 为了更为细致地解析两种丛枝菌根真菌,即根内根孢囊霉(Glomus intraradices, 简称GI)与摩西管柄囊霉(G. mosseae, 简称GM)对青山杨植株生长及其物质代谢的具体影响,选用了孢子含量为15个/g的GI和GM基质,将20 g的孢子基质与1.3 kg的灭菌土壤进行均匀混合,制备成特定的混合基质。然后将青山杨的扦插苗种植于该混合基质中,以确保其生长环境的一致性和可重复性。在植株生长的第80天时,系统地进行了青山杨生长状况的评估与叶片内N、P元素、营养物质的定量分析,测定了叶片中次生代谢产物的含量。结果表明,GI组青山杨的株高和地上生物量相较于对照组呈现出显著的降低(p<0.05),在根长和地下生物量方面,GI组则显著高于对照(p<0.05);GM组的株高、根长以及生物量方面显著高于对照(p<0.05)。在GI和GM处理的青山杨叶片中,N元素以及可溶性蛋白质的含量都明显低于对照(p<0.05);而在GM组中,叶片的可溶性糖和P元素则有着显著的增长(p<0.05)。在GI组中,次生代谢物质中的总黄酮含量显著高于对照(p<0.05),而总酚含量则明显低于对照,单宁和木质素的含量,与对照相比并无显著性差异;GM组,总酚和单宁的含量都明显低于对照(p<0.05),木质素含量显著高于对照(p<0.05),总黄酮与对照组差异不显著。GI、GM均降低了青山杨叶片中N元素和可溶性蛋白的含量;GI抑制了青山杨地上部分的生长,提高了叶片总黄酮的含量;GM对青山杨有促生作用,提高了叶片中可溶性糖和P元素含量,抑制了次生代谢物单宁、总酚的产生。
关键词: 丛枝菌根真菌; 青山杨; 生长发育; 次生代谢物质
中图分类号: S 723.1+39 文献标识码: A 文章编号:1001 - 9499(2024)05 - 0036 - 07
The Growth and Secondary Metabolites of Populus pseudo-cathayana×P.deltoides are Affected by Arbuscular Mycorrhizal Fungi. Deltoides Seedlings
Abstract In order to make a more detailed analysis of the two kinds of mycobacterium root fungi -- that is, the effect of the growth of the plant and the metabolism of the plant, and the effect of the metabolism of the plant. In this study, the spores of 15/g were selected by the GI and GM matrix, and the 20 g spore matrix was mixed with the sterilized soil of 1.3 kg, and was prepared as a specific mixing matrix. Then, the cuttings of qingshan young are planted in the mixed matrix to ensure the consistency and repeatability of the growth environment.In the 80th day of the plant growth, the evaluation of the growth status of the Qingshan Yang growth and the quantitative analysis of the nnlic and nutrient in the leaves were measured, and the content of the secondary metabolites in the leaves was determined.The results showed that the high and ground biomass of the GI group in the GI group was significantly lower than that of the control group (p<0.05), and the group of GI groups were significantly higher than the control group (p<0.05) in the root and the subsurface biomass. The gm group's high, root and biomass were significantly higher than that of the comparison (p<0.05).The contents of N element and soluble protein in Qingshanyangye tablets treated with GI and GM were significantly lower than those in control group (p<0.05). In GM group, soluble sugar and P elements in leaves increased significantly (p<0.05).In GI group, the content of total flavone in secondary metabolites was significantly higher than that in control group (p<0.05), while the content of total phenol was significantly lower than that in control group, and the content of tannin and lignin had no significant difference compared with control group. The contents of total phenol and tannin in GM group were significantly lower than those in the control group (p<0.05), the lignin content was significantly higher than that in the control group (p<0.05), and there was no significant difference in total flavonoids between GM group and the control group.GI and GM both decreased the levels of N element and soluble proteins in the leaves of young Qingshan poplar trees. While GI suppressed the growth above ground of the poplar trees, it also raised the levels of total flavonoids in the leaves. GM enhanced overall growth (biomass) of the poplar seedlings and increased the contents of soluble sugars and P element in the leaves, but inhibited the production of secondary metabolites, tannins and total phenols.
Key words arbuscular mycorrhiza fungi; Populus pseudo-cathayana×P. deltoides; growth and development; metabolite
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)与超过80%的陆地植物,尤其是农作物,建立了共生伙伴关系[ 1 ]。这种与植物紧密相关的微生物对于植物的生长有着重要的推动作用。它们不仅能增强植物对营养物质及水分的摄取能力,还能提升光合作用的效果并参与到C、N、P等元素的循环过程中来助力植物的生长[ 2 - 5 ]。此外,AMF也能显著改善植物的抗逆性。借助其产生的次级代谢产物,植物可使害虫产生过量消耗,减缓他们对食物资源的使用率,进而影响其正常生长发育[ 6 ]。当AMF与植物共同构建起相互依存的关系时,两者之间便开始了一系列复杂的信号分子交换,这些活动会影响到植物的次生代谢进程,进一步引发其次生代谢产物的变化[ 7 ]。一般来讲,AMF对植物次生代谢物含量的影响是一个错综复杂的现象,不仅涵盖了促进、抑制和无显著作用等多种情形,而且受到多种因素的调控。这些因素包括AMF的种类[ 8 ]、植物不同部位[ 9 - 10 ]、生长环境的差异[ 11 ]、接种真菌的时机[ 12 - 13 ]以及养分的供给[ 14 ]等。这些因素之间可能存在相互关联和协同作用,共同影响植物次生代谢产物的累积。目前的研究表明,多数高等植物需依靠与AMF共生来提高对环境的适应能力。
杨树不仅在生态和经济方面具有显著的价值,而且能够与AMF建立共生关系[ 15 ]。随着毛果杨(Populus trichocarpa)基因组序列的公布[ 16 ],这一树种已被视为木本植物研究的典范[ 17 ]。随着对丛枝菌根真菌的深入研究及其在林业中的广泛应用,通过接种这种真菌来调节植物的生长和代谢过程,为增强林木的抗虫能力提供了新的方法[ 18 ]。在本研究中,选用了青山杨(Populus pseudo-cathayana×P. deltoides)作为实验对象,并进行了根内孢囊霉(Glomus intraradices,GI)和摩西管柄囊霉(G. mosseae,GM)的接种实验。在侵染高峰期测定了青山杨叶片的氮磷含量、营养物质组成以及次生代谢物水平,旨在深入探究丛枝菌根真菌(AMF)对青山杨生理过程和化学防御机制的具体影响。
1 材料与方法
1. 1 实验材料
供试菌株:实验菌株分别是根内根孢囊霉(GI)和摩西管柄囊霉(GM)。均为甘肃省农业科学院提供,并在宿主植物玉米和三叶草上进行了繁殖培养。制备的菌剂中包含了孢子、菌丝、根段以及沙子,其中孢子的浓度达到了每克菌剂中含有15个孢子的水平。
供试植物:1年生青山杨扦插苗。
供试土壤:由草炭土、蛭石和沙子按照1∶1∶1的体积比例混合而成。在使用前,混合土壤经过了121 ℃下的高压灭菌处理,持续时间为2 h,以确保土壤中不含有其他微生物的干扰。
1. 2 杨树苗的培养及接菌处理
在进行实验前,为确保花盆的无菌环境,使用0.3%的KMnO4溶液将花盆浸泡2 h进行消毒处理。消毒完成后,将花盆晾干,并在每个花盆中装入1.3 kg经过高压灭菌处理的土壤。随后,花盆被转移到东北林业大学育种苗圃内的温室进行实验。实验设计包括一个对照组(CK)和两个处理组,这两个处理组分别接种了两种不同的丛枝菌根菌:GI和GM。在接入前,每1.3 kg土壤均匀混入20 g菌剂,确保菌剂与土壤充分混合。对照组(CK)则混入等量的无菌土壤。每盆栽种1株1年生的青山杨扦插苗,每组300盆,共计900盆,定期浇水除草。
1. 3 指标测定
1. 3. 1 侵染率指标的测定
在移植后的60、80、100 d,按照随机原则从每个处理组中分别选取5株样树,剪下根部须根,并进行彻底的清洗,以去除附着的土壤和其他杂质。将清洗干净的须根切割成1~2 cm长的小段,确保每个样树至少有50小段的根样用于观察。采用Phillips等[ 19 ]所描述的方法测定菌根的侵染率。当菌根的侵染率达到峰值时,进一步进行样本采集,以测定叶片中营养元素的含量、营养物质的水平以及次生代谢产物的积累量。
1. 3. 2 生长量指标的测定
在栽种第80 d时,从每个处理组中随机挑选9株青山杨进行整株采样研究。对这些样本进行了彻底的清理,以确保测量结果的准确性。对每株苗木进行详细划分,分为地上和地下两个部分,系统测量每株苗木的株高、根长以及地上和地下部分的鲜重和干重。在测量干重时,将地上和地下部分分别放入信封中,再放入烘箱进行烘干处理,105 ℃下进行5 min快速杀青,以去除残余水分并固定样本。随后将温度降至80 ℃进行长时间的干燥处理,直至达到恒重。
1. 3. 3 营养物质和N、P元素的测定
在每个处理组中随机选取9株样树,将其划分为3个重复组,每组3株样树,进行重复测量,下同。使用考马斯亮蓝法[ 20 ]检测青山杨叶片中的可溶性蛋白质含量;用蒽酮比色法[ 21 ]测定其可溶性糖的含量;通过奈氏比色法[ 22 ]对叶片全氮素含量和利用钼锑抗比色法[ 23 ]计算磷元素含量。
1. 3. 4 次生代谢物质含量的测定
使用苏州格锐思生物科技有限公司的试剂盒,对青山杨叶片中的总酚、单宁、总黄酮和木质素进行检测。计算公式如下:
总酚含量(mg/g 鲜重)=0.146 4×(ΔA+0.0025)×V÷W×D
单宁含量(mg/g 鲜重)=0.953×(ΔA-0.005 4)÷W×D
总黄酮含量(mg/g 鲜重)=0.4×(ΔA+0.000 1)÷W×V×D
木质素含量(mg/g 干重)=0.04×(ΔA+0.010 3)÷W×D
式中,V—提取液体积;W—样品质量;D—稀释倍数。
1. 4 数据处理与分析
在Excel 2016中,计算青山杨的株高、地径、根长、地面上下部分的干鲜量、叶片中的可溶性糖分和蛋白质含量、氮元素和磷元素的含量、总酚含量、单宁含量、木质素含量以及总黄酮含量的平均值和标准误差。然后利用SPSS 19.0软件中的单因素方差分析(one-way ANOVA)方法,对所得数据进行差异显著性检验。在0.05的显著性水平下,进一步采用最小显著差异法(LSD)进行多重比较,以判断不同小组之间的数据是否存在统计学上的显著差异。
2 结果与分析
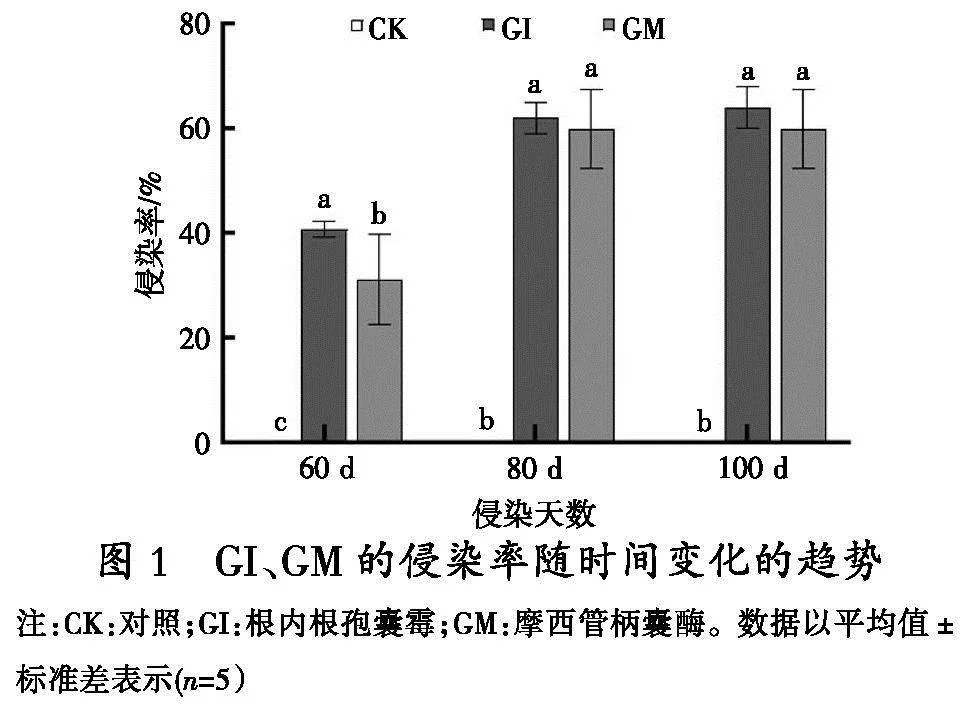
2.1 GI、GM的侵染率变化趋势
在青山杨扦插苗种植60、80、100 d后,其根部侵染率持续上升(图1),并在第80 d达到最高点。在第60 d时,GI显示出40.95%的感染率,而GM的感染率为32.5%,这两者之间差异显著(p<0.05)。80 d时,GI的侵染率上升至62.1%,而GM则达到了60.8%。100 d时,侵染率呈现出稳定的状态,GI值为64.35%,而GM值则为60.45%。CK组中并未观察到任何的侵染现象。
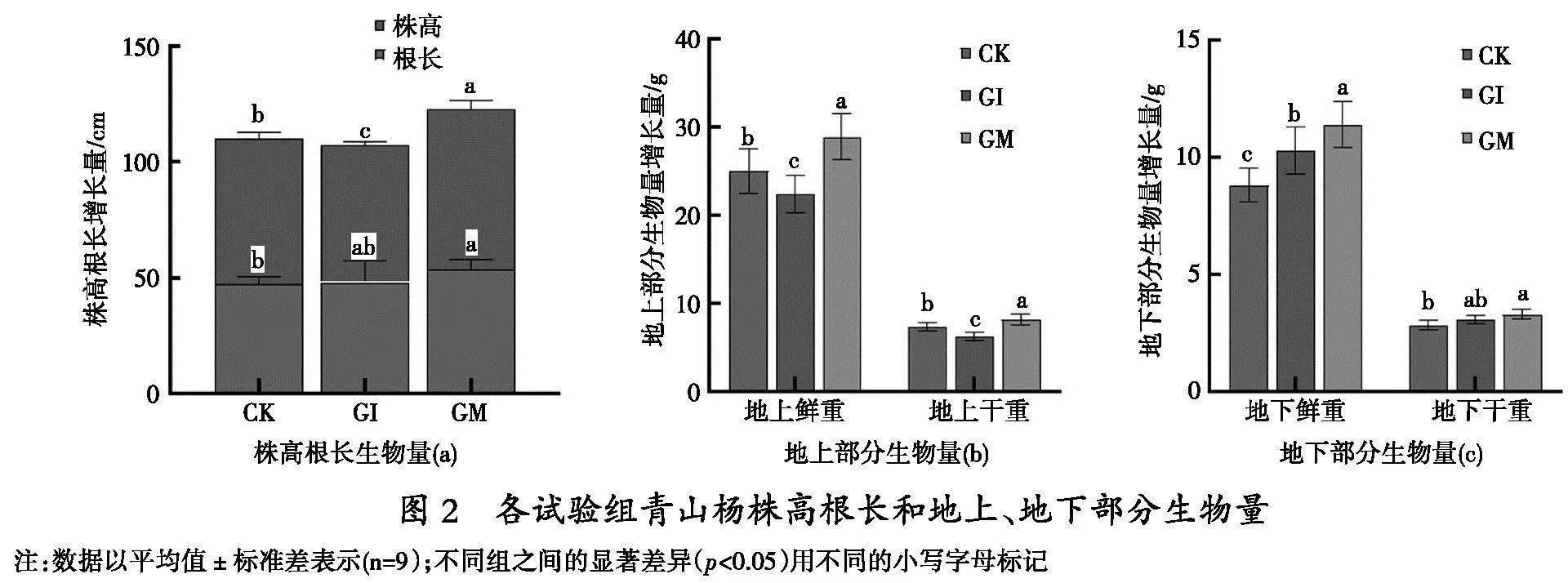
2. 2 GI、GM定殖对青山杨生长发育的影响
对青山杨分别接种GI、GM 80 d之后相比于CK组和GM组,GI组的植株高度明显较低(p<0.05),而其根部长度则无显著区别;GM组的株高和根长都明显超过CK和GI组(p<0.05)(图2a)。在植物地上部分的鲜重和干重方面,GI组的数值低于CK和GM组(p<0.05),而GM组的数值则显著高于CK(p<0.05)(图2b)。至于地下部分的重量,无论是鲜重还是干重,GI组和GM组的数值都明显高于CK(p<0.05),并且GM组的数值还显著高于GI(p<0.05)(图2c)。
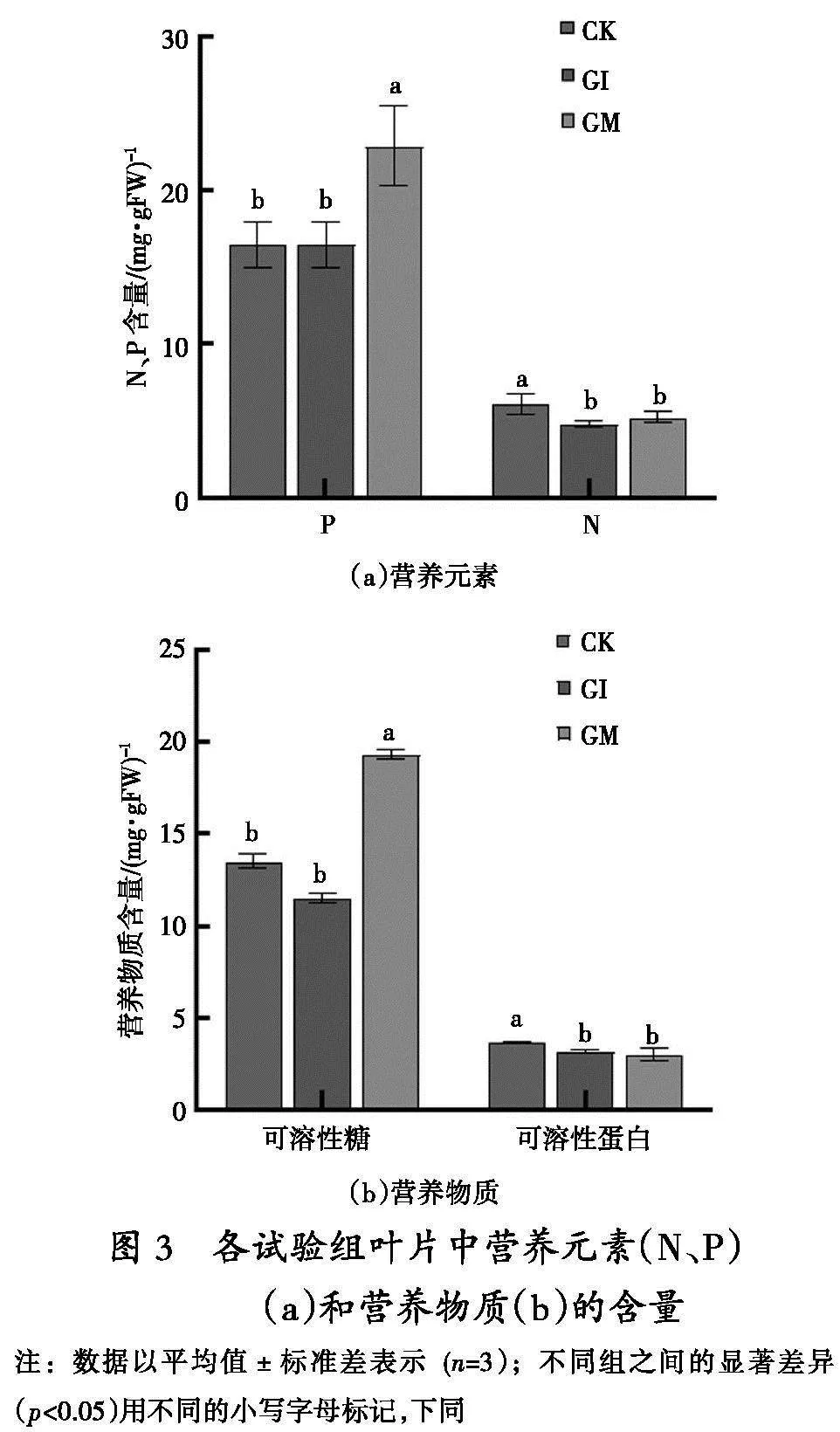
2. 3 GI、GM定殖青山杨叶片中N、P及营养物质的含量
在接种GI和GM 80 d后(图3),青山杨叶片中N元素的含量,无论是GI处理组还是GM处理组,都明显低于对照(p<0.05),然而这两组之间在氮含量上并没有显著区别。P元素的含量,GI处理组与对照组无明显差异,但是GM处理组的P含量显著高于CK和GI组(p<0.05)(图3a)。可溶性糖的含量,GI组显著低于CK组(p<0.05),而GM组却呈现出了比CK和GI组提升的趋势(p<0.05)。可溶性蛋白的含量,无论是GI组还是GM组均显著低于CK组(p<0.05),并且二者之间并无显著区别(图3b)。
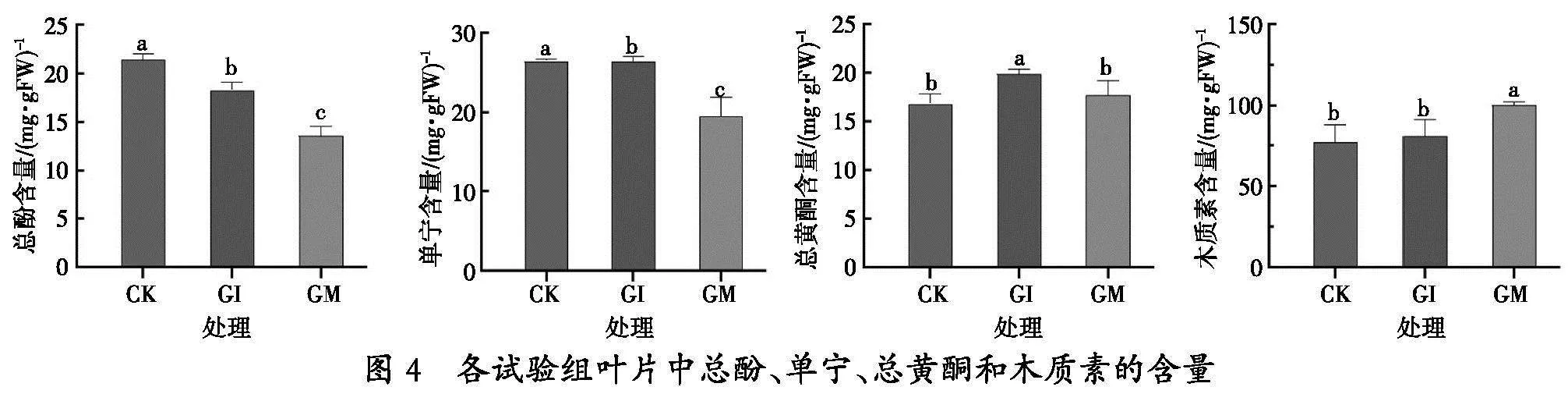
2. 4 GI、GM定殖青山杨叶片中次生代谢产物的含量
在接种GI和GM后的80 d,由图4可见,青山杨叶片总酚的含量在GI组显著低于CK组(p<0.05),而GM组的总酚含量则进一步降低,比GI组还要低(p<0.05)。单宁含量在GI组与CK组之间没有显著差异,然而,GM组的单宁含量则明显低于CK组和GI组(p<0.05)。总黄酮含量在GI组中显著高于CK组和GM组(p<0.05),但GM组与CK组差异并不显著。木质素含量在GI组与CK组之间也没有显著差异,但GM组的木质素含量则显著高于CK组和GI组(p<0.05)。
3 结论与讨论
植物的株高与干鲜质量是反映植物生长情况的直观指标。研究表明,接种 AMF 可以提高紫花苜蓿(Medicago sativa)[ 24 ]、福鼎大白茶(Camellia sinensis)植株生物量[ 25 ]。 在本研究中,GM的接种对青山杨的株高、根长和生物量都有显著的促进效果,然而,GI的接种却大幅减少了青山杨的株高以及地上部分的鲜重和干重,同时增加了地下部分的鲜重和干重。
关于AMF如何影响宿生植物的研究表明,AMF可以提高植株的生长速度。这主要归因于AMF能够提升植物的光合作用效率,增加对氮(N)、磷(P)、钾(K)等关键营养元素的摄取量[ 26 - 27 ]。通过与根部的结合,AMF构建了一个庞大的根系系统,从而扩展了植物对于这些养分的获取途径。此外,AMF还会释放出有机酸等化学物质来优化土质环境,使那些不易被土壤吸收的微量元素得以溶解,进而刺激菌丝体对这些元素的吸附和转换,为宿主生长提供所需的营养[ 28 ]。尽管有研究表明GI可以有效地从土壤中吸收无机N,但它只将部分N传递给宿主植物[ 29 ]。Wu[ 30 ]等人发现AMF抑制了杨树对NO3-的关键吸收基因,这表明AMF途径直接影响根系对NO3-的吸收。Wurst[ 31 ]等人观察到,GI增加了车前草叶片中的磷含量,但却降低了其总氮含量,这与本研究的结果相符。本研究发现,GI和GM组的氮含量都低于对照组,这可能是因为AMF在与植物进行养分交换的过程中截留了大量的氮,导致宿主植物体内的氮减少。这种氮的减少会抑制植物体内可溶性蛋白的合成[ 32 ]。通常AMF的定殖会消耗宿主植物中的大量碳水化合物,对植物产生一定的负面影响[ 33 ]。然而本研究发现,由于AMF消耗宿主植物糖类的水平不同[ 34 ],GI对青山杨叶片可溶性糖含量没有显著影响,GM提高了青山杨叶片可溶性糖含量,而且还积极促进了青山杨幼苗的生长。这表明在高侵染率的环境中,GM依然能够与青山杨建立并维持一种有益的共生关系。
宿主植物在AMF侵染后,会对其次生代谢产物进行改变。这些改变中的一部分化合物如酚类和萜类,是植物为了应对环境胁迫而产生的反应。在针对喜树(Camptotheca acuminata)的研究中,我们明确发现,当植株被接种三种不同的丛枝菌根真菌(AMF)后,其嫩叶中喜树碱的含量显著提升。
这种显著的增长是喜树对AMF感染的一种有效的防御机制[ 35 ]。通过实施GI接种策略,成功地在黑吉豆(Vigna mungo)叶片中诱导出丰富的防御性代谢产物,涵盖了酚类物质、超氧化物歧化酶以及各类防护性蛋白质,这些物质共同作用,显著抑制了斜纹夜蛾(Spodoptera litura)对植物的摄食量及营养吸收能力,并能延缓它们的发育进程[ 36 ]。在深入探索宿主植物与AMF的共生关系时,我们观察到不同种类的AMF对宿主植物体内次生代谢物的产生和积累具有显著的差异性影响。研究表明,当山菅草(Inula ensifolia)被接种了明球囊霉(Glomus clarum)后,其根部的一种重要萜类化合物——百里香酚(Thymol)的含量有了明显的增加。在接种了GI之后,山菅草的根部所含有的百里香酚量却有所减少[ 37 ]。在针对贯叶金丝桃(Hypericum perforatum)的研究中,我们注意到接种GI后,其叶片部位中的金丝桃素和伪金丝桃素(均属于酚类物质)的含量有了显著的增加,分别提高了约40%和35%。然而,在接种GM的情况下,这两种酚类物质的含量并未出现明显的波动或变化[ 38 ]。在本研究中,接种GI菌种使得青山杨叶片的总黄酮含量得到增加,而总酚含量则有所减少。同时,接种GM菌种导致了叶片中总酚和单宁含量的下降,并且显著提升了木质素的含量。武帅[ 39 ]等人研究发现,接种GI和GM的银中杨叶片中的总酚和单宁含量明显高于未接种的对照组,然而其可溶性糖含量却低于对照组。这一发现与本研究观察到的结果形成了对比,表明即使是相同菌种对不同树种的作用也展现出明显的差别。
本试验结果说明GI对青山杨的生长有抑制作用,GM对青山杨生长发育有促进作用,可增加其叶片营养,但是降低了总酚和单宁的含量,说明AMF对同种宿主植物生长发育的影响具有种类特异性。AMF对青山杨抗虫性的影响有待进一步生物测定试验的验证。
参考文献
[1] 张伟珍, 李应德, 闫智臣, 等. AM真菌分子生物学研究进展[J].草业科学, 2018, 35(7): 41 - 52.
[2] 李柄霖, 丁德东, 何静, 等. 丛枝菌根真菌对枸杞生长及抗根腐病的影响[J]. 云南农业大学学报(自然科学), 2022, 37(4):547 - 552.
[3] Musa Y, Ridwan I, Ponto H, et al. Application of Arbuscular Mycorrhizal Fungus(AMF) improves the growth of single-bud sugarcane (Saccharum officinarum) seedlings from different bud location[J]. IOP Conference Series Earth and Environmental Science, 2020, 486(1): 1315-1323.
[4] 马炬峰, 辛敏, 徐陈超, 等. 丛枝菌根真菌与氮添加对不同根形态基因型水稻氮吸收的影响[J].植物生态学报, 2021, 45(7):728 - 737.
[5] Sophie T, Laurent B, Dirk R, et al. Arbuscular mycorrhiza
symbiosis in viticulture: a review[J]. Agronomy for Sustainable
Development, 2015, 35(4): 1449 - 1467.
[6] 刘佳妮, 黄鹤平, 郑旴, 等. 植物次生代谢物烟碱对马铃薯块茎蛾生长发育的影响[J]. 西南农业学报, 2015, 28(3): 1105 - 1109.
[7] 李侠, 张俊伶. 丛枝菌根真菌对氮素的吸收作用和机制[J]. 山西大同大学学报: 自然科学版, 2008, 24(6): 75 - 78.
[8] Zubek S, Stojakowska A, Anielska T, et al. Arbuscular mycorrhizal fungi alter thymol derivative contents of Inula ensifnlia L[J]. Mycorrhiza, 2010, 20(7): 497 - 504.
[9] Zubek S, Mielcarek S, Turnau K. Hypericin and pseudo-hypericin concentrations of a valuable medicinal plant Hypericurm peforatum are enhanced by arbuscular mycorrhizal fungi [J]. Mycorrhiza, 2011, 22(2): 149 - 152.
[10] 张华, 包玉英, 特布沁. 盐胁迫下接种丛枝菌根真菌对小叶锦鸡儿的生长及总黄酮含量的影响[J]. 微生物前沿, 2013, 2(3): 71 - 77.
[11] Berger F, Gutjahr C. Factors affecting plant responsiveness to arbuscular mycorrhiza[J]. Current Opinion in Plant Biology,
2021, 59(1): 1369 - 1377.
[12] 韩冰洋, 王科东, 周浓, 等. 丛枝菌根真菌对腺花香茶菜菇类成分的影响[J]. 中药材, 2013, 36(2): 191 - 195.
[13] 郭巧生, 程俐陶, 刘作易. 丛枝菌根真菌对半夏产量及化学成分的影响[J]. 中国中药杂志, 2010, 35(3): 333 - 338.
[14] Zeng H, Yu L, Liu P, et al. Nitrogen fertilization has a stronger influence than cropping pattern on AMF community in maize/
soybean strip intercropping systems[J]. Applied Soil Ecology, 2021, 167(1): 104 - 114.
[15] Fei W, Zhang H Q, Fang F, et al. Effects of Nitrogen and Exogenous Rhizophagus irregularis on the Nutrient Status, Photosynthesis and Leaf Anatomy of Populus×canadensis ‘Neva’[J]. Journal of Plant Growth Regulation, 2017, 36(4): 824 - 835.
[16] Tuskan G, Difazio S, Jansson S, et al. The Genome of Black Cottonwood, Populus trichocarpa(Torr. & Gray)[J]. Science, 2006, 313(5793): 1596 - 1604.
[17] Jansson S, Douglas C J. Populus: A Model System for Plant Biology[J]. Annual Review of Plant Biology, 2007, 58(1): 435 - 458.
[18] Gonzalez J B, Petipas R H, Franken O, et al. Herbivore removal reduces influence of arbuscular mycorrhizal fungi on plant growth and tolerance in an East African savanna[J]. Oecologia,
2018, 187(1): 123 - 133.
[19] Phillips J M. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55(1): 158 - 161.
[20] 杨静华. 考马斯亮蓝法测定苦荞麦中可溶性蛋白的含量[J]. 山西医药志, 2018, 47(2): 206 - 207.
[21] 张述伟, 宗营杰, 方春燕, 等. 蒽酮比色法快速测定大麦叶片中可溶性糖含量的优化[J]. 食品研究与开发, 2020, 41(7): 196 - 200.
[22] 高凤梅, 武际. 2种植株全氮测定方法比较[J]. 现代农业科技, 2012, 14(2): 204 - 205.
[23] 李萍, 李明明, 王浩, 等. 改良钼锑抗比色法测定不同谷子材料组织磷含量[J]. 激光生物学报, 2020, 29(3): 237 - 244. [24] Liu J Y, Liu X S, Zhang Q B, et al.Response of alfalfa growth to arbuscular mycorrhizal fungi and phosphate-solubilizing bacteria under different phosphorus application levels[J]. AMB
Express, 2020, 10(1): 200.
[25] 王玉娟, 高秀兵, 吴强盛, 等. 不同水分条件下AM真菌对福鼎大白茶生长和茶叶品质的影响[J]. 茶叶科学, 2020, 40(5): 588 - 596.
[26] 赵飞, 唐明, 张好强. 丛枝菌根真菌对宁夏枸杞生长和氮代谢影响[J]. 西北林学院学报, 2022, 37(1): 166 - 171 + 252.
[27] 郑玲玲, 陈美兰, 康利平, 等. 根内根孢囊霉Rhizophagus intraradices对丹参生长作用的研究[J].中国中药杂志, 2023, 48(2): 349 - 355.
[28] 雷梅, 丁驰, 甘子莹, 等. 丛枝菌根真菌和施加不同形态氮肥对杉木幼苗养分吸收的影响[J]. 热带亚热带植物学报, 2022, 30(4): 518 - 527.
[29] Johansen A, Jakobse I, Jensen E S. Hyphal transport of 15N- labelled nitrogen by a vesicular-arbuscular mycorrhizal fungus and its effect on depletion of inorganic soil N[J]. New Phytologist, 2010, 122(2): 281 - 288.
[30] Wu F, Fang F, Wu N ,et al. Nitrate Transporter Gene Expression and Kinetics of Nitrate Uptake by Populus×canadensis 'Neva' in Relation to Arbuscular Mycorrhizal Fungi and Nitrogen Availability[J]. Frontiers in microbiology, 2020, 11(2): 176 - 185.
[31] Wurst S, Dugassa Ugassa-Gobena D, Scheu S. Earthworms and Litter Distribution Affect Plant-Defensive Chemistry[J]. Journal of Chemical Ecology, 2004, 30(4): 691 - 701.
[32] 史俊, 杨鹤同, 徐超, 等. 氮素营养对铁皮石斛生长和生理的影响[J]. 江苏农业科学, 2018, 46(23): 119 - 122.
[33] Campo S, Martin-Cardoso H, Oilive M, et al. Effect of Root Colonization by Arbuscular Mycorrhizal Fungi on Growth, Productivity and Blast Resistance in Rice[J]. Rice (New York, N.Y.), 2020, 13(1): 42 - 55.
[34] 邹碧莹, 张云翼. 丛枝菌根(AM)真菌对植物营养代谢的影响研究进展[J]. 现代农业科技, 2008(15): 10 - 13.
[35] 于洋. 喜树幼苗丛枝菌根形成与喜树碱含量的对应分析[D]. 哈尔滨: 东北林业大学, 2011.
[36] Selvaraj A, Thangavel K, Uthandi S, et al. Arbuscular mycorrhizal fungi (Glomus intraradices) and diazotrophic bacterium (Rhizobium BMBS) primed defense in blackgram against herbivorous insect(Spodoptera litura) infestation[J]. Microbiological Research, 2020, 231(C): 126 - 160.
[37] Zubek S, Stojakowska A, Anielska T, et al. Arbuscular mycorrhizal fungi alter thymol derivative contents of Inula ensifnlia L[J]. Mycorrhiza, 2010, 20(7): 497 - 504.
[38] Zubek S, Mielcarek S, Turnau K. Hypericin and pseudo-hypericin concentrations of a valuable medicinal plant Hypericurm peforatum L. are enhanced by arbuscular mycorrhizal fungi[J]. Mycorrhiza, 2011, 22(2): 149 - 152.
[39] 武帅, 姜礅, 马庆辉, 等. 丛枝菌根真菌对银中杨叶片物质代谢及化学防御的影响[J].北京林业大学学报, 2021, 43(5): 86 - 92.

