接种蚯蚓和腐解菌对秸秆腐解及土壤矿物结合有机碳形成的影响


收稿日期:2023-07-07
基金项目:江苏省自然科学基金项目(BK20200552)
作者简介:裴诗宇(1998-),男,河南新乡人,硕士研究生,主要从事土壤动物对土壤有机碳动态影响的相关研究。(E-mail)2021803157@stu.njau.edu.cn
通讯作者:叶成龙,(E-mail)chenglongye@njau.edu.cn
摘要: 为了探究接种蚯蚓和腐解菌对秸秆分解及土壤矿物结合有机碳形成的影响,本研究以商品腐解菌和赤子爱胜蚓为接种物,分别设置仅添加秸秆(CK)、添加秸秆并接种腐解菌(SM)、添加秸秆并接种赤子爱胜蚓(SE)和添加秸秆并同时接种腐解菌和赤子爱胜蚓(SME)的试验处理,探讨腐解菌和蚯蚓的交互作用对土壤温室气体排放、细菌和真菌丰度、团聚体结构、金属离子含量、颗粒有机碳含量及矿物结合有机碳含量的影响及潜在机制。结果表明:(1)与CK相比,SE和SME处理显著增加了秸秆的腐解率;(2)与CK相比,SE和SME处理显著促进了土壤CO2和N2O的排放;SE和SM处理显著增加了土壤细菌的丰度,但是各处理间土壤真菌丰度无显著差异;(3)与CK相比,SE和SME处理显著增加了土壤中可提取钙镁含量,但是各处理间的非晶型铁铝含量和团聚体结构无显著差异;(4)与CK相比,SE和SME处理显著增加了土壤矿物结合有机碳和钙镁结合碳的含量,但是各处理间颗粒有机碳、铁铝结合碳的含量无显著差异;(5)线性回归分析结果表明,土壤钙镁结合碳含量与土壤可提取钙镁含量显著正相关,土壤矿物结合有机碳含量与细菌基因拷贝数呈正相关。综上所述,蚯蚓主导了秸秆的腐解和矿物结合有机碳的形成,蚯蚓和腐解菌的交互作用没有进一步促进秸秆腐解转化为土壤矿物结合有机碳。
关键词: 土壤有机碳;土壤活性矿物;秸秆还田;腐解菌;蚯蚓
中图分类号: Q148;S152 文献标识码: A 文章编号: 1000-4440(2024)08-1424-10
Effects of earthworms and straw-decomposing microbial inoculants on straw decomposition and soil mineral-associated organic carbon formation
PEI Shiyu1, YANG Jiawei1, WU Bin1, ZHAO Yexin1, YE Chenglong1, HU Shuijin1,2
(1.College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;2.Department of Entomology and Plant Pathology, North Carolina State University, Raleigh 27695, USA)
Abstract: To explore the impact of earthworms and straw-decomposing microbial inoculants on straw decomposition and the formation of soil mineral-associated organic carbon, we conducted an incubation experiment with four treatments, i.e., soil + straw (CK), soil + straw + straw-decomposing microbial inoculant (SM), soil + straw + earthworms (SE) and soil + straw + straw-decomposing microbial inoculant + earthworms (SME), to investigate interactive effects of straw-decomposing microbial inoculants and earthworms on soil greenhouse gas emission, bacterial and fungal abundance, soil aggregate structure, metal ion content, particulate organic carbon content and mineral-associated organic carbon content. The results indicated that compared with CK, SE and SME treatments significantly increased the straw decomposition rate and promoted the emission of CO2 and N2O in soil. In addition, SE and SM treatments significantly increased bacterial abundance compared with CK, while there was no significant difference in soil fungal abundance among treatments. Compared with CK, SE and SME treatments significantly increased the contents of extractable calcium and magnesium in soil, and significantly facilitated the formation of mineral-associated organic carbon and Ca/Mg-associated carbon. But there were no significant differences in aggregate structure and the contents of non-crystalline Fe and Al, particulate organic carbon and Fe/Al-associated carbon among treatments. Linear correlation analysis showed that mineral-associated organic carbon formation and Ca/Mg-associated carbon were positively related with bacterial gene copy number and content of soil extractable Ca and Mg, respectively. In conclusion, earthworms dominated straw decomposition and mineral-associated organic carbon formation, and the interactions between earthworms and straw-decomposing microbial inoculants did not further promote the decomposition of straw into mineral-bound organic carbon.
Key words: soil organic carbon;soil reactive metals;straw returning;straw-decomposing microbial inoculant;earthworm
土壤有机碳不仅在调节生态系统碳平衡过程中起到至关重要的作用[1],而且还是衡量土壤肥力的重要指标[2-3],提升农田土壤有机碳含量是提高农业生产力的关键所在。据统计,中国农作物秸秆年均产量多达8.65×108 t[4],农作物秸秆是农田土壤有机碳的重要来源,且含有植物生长所必须的氮、磷、钾等营养元素[5],因此秸秆还田是提升土壤有机碳含量及农作物产量经济且有效的手段。然而秸秆直接还田腐解缓慢,秸秆中的养分难以释放到土壤中,还会造成耕作困难和病虫害蔓延等问题[6-7]。腐解菌剂是一种由黑曲霉、酵母菌及芽孢杆菌等微生物组成的复合制剂[8],能够加速秸秆中纤维素、半纤维素及木质素等有机物质的分解,目前已被广泛应用于加速还田秸秆的分解[8-10]。此外,作为土壤生态系统中常见的大型无脊椎动物,蚯蚓的活动能够提高土壤中微生物的活性,促使秸秆与土壤混合,进而能够加快秸秆向土壤有机碳的转化[11-12]。
目前根据稳定性的差异通常将土壤有机碳划分为颗粒有机碳和矿物结合有机碳2种形式[13-15]。其中颗粒有机碳主要由植物凋落物和其他有机残余物组成,直接存在于土壤中或受团聚体保护,易被土壤微生物利用[16]。而矿物结合有机碳主要来源于微生物衰亡后形成的微生物残体碳,是土壤中的有机碳与矿物相互作用形成的有机矿物复合体,具有较高的稳定性,能够在土壤中保留几百甚至上千年[14]。土壤有机碳的稳定性会影响其在土壤中的周转和储量,因此促进秸秆分解转化为矿物结合有机碳对于缓解全球气候变化、提升农田土壤有机碳含量及稳定性都具有重要意义。
越来越多的研究结果表明土壤中微生物的死亡残体碳是土壤矿物结合有机碳的主要来源[17-18],秸秆分解过程中产生的小分子水溶性有机碳也容易被土壤矿物吸附形成矿物结合有机碳,并且这些小分子有机碳很容易被微生物利用,促进土壤微生物的生长[19-20]。腐解菌剂的施用能够加速秸秆中有机碳的释放并能够直接增加土壤微生物生物量[9, 21],因此施用腐解菌剂能够直接或间接地促进矿物结合有机碳的形成。目前有大量研究结果表明,蚯蚓能够促进土壤微生物生物量的积累和微生物残体的周转,进而促进矿物结合有机碳的形成[11,22-24]。此外,土壤中金属氧化物和黏土矿物也是影响矿物结合有机碳形成的重要因素,其中非晶形铁铝氧化物具有较大的比表面积,能够通过吸附和共沉淀等方式与土壤有机碳相互作用形成矿物结合有机碳[25-26],交换性钙镁离子能够通过多价阳离子桥键与土壤有机碳结合形成矿物结合有机碳[27],目前已有研究发现,蚯蚓能够提升土壤可提取钙镁含量[28-30],这有益于矿物结合有机碳的形成,但还需要试验进一步验证。目前还不清楚腐解菌与蚯蚓之间是否存在协同作用共同促进秸秆的分解及其向土壤矿物结合有机碳的转化。因此,本研究拟通过室内培养试验,向土壤中接种腐解菌和蚯蚓,探究腐解菌和蚯蚓的交互作用对土壤理化性质、温室气体排放量以及土壤有机碳含量的影响,以期为研究腐解菌和蚯蚓调控农田秸秆腐解及土壤有机碳形成的机制提供理论依据。
1 材料与方法
1.1 供试土壤和材料
土壤采自江苏省常熟市古里镇康博村(31°30′N,120°33′E),该地区位于太湖平原中部,属于亚热带季风气候,年均气温为16 ℃,年均降雨量为1 100~1 200 mm。种植制度为水稻-冬小麦轮作,土壤类型为湖积物母质发育而成的水稻土,试验前土壤基本理化性质如下:pH值为7.0,有机碳含量为19.2 g/kg,全氮含量为1.6 g/kg,速效磷含量为12.3 mg/kg,速效钾含量为93.4 mg/kg,交换性钙含量为3.4 g/kg,交换性镁含量为0.5 g/kg,土壤砂粒、粉粒和黏粒的含量分别为33.8%、38.6%、27.6%。
土壤样品采集于2021年3月,在稻田中随机采集表层0~20 cm的土壤10钻,均匀混合后过8 mm筛去除肉眼可见的植物残体及砂石等杂质,保存于4 ℃冰箱备用。本研究中采用的秸秆为玉米秸秆,蚯蚓为正蚓科爱胜蚓属的赤子爱胜蚓(Eisenia foetida),腐解菌剂由河南沃宝生物科技有限公司生产,腐解菌的主要菌属为芽孢杆菌、木霉菌、酵母菌等。
1.2 试验设计
称取过8 mm筛的250 g土壤(干重)置于密封良好的500 ml棕色培养瓶中,将土壤水分调节到田间最大持水量的60%,在20 ℃条件下预培养3 d后向每个培养瓶中加入秸秆1 g(干重),用剪刀剪成2 cm长的小段,使秸秆平铺于土壤表面,模拟秸秆破碎后直接还田。试验共设置4个处理,包括:仅添加秸秆的对照(CK);添加秸秆并接种赤子爱胜蚓(SE);添加秸秆并接种腐解菌(SM);添加秸秆并同时接种赤子爱胜蚓和腐解菌(SME)。在接种蚯蚓的处理中,向每个培养瓶中接种重量和活力相似的蚯蚓4条;在接种腐解菌的处理中,称取0.1 g腐解菌剂(有效活菌数约为1.0 g 1×109)溶于无菌水后均匀撒在秸秆表面。每个处理设置4个重复,于20 ℃恒温培养室中培养46 d,培养期间定期补充去离子水保持含水量恒定。在培养的前21 d内每天进行土壤CO2和N2O排放速率的测定,之后每隔1 d进行测定。培养结束后,对培养瓶中的土壤进行破坏性采样,将土壤中的秸秆用镊子取出,烘干后称重量,计算秸秆的腐解率,计算公式为:
R=(m1-m0)/m0(1)
R为秸秆腐解率,m1为试验结束时秸秆的干重(g),m0为试验开始时加入的秸秆干重(g)。每个培养瓶中的土壤混合均匀后,分成两部分。一部分鲜土用于土壤微生物丰度和群落结构的测定,另一部分土壤自然风干后用于土壤基本理化性质、颗粒有机碳及矿物结合有机碳含量等指标的测定。
1.3 土壤基本理化性质指标及微生物指标的测定
土壤pH采用奥豪斯pH计(Ohaus公司产品)测定(水土质量比2.5∶1.0);土壤可溶性有机碳用0.5 mol/L的硫酸钾(K2SO4)溶液浸提后(水土质量比4∶1),采用TOC分析仪(Analytik Jena公司产品)测定含量;土壤非晶形铁铝采用0.2 mol/L草酸铵溶液提取(水土质量比50∶1),并在25 ℃避光条件下振荡2 h,分离出上清液,采用ICP-OES电感耦合等离子体发射光谱仪(Agilent Technologies公司产品)测定含量。土壤可提取钙镁采用0.11 mol/L乙酸溶液提取(水土质量比20∶1),在22 ℃条件下振荡16 h,分离出上清液,采用ICP-OES电感耦合等离子体发射光谱仪测定含量。
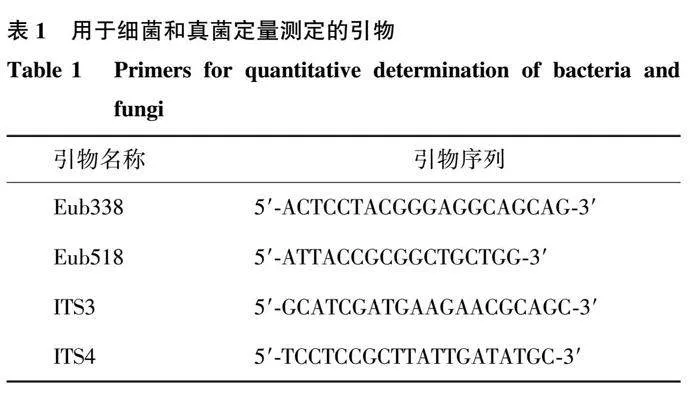
土壤真菌和细菌的丰度采用荧光定量PCR法测定。称取0.25 g鲜土,使用MoBio Power SoilTM DNA提取试剂盒提取DNA,然后使用QuantStudioTM 3荧光定量PCR仪(Applied Biosystems公司产品)和 SYBRPremix Ex TaqTM试剂盒(TaKaRa公司产品)对提取的土壤DNA进行扩增和测定。qPCR反应体系为25.0 μL,包括12.5 μL SYBRPremix Ex TaqTM、0.5 μL正向引物、0.5 μL反向引物、0.5 μL ROX Reference Dye II(50×)、1.0 μL DNA模板以及10.0 μL ddH2O。用含有环境DNA克隆靶基因产物的 pMD-19质粒构建基因拷贝数的标准曲线。细菌定量扩增引物为Eub338和Eub518(表1),扩增程序为:95 ℃ 3 min;95 ℃ 15 s,65 ℃ 30 s,72 ℃ 30 s,进行40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。真菌定量扩增引物为ITS3和ITS4(表1),反应条件为95 ℃ 3 min;95 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
选取细菌16S rRNA基因的V4区和真菌的ITS3和ITS4区,并通过上海派森诺生物科技股份有限公司在Illumina MiSeq测序平台对扩增产物进行高通量测序。然后,采用QIIME1.9.1去除低质量序列并用核糖体数据库(RDP)去除嵌合体,将得到的高质量序列采用UPARSE软件以97%的相似度进行操作分类单元(Operational taxonomic units, OTUs)的划分。最后,利用细菌和真菌群落的OTUs计算丰富度指数Chao1和Shannon多样性指数。
1.4 土壤CO2和N2O排放速率的测定
土壤CO2和N2O排放速率采用气相色谱法测定。测定前用高纯空气(70% 氮气,30% 氧气)排除培养瓶中的CO2和N2O气体,在25 ℃黑暗条件下培养1 h后,用注射器从培养瓶中抽取10 mL左右的气体,再将气体样品注入气相色谱(Agilent Technologies公司产品)中测定CO2和N2O浓度,气体排放速率的计算公式为[31]:
F=C×V×ρ/m×24×n(2)
式中:F为土壤气体排放速率;C为气相色谱测得的气体浓度;V为标准状况下(0 ℃, 101.3 kPa)的气体总体积(L);ρ为标准状况下的气体密度(g/L);m为培养瓶内干土重量(g);24为换算时间(h),将1 h的气体排放速率换算为1 d的排气速率;n为C或N的摩尔分数(C为12/44,N为28/44),由于N2O排放速率较小将计算结果扩大1 000倍,单位换算为[μg /(kg·d),干土]。
气体累积排放量的计算公式[31]为:
G=∑ni=0FiTi(3)
式中,G为培养第n d气体累积排放量;Fi为连续2次测得的气体排放速率平均值;Ti为连续2次测定的时间间隔(d)。
1.5 土壤团聚体分级
土壤团聚体分级采用湿筛法[32]。称取20 g风干土样置于孔径为250 μm的筛中,在室温(20 ℃)条件下浸没于去离子水中2 min,使水分充满土壤孔隙。首先,手动上下振荡筛子5 min,振幅在3 cm左右,频率为1 min 50次,将滞留于筛上的土壤颗粒用水清洗并转移至离心管中,得到大于250 μm的大团聚体组分。其次,将土壤悬浊液倒入孔径为53 μm的筛子,重复上述步骤,得到53~250 μm的团聚体组分。将余下的土壤悬液进行离心,得到小于53 μm的团聚体组分。将回收的样品在65 ℃条件下烘干至恒重后,对不同粒径团聚体进行称重,团聚体平均重量直径(MWD)按公式(4)计算[33]:
MWD=∑Ri×wi(4)
式中,MWD为平均重量直径;Ri为相邻2级筛孔的平均直径(mm);wi为不同粒级团聚体的相对质量分数(%)。
1.6 土壤颗粒有机碳和矿物结合有机碳的测定
称取10 g风干土样装入50 mL离心管中,加入30 mL 0.5%的六偏磷酸钠溶液和玻璃珠若干,180 r/min振荡18 h,使土壤溶液分散。将振荡后的溶液过53 μm筛,大于53 μm的部分即为颗粒有机碳组分,小于53 μm的部分为矿物结合有机碳组分。将各组分在55 ℃下烘干后称重量,磨细后过80目筛,采用元素分析仪(Elementar公司产品)测定颗粒有机碳和矿物结合有机碳含量。
采用连续提取法测定土壤钙镁和铁铝结合有机碳的含量[34]。首先,称取0.25 g小于53 μm的矿物结合有机碳组分放入50 mL离心管中,加入0.5 mol/L的硫酸钠(Na2SO4)溶液20 mL,180 r/min振荡2 h,3 000 r/min离心10 min后,用总有机碳(TOC)含量分析仪测定上清液中的有机碳含量,即可计算得到钙镁结合有机碳含量。去除离心管中剩余的Na2SO4溶液后,称取0.40 g连二亚硫酸钠(Na2S2O4)放入离心管中,加入40 mL去离子水,180 r/min振荡16 h,3 000 r/min再次离心10 min,用TOC含量分析仪测定上清液中的有机碳含量,可计算得到铁铝结合有机碳含量。
1.7 数据处理
数据统计分析和绘图均使用R统计软件(Version 4.1.1)。采用单因素方差分析(One-way ANOVA)检验不同处理对秸秆腐解率、土壤理化性质和微生物学性质的影响,并用最小显著性差异法(LSD)进行差异显著性检验。利用基于Bray-Curtis距离的非度量多维尺度(Non-metric multidimensional scaling, NMDS)分析比较不同处理间微生物群落结构的差异。采用线性回归模型分析影响土壤矿物结合有机碳含量与土壤理化性质指标和微生物学指标之间的相关性。
2 结果与分析
2.1 蚯蚓及腐解菌对秸秆腐解率的影响
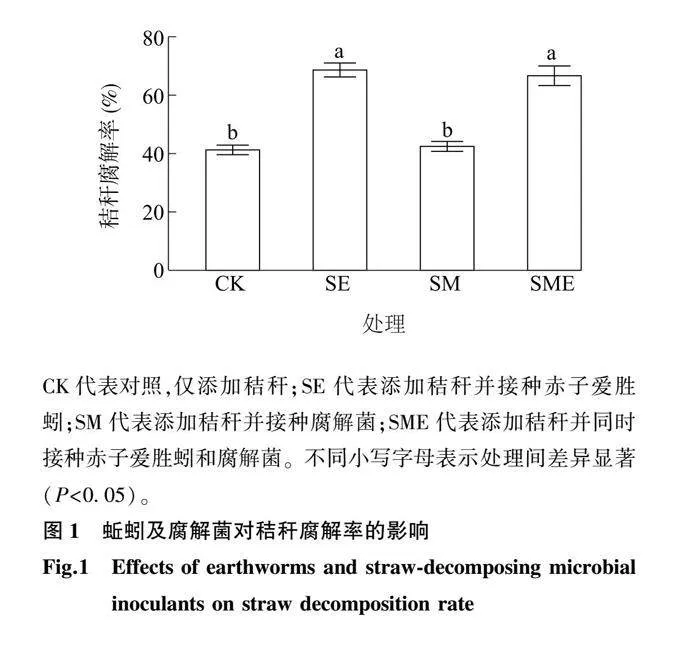
图1显示,与CK相比,SE和SME处理均显著增加了秸秆的腐解率,使得秸秆的腐解率分别显著提升27.36%和25.38%(P<0.05),而SM处理对秸秆腐解率无显著影响(P>0.05)。
2.2 蚯蚓及腐解菌对土壤理化性质及微生物学性质的影响
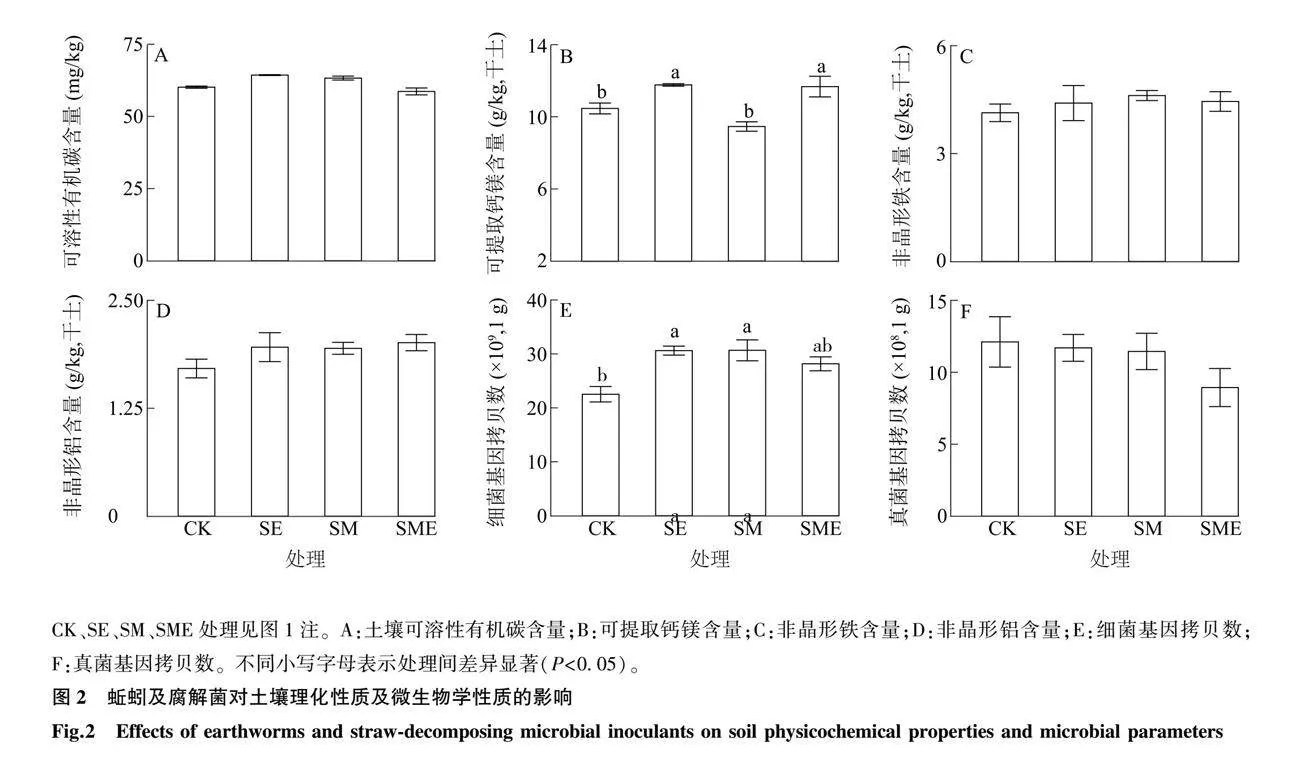
由图2可知,蚯蚓及腐解菌添加对土壤可溶性有机碳、非晶形铁、非晶形铝含量均无显著影响(P>0.05,图2A、图2C、图2D)。与CK相比,SE和SME处理均显著增加了土壤可提取钙镁含量(P<0.05,图2B),SM处理对土壤可提取钙镁含量无显著影响(P>0.05,图2B)。与CK相比,SE和SM处理均显著增加了土壤细菌基因拷贝数(P<0.05,图2E)。不同处理间土壤真菌基因拷贝数无显著差异(P>21337b83fcdf1dd387a13895cbb100280.05,图2F)。
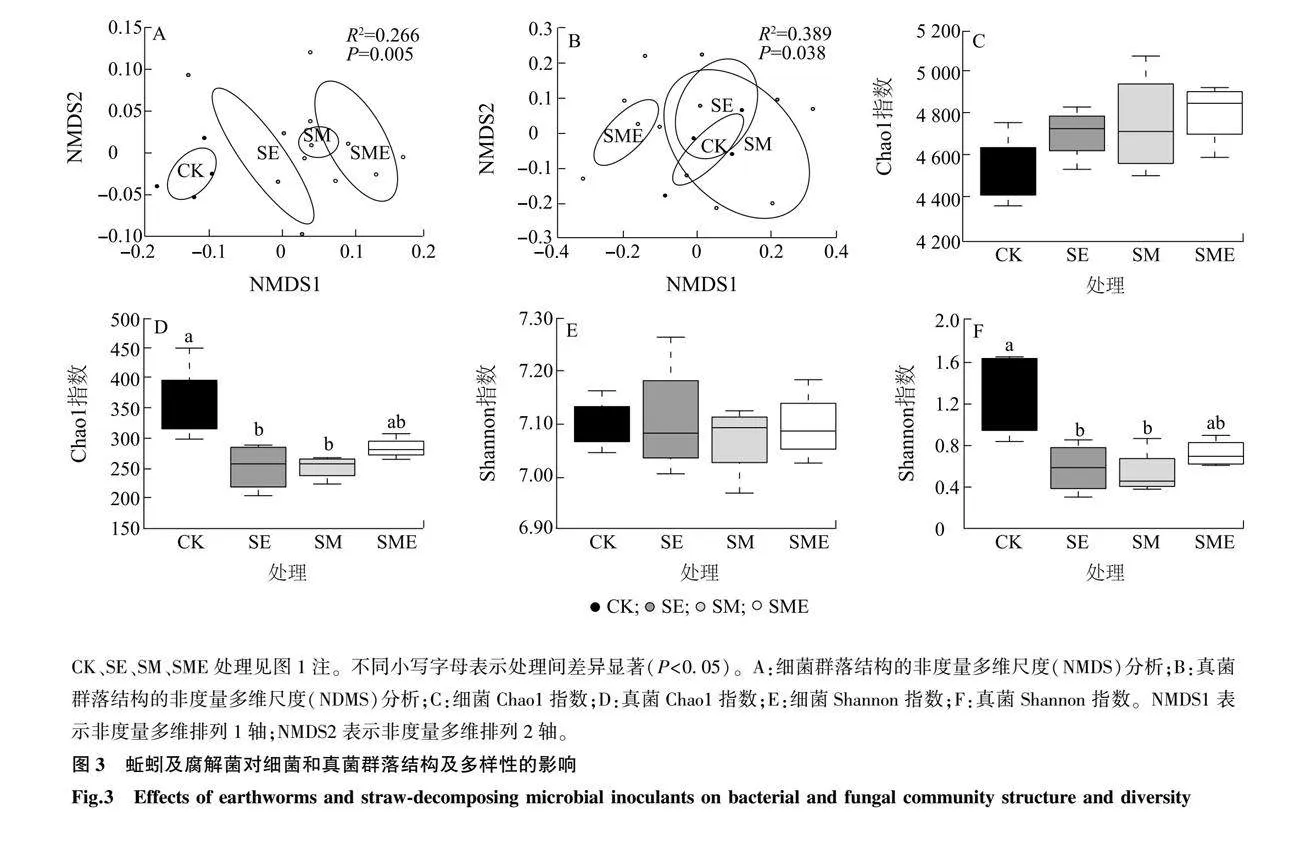
由NMDS分析可知,与CK相比,SE、SM和SME处理均显著改变了土壤细菌和真菌的群落结构(P<0.05,图3A、图3B),不同处理间细菌群落多样性无显著差异(P>0.05,图3C、图3E),但与CK相比,SE和SM处理均显著降低了真菌群落多样性(P<0.05,图3D、图3F)。
2.3 蚯蚓及腐解菌对土壤CO2和N2O排放的影响
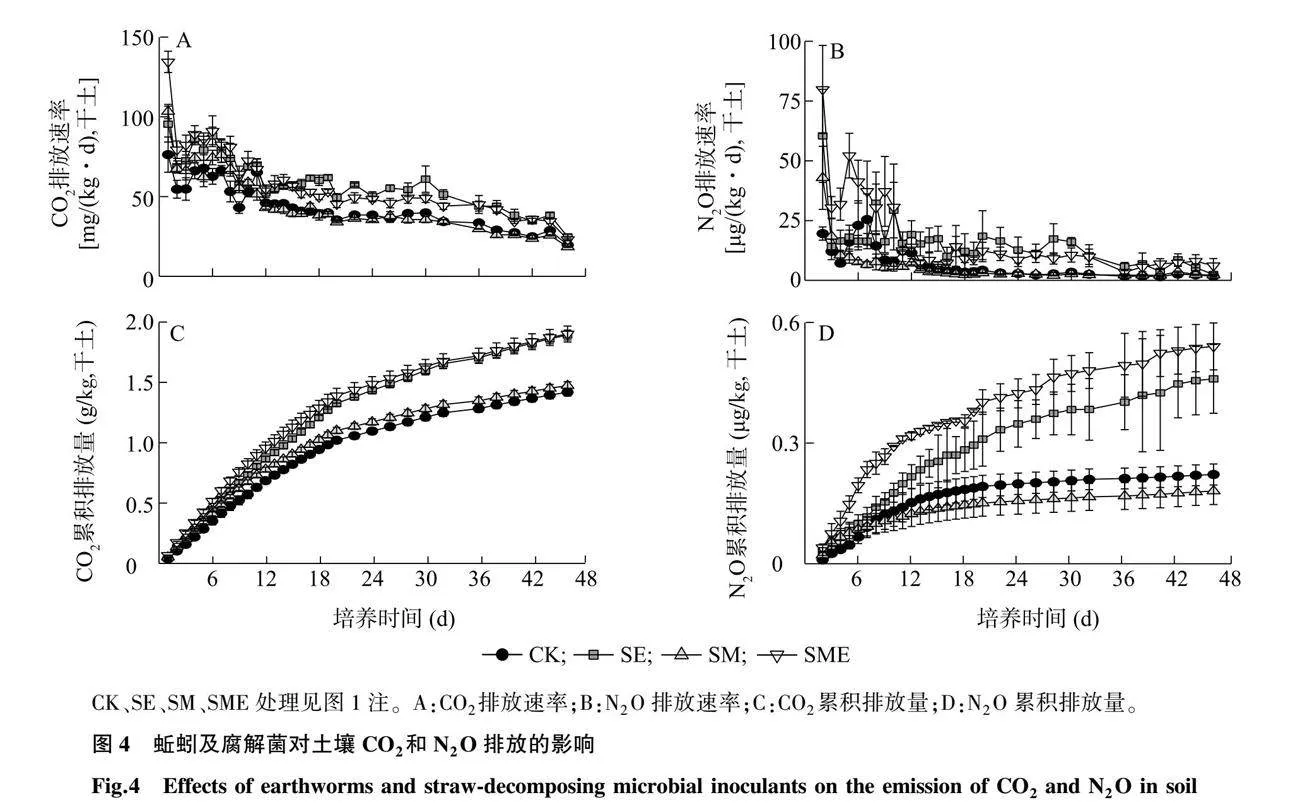
与CK相比,SE与SME处理均显著增加了土壤CO2及N2O排放速率(P<0.05,图4A、图4B),且显著提高了土壤CO2及N2O的累积排放量(P<0.05,图4C、图4D),SM处理对土壤CO2及N2O排放速率和累积排放量无显著影响(P>0.05,图4)。
2.4 蚯蚓及腐解菌对土壤团聚体和土壤有机碳含量的影响
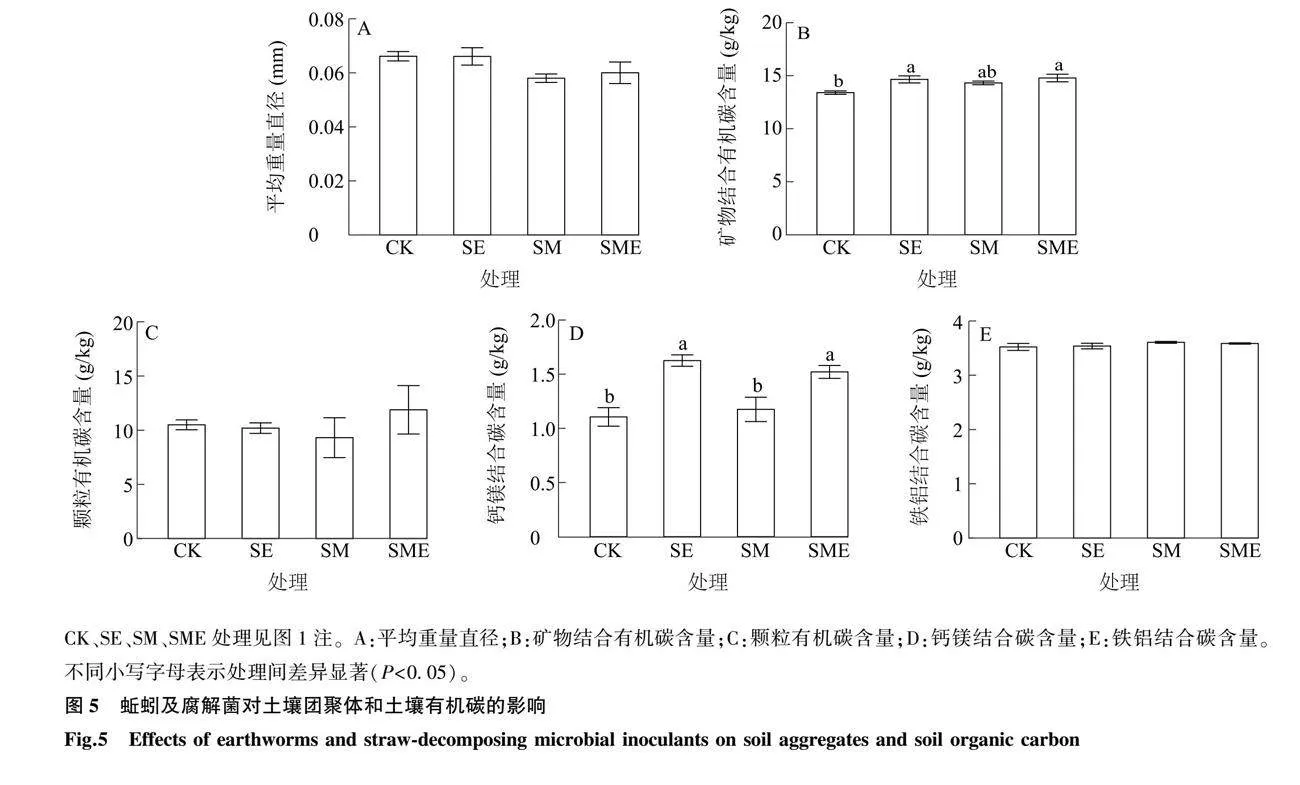
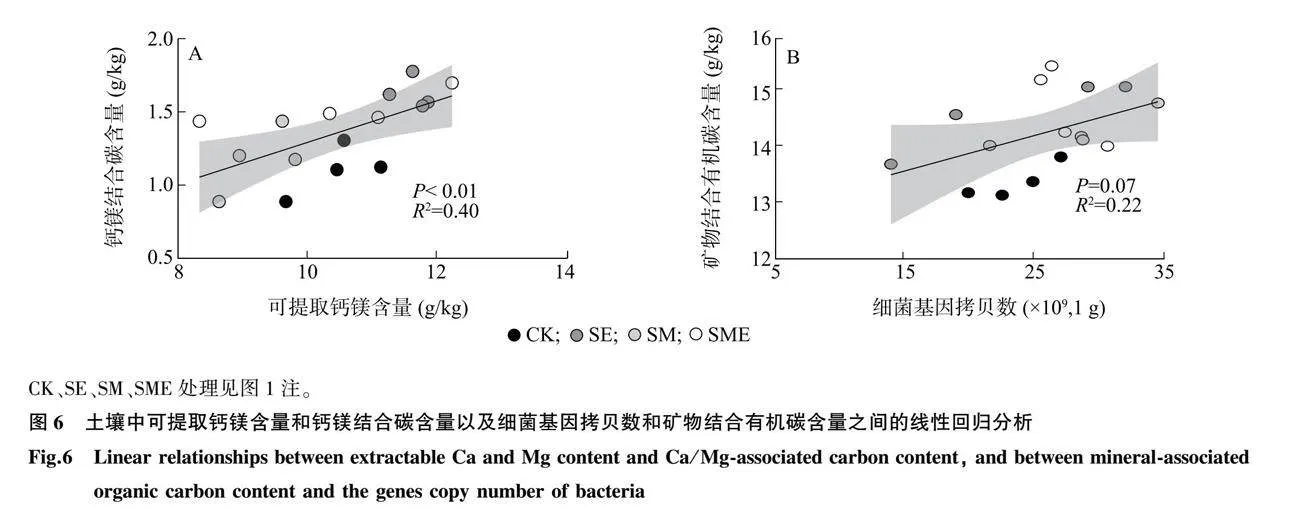
不同处理对土壤团聚体平均重量直径无显著影响(P>0.05,图5A)。与CK相比,SE和SME处理均显著增加了土壤矿物结合有机碳含量和钙镁结合碳含量(P<0.05,图5B、图5D),SM处理对土壤矿物结合有机碳和钙镁结合碳含量影响不显著(P>0.05,图5B、图5D),不同处理间土壤颗粒有机碳和铁铝结合碳含量无显著差异(P>0.05,图5C、图5E)。线性回归分析结果(图6)表明,土壤中钙镁结合碳含量与可提取钙镁含量之间存在显著正相关关系(R2 = 0.40,P<0.01),土壤矿物结合有机碳含量与细菌基因拷贝数之间存在正相关关系(R2 =0.22,P=0.07)。
3 讨论
3.1 蚯蚓及腐解菌对土壤理化性质及温室气体排放的影响
本研究发现接种蚯蚓显著提高了土壤可提取钙镁含量,这与先前一些研究[28-30]的结果一致,蚯蚓能够通过多种途径增加土壤交换性阳离子含量。首先,蚯蚓分泌的黏液以及排泄的蚓粪中有大量的钙镁等营养元素,能够直接向土壤释放钙镁离子。其次,蚯蚓取食土壤并通过肠道的消化作用促进土壤交换性钙镁的释放[28]。需要指出的是,本研究所用的赤子爱胜蚓存在钙腺,能够向土壤中分泌碳酸钙[35-36],该过程可以直接增加土壤可提取钙含量。Dobson等[29]也提出,蚯蚓还能够通过加速凋落物分解促进凋落物中的可提取阳离子如Ca2+、Mg2+、K+等释放到土壤中。
许多研究结果表明,蚯蚓在土壤中的活动能够促进团聚体的形成[37-39]。蚯蚓一方面能够通过取食土壤直接影响土壤团聚体的结构,另一方面也可以通过排泄蚓粪、捕食土壤微生物以及促进土壤有机质形成等途径来间接影响土壤团聚体结构[39]。然而由于不同种类蚯蚓取食偏好和生境类型的差异,其对土壤团聚体的影响也有所不同[40]。本研究发现,接种赤子爱胜蚓对土壤团聚体结构并无显著影响,这与前人的研究结果[40-41]一致。其主要原因可能是由于接种的赤子爱胜蚓为表栖类蚯蚓,主要在土壤表层或枯枝落叶层活动,对土壤团聚体的形成影响较小[37,40-41]。
本研究中,接种蚯蚓显著增加了土壤CO2排放,而单独添加腐解菌对土壤CO2排放的影响不显著,以往的许多研究结果都证实了接种蚯蚓能够显著提升土壤CO2的排放[42-46],这与本研究结果一致。蚯蚓能够通过自身的呼吸作用直接提升土壤CO2的排放[44],而蚯蚓促进土壤CO2排放的另一重要原因是其在土壤中的活动促进了微生物对秸秆的分解。首先,蚯蚓的活动能加速秸秆破碎,促进秸秆与土壤的混合,从而使秸秆更容易被微生物分解[42]。其次,蚯蚓排泄到土壤中的蚓粪能够为微生物提供大量易于利用的营养物质和能量,从而促进微生物的生长繁殖[44-45]。此外,本研究发现蚯蚓显著增加了土壤N2O排放,这主要是由于蚯蚓肠道为厌氧环境,并且富集了大量的矿质氮和微生物可利用的碳底物,对反硝化微生物的活动和生长十分有利[47]。此外,蚯蚓的挖穴活动会促进凋落物与土壤混合,改变土壤通气性和含水率,为硝化微生物提供更适宜生存的环境[48],并且蚯蚓体表分泌的黏液以及排出的蚓粪也为硝化微生物和反硝化微生物提供更多易分解的碳源、氮源,促进土壤中的反硝化作用,从而增加N2O的排放[49-50]。
在本研究中,添加腐解菌并没有显著促进秸秆的腐解,对土壤温室气体排放也无显著影响。腐解菌的促腐作用会受到秸秆类型、秸秆初始碳氮比、土壤理化性质及土壤有机碳含量等多种因素的影响[51]。本研究中,腐解菌的促腐效应不显著可能是由于以下2点原因:第一,向中性土壤中添加腐解菌并不能显著促进秸秆的腐解[52]。本研究所用的土壤pH正好为7.0,本研究的结果也进一步证实上述研究的结果。第二,腐解菌进入土壤后会与土著微生物群落产生竞争,而中性土壤中微生物的丰度和活性相比于酸性或碱性土壤更高[53-54],对外源腐解菌的竞争作用也更大,因此更易导致腐解菌的功能发挥受阻[55]。
3.2 蚯蚓及腐解菌对土壤矿物结合有机碳形成的影响
越来越多的研究结果表明,蚯蚓在土壤有机碳形成及稳定的过程中起到重要作用[22,24]。Angst等[11]指出,蚯蚓能够通过促进微生物残体的积累,进而促进矿物结合有机碳形成。本研究发现,蚯蚓显著增加了土壤中矿物结合有机碳含量,并且细菌丰度与矿物结合碳含量呈正相关,该结果进一步证实了上述观点。同时,蚯蚓显著增加了土壤矿物结合有机碳中的钙镁结合有机碳含量,且钙镁结合有机碳含量与土壤可提取钙镁含量呈显著正相关。该结果表明,蚯蚓活动释放的钙镁离子在土壤中可以有效地与有机碳分子结合形成钙镁结合碳,这揭示了蚯蚓促进土壤矿物结合有机碳形成的另一条重要途径。但我们发现接种蚯蚓并没有促进铁铝结合碳的形成,这可能是由于接种蚯蚓并未增加土壤中非晶形铁铝氧化物含量。非晶形铁铝氧化物具有较大的比表面积,能够通过吸附和共沉淀等方式与土壤有机碳结合[25,56]。有研究结果表明土壤中氧化还原条件的波动能够增加铁的溶解,进而促进非晶形铁氧化物的形成[57-58],虽然蚯蚓在土壤中的活动能够增加土壤的通气性,但可能由于在本研究中会定期对培养瓶进行通气维持培养瓶中氧气浓度,培养瓶中氧化还原条件波动不大,因此非晶形铁铝氧化物的含量变化不明显。
尽管添加腐解菌同样增加了土壤细菌丰度,但对土壤矿物结合有机碳的形成没有显著影响,可能是由于以下2点原因:首先,土壤中的非晶形铁铝氧化物及可提取钙镁含量是影响土壤矿物结合有机碳形成的重要因素,添加腐解菌后土壤非晶形铁铝氧化物及可提取钙镁含量均无显著变化。其次,在本研究中腐解菌并没有促进秸秆的腐解,这表明腐解菌并没有显著促进秸秆转化为容易与土壤矿物结合的小分子有机碳化合物。
4 结论
本研究结果表明,蚯蚓能够提升土壤微生物活性,进而促进秸秆腐解,增加土壤CO2与N2O的排放量,并能够通过增加土壤可提取钙镁含量促进矿物结合有机碳的形成,提高土壤的碳固定。然而,腐解菌对秸秆腐解的促进作用不显著,且蚯蚓和腐解菌的交互作用没有进一步显著促进秸秆分解转化为土壤矿物结合有机碳,其原因还需要进一步探究。
参考文献:
[1] SCHIMEL D S. Terrestrial ecosystems and the carbon cycle[J]. Global Change Biology,1995,1(1):77-91.
[2] MANLAY R J, FELLER C, SWIFT M J. Historical evolution of soil organic matter concepts and their relationships with the fertility and sustainability of cropping systems[J]. Agriculture, Ecosystems and Environment,2007,119(3/4):217-233.
[3] TIESSEN H, CUEVAS E, CHACON P. The role of soil organic matter in sustaining soil fertility[J]. Nature,1994,371(6500):783-785.
[4] 石祖梁,王 飞,王久臣,等. 我国农作物秸秆资源利用特征、技术模式及发展建议[J]. 中国农业科技导报,2019,21(5):8-16.
[5] 冷明珠,金 月,童喻浩,等. 秸秆还田量对土壤肥力和小麦产量的影响[J]. 浙江农业科学,2022,63(4):679-681.
[6] 张 国,逯 非,赵 红,等. 我国农作物秸秆资源化利用现状及农户对秸秆还田的认知态度[J]. 农业环境科学学报,2017,36(5):981-988.
[7] 章力干,石心怡,王玉宝,等. 秸秆还田对中国主要粮食作物病害影响的Meta分析[J]. 农业工程学报,2022,38(21):93-100.
[8] 张建峰,侯红燕,付志金,等. 速腐菌剂在东北地区秸秆堆肥中的功能验证及微生物菌群动态研究[J]. 中国农学通报,2013,29(26):112-117.
[9] 董春华,周 旋,孙继民,等. 腐解菌剂对红壤橘园圆叶决明腐解及养分释放动态的影响[J]. 中国农学通报,2022,38(1):106-113.
[10]徐 杰,王泽懿,刘文越,等. 玉米秸秆田间原位腐解菌剂研制及功能验证[J]. 安徽农业科学,2021,49(13):74-79.
[11]ANGST G, FROUZ J, VAN GROENIGEN J W, et al. Earthworms as catalysts in the formation and stabilization of soil microbial necromass[J]. Global Change Biology,2022,28(16):4775-4782.
[12]LAVELLE P, BLANCHART E, MARTIN A, et al. A hierarchical model for decomposition in terrestrial ecosystems:application to soils of the humid tropics[J]. Biotropica,1993,25(2):130-150.
[13]COTRUFO M F, RANALLI M G, HADDIX M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience,2019,12(12):989-994.
[14]LAVALLEE J M, SOONG J L, COTRUFO M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology,2020,26(1):261-273.
[15]SOKOL N W, WHALEN E D, JILLING A, et al. Global distribution, formation and fate of mineral-associated soil organic matter under a changing climate:a trait-based perspective[J]. Functional Ecology,2022,36(6):1411-1429.
[16]WITZGALL K, VIDAL A, SCHUBERT D I, et al. Particulate organic matter as a functional soil component for persistent soil organic carbon[J]. Nature Communications,2021,12(1):4115.
[17]LIANG C, AMELUNG W, LEHMANN J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology,2019,25(11):3578-3590.
[18]MILTNER A, BOMBACH P, SCHMIDT-BRCKEN B, et al. SOM genesis:microbial biomass as a significant source[J]. Biogeochemistry,2012,111(1/2/3):41-55.
[19]LEHMANN J, KLEBER M. The contentious nature of soil organic matter[J]. Nature,2015,528(7580):60-68.
[20]COTRUFO M F, SOONG J L, HORTON A J, et al. Formation of soil organic matter via biochemical and physical pathways of litter mass loss[J]. Nature Geoscience,2015,8(10):776-779.
[21]姚云柯. 促腐菌对水稻秸秆腐解的影响及其机理[D]. 北京:中国农业科学院,2021.
[22]ANGST G, MUELLER C W, PRATER I, et al. Earthworms act as biochemical reactors to convert labile plant compounds into stabilized soil microbial necromass[J]. Communications Biology,2019,2:441.
[23]LIU T, CHEN X Y, GONG X, et al. Earthworms coordinate soil biota to improve multiple ecosystem functions[J]. Current Biology,2019,29(20):3420-3429.
[24]ZHANG W, HENDRIX P F, DAME L E, et al. Earthworms facilitate carbon sequestration through unequal amplification of carbon stabilization compared with mineralization[J]. Nature Communications,2013,4:2576.
[25]MIKUTTA R, LORENZ D, GUGGENBERGER G, et al. Properties and reactivity of Fe-organic matter associations formed by coprecipitation versus adsorption:clues from arsenate batch adsorption[J]. Geochimica et Cosmochimica Acta,2014,144:258-276.
[26]KEILUWEIT M, BOUGOURE J J, NICO P S, et al. Mineral protection of soil carbon counteracted by root exudates[J]. Nature Climate Change,2015,5(6):588-595.
[27]赵天鑫,俄胜哲,袁金华,等. 土壤中钙与有机碳之间相互作用的研究进展与展望[J]. 中国农学通报,2022,38(14):77-81.
[28]张孟豪,吴家龙,张 池,等. 赤子爱胜蚓对赤红壤铝形态的影响[J]. 华南农业大学学报,2020,41(2):48-54.
[29]DOBSON A M, BLOSSEY B, RICHARDSON J B. Invasive earthworms change nutrient availability and uptake by forest understory plants[J]. Plant and Soil,2017,421(1/2):175-190.
[30]LAMBKIN D C, GWILLIAM K H, LAYTON C, et al. Production and dissolution rates of earthworm-secreted calcium carbonate[J]. Pedobiologia,2011,54:S119-S129.
[31]YANG X Y, DUAN P P, LI G T, et al. Spatial-heterogeneous granulation of organic amendments and chemical fertilizer stimulated N2O emissions from agricultural soil:an microcosm study[J]. Journal Environmental Management,2021,277:111437.
[32]CHIVENGE P, VANLAUWE B, GENTILE R, et al. Organic resource quality influences short-term aggregate dynamics and soil organic carbon and nitrogen accumulation[J]. Soil Biology and Biochemistry,2011,43(3):657-666.
[33]蒋雪洋,张前前,沈浩杰,等. 生物质炭对稻田土壤团聚体稳定性和微生物群落的影响[J]. 土壤学报,2021,58(6):1564-1573.
[34]YE C, CHEN D, HALL S J, et al. Reconciling multiple impacts of nitrogen enrichment on soil carbon:plant,microbial and geochemical controls[J]. Ecology Letters,2018,21(8):1162-1173.
[35]HUANG J, ZHANG W, LIU M, et al. Different impacts of native and exotic earthworms on rhizodeposit carbon sequestration in a subtropical soil[J]. Soil Biology and Biochemistry,2015,90:152-160.
[36]BRIONES M J I, OSTLE N J, PIEARCE T G. Stable isotopes reveal that the calciferous gland of earthworms is a CO2-fixing organ[J]. Soil Biology and Biochemistry,2008,40(2):554-557.
[37]黄福珍. 论蚯蚓对土壤结构形成及性态的影响[J]. 土壤学报,1979,16(3):211-217.
[38]程思远,李 欢,梅慧玲,等. 接种蚯蚓与添加有机物料对茶园土壤结构的影响[J]. 土壤学报,2021,58(1):259-268.
[39]BOSSUYT H, SIX J, HENDRIX P F. Protection of soil carbon by microaggregates within earthworm casts[J]. Soil Biology and Biochemistry,2005,37(2):251-258.
[40]王 笑,王 帅,滕明姣,等. 两种代表性蚯蚓对设施菜地土壤微生物群落结构及理化性质的影响[J]. 生态学报,2017,37(15):5146-5156.
[41]崔莹莹,吴家龙,张 池,等. 不同生态类型蚯蚓对赤红壤和红壤团聚体分布和稳定性的影响[J]. 华南农业大学学报,2020,41(1):83-90.
[42]JIANG Y B, WANG J, MUHAMMAD S, et al. How do earthworms affect decomposition of residues with different quality apart from fragmentation and incorporation?[J]. Geoderma,2018,326:68-75.
[43]罗天相,李辉信,王 同,等. 线虫和蚯蚓对土壤微量气体排放的影响[J]. 生态学报,2008,28(3):993-999.
[44]卢明珠,吕宪国,管 强,等. 蚯蚓对土壤温室气体排放的影响及机制研究进展[J]. 土壤学报,2015,52(6):1209-1225.
[45]LIU Z G, ZOU X M. Exotic earthworms accelerate plant litter decomposition in a Puerto Rican pasture and a wet forest[J]. Ecological Applications,2002,12(5):1406-1417.
[46]POTTHOFF M, JOERGENSEN R, WOLTERS V. Short-term effects of earthworm activity and straw amendment on the microbial C and N turnover in a remoistened arable soil after summer drought[J]. Soil Biology and Biochemistry,2001,33(4/5):583-591.
[47]DRAKE H L, HORN M A. Earthworms as a transient heaven for terrestrial denitrifying microbes:a review[J]. Engineering in Life Sciences,2006,6(3):261-265.
[48]ELLIOTT P W, KNIGHT D, ANDERSON J M. Variables controlling denitrification from earthworm casts and soil in permanent pastures[J]. Biology and Fertility of Soils,1991,11(1):24-29.
[49]LUBBERS I M, PULLEMAN M M, VAN GROENIGEN J W. Can earthworms simultaneously enhance decomposition and stabilization of plant residue carbon?[J]. Soil Biology and Biochemistry,2017,105:12-24.
[50]KUIPER I, DE DEYN G B, THAKUR M P, et al. Soil invertebrate fauna affect N2O emissions from soil[J]. Global Change Biology,2013,19(9):2814-2825.
[51]陈 帅,刘峙嵘,曾 凯. 腐秆剂对水稻秸秆腐解性能的影响[J]. 环境工程学报,2016,10(2):839-844.
[52]杨欣润,许 邶,何治逢,等. 整合分析中国农田腐秆剂施用对秸秆腐解和作物产量的影响[J]. 中国农业科学,2020,53(7):1359-1367.
[53]PIETRI J A, BROOKES P. Relationships between soil pH and microbial properties in a UK arable soil[J]. Soil Biology and Biochemistry,2008,40(7):1856-1861.
[54]ROUSK J, BAATH E, BROOKES P, et al. Soil bacterial and fungal communities across a pH gradient in arable soil[J]. The ISME Journal,2010,4:1340-1351.
[55]XIONG W, GUO S, JOUSSET A, et al. Bio-fertilizer application induces soil suppressiveness against Fusarium wilt disease by reshaping the soil microbiome[J]. Soil Biology and Biochemistry,2017,114:238-247.
[56]WISEMAN C L S, PTTMANN W. Interactions between mineral phases in the preservation of soil organic matter[J]. Geoderma,2006,134(1/2):109-118.
[57]VOGELSANG V, KAISER K, WAGNER F E, et al. Transformation of clay-sized minerals in soils exposed to prolonged regular alternation of redox conditions[J]. Geoderma,2016,278:40-48.
[58]WINKLER P, KAISER K, THOMPSON A, et al. Contrasting evolution of iron phase composition in soils exposed to redox fluctuations[J]. Geochimica et Cosmochimica Acta,2018,235:89-102.
(责任编辑:陈海霞)

