黄腐酸对Ca(NO3)2胁迫下菜薹幼苗生长及生理生化特性的影响
收稿日期:2023-10-24
基金项目:宁夏回族自治区重点研发计划项目(2021BBF02006);国家重点研发计划项目(2021YFD1600300)
作者简介:徐 垒(2000-),男,山东菏泽人,硕士研究生,研究方向为蔬菜栽培学。(E-mail)m19853568090@163.com
通讯作者:叶 林,(E-mail)yelin.3993@163.com;曹 凯,(E-mail)kcao@jaas.ac.cn
摘要: 土壤次生盐渍化会严重影响菜薹的产量及品质,黄腐酸作为一种全水溶性的有机物质,对缓解植物盐胁迫具有积极作用。本研究以金秋红二号红菜薹为试验材料,探究在Ca(NO3)2胁迫下外源施用黄腐酸对菜薹幼苗生长发育和生理生化指标的影响。结果表明,与15 mmol/L Ca(NO3)2(CK)相比,80 mmol/L Ca(NO3)2处理显著抑制了菜薹的生长,而与80 mmol/L Ca(NO3)2处理相比,80 mmol/L Ca(NO3)2+100 μmol/L黄腐酸处理可以显著缓解Ca(NO3)2对菜薹的抑制作用,促进菜薹幼苗的生长,增加菜薹幼苗的净光合速率及气孔导度。同时与80 mmol/L Ca(NO3)2处理相比,80 mmol/L Ca(NO3)2+100 μmol/L黄腐酸处理可以显著降低菜薹幼苗叶片相对电导率和丙二醛含量,减少O2·-、H2O2的积累,增强抗氧化酶(超氧化物歧化酶、过氧化氢酶、抗坏血酸酶)活性。上述结果表明,外源施用黄腐酸可以通过提高菜薹的光合和抗氧化能力来缓解Ca(NO3)2胁迫,本研究结果可为黄腐酸在缓解蔬菜盐胁迫中的应用提供理论依据。
关键词: 菜薹;黄腐酸;Ca(NO3)2胁迫;光合特性;抗氧化
中图分类号: TQ441.23 文献标识码: A 文章编号: 1000-4440(2024)08-1371-08
Effect of fulvic acid on the growth and physiological and biochemical characteristics of Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee. under Ca(NO3)2 stress
XU Lei1, ZHANG Ying1,2, LUO Yuan1, GAO Fucheng1, WU Xue2, CAO Kai2, YE Lin1
(1.College of Enology and Horticulture, Ningxia University, Yinchuan 750021, China;2.Institute of Agricultural Facilities and Equipment, Jiangsu Academy of Agricultural Sciences/Key Laboratory of Protected Agricultural Engineering in the Middle and Lower Reaches of Yangtze River, Ministry of Agriculture and Rural Affairs, Nanjing 210014, China)
Abstract: The yield and quality of Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee. can be seriously affected by soil secondary salinization. As a full water-soluble organic substance, fulvic acid (FA) played an active role in relieving salt stress in plants. The effects of fulvic acid (FA) on the growth and physiological and biochemical indexes of B. campestris L. seedlings under Ca(NO3)2 stress were studied, using Jinqiuhong No.2 as the test material. The results showed that compared with 15 mmol/L Ca(NO3)2 (CK), 80 mmol/L Ca(NO3)2 treatment significantly inhibited the growth of B. campestris L., while compared with 80 mmol/L Ca(NO3)2 treatment, 80 mmol/L Ca(NO3)2 + 100 μmol/L fulvic acid treatment could significantly alleviate the inhibitory effect of Ca(NO3)2 on B. campestris L., promote the growth of B. campestris L. seedlings, and increase the net photosynthetic rate and stomatal conductance. At the same time, compared with 80 mmol/L Ca(NO3)2 treatment, 80 mmol/L Ca(NO3)2+ 100 μmol/L fulvic acid treatment could significantly reduce the relative electrical conductivity and malondialdehyde content in leaves of B. campestris L. seedlings, reduce the accumulation of O·-2 and H2O2, and enhance the activities of antioxidant enzymes (superoxide dismutase, catalase, ascorbate peroxidase). The results indicated that exogenous application of fulvic acid could alleviate Ca(NO3)2 stress by improving photosynthetic and antioxidant ability of B. campestris L.. The results of the study can provide a theoretical basis for the application of fulvic acid in relieving salt stress of vegetables.
Key words: Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee.;fulvic acid;Ca(NO3)2 stress;photosynthetic characteristics;antioxidant
菜薹(Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee.)是一二年生十字花科芸薹属蔬菜,在中国被广泛种植[1]。宁夏位于中国西北内陆地区,具有光照时间长、干旱少雨、昼夜温差大等气候特点,当地独特的气候条件为供港蔬菜生产提供了得天独厚的优势,该地区生产的蔬菜颜色翠绿、口感好、营养价值高,因此供港蔬菜产业发展迅速。截至2020年,供港蔬菜种植总面积已达到1.71×104 hm2,其中供港菜薹的种植面积占67.2%,成为了当地蔬菜产业的亮点[2-3]。由于宁夏地区气候干旱且降水稀少,农业生产用水主要依赖黄河水,而黄河灌溉水并无水平排泄通道,承压水和蒸发作用使下部盐分在地表逐渐累积,进而引发土壤盐渍化现象[4-5]。氮对提高光合效率有着重要的意义[6-7],合理施用氮肥、保证植物氮素的供应是提高农作物产量和品质的关键措施[8]。过量的氮肥会导致植物对其他营养元素如磷、钾等吸收受阻,从而使植物的养分利用效率降低[9]。此外,硝态氮的累积还会引起离子毒害问题,不仅会使作物的产量和品质降低,还会对土壤微生物群落造成破坏,进一步加剧土壤退化[10-11]。
在菜薹大规模种植的过程中,硝酸盐的积聚是导致土壤出现次生盐渍化的关键因素之一,已有研究结果表明,硝酸盐的来源主要为Ca(NO3)2,因此本试验选取Ca(NO3)2作为盐胁迫因子[9,12]。过量的Ca(NO3)2会导致番茄[13]、黄瓜[14]、甜瓜[15]净光合速率降低,生物量减少。Ca(NO3)2胁迫会使菜薹种子发芽率降低,抑制幼苗生长[16],使幼苗产生过氧化物等有毒物质,提高过氧化酶活性[17]。蔬菜是人类膳食的重要组成部分,人体所需的硝酸盐主要来源于蔬菜[18],然而蔬菜中过量的硝酸盐会在特定条件下会转化为致癌物质,对人类的健康造成威胁[19-20]。因此,降低蔬菜中的硝酸盐含量对于保障人类健康和叶菜类农产品的安全生产都具有重要意义。有研究发现,施用外源化学物质、有机肥配施减量化肥、施用微生物菌剂等方法可以有效缓解番茄[13]、油菜[21]、菜薹[17,22]、辣椒[23]、黄瓜[24]等作物受到的Ca(NO3)2胁迫。然而,这些方法在实际应用中可能引入化学残留物,对环境和人体健康造成潜在风险。且这些方法效率并不高,需要长时间才能看到明显的效果,还会抑制蔬菜根系的生长,从而影响蔬菜的品质和产量等[22,25]。目前需要更环保、高效的硝酸盐控制方法。
有研究结果表明,黄腐酸(Fulvic acid)对促进植物生长发育和改善土壤环境有着重要作用[26],不仅能够使作物增产、提高作物品质,还能提高肥料的利用效率,改善土壤的理化性质[27-28]。黄腐酸与氮、磷、钾肥配施显著改善了土壤结构,提高了地力和肥料利用率[29-30]。黄腐酸的施用还可增加作物生物量,缓解植物生理干旱,提高光合速率以及抗氧化酶基因表达水平[31-33]。目前,关于黄腐酸缓解土壤次生盐渍化的研究较少,因此本研究以金秋红二号菜薹为试验材料,探究外源施用黄腐酸对Ca(NO3)2胁迫下菜薹生长及生理指标的影响,并进一步分析外源施用黄腐酸缓解Ca(NO3)2胁迫的作用机理,以期为黄腐酸在缓解蔬菜盐胁迫中的应用提供理论依据。
1 材料与方法
1.1 试验设计
本试验于2022年在江苏农业科学院农业设施与装备研究所植物与环境互作实验室内进行。光照时间12 h/d,光照强度300 μmol/(m2·s),温度(25±2) ℃;黑暗时间12 h/d,温度(25±2) ℃。供试材料为金秋红二号红菜薹。把菜薹种子杀菌消毒后置于去离子水中浸泡中5 h,放在黑暗环境中。待种子露白后将其移植至800 mL黑色水培盒中,并加入500 mL 1/4霍格兰氏培养液。当菜薹生长至2张真叶时,将其移植至1 200 mL黑色水培盒中,并加入800 mL 1/4霍格兰氏培养液,将溶液pH调为6.5,2 d更换1次培养液。当菜薹幼苗长至两叶一心时,在培养液中分别添加15 mmol/L Ca(NO3)2(CK)、15 mmol/LCa(NO3)2+100 μmol/L黄腐酸(T1)、80 mmol/L Ca(NO3) 2(T2)、80 mmol/L Ca(NO3)2+100 μmol/L黄腐酸(T3)。
1.2 测定指标及测定方法
处理5 d后,随机挑选5株幼苗测定相关指标,各项指标重复测定5次。用直尺测得根长和株高,计算平均值。将整株菜薹幼苗分为地上部和地下部,使用天平称量鲜重,并计算平均值。将其放入150 ℃烘箱杀青20 min,在85 ℃烘箱内进行烘干,直到重量恒定,使用天平称量其干重(0.000 1 g)。
处理5 d后,用光合仪(型号Li-6800)测定菜薹叶片的蒸腾速率、净光合速率、胞间CO2浓度和气孔导度。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及抗坏血酸过氧化物酶(APX)的活性分别通过氮蓝四唑法、愈创木酚法、紫外分光光度法与试剂盒法进行测定,相对电导率(RC)、丙二醛(MDA)含量、过氧化氢(H2O2)含量及超氧阴离子(O2·-)产生速率分别通过电导仪法、硫代巴比妥酸显色法、四氯化钛沉淀法与羟胺氧化法进行测定[34]。参照Wu等[35]的二氨基联苯胺(DBA)染色法和氮蓝四唑(NBT)染色法对菜薹叶片进行染色。
1.3 数据处理与分析
利用Microsoft Excel 2021整理数据,利用Origin 2022软件进行绘图。利用IBM SPSS Statistics 26软件进行方差分析(ANOVA)和最小显著性差异分析(LSD)。
2 结果与分析
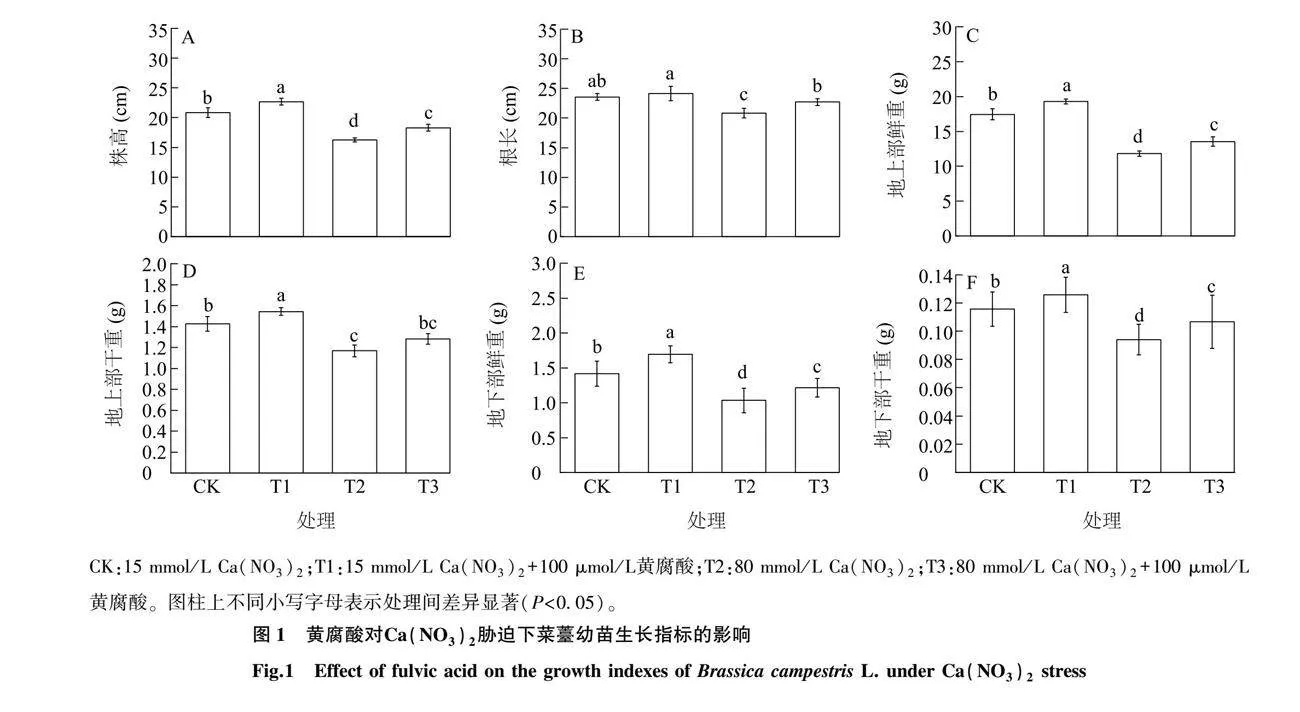
2.1 黄腐酸对Ca(NO3)2胁迫下菜薹幼苗生长的影响
如图1所示,与对照相比,T1处理菜薹幼苗株高显著提高(P<0.05),T2处理和T3处理菜薹幼苗株高显著降低(P<0.05),说明Ca(NO3)2显著抑制了菜薹幼苗的生长。与对照相比,T2处理菜薹幼苗地上部鲜重、干重分别显著降低了32%、18%(P<0.05),地下部鲜重、干重分别显著降低了27.0%、18.7%(P<0.05),株高、根长分别显著降低了22.0%、11.6%(P<0.05)。与T2处理相比,T3处理地上部鲜重显著提高了14.6%(P<0.05),地下部干重、鲜重分别显著提高了13.5%、17.5%(P<0.05),株高、根长分别显著提高了12.5%、9.0%(P<0.05)。结果表明,外源添加黄腐酸减轻了Ca(NO3)2对菜薹生长的抑制。
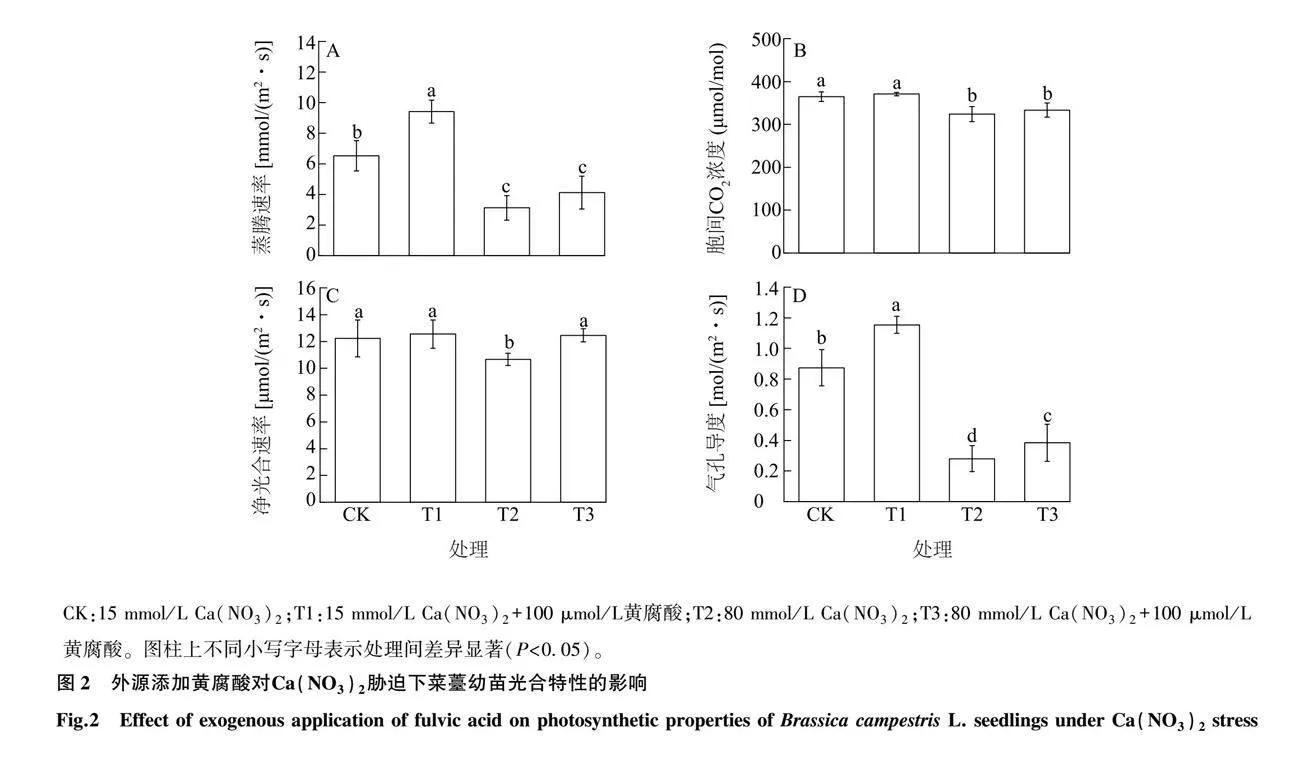
2.2 黄腐酸对Ca(NO3)2胁迫下菜薹幼苗光合特性的影响
由图2可知,与对照相比,T1处理菜薹幼苗叶片的蒸腾速率和气孔导度分别显著增加了44.26%和32.18%(P<0.05),T1处理胞间CO2浓度和净光合速率与对照相比无显著性差异(P>0.05),表明添加黄腐酸可以促进菜薹幼苗的光合作用。与对照相比,T2处理菜薹幼苗叶片的蒸腾速率、净光合速率、胞间CO2浓度和气孔导度分别显著降低了52.22%、11.17%、12.30%和67.82%(P<0.05),说明Ca(NO3)2胁迫使菜薹幼苗的光合速率显著降低。与T2处理相比,T3处理菜薹幼苗叶片的净光合速率和气孔导度分别显著提高了29%、36%,T3处理菜薹幼苗叶片的蒸腾速率和胞间CO2浓度与T2处理无显著差异。结果表明,黄腐酸可以在一定程度上缓解硝酸钙对菜薹幼苗叶片光合作用的抑制。
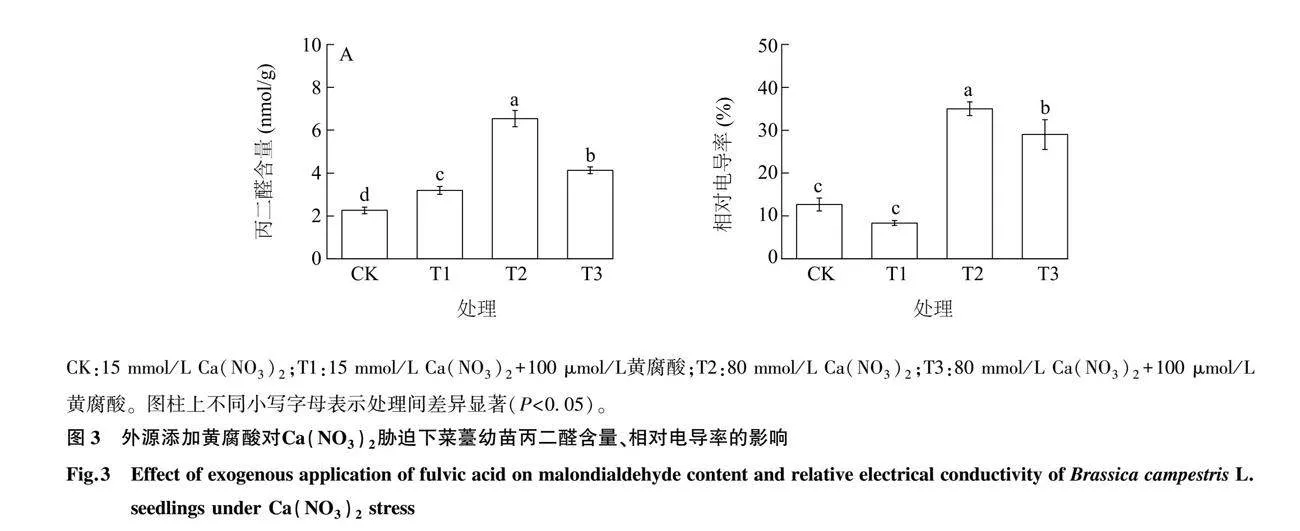
2.3 黄腐酸对Ca(NO3)2胁迫下菜薹幼苗丙二醛含量、相对电导率的影响
由图3可知,与对照相比,T2处理菜薹幼苗的丙二醛含量和相对电导率分别显著增加了189.00%和176.24%(P<0.05),说明在Ca(NO3)2胁迫下,菜薹幼苗的细胞膜结构受到了一定程度的损伤,从而引发了膜脂过氧化。与T2处理相比,T3处理菜薹幼苗的丙二醛含量显著降低了36.90%(P<0.05),表明添加黄腐酸可以减轻Ca(NO3)2对菜薹细胞膜结构造成的损伤。与对照相比,T1处理菜薹幼苗的丙二醛含量显著增加了41.60%(P<0.05)。T1处理菜薹幼苗的相对电导率和对照相比无显著差异(P>0.05)。
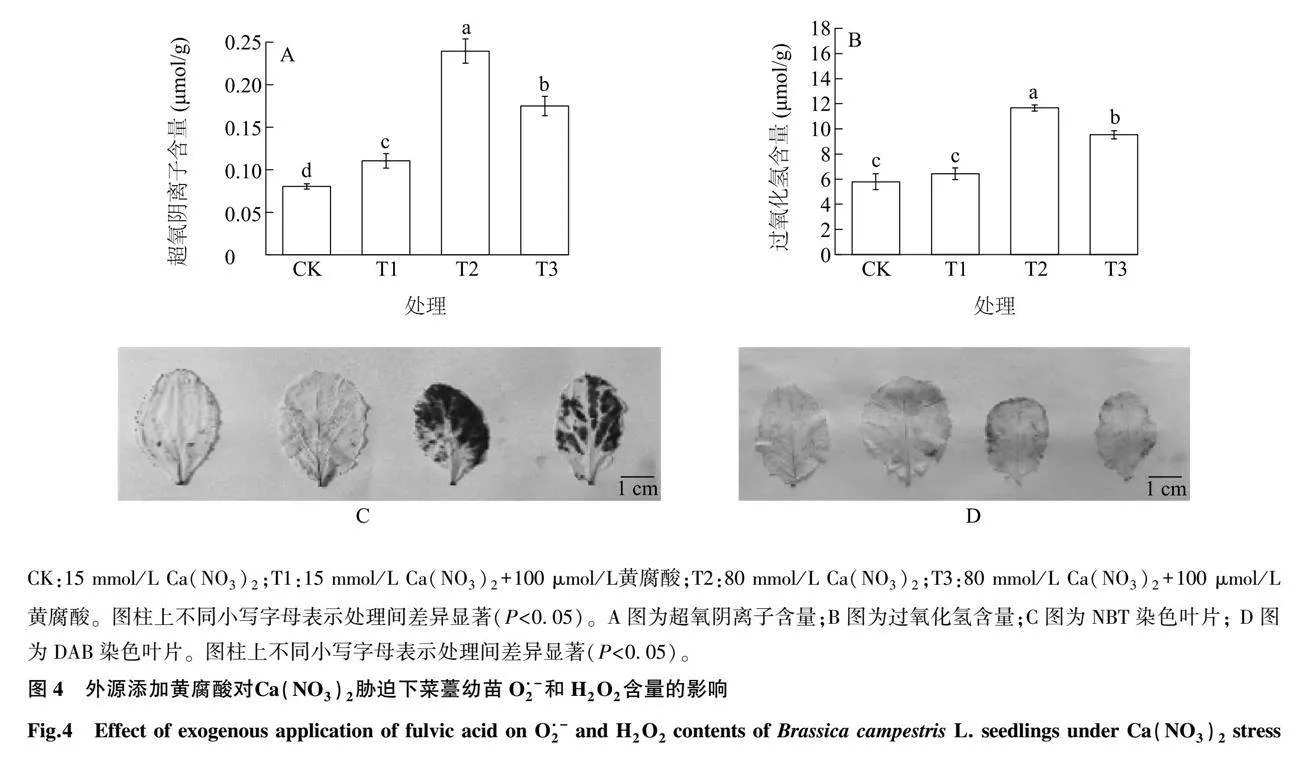
2.4 黄腐酸对Ca(NO3)2胁迫下菜薹幼苗O2·-和H2O2含量的影响
从图4可以看出,在Ca(NO3)2胁迫下,菜薹幼苗中O2·-和H2O2含量最高,与对照相比,分别增加了200.00%和101.21%。而在Ca(NO3)2胁迫情况下,添加黄腐酸会降低菜薹中O2·-和H2O2的含量:与T2处理相比,添加黄腐酸的T3处理菜薹中O2·-和H2O2的含量分别显著降低了25.00%和18.34%(P<0.05)。在NBT染色结果中,Ca(NO3)2+黄腐酸处理的染色程度要比硝酸钙胁迫处理浅;且在DAB染色结果中,Ca(NO3)2+黄腐酸处理染色程度也要比单独Ca(NO3)2胁迫处理浅。以上研究结果表明,在Ca(NO3)2胁迫下,添加黄腐酸可以减少菜薹幼苗O2·-和H2O2含量,减轻过氧化物对菜薹的损伤。
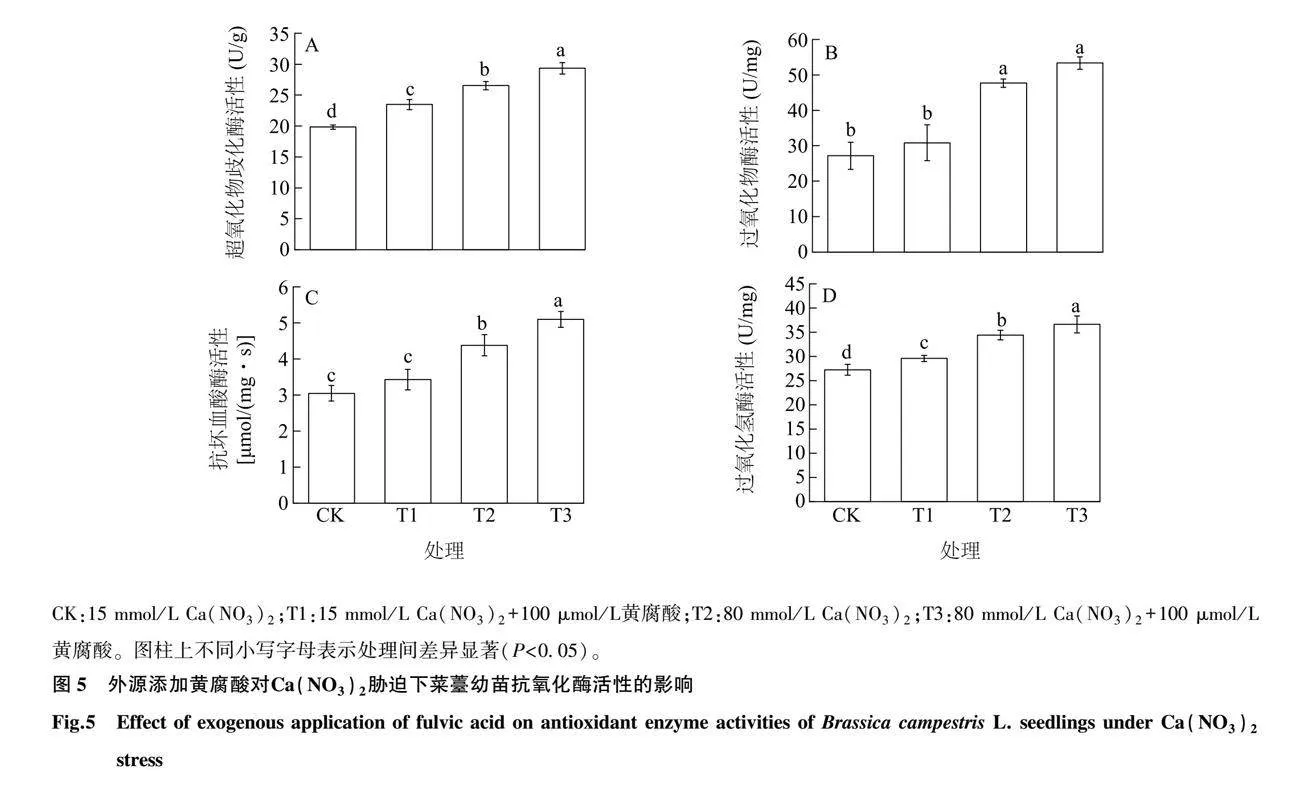
2.5 黄腐酸对Ca(NO3)2胁迫下菜薹幼苗抗氧化酶活性的影响
如图5所示,与对照相比,T1处理菜薹幼苗的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性分别显著增加了18.52%、8.63%(P<0.05)。 在Ca(NO3)2胁迫下,与对照相比,菜薹幼苗的SOD、过氧化物酶(POD)、CAT和抗坏血酸酶(APX)活性显著增加(P<0.05),可能是因为在逆境下菜薹幼苗中过氧化物增多,通过增强抗氧化酶的活性减轻Ca(NO3)2胁迫。在Ca(NO3)2胁迫处理下添加黄腐酸进一步增加了SOD、POD、CAT和APX的活性。与T2处理相比,T3处理SOD、CAT和APX的活性分别显著增加了10.55%、6.39%和16.21%(P<0.05)。表明在Ca(NO3)2胁迫下,添加黄腐酸有助于提高菜薹的抗氧化酶活性,从而缓解Ca(NO3)2胁迫。
3 讨论
Ca(NO3)2胁迫会在植物生长发育过程中产生巨大的影响[16]。大量的Ca(NO3)2会显著抑制作物的生长发育,使其产量降低[13,17,24]。本研究发现,在Ca(NO3)2胁迫下,菜薹幼苗的生长发育受到抑制,前人也有相似研究结果,Ca(NO3)2胁迫会严重抑制菜薹的生长。有研究结果表明,黄腐酸能增加草莓地上鲜重[36],黄腐酸可将镉胁迫下的莴苣净光合速率显著提高29.2%[32]。本研究发现,在Ca(NO3)2胁迫下,外源添加黄腐酸可以促进菜薹幼苗的生长发育,可能是因为黄腐酸通过上调抗氧化酶基因表达量[33],从而提升植物中各种抗氧化物酶的活性,增加叶绿素含量,进而促进新陈代谢与光合作用,提高作物对抗逆境的能力,提高作物产量与品质[37-38]。盐胁迫会使植物的吸水能力降低、叶片气孔导度减小、CO2同化能力减弱[39],而添加黄腐酸可以显著提高作物的净光合速率[40]。
在Ca(NO3)2胁迫下,不饱和脂肪酸会被氧化成MDA(丙二醛),MDA的积累会严重破坏细胞膜的结构,增加膜的透性,导致大量的电解质从细胞内泄漏出来,使植物相对电导率提高[41]。MDA含量和质膜相对透性则可以被用作衡量细胞受损程度的重要指标。在Ca(NO3)2胁迫下,菜薹幼苗的细胞膜遭受了严重的氧化损伤,MDA含量大幅度增加,同时其相对电导率也有所上升,说明在Ca(NO3)2胁迫下,菜薹幼苗发生了氧化应激反应。高云晓等[31]发现,添加外源黄腐酸可以显著减少MDA含量,使相对电导率降低,该结论与本试验结果相同。可能是因为黄腐酸能够清除细胞内的活性氧自由基,并且通过调节细胞内的信号转导通路影响细胞的代谢和生理功能,从而进一步降低MDA含量和相对电导率。
在Ca(NO3)2胁迫下,植物的光合作用受到严重抑制,导致大量活性氧(ROS)产生。ROS包括超氧阴离子自由基(O2·-)和过氧化氢(H2O2)等,它们的过度积累会导致脂质过氧化程度增加,进一步对细胞膜造成伤害[41]。本研究发现,在Ca(NO3)2胁迫下,施用黄腐酸可以增强菜薹幼苗的抗氧化酶活性,降低叶片中O2·-和H2O2含量,减少硝酸盐对菜薹幼苗造成的伤害。抗氧化酶通过降低超氧阴离子自由基以及由此产生的活性氧含量,减少对细胞膜的破坏[34,41],可能是因为黄腐酸具有清除活性氧的功能,同时可以诱导抗氧化酶SOD和POD基因表达,从而提高植物的耐盐性。
4 结论
综上所述,外源添加100 μmol/L黄腐酸可以明显减轻Ca(NO3)2对菜薹幼苗生长发育的抑制,其主要作用机理是黄腐酸可以提高菜薹幼苗的光合作用效率,减轻细胞膜的损伤,增加过氧化物含量并提高抗氧化酶活性。本研究探索了黄腐酸缓解菜薹受到硝酸盐胁迫的机制,为农业生产中的黄腐酸应用提供了依据。
参考文献:
[1] 肖柳英. WRKY转录因子在低温调控菜心抽薹开花中的功能研究[D]. 广州:华南农业大学,2018.
[2] 蒋学勤,温学萍,徐苏萌,等. 宁夏供港蔬菜发展现状与对策[J]. 中国蔬菜,2021(7):1-4.
[3] 赵鹏志. 水肥耦合对贺兰县供港蔬菜光合、品质及产量的影响[D]. 银川:宁夏大学,2020.
[4] 王葆芳,杨晓晖,江泽平. 引黄灌区水资源利用与土壤盐渍化防治[J]. 干旱区研究,2004,21(2):139-143.
[5] 缑倩倩,韩致文,王国华. 中国西北干旱区灌区土壤盐渍化问题研究进展[J]. 中国农学通报,2011,27(29):246-250.
[6] 辛正琦,代欢欢,辛余凤,等. 盐胁迫下外源2,4-表油菜素内酯对颠茄氮代谢及TAs代谢的影响[J]. 作物学报,2021,47(10):2001-2011.
[7] QU F, PENG T L, JIA Y J, et al. Adjusting leaf nitrogen allocation could promote photosynthetic capacity,and nitrogen accumulation in Cucumis sativus L.[J]. Environmental and Experimental Botany,2022,198:104855.
[8] XLAB C, AUB D, SSB E, et al. Responses of carbohydrate metabolism enzymes in leaf and spike to CO2 elevation and nitrogen fertilization and their relations to grain yield in wheat[J]. Environmental and Experimental Botany,2019,164:149-156.
[9] 杜应琼,王富华,李乃坚,等. 广东省蔬菜硝酸盐含量的调查与分析[J]. 生态环境,2004(1):19-22.
[10]巨晓棠,张 翀. 论合理施氮的原则和指标[J]. 土壤学报,2021,58(1):1-13.
[11]ZHANG H Y, ZHANG C R, SUN P, et al. Optimizing planting density and nitrogen application to enhance profit and nitrogen use of summer maize in Huanghuaihai region of China[J]. Scientific Reports,2022,12(1):2704-2704.
[12]李永胜,杜建军,王 浩,等. 氮磷钾配施对菜心生长及土壤养分状况的影响[J]. 广东农业科学,2011,38(2):53-56.
[13]ZHANG Y, YAO Q, SHI Y, et al. Elevated CO2 improves antioxidant capacity,ion homeostasis,and polyamine metabolism in tomato seedlings under Ca(NO3)2-induced salt stress[J]. Scientia Horticulturae,2020,273:109644.
[14]YANG Y, LU Z Y, LI J, et al. Effects of Ca(NO3)2 stress on mitochondria and nitrogen metabolism in roots of cucumber seedlings[J]. Agronomy-Basel,2020,10(2). DOI:10.3390/agronomy10020167.
[15]HU X, XU Z, XU W, et al. Application of γ-aminobutyric acid demonstrates a protective role of polyamine and GABA metabolism in muskmelon seedlings under Ca(NO3)2 stress[J]. Plant Physiology & Biochemistry,2015,92:1-10.
[16]孙彤彤,武春成,宋士清. 外源水杨酸(SA)、油菜素内酯(BR)浸种对Ca(NO3)2胁迫下黄瓜幼苗光合特性及叶片解剖结构的影响[J]. 江苏农业学报,2019,35(5):1184-1190.
[17]WEN X, CHEN J, CHEN H, et al. Hydrogen-rich water ameliorates the toxicity induced by Ca(NO3)2 excess through enhancing antioxidant capacities and re-establishing nitrate homeostasis in Brassica campestris spp. chinensis L. seedlings[J]. Acta Physiologiae Plantarum,2021,43:1-12.
[18]CORRE W J, BREIMER T. Nitrate and nitrite in vegetables[M]. Wageningen:Centre for Agricultural Publishing and Documentation,1979.
[19]陈云增,李天奇,马建华,等. 沙颍河流域典型癌病高发区居民硝酸盐和亚硝酸盐暴露及健康风险[J]. 环境科学学报,2018,38(1):363-371.
[20]BAHADORAN Z, MIRMIRAN P, GHASEMI A,et al. Is dietary nitrate/nitrite exposure a risk factor for development of thyroid abnormality? A systematic review and meta-analysis[J]. Nitric Oxide,2015,47:65-76.
[21]高纪超,石元亮,魏占波,等. 腐殖酸与硝化抑制剂配施对油菜生长及品质的影响[J]. 中国土壤与肥料,2021(4):218-223.
[22]马 垚. 钼肥配施菌剂对小白菜生长及土壤硝酸盐含量的影响[D]. 扬州:扬州大学,2022.
[23]余 高,陈 芬,谢英荷,等. 化肥减施、有机肥配施对辣椒产量及品质的影响[J]. 北方园艺,2020(4):47-53.
[24]DU J, SHU J, SHAO Q S, et al. Mitigative effects of spermidine on photosynthesis and carbon-nitrogen balance of cucumber seedings under Ca(NO3)2 stress[J]. Journal of Plant Research,2016,129:79-91.
[25]王凤华,赵田园,李雨霏,等. 双氰胺对樱桃萝卜硝酸盐积累及根系生长的影响[J]. 中国土壤与肥料,2022,305(9):133-138.
[26]NARDI S, PIZZEGHELLO D, MUSCOLO A, et al. Physiological effects of humic substances on higher plants[J]. Soil Biology & Biochemistry,2002,34(11):1536.
[27]郭新送,苏秀荣,范仲卿,等. 盐分胁迫下控释尿素配施腐植酸对棉花幼苗生长和抗氧化系统的影响[J]. 土壤,2021,53(1):112-117.
[28]薄录吉,李 冰,李 彦,等. 腐植酸尿素在农业生产和面源污染防控中的研究与应用[J]. 中国土壤与肥料,2020(4):240-251.
[29]朱会调,高登涛,白 茹,等. 黄腐酸对土壤养分、葡萄品质和产量的影响[J]. 新疆农业科学,2021,58(4):672-681.
[30]袁子琪,韩 哲,陈登论,等. 黄腐酸复合肥对土壤养分及小麦生长的影响[J]. 腐植酸,2020(6):38-43.
[31]高云晓,庞元湘,毛培利,等. 黄腐酸有机肥对盐胁迫下刺槐幼苗生长的影响[J]. 西南林业大学学报(自然科学),2019,39(2):36-43.
[32]WANG Y M, YANG R I, ZHENG J Y, et al. Exogenous foliar application of fulvic acid alleviate cadmium toxicity in lettuce (Lactuca sativa L.)[J]. Ecotoxicology and Environmental Safety,2019,167:10-19.
[33]庞强强,孙光闻,蔡兴来,等. 硝酸盐胁迫下黄腐酸对小白菜活性氧代谢及相关基因表达的影响[J]. 分子植物育种,2018,16(17):5812-5820.
[34]束秀玉. CO2加富对盐胁迫下西瓜幼苗生长及生理生化特性的影响[J]. 河南农业科学,2020,49(12):107-114.
[35]WU X, WU C N, BIAN Z H, et al. Abscisic acid and reactive oxygen species were involved in slightly acidic electrolyzed water-promoted seed germination in watermelon[J]. Scientia Horticulturae,2022,291:110581.
[36]马 欣,宗 静,祝 宁. 黄腐酸叶面肥对草莓育苗效果的影响[J]. 中国果树,2019,196(2):57-59.
[37]KUMAR M. 黄腐酸对三种典型障碍土壤特性和作物生长的改良[D]. 北京:中国农业科学院,2019.
[38]周海涛,张艳阳,赵孟圆,等. S-诱抗素和黄腐酸对干旱胁迫下皮燕麦抗旱生理特性的影响[J]. 农学学报,2020,10(4):7-13.
[39]齐 琪,马书荣,徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展[J]. 分子植物育种,2020,18(8):2741-2746.
[40]林雪婷,高莉娜,宋希亮,等. 生物炭、黄腐酸、黑曲霉对狼尾草苗期生长及光合特性的影响[J]. 中国草地学报,2022,44(6):77-84.
[41]ZHAO C Z, ZHANG H, SONG C P, et al. Mechanisms of plant responses and adaptation to soil salinity[J]. Innovation,2020,1(1):100017.
(责任编辑:成纾寒)

