三株鸡传染性支气管炎病毒优势流行毒株全基因组分析及其致病性









摘 要: 为调查研究禽传染性支气管炎病毒(IBV)的流行及优势毒株致病特性,本研究对实验室分离的IBV毒株进行了遗传演化研究和致病性研究,旨在了解我国当下IBV流行毒株基因型、生物学特性以及为新疫苗的研制提供借鉴参考。首先对56株IBV分离毒株S1全长核苷酸序列进行遗传演化分析,从中挑选了MH20、KC和JS96 3株优势基因型毒株进行全基因组测序分析,然后选取毒力较强的JS96毒株进行了SPF鸡致病性试验。结果表明:遗传演化分析结果显示GI-19是我国主要流行毒株,占比约53.57%,同时变异毒不断涌现,GVI(新基因型)明显的流行增多。3株优势基因型分离毒株的全长基因组与QX-like毒株相似性最高,达到97%以上,但与国内外疫苗株、经典毒株的相似性低,仅为77%左右。抗原表位分析同样表明了分离株与疫苗毒株、经典毒株的B细胞抗原表位数量和序列都存在差异。3株分离毒株均可导致SPF鸡胚矮化和致死,其中JS96对1日龄SPF鸡的致病率高于15日龄SPF鸡,1日龄SPF鸡100%死亡率,15日龄SPF鸡出现生长显著迟缓和个别鸡症状明显,发病鸡剖检均可见“花斑肾”。本研究表明,QX-like基因型IBV毒株是现下IBV的主要流行毒株,对低日龄鸡致病性强,易发生基因重组,与疫苗毒株、经典毒株S蛋白相似性低,适配性较差,急需选择合适疫苗及研发新型疫苗,才能控制当下IBV疫病流行,减少养禽业的损失。
关键词: 禽传染性支气管炎病毒;基因测序;演化与相似性分析;致病性
中图分类号: S852.659.6
文献标志码:A""" 文章编号:0366-6964(2024)05-2109-14
收稿日期:2023-07-13
基金项目:广东省重点领域研发计划项目(2021B0707010009);广东省重点领域研发计划项目(2022B1111040001);肇庆市科技计划项目(2021C001);岭南现代农业科学与技术广东省实验室肇庆分中心自主立项项目(P20211154-0301)
作者简介:熊 挺(1990-),男,江西南昌人,博士,主要从事动物传染病学研究,E-mail:bearvet@163.com
*通信作者:陈瑞爱,主要从事重要畜禽疾病疫苗研制研究,E-mail:chensa727@vip.126.com
Whole Genome Analysis of Three Predominant Epidemic Strains of Chicken Infectious Bronchitis
Virus and Their Pathogenicity
XIONG" Ting1,2, HE" Xianming1, ZHAO" Xiya1, ZHUANG" Tingting1, HUANG" Meizhen1, LIANG" Shijin1, YU" Chuanzhao1, LIANG" Xuejing1, CHEN" Ruiai1,2*
(1.Zhaoqing Branch Center of Guangdong Provincial Laboratory of Modern Agricultural Science
and Technology, Zhaoqing 526238," China;
2.College of Veterinary Medicine,
South China Agricultural University, Guangzhou 510642," China)
Abstract:
The genetic evolution and pathogenicity of isolated infectious bronchitis virus (IBV) strains in the laboratory were studied to investigate the prevalence of IBV and the pathogenic characteristics of dominant strains, and to provide reference for the development of new vaccines.
In this study, the complete S1 nucleotide sequences of 60 strains IBV were analyzed, and three dominant genotypes were selected for whole genome sequencing analysis, named MH20, KC and JS96 strains. JS96 strain with higher virulence was selected for SPF chicken pathogenicity experiment. The results of genetic evolution analysis show that GI-19 is the main epidemic strain in China, accounting for about 53.57% of cases. At the same time, variants were emerging, and GVI (new genotype) was obviously prevalent. The whole genome sequencing showed that the complete genome of the three isolated strains had the highest similarity with QX-like strains (more than 97%), but the sequence homology with vaccine strains and classical strains was low, only about 77%. Epitope analysis also showed that there were differences in the number and sequence of B cell epitopes among the isolates, vaccine strains and classical strains. The pathogenicity of JS96 in 1-day-old SPF chickens was higher than that in 15-day-old SPF chickens, and the mortality rate of 1-day-old SPF chickens was 100%. Significant growth retardation and obvious symptoms were observed in some 15-day-old SPF chickens. This study shows that QX-like IBV strain is the main epidemic strain of IBV at present, which has strong pathogenicity to young chickens, is prone to I gene recombination, has low similarity with S protein of vaccine strain and classical strain, and has poor adaptability, so it is urgent to select appropriate vaccines and develop new vaccines in order to control the current epidemic of IBV and reduce losses in the poultry industry.
Key words: avian infectious bronchitis virus; sequencing; evolution and homology analysis; pathogenicity
*Corresponding author:" CHEN Ruiai, E-mail: chensa727@vip.126.com
禽传染性支气管炎病毒(infectious bronchitis virus,IBV)属于γ-冠状病毒,是一种鸡的高度传染性病毒,主要损害呼吸系统、泌尿生殖系统和消化系统,可造成雏鸡死亡以及饲料报酬率降低,蛋鸡产蛋量、品质下降等,严重危害着鸡养殖业[1]。IB可分为呼吸型、肾型、生殖型、肠型和腺胃型[2]。1931年SChalk等首次报道一种新型的鸡呼吸道疾病,该病主要侵害雏鸡的呼吸道,表现为张口呼吸、咳嗽和气管啰音等[3];随后发现IB的组织嗜性越来越广泛,引起感染鸡其他症状的病例先后被报道。IB可侵害鸡生殖系统,引起卵巢充血、出血,和输卵管永久性损伤,最终导致蛋鸡产蛋量和蛋品质下降[4];1962年,Cumming等发现可引起“花斑肾”肾炎的Holt和Gray毒株;1986年又分离出肠型毒株,可造成肠道损伤[5]。我国在1972年首次报道鸡群中存在IB,于1982年发现肾病变型,1990年代末,我国分离到以鸡腺胃肿大为特征的腺胃型IBV毒株[6-7]。目前,IB已在美洲、亚洲、欧洲等的50多个国家及地区发生和流行。
IBV属于冠状病毒科冠状病毒亚科的Gamma冠状病毒,病毒为有囊膜不分节段单股正链RNA病毒。IBV复制依赖RNA 聚合酶,然而 RNA 聚合酶缺乏校正能力[1]。因此,病毒的这种复制机制使得病毒很容易发生变异或重组。IBV不同毒株间自然重组可以产生新的毒株,进而导致新的基因型或血清型的出现。目前已发现该病毒的血清型有30 种以上,不同的血清型之间交叉保护低或无交叉保护[8]。其中,S1基因的遗传多样性非常高,如GVIII-2与其他基因型核苷酸相似性低至52.7%,S1基因是IBV基因分型的靶基因,其演化和变异可能引起IBV抗原漂移、基因型和血清型变化[9]。
高明燕等[10]统计近年来我国IBV的传播和流行现状,结果表明与疫苗广泛使用相关的IBV基因型主要是Mass型(GI-1)和4/91型(GI-13)。上述两种弱毒活疫苗均出现疫苗再分离的情况[11],频繁参与其他流行毒株的重组,已成为IBV的重要基因供体[12]。但Mass型和4/91型疫苗株又与我国流行的各个基因型毒株演化距离都较远,难以给鸡群提供足够的免疫保护,比如,王露等[13]报道4/91型疫苗不能抵抗QX型和LDT3型野毒株的感染。QX型或LX4型(GI-19)是我国20多年以来最主要的IBV本土优势基因型[10]。QX型IBV毒株没有明显的时间和地理分布倾向,不仅在国内广泛流行,还在日本、韩国、俄罗斯以及欧洲各国传播[9]。牛登云等[14]研究发现,该型在2018—2019年全国12个省份的分离毒株中占比79.85%,而且与参考毒株SZ相比,氨基酸变异已经超过13%。该型毒株毒力较强,主要侵害鸡的肾脏,造成肾组织损伤,尿酸盐沉积,死亡率高[10]。
我国贸易与人员来往频繁,地域环境差异大,养殖方式不同,畜牧业发展水平不一,鸡群免疫压力不一样等因素导致IBV多基因型并存,疫病防控困难,对养禽业危害重大[15]。因此分离鉴定临床流行毒株,对于IBV疫苗毒株的选择与研制具有重要的指导意义。本研究对实验室从养殖场疑似IB病鸡气管和肾中分离到3株IBV代表毒株进行病毒全基因组测序分析和致病性研究,以其为IBV流行病学调查和新疫苗的研制提供借鉴参考。
1 材料与方法
1.1 主要病原与试剂
IBV分离株由实验室分离保存(病毒分离背景见表1),挑选的3株IBV分离株已用加粗标出。SPF鸡胚和SPF鸡购自广东温氏大华农生物药品有限公司。RNA反转录试剂盒(KP118-02)购自天根生物科技有限公司;TaKaRa MiniBEST Universal RNA Extraction Kit和PrimeSTAR GXL DNA Polymerase购自TAKARA公司;DNA Marker和RNase-free水购自北京全式经生物技术有限公司。
1.2 2014—2022年禽传染性支气管炎病毒分离株演化分析
本实验室从2014—2022年间于山东、广东和江苏等地分离的IBV毒株56株IBV,采用靶向IBV S1全长基因核苷酸序列的特异引物IBV-S1F(AAGACTGAACAAAAGACCGACT)和IBV-S1R(CAAAACCTGCCATAACTAACATA)进行PCR扩增S1基因,产物送测序。获得测序结果后,基于S1基因序列对60株IBV毒株进行演化分析。
1.3 3株IBV代表毒株的全基因组测序分析
1.3.1 3株禽传染性支气管炎病毒分离毒株的增殖与鉴定
文献报道,IB与禽流感或/和新城疫混合感染病例也时有发生。因此采用文献报道的引物对本实验室分离保存的3株IBV毒株进行外源病毒检测(表2)。将鉴定后的3株IBV毒株尿囊液用0.22 μm微孔滤膜过滤除菌后,按1∶100的比例加入青霉素。将过滤和抗生素处理的上清以0.2 mL·枚-1剂量接种7日龄SPF鸡胚尿囊腔,置37℃培养箱孵育3 d,每12 h照胚观察一次,弃去24 h内死亡胚,第3天收尿囊液连续传2代。提取第3代次病毒的RNA,并反转录为cDNA,用“1.2”中的IBV特异引物进行PCR鉴定,并将尿囊液于-80℃保存。
1.3.2 3株禽传染性支气管炎病毒分离毒株病毒全基因组测序与分析
用TaKaRa MiniBEST Universal RNA Extraction Kit提取种毒尿囊液总RNA,立即使用RNA反转录试剂盒(KP118-02)反转录成cDNA,干冰冷链送测序上海探普生物科技有限公司进行二代测序。测序结果拼接成病毒全长基因组。并对IBV分离毒株的S、E、M和N四个结构蛋白基因序列进行Blast分析,并采用MegAlign、MEGA7.0、RDP4和BepiPred 1.0 Server生物信息学软件进行相似性分析、演化分析、重组分析以及B细胞线性化抗原表位预测。
1.3.3 3株禽传染性支气管炎病毒分离毒株病毒对鸡胚的致病性
将病毒液用灭菌PBS进行10倍梯度稀释,从10-1~10-8,将稀释后的病毒以0.2 mL·枚-1剂量接种7日龄SPF鸡胚,每个稀释度重复5枚,观察记录鸡胚的死亡数以及病变情况,按Reed-Muench法计算出病毒的EID50。
1.3.4 JS96代表毒株对1日龄和15日龄SPF鸡致病性
以104 EID50的JS96经点眼滴鼻方式接种1日龄SPF鸡4只,1只不攻毒作为对照,观察SPF鸡的发病情况,剖检病鸡并取内脏组织做病理组织切片。将60只15日龄SPF鸡随机分为2组,分别用104 EID50的JS96和PBS滴鼻和肌注结合攻毒。各试验组在攻毒后48、96、120和164 h各随机取1只鸡进行放血处死,剖检观察肾脏病理变化。剩余鸡继续饲养7 d后统计体重差异。
2 结 果
2.1 56株禽传染性支气管炎病毒分离株演化分析
测序获得本实验室2014—2022年分离的56株病毒S1全长基因核苷酸序列。基于病毒S1全长基因核苷酸序列,应用MEGA7软件进行同源演化分析,演化树显示目前我国主要流行毒株包括GI-1、GI-7、GI-13、GI-18、GI-19、GI-22、GI-23、GV1-1和变异毒株。而且,近年来分离的毒株近一半属于QX-like基因型(GI-19病毒谱系)(图1),流行最为广泛,占比达51.67%,GVI-1次之,因此根据演化树位置挑选3株GI-19基因型分离株进一步研究。
2.2 3株GI-19 (QX-like)基因型IBV代表毒株种毒的增殖与鉴定
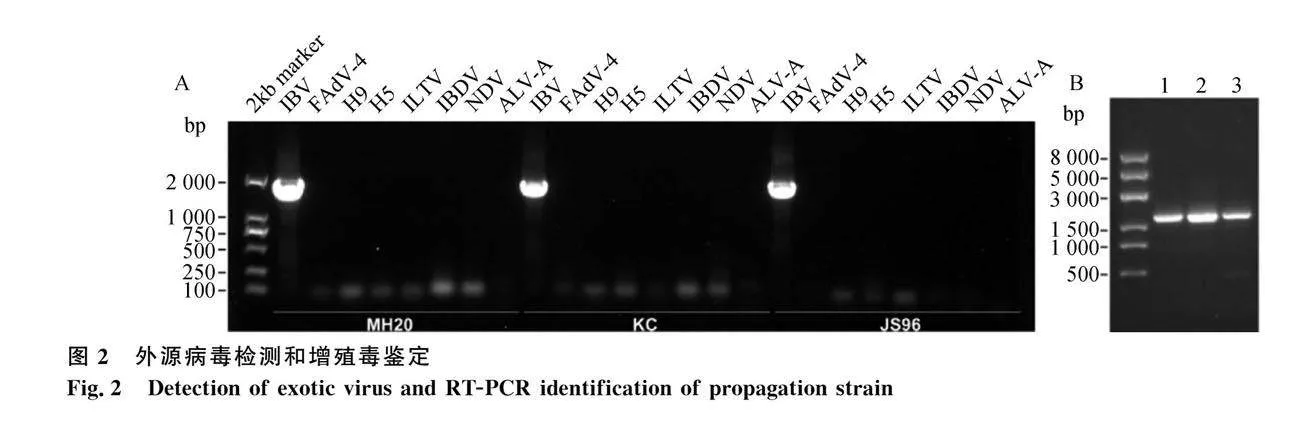
采用表2特异性引物进行外源病毒检测,RT-PCR检测结果显示3株GI-19 (QX-like)基因型IBV代表毒株均只能扩增出IBV的特异性检测条带,FAdV-4、H9AIV、H5AIV、ILTV、IBDV、NDV和ALV-A均不能扩增出目的条带(图2A),因此,可判断实验室分离保存的3株IBV毒株不存在FAdV-4、H9AIV、H5AIV、ILTV、IBDV、NDV和ALV-A污染,3株分离毒株纯净度好。将鸡胚增殖的尿囊液病毒,在使用之前RT-PCR再次鉴定,图2B鉴定结果显示3株毒株增殖的尿囊液均呈阳性(1~3分别为KC、MH20和JS96),说明3株分离毒株增殖成功。
2.3 3株分离毒株全基因组比较分析
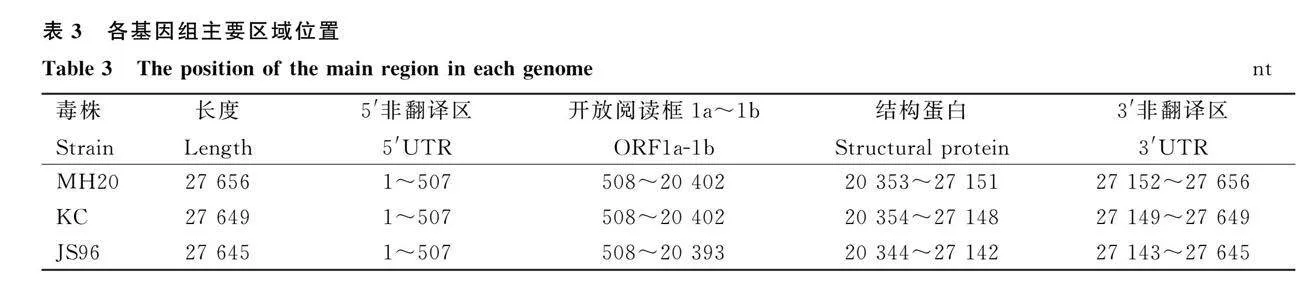
3株分离毒株基因组大小约为27.6 kb,具5′端帽子和3′端PolyA尾结构,其中各种辅助基因分布在5′端1/3区域的非结构基因内(表3),这些辅助基因虽不参与编码结构蛋白,但对于调控病毒复制以及致病机制具有重要作用[18]。MH20、KC和JS96 3株分离毒株结构蛋白基因S、E、M和N分别位于20 353—23 850、24 198—24 524、24 496—25 168和25 917—27 146、20 353—23 850、24 198—24 524、24 496—25 168和25 917—27 146、20 344—23 841、24 189—24 515、24 487—25 164和25 913—27 142 nt。S、E、M和N结构蛋白基因全长分别为3 498、327、678、1 230 nt。
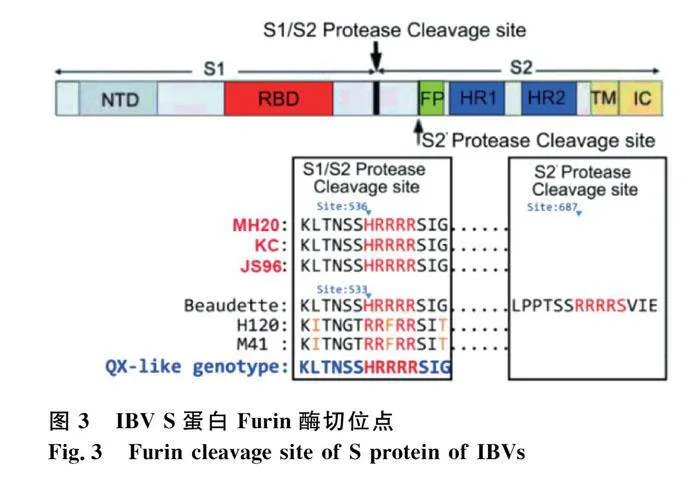
2.4 3株分离毒株Furin酶位点分析
Furin酶切位点对基因型具有一定指征性,对MH20、KC和JS96 3株分离毒株Furin酶切位点进行分析。发现3株IBV在536位氨基酸处具有相同的Furin酶切位点HRRRR,与QX-like基因型毒株具有相似的Furin酶切位点(HRRRR)(图3),初步判断此3株分离毒株很可能是QX-like基因型毒株。缺失第二Furin酶切位点,这可能是该3株毒株缺乏与Beaudette相似的细胞适应性的重要原因之一。
2.5 3株分离毒株相似性分析
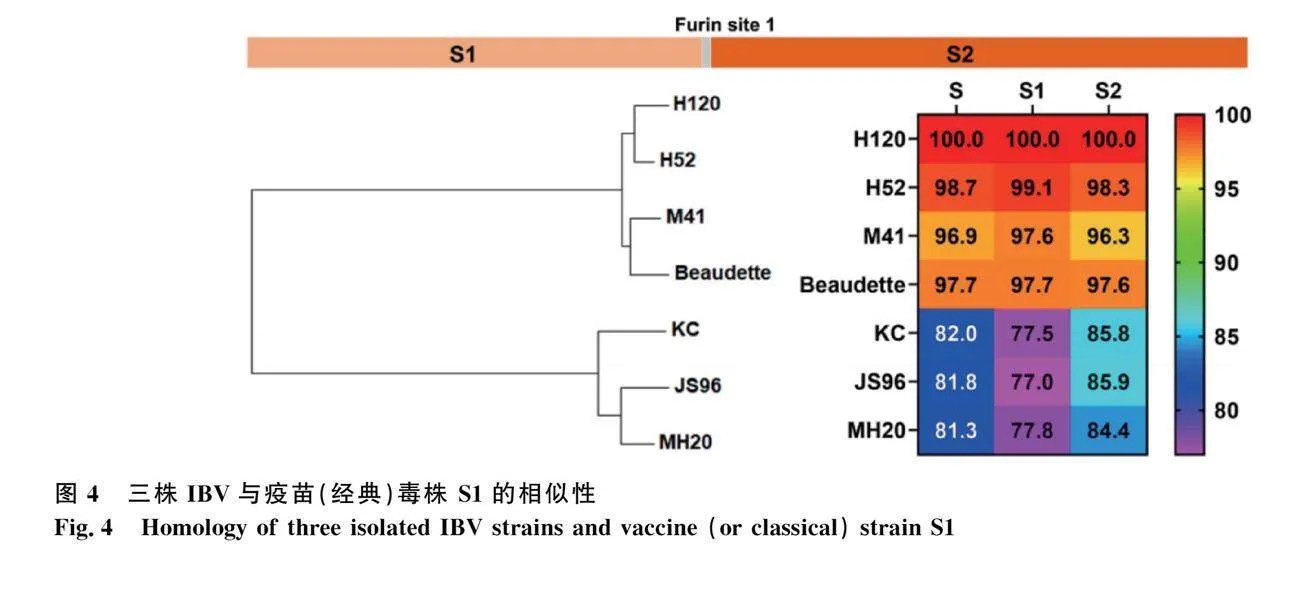
用Snapgene进行病毒全基因组拼接,将3株分离病毒全基因组在NCBI进行blast比较分析核苷"" 酸相似性。结果显示,MH20、KC和JS96毒株分别与NCBI数据库中YX10(JX840411.1)、CK/CH/LLN/131040(KX252787.1)和CK/CH/LJL/140924(KX302873.1)毒株相似性最高,相似性为99.15%、97.09%和97.83%。S蛋白是诱导中和抗体的主要免疫原蛋白,诱导机体产生中和抗体,故对高变区S1基因序列进行分析,3株毒株与QX-like代表毒株(MN548289.1)比较,未发现基因插入和缺失现象,以基因点突变导致的差异为主。而S1相似性进行分析,结果显示,3株毒株之间S1的相似性较高,为95.1%~96.7%,而3株分离毒株与国内外疫苗毒株H120、H52以及ArkDPI的S1的相似性,仅为75.9%~78.1%,与经典毒株M41和Beaudette的相似性也只有77.2%~77.7%(图4)。这说明当下流行的IBV毒株基因型与现有商品化疫苗的适配性较差。
2.6 3株分离毒株抗原B抗原表位分析
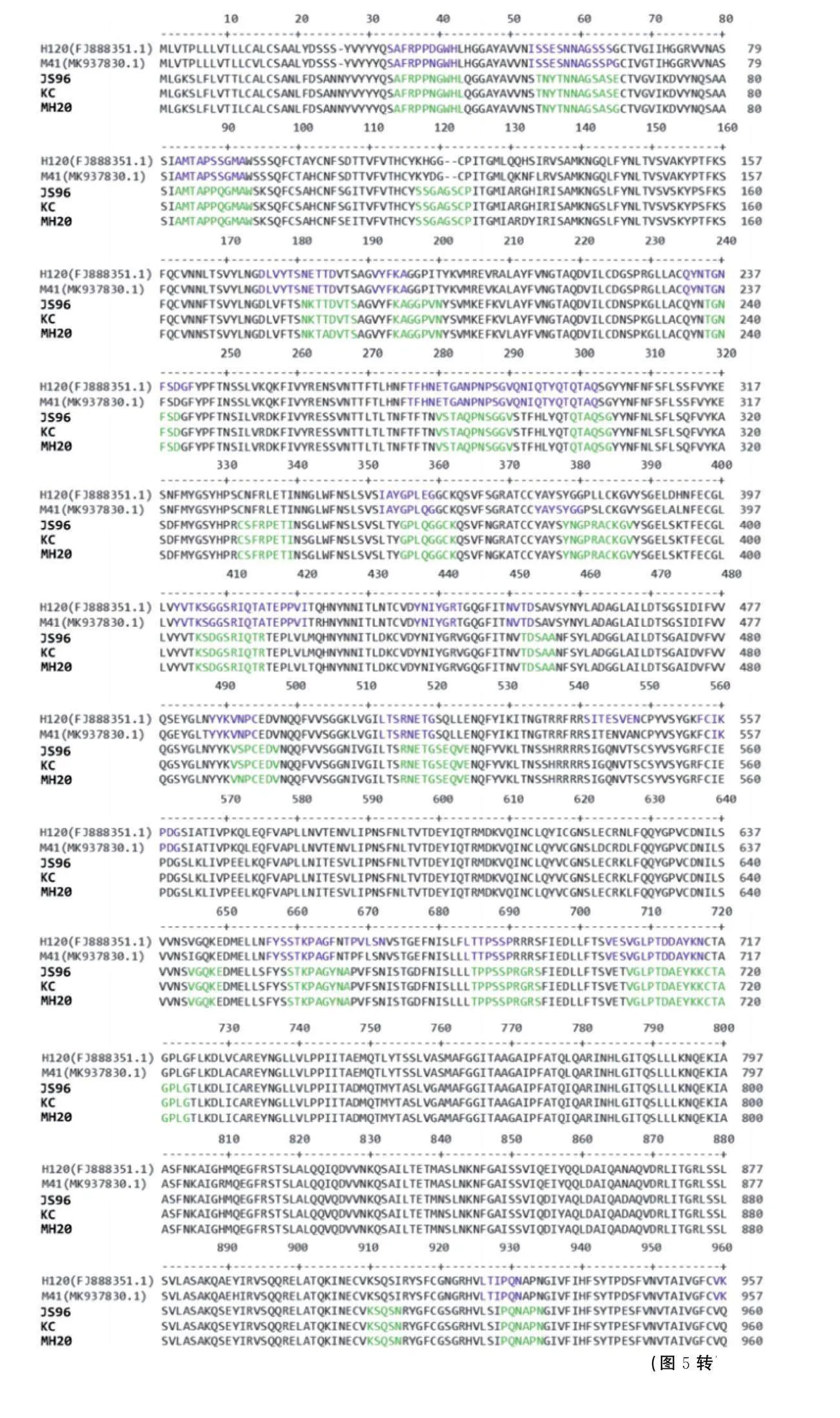
通过在线软件BepiPred 1.0 Server对分离毒株与疫苗毒株H120和经典毒株M41主要免疫原蛋白S的B细胞抗原表位进行预测。结果显示分离毒株(绿色)有31个抗原表位,与对照毒株(蓝色)有30个抗原表位,此外,分离毒株与对照毒株相比,其S蛋白B细胞抗原表位除数量差异外,序列一致性上也存在一定的差异(图5)。这也一定程度上解释了流行毒株与疫苗毒株交叉免疫反应差的原因。
2.7 3株分离毒株重组分析
通过RDP4生物信息学软件,将3株分离毒株与2株疫苗毒株(H120和H52)、经典毒株M41以及其他7株同源较高的同基因型毒株进行重组事件分析,结果显示CK/CH/SD/MH20 2015、CK/CH/GD/KPLH-CZQ 2018和Isolated SD(GenBank: KY421673)分别在4 678—11 032和5 462—9 180处发生重组(图6A、B);CK/CH/JS/TAYH 2018和CK/CH/LJL/140734(GenBank: KX425847)在10 972—11 401处发生重组(图6C),它们的亲本分别是SD_QX-like (KY421673)、SD_QX-like (KY421673)和CK/CH/LJL/140734(KX425847.1)。这说明IBV容易发生基因重组事件,基因重组可能是IBV形成新的基因型和血清型重要原因之一。
2.8 3株分离毒株对SPF鸡胚的致病性
MH20、KC和JS96 3株分离毒株均具有鸡胚致病性。其中MH20(图7a)和KC(图7b)主要引起鸡胚矮化;JS96则具有更强的鸡胚致病性,不仅可致鸡胚矮化还可引起鸡胚严重出血(图7c),三者的EID50分别为106.668、106.468和107.699·mL-1。因此,选取JS96为代表毒株进一步研究QX-like流行毒株对SPF鸡的致病性。
2.9 JS96分离毒株对1和15日龄SPF鸡的致病性
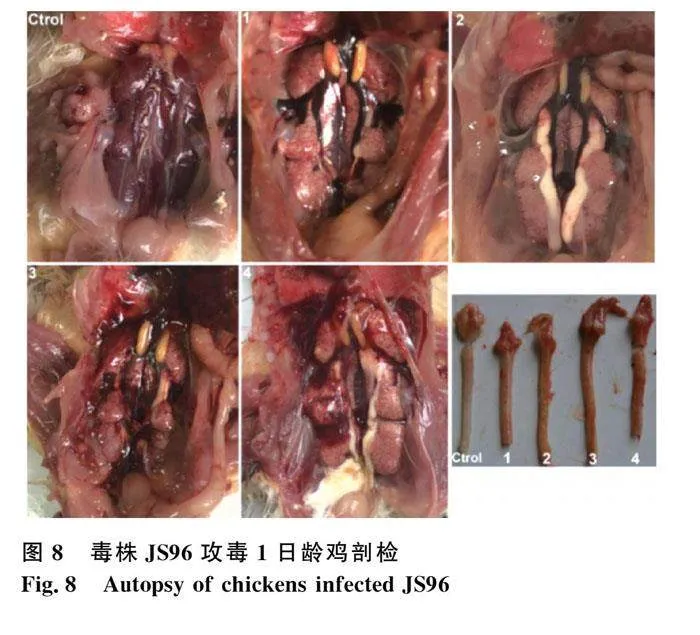
以每只滴鼻点眼和肌注结合攻毒4只1日龄SPF鸡,200 μL·只-1(约104 EID50)。结果显示:JS96对于1日龄SPF鸡具有致病性,发病率100%。发病鸡出现精神沉郁、羽毛蓬乱、排白色稀粪等症状。剖检典型病变为肾肿大、尿酸盐沉积,可见“花斑肾”,气管出血(图8)。JS96接种1日龄SPF鸡,病理组织切片结果显示JS96毒株主要对1日龄SPF鸡的气管、肺和肾造成病理损伤,气管表现为纤毛和黏膜上皮脱落,肺则呈现气泡壁淤血、出血,肾的病理变化主要为肾小管变性坏死(图9)。
以相同剂量滴鼻点眼和肌注结合接种15日龄SPF鸡。结果显示JS96对于15日龄SPF鸡仍然具有一定致病性,但发病率明显低于1日龄SPF鸡,攻毒的35只鸡仅个别鸡症状明显,表现为精神沉郁、羽毛蓬乱、嗜睡和离群等症状如图10a红色箭头所指鸡。发病症状明显鸡在感染后96和120 h剖检,发现发病鸡肾肿大、尿酸盐沉积,可见“花斑肾”,其中感染120 h鸡肾比96 h肾更苍白,尿酸盐沉积更加严重,质脆易碎。这说明JS96感染120 h左右肾病变最为严重(图10b、c)。JS96感染15日龄SPF鸡,除了导致呼吸道损伤外,还可以导致鸡群体重下降,将攻毒后,连续饲养15 d的所有剩下鸡称重,计算比较鸡只平均体重,发现JS96攻毒组的鸡群平均体重显著低于对照组鸡群(图10e),这说明IBV不仅可导致鸡群发病,还会影响鸡群生长。
3 讨 论
基于2021年最新S1全长的分类系统将IBV分为GI~GVII 7个基因型,其中GI有27个病毒谱系(GI-1~GI-27)[19]。本研究对本实验室2014—2022年间从江苏、山东、广东广西等地分离的56株IBV毒株进行S1测序演化分析,结果显示我国目前主要流行毒株的基因型包括了GI-1、GI-19、GI-22、GI-23、GⅡ-1、GIV-1、GV-1、GV1-1和变异毒株,其中GI-19 (QX)是优势基因型,占比约53.57%,此外,GVI呈现流行增多,变异毒不断涌现趋势,需要加强关注和监测。这些数据均说明了当下GI-19 (QX-like基因型)已是危害我国养禽业发展的主要毒株。这也与Ji等[20]对2016—2018年从华中地区各个养鸡场获得的临床样本中分离鉴定了56株IBV毒株,分离株的基因型包括GI-13 (4/91)、GI-7 (TW-I)、GI-24 (Mass)、GI-19 (QX)和GI-18 (LDT3-A)),其中GI-19 (QX)是主要基因型的研究报道是一致的。除我国外,亚欧地区多个国家均有GI-19基因型IBV的流行,包括俄罗斯、哈萨克斯坦和伊朗等[21-23],这说明GI-19基因型IBV流行株具有较强的传播能力和广泛的地域性。亟需对其基因组特点和生物学特性进行分析研究。本研究选取3株GI-19代表毒株进行全基因组测序分析和致病性进行研究。全基因组测序分析显示3株IBV分离毒株S1全基因序列与GI-19(QX-like)基因型毒株的相似性在95%左右,具有典型的“花斑肾”致病特点。
Furin酶切位点对IBV基因型具有一定指征性意义。在536位氨基酸处均具有与QX-like基因型毒株相似的Furin酶切位点HRRRR,这说明GI-19(QX-like)具有典型的Furin酶切位点HRRRR,而通过比对发现GI-1、GI-7和GI-22的Furin酶切位点为HRFRR,GI-13的Furin酶切位点为HRSRR,GI-18的Furin酶切位点为HRLRR,GI-23的Furin酶切位点为HRTRR,GVI-1的Furin酶切位点为HRRKR。
重组分析显示3株GI-19毒株均存在基因重组事件,这说明基因重组是IBV形成新基因型的重要原因。这与S.W.Thor等研究发现重组位点广泛分布于IBV整个基因组,认为基因重组是IBV不断演化的重要分子机制之一[24],以及吴翠兰等[25]报道的“当S1蛋白发生基因突变、缺失、插入和重组时会导致新的血清型和基因型出现和流行”的观点是一致的。S1基因的遗传多样性非常高,其演化和变异是引起IBV抗原漂移以及基因型和血清型变化的主要原因,因此成为IBV基因分型的靶基因[9]。对高变区S1基因序列进行了分析,显示3株毒株与国内外疫苗毒株(H120、H52、ArkDPI)和经典毒株(M41、Beaudette)作对比,相似性只有77%左右。E、M和N基因与常用国内外疫苗株、经典株演化遗传距离稍远,不属于同一演化分支。并且通过软件预测S蛋白的B细胞抗原表位,结果显示3株分离株与疫苗毒株H120、经典毒株M41相比,抗原表位的数量和序列均不一致,存在一定的差异性。这说明了现有的经典疫苗株可能已不适用于当下GI-19基因型流行毒株。这也是当下IBV疫苗免疫失败或免疫交叉保护差的重要原因。需选择合适疫苗及研发新型疫苗,才能对IBV疫病进行控制。
GI-19(QX-like)基因型传染性支气管炎病毒对不同日龄SPF鸡均具有一定的致病性,本研究通过对1日龄和15日龄SPF致病性比较研究发现,JS96对低日龄致病性更强,这与文献报道基本一致[26]。仍然以呼吸道症状为主,表现为精神沉郁、打喷嚏、流鼻涕、气管啰音和呼吸困难[27],此外还会损伤肾脏[28],导致尿酸盐沉积,严重者出现排白色稀粪。本研究发现IBV通过上呼吸道感染进入机体,可导致气管黏液分泌亢进、纤毛和黏膜上皮脱落和大量炎性细胞增生浸润,可能导致病毒血症而侵染其他组织器官;肺气泡壁淤血出血和细支气管见炎性物质的脱落;肾脏肾小管变性坏死。文献显示QX-like基因型IBV还可以导致肾脏肾小管上皮脱落、盐类晶体沉着以及固有层单核细胞和淋巴细胞浸润[16];输卵管出现特征性扩张和血清样液体积聚,在扩张的输卵管中,可以看到发育中的褶皱变平和管壁变薄,上皮层或浆膜层下局灶性单核细胞浸润[29],其他组织器官无明显的病理变化迹象。此外,作者还发现该基因型IBV还可导致鸡群体重下降、生长迟缓。这说明GI-19 (QX-like基因型)IBV引起鸡群发病且生长迟缓,严重危害我国养禽业发展。
鉴于当下流行的QX-like毒株毒力强,传播地域广泛,主要免疫原蛋白S与现有疫苗株相似度低,B细胞表位存在差异和出现基因重组事件的现状。开发QX-like适配性更好的新疫苗迫在眉睫。本研究仅选取3株GI-19毒株进行致病性研究,选取的毒株为2015和2018年分离毒株可能与近3年同基因型流行毒株致病性具有一定差异,后续研究将选取近3年毒株与2015和2018年毒株进行致病性研究,此外,增加其他生物学特性比较分析,为IBV的精准防控提供更可靠的参考。
4 结 论
本研究对实验室2014—2022年分离的IBV毒株进行了遗传演化研究和致病性研究。遗传演化分析表明,我国主要流行毒株呈现多基因型同时存在,其中GI-19(QX-like基因型)是我国主要优势流行毒株,占比达51.67%。GVI-1次之,其流行呈现增多趋势,需重视关注。挑选的3株GI-19(QX-like)优势基因型IBV毒株与现有的商品疫苗株的主要免疫原蛋白S相似度低,B细胞表位差异明显,流行毒株与疫苗株交叉免疫保护差;3株分离毒株均存在基因重组事件,这说明IBV基因重组易发生基因重组,基因重组是导致IBV变异的重要原因之一。致病性研究显示当下流行的GI-19(QX-like)毒株毒力较较强,对1和15日龄的鸡均有致病性,主要以花斑肾和轻度呼吸道症状为特征,可导致料肉比下降,严重影响养鸡生产性能。本研究掌握IBV基本流行情况,从分子层面阐述了流行优势毒株与现有疫苗适配性差异,亟需开发QX-like适配性更好的新疫苗。
参考文献(References):
[1] SAIF Y M. 禽病学[M]. 苏敬良, 高 福, 索 勋, 译. 12版. 北京: 中国农业出版社, 2012:108-130.
SAIF Y M. Diseases of poultry[M]. SU J L, GAO F, SUO X, trans. 12th ed. Beijing: China Agriculture Press, 2012:108-130. (in Chinese)
[2] MO M L, HONG S M, KWON H J, et al. Genetic diversity of spike, 3a, 3b and E genes of infectious bronchitis viruses and emergence of new recombinants in Korea[J]. Viruses, 2013, 5(2):550-567.
[3] COOK J K A, JACKWOOD M, JONES R C. The long view: 40 years of infectious bronchitis research[J]. Avian Pathol, 2012, 41(3):239-250.
[4] BENYEDA Z, MAT T, SVEGES T, et al. Comparison of the pathogenicity of QX-like, M41 and 793/B infectious bronchitis strains from different pathological conditions[J]. Avian Pathol, 2009, 38(6):449-456.
[5] RAJ G D, JONES R C. Infectious bronchitis virus:Immunopathogenesis of infection in the chicken[J]. Avian Pathol, 1997, 26(4):677-706.
[6] 马凤龙, 傅兴伦, 陈国柱, 等. 腺胃病变型鸡传染性支气管炎病毒的分离鉴定及免疫试验[J]. 中国兽医学报, 2004, 24(3):225-227.
MA F L, FU X L, CHEN G Z, et al. The isolation, identification and experimental vaccination of avian infectious bronchitis virus causing proventriculitis[J]. Chinese Journal of Veterinary Science, 2004, 24(3):225-227. (in Chinese)
[7] 荣骏弓, 崔尚金, 李建伟. 腺胃病变型鸡传染性支气管炎病毒D971毒株S1基因的序列测定与分析[J]. 中国兽医科技, 2002, 32(7):3-6.
RONG J G, CUI S J, LI J W. The sequence determination and analysis of S1 gene of IBV-D971 strain which is pathogenic for chick’s proventriculus[J]. Chinese Journal of Veterinary Science and Technology, 2002, 32(7):3-6. (in Chinese)
[8] 边葶苈, 朱林文思, 雷 静, 等. 鸡传染性支气管炎病毒变异株的分离及分子特征研究[J]. 中国预防兽医学报, 2013, 35(12):960-963.
BIAN T L, ZHU L W S, LEI J, et al. Isolation and molecular characterization of an avian infectious bronchitis virus variant[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(12):960-963. (in Chinese)
[9] DOMANSKA-BLICHARZ K, SAJEWICZ-KRUKOWSKA J, LISOWSKA A. New PA/1220/98-like variant of infectious bronchitis virus in Poland[J]. Avian Pathol, 2020, 49(4):380-388.
[10] 高明燕, 姜 逸, 程 旭, 等. 我国禽传染性支气管炎病毒分子流行病学研究进展[J]. 中国家禽, 2023, 45(12):87-94.
GAO M Y, JIANG Y, CHENG X, et al. Advances on molecular epidemiology of avian infectious virus in China[J]. China Poultry, 2023, 45(12):87-94. (in Chinese)
[11] LIAN J M, WANG Z X, XU Z Y, et al. Distribution and molecular characterization of avian infectious bronchitis virus in southern China[J]. Poult Sci, 2021, 100(7):101169.
[12] ZHANG X R, GUO M J, ZHAO J, et al. Avian infectious bronchitis in China:epidemiology, vaccination, and control[J]. Avian Dis, 2021, 65(4):652-656.
[13] 王 露, 唐金文, 范文胜, 等. 免疫鸡群IBV的分离鉴定及其S1基因序列研究[J]. 中国家禽, 2020, 42(7):24-28.
WANG L, TANG J W, FAN W S, et al. Isolation and identification of five infectious bronchitis viruses isolated from immunized chickens and their S1 genes sequence analysis[J]. China Poultry, 2020, 42(7):24-28. (in Chinese)
[14] 牛登云, 马利芳, 段宝敏, 等. 2018—2019年LX4型鸡传染性支气管炎病毒S1基因变异性分析[J]. 中国家禽, 2020, 42(8):101-105.
NIU D Y, MA L F, DUAN B M, et al. Analysis on S1 gene variability in LX4 type infectious bronchitis virus from 2018 to 2019[J]. China Poultry, 2020, 42(8):101-105. (in Chinese)
[15] 陈良珂, 封柯宇, 李鸿鑫, 等. 2013~2017年鸡传染性支气管炎病毒分子流行病学分析[J]. 中国家禽, 2018, 40(15):16-20.
CHEN L K, FENG K Y, LI H X, et al. Molecular epidemiology analysis on infectious bronchitis viruses circulated in China during 2013 to 2017[J]. China Poultry, 2018, 40(15):16-20. (in Chinese)
[16] 刘 帆. 传染性支气管炎病毒的分离鉴定、生物学特性及疫苗候选株的初步研究[D]. 广州:华南农业大学, 2019.
LIU F. Isolation, identification and primary study of vaccine candidate strains of infectious bronchitis virus[D]. Guangzhou: South China Agricultural University, 2019. (in Chinese)
[17] 张艳芳, 谢芝勋, 邓显文, 等. 禽腺病毒4型与鸡传染性贫血病毒双重PCR检测方法的建立[J]. 畜牧产业, 2020(3):57-61.
ZHANG Y F, XIE Z X, DENG X W, et al. Establishment of a double PCR assay for detection of avian adenovirus type 4 and avian infectious anemia virus[J]. Animal Husbandry Industry, 2020(3):57-61. (in Chinese)
[18] ARMESTO M, CAVANAGH D, BRITTON P. The replicase gene of avian coronavirus infectious bronchitis virus is a determinant of pathogenicity[J]. PLoS One, 2009, 4(10):e7384.
[19] HOUTA M H, HASSAN K E, El-SAWAH A A, et al. The emergence, evolution and spread of infectious bronchitis virus genotype GI-23[J]. Arch Virol, 2021, 166(1):9-26.
[20] JI J, GAO Y Y, CHEN Q X, et al. Epidemiological investigation of avian infectious bronchitis and locally determined genotype diversity in central China:a 2016—2018 study[J]. Poult Sci, 2020, 99(6):3001-3008.
[21] HAMADAN A M, GHALYANCHILANGEROUDI A, HASHEMZADEH M, et al. Genotyping of Avian infectious bronchitis viruses in Iran (2015-2017) reveals domination of IS-1494 like virus[J]. Virus Res, 2017, 240:101-106.
[22] NAJAFI H, LANGEROUDI A G, HASHEMZADEH M, et al. Molecular characterization of infectious bronchitis viruses isolated from broiler chicken farms in Iran, 2014—2015[J]. Arch Virol, 2016, 161(1):53-62.
[23] OVCHINNIKOVA E V, BOCHKOV Y A, SHCHERBAKOVA L O, et al. Molecular characterization of infectious bronchitis virus isolates from Russia and neighbouring countries:identification of intertypic recombination in the S1 gene[J]. Avian Pathol, 2011, 40(5):507-514, doi:10. 1080/03079457. 2011. 605782.
[24] THOR S W, HILT D A, KISSINGER J C, et al. Recombination in avian Gamma-coronavirus infectious bronchitis virus[J]. Viruses, 2011, 3(9):1777-1799.
[25] 吴翠兰, 何怡宁, 李和鸣, 等. 一株重组鸡传染性支气管炎病毒的分离及结构蛋白基因变异和血清型分析[J]. 畜牧兽医学报, 2015, 46(5):815-823.
WU C L, HE Y N, LI H M, et al. Isolation and analysis of structural protein genes variation and serotype of a recombinant strain of chicken infectious bronchitis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(5):815-823. (in Chinese)
[26] KHANH N P, TAN S W, YEAP S K, et al. Comparative pathogenicity of malaysian QX-like and variant infectious bronchitis virus strains in chickens at different age of exposure to the viruses[J]. J Comp Pathol, 2018, 161:43-54.
[27] SHAO L, ZHAO J, LI L H, et al. Pathogenic characteristics of a QX-like infectious bronchitis virus strain SD in chickens exposed at different ages and protective efficacy of combining live homologous and heterologous vaccination[J]. Vet Res, 2020, 51(1):86.
[28] YOUN S Y, LEE J Y, BAE Y C, et al. Genetic and pathogenic characterization of QX(GI-19)-recombinant infectious bronchitis viruses in South Korea[J]. Viruses, 2021, 13(6):1163.
[29] BENYEDA Z, SZEREDI L, MAT T, et al. Comparative histopathology and immunohistochemistry of QX-like, Massachusetts and 793/B serotypes of infectious bronchitis virus infection in chickens[J]. J Comp Pathol, 2010, 143(4):276-283.
(编辑 白永平)

