线粒体tRNA-Lys(T7719G)基因变异影响绵羊颗粒细胞凋亡生理机制研究


摘 要: 本团队前期研究发现小尾寒羊线粒体tRNA-Lys基因(T7719G)变异与产羔数显著相关,并降低了颗粒细胞凋亡率,为此,开展了该变异影响颗粒细胞凋亡生理机制的研究。本研究选取G、T基因型绵羊各3只,屠宰后取卵巢组织培养颗粒细胞,颗粒细胞生理指标检测试验分为两组,每组3个重复,分别检测线粒体基因组拷贝数,线粒体呼吸酶复合物Ⅰ、复合物Ⅱ、复合物Ⅲ、复合物Ⅳ、复合物Ⅴ活性,线粒体耗氧量和胞外产酸能力、ROS产量、ATP水平和膜电位,以及tRNA-Lys总量和氨酰化水平,13个mtDNA编码多肽蛋白表达水平。结果表明,G基因型颗粒细胞线粒体拷贝数与T基因型差异极显著(Plt;0.01),为T基因型的1.78倍。G基因型细胞线粒体复合物Ⅲ活性是T型细胞的1.25倍(Plt;0.05),表明G基因型细胞氧化呼吸功能增强。G基因型颗粒细胞线粒体耗氧量、ATP偶联耗氧量比T基因型细胞分别提高了6.84%(Plt;0.05)和15.46%(Plt;0.01),G基因型细胞糖酵解能力显著降低(Plt;0.01),活性氧含量水平显著降低了34%,ATP含量明显上升,为T基因型的1.25倍(Plt;0.05),线粒体膜电位显著上升,为T基因型的1.24倍(Plt;0.01);G基因型细胞tRNA-Lys总量显著提高50%(Plt;0.01),氨酰化tRNA-Lys比例较T型细胞提高33.4%(Plt;0.01)。线粒体基因组编码的13个多肽(ND1、ND2、ND3、ND4、ND4L、ND5、ND6、CtyB、COⅠ、COⅡ、COⅢ、ATP6、ATP8)表达水平均显著提高(Plt;0.05)。初步解析了线粒体tRNA-Lys(T7719G)变异影响绵羊颗粒细胞凋亡的生理机制,即tRNA-Lys(T7719G)变异影响tRNA-Lys稳态和氨酰化水平,影响mtDNA 编码的多肽翻译效率,同时引起拷贝数、ATP水平、ROS含量和部分酶活性变化,进而改变线粒体能量代谢功能和细胞凋亡。
关键词: 线粒体;tRNA-Lys基因;颗粒细胞;生理功能
中图分类号:S826.3
文献标志码:A""" 文章编号:0366-6964(2024)05-2011-11
收稿日期:2023-11-24
基金项目:河北省自然科学基金项目(C2020204001)
作者简介:吕世琪(1997-),女,内蒙古赤峰人,硕士生,主要从事绵羊遗传育种研究,E-mail:157542096@qq.com
*通信作者:陈晓勇,主要从事绵羊遗传育种与繁殖领域研究,E-mail: chenxiaoyong-2000@163.com
Study on the Physiological Mechanism of Mitochondrial tRNA-Lys(T7719G)
Gene Variation Affecting Apoptosis of Ovine Granulosa Cell
L Shiqi, ZHOU" Rongyan, TIAN" Shujun, CHEN" Xiaoyong*
(College of Animal Science and Technology, Hebei Agricultural University, Baoding 071000," China)
Abstract:" The previous studies have found that mitochondrial tRNA-Lys(T7719G) variation was associated with litter size, which decreased the apoptosis of granulosa cells in Small-tailed Han sheep. Therefore, the physiological mechanism of mitochondrial tRNA-Lys(T7719G) variation on granulosus cell apoptosis was explored. Three sheep were selected with G and T genotypes respectively, and slaughtered for ovarian tissue culture of granulosa cells. The detection experiment of granule cells physiological function were divided into two groups with 3 replicates in each group. Mitochondrial genome copy number, mitochondrial respiratory enzyme complex Ⅰ, complex Ⅱ, complex Ⅲ, complex Ⅳ and complex Ⅴ activities were detected, respectively. Mitochondrial oxygen consumption and extracellular acid production capacity, ROS production, ATP level and membrane potential, as well as total tRNA-Lys and aminoacylation level, expression level of 13 mtDNA-encoded polypeptide proteins were detected.
The results showed that the mitochondrial copy number of G genotype granulosa cells was significantly different from that of T genotype (Plt;0.01), which was 1.78 times that of T genotype. The activity of mitochondrial complex III in G genotype cells was 1.25 times higher than that in T type cells (Plt;0.05), indicating that the oxidative respiratory function of G genotype cells was enhanced. The mitochondrial oxygen consumption and ATP-coupled oxygen consumption of G genotype granulosa cells were 6.84% (Plt;0.05) and 15.46% (Plt;0.01) higher than those of T genotype cells, respectively. The glycolysis ability of G genotype cells was significantly decreased (Plt;0.01), the level of reactive oxygen species was significantly decreased by 34%, the ATP content was significantly increased, which was 1.25 times that of T genotype (Plt;0.05), and the mitochondrial membrane potential was significantly increased, which was 1.24 times that of T genotype (Plt;0.01).
Total tRNA-Lys was significantly increased by 50% (Plt;0.01) in G genotype cells, and the proportion of amylated tRNA-Lys was increased by 33.4% (Plt;0.01) compared to T genotype cells. The expression levels of all 13 polypeptides encoded by the mitochondrial genome (ND1, ND2, ND3, ND4, ND4L, ND5, ND6, CtyB, COⅠ, COⅡ, COⅢ, ATP6, ATP8) were significantly increased (Plt;0.05). The physiological mechanism of mitochondrial tRNA-Lys(T7719G) variation affecting ovine granulosa cell apoptosis was initially analyzed, that is, tRNA-Lys(T7719G) variation affected tRNA-Lys homeostasis and aminoacylation level, affected the translation efficiency of mtDNA-encoded peptides, and caused changes in copy number, ATP level, ROS content, and some enzyme activities, and then the energy metabolism function of mitochondria and apoptosis were changed.
Key words: mitochondrion; tRNA-Lys gene; granulosa cells; physiological functions
*Corresponding author:CHEN Xiaoyong, E-mail: chenxiaoyong-2000@163.com
长期以来绵羊产羔数性状主要集中在细胞核染色体基因遗传效应领域,细胞核外的线粒体基因遗传效应研究则较少。研究报道猪产仔数不仅与卵母细胞数量高度相关,而且与线粒体DNA多态性[1]及线粒体tRNA-Lys变异显著相关[2]。本团队前期研究发现小尾寒羊线粒体tRNA-Lys基因(T7719G)变异与产羔数显著相关(Plt;0.05)[3]。颗粒细胞是卵泡的重要组成成分,可分泌多种卵泡发育的所需因子调控卵母细胞的生长、分化和成熟[4-6],其生理功能直接影响卵泡的发育和闭锁。绵羊一生中大约有106个卵泡,而大部分的卵泡会在体内发生闭锁,丧失排卵和激素释放的功能[7],引起卵泡闭锁的主要原因是颗粒细胞的凋亡[8]。可见,线粒体tRNA-Lys基因(T7719G)变异可能通过调控颗粒细胞凋亡进而影响绵羊产羔数。
线粒体是细胞核外具有自身DNA(mtDNA)的细胞器,mtDNA编码的多肽是氧化磷酸化复合酶I、II、IV的组成成分,因此,mtDNA对于细胞呼吸和能量产生非常重要[9-10]。研究报道mt-tRNA突变会影响二级结构、稳态水平[11],进而导致线粒体蛋白合成及呼吸链缺陷,同时引起mt-tRNA分子成熟不正常、降低与同源氨基酸结合及识别相应密码子的能力[12-13]。很多研究报道mt-tRNA突变不仅导致自身稳态和氨酰化水平降低,同时引发线粒体疾病。如线粒体肌病脑病伴乳酸中毒及中风样发作疾病杂交细胞中mt-tRNALeu(UUR)和氨酰化作用均降低50%以上[14-15]。研究表明人线粒体tRNA突变导致氧气消耗速率降低、呼吸复合物酶活性和ATP水平降低、膜电位改变、活性氧(ROS)水平升高,导致线粒体功能缺陷[16-17],同时引起细胞凋亡[18]。本团队前期研究发现,线粒体tRNA-Lys(T7719G)变异影响绵羊颗粒细胞凋亡,其生理机制尚不清楚。为此,本研究开展线粒体tRNA-Lys(T7719G)基因变异对绵羊颗粒细胞生理功能及其分子机制的影响研究,为线粒体基因变异与细胞生理功能关系研究提供基础。
1 材料与方法
1.1 试验动物
卵巢来源于河北省保定市瑞丽屠宰场。屠宰后取卵巢组织用温生理盐水冲洗并用75%酒精喷洒消毒后,放于含有1%双抗和37 ℃生理盐水的保温壶中,在4 h内送至实验室进行后续试验。
1.2 引物设计
根据绵羊线粒体基因组序列(GenBank:AF010406),设计扩增含有tRNA-Lys(T7719G)位点序列的引物,引物序列:
上游引物:5′-CTACGGTCAATGCTCAGAA-3′;下游引物:5′-GTTGTGGTAGAAGTTGTGTT-3′。该引物由北京六合华大基因科技股份有限公司合成。
1.3 组织采集与DNA提取
按照组织基因组DNA提取试剂盒(天根生化科技有限公司)说明书进行DNA提取,通过紫外分光光度计测定DNA样品在260 nm、280 nm处的OD值,计算DNA含量和OD260 nm/OD280 nm的比值,琼脂糖凝胶电泳检测DNA质量。
1.4 PCR测序检测变异
PCR扩增反应体系(25 μL):Mix 10 μL,上游引物0.4 μL,下游引物0.4 μL,ddH2O 13.2 μL,模板DNA 1 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃总延伸5 min。使用1%的琼脂糖凝胶电泳检测PCR扩增产物,其中电泳电压为100 V,电流为100 mA,时间为30 min。利用PCR产物进行测序,分析鉴定基因型。测序结果通过DNAMAN软件对其数据进行拼接,运用Oligo 7 Primer Analysis Software将试验绵羊序列与绵羊线粒体基因组标准序列(GenBank:AF010406)进行比对分析。
1.5 颗粒细胞分离培养
选取G、T基因型母羊各3只,采集双侧卵巢并使用生理盐水、75%酒精清洗,切割适当大小卵泡并在超净台中收集卵泡液,加入10%胎牛血清、1%双抗和DMEM细胞培养基,将不同基因型每只母羊双侧卵巢颗粒细胞在 37℃、5% CO2细胞培养箱中培养24 h后观察细胞贴壁情况并进行后续试验。
1.6 细胞检测
1.6.1 线粒体tRNA稳态及氨酰化水平检测
使用AngleGene公司线粒体分离试剂盒进行线粒体分离,TRIzol Plus RNA 纯化试剂盒进行RNA提取。使用的地高辛标记的线粒体tRNA-Lys以及核基因编码的线粒体5S RNA 寡核苷酸探针相关信息如表1所示。参考文献[19]进行转膜和杂交试验。
1.6.2 颗粒细胞ATP水平检测
使用发光法细胞活力检测试剂盒(碧云天生物技术有限公司)测定细胞的ATP产生水平,检测其荧光信号,记录试验数据。
1.6.3 线粒体膜电位测定
应用JC-10荧光染料(Abcam)并结合流式细胞术检测细胞线粒体膜电位水平。按照JC-10检测试剂盒说明操作,上镜检测,红绿荧光强度比代表线粒体膜电位水平。
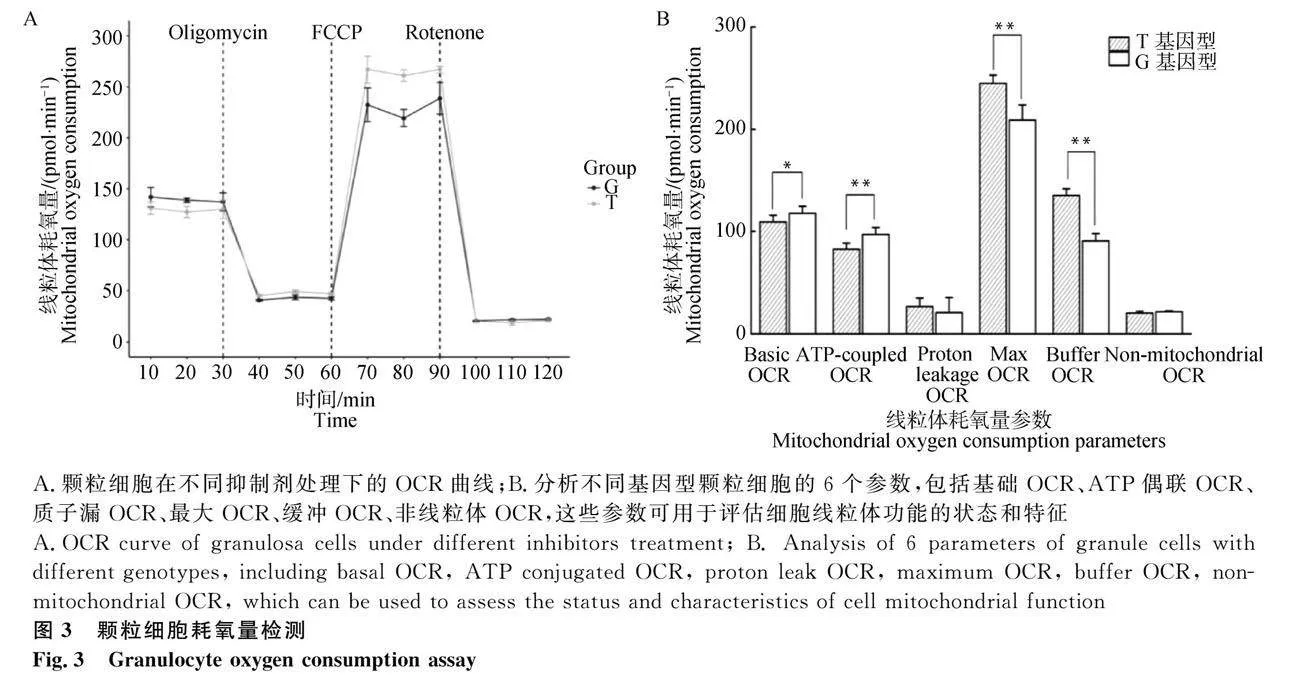
1.6.4 线粒体耗氧量(OCR)和胞外产酸能力(ECAR)测定
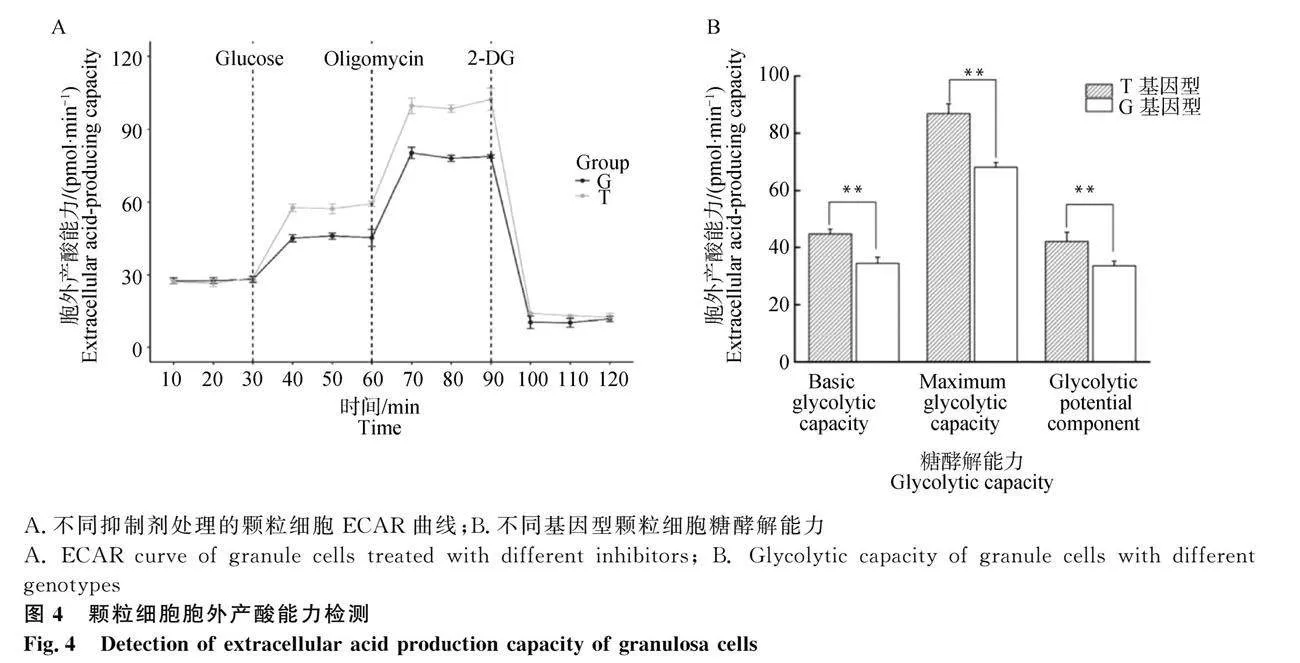
将不同基因型的颗粒细胞分别以每孔约1.8×104个铺板到细胞培养微孔板中,于室温1 h后置于37℃细胞培养箱中培养过夜。加入1.5 μmol·L-1寡霉素、0.5 μmol·L-1羰基-氰-对-三氟甲氧基本腙、复合体Ⅰ抑制剂鱼藤酮(0.5 μmol·L-1)和复合体Ⅲ抑制剂抗霉素A(0.5 μmol·L-1),通过CyQuANT Cell Proliferation Assay Kit检测孔中的细胞数。通过计算得到不同基因型颗粒细胞的基础OCR、ATP偶联OCR、质子漏OCR、最大OCR、缓冲OCR、非线粒体OCR的6个参数。通过检测培养基pH变化从而反映颗粒细胞ECAR,分别加入葡萄糖、寡霉素和2-脱氧葡萄糖,通过CyQuANT Cell Proliferation Assay Kit检测孔中的细胞数,得到细胞的基础糖酵解能力、细胞的最大糖酵解能力、非糖酵解产酸值。
1.6.5 呼吸复合物酶活性检测
采用GENMED试剂盒检测动物线粒体呼吸酶复合物Ⅰ、复合物Ⅱ、复合物Ⅲ、复合物Ⅳ、复合物Ⅴ活性。使用酶标仪读取光吸收值。
1.6.6 细胞活性氧(ROS)含量检测
取出培养好的颗粒细胞,PBS清洗2~3次重悬细胞,加入1 mL含有100μmol·L-1 DCFH-DA的PBS,室温培养20 min,在激光共聚焦显微镜下观察细胞形态,拍照。
1.6.7 qRT-PCR测定线粒体基因组拷贝数
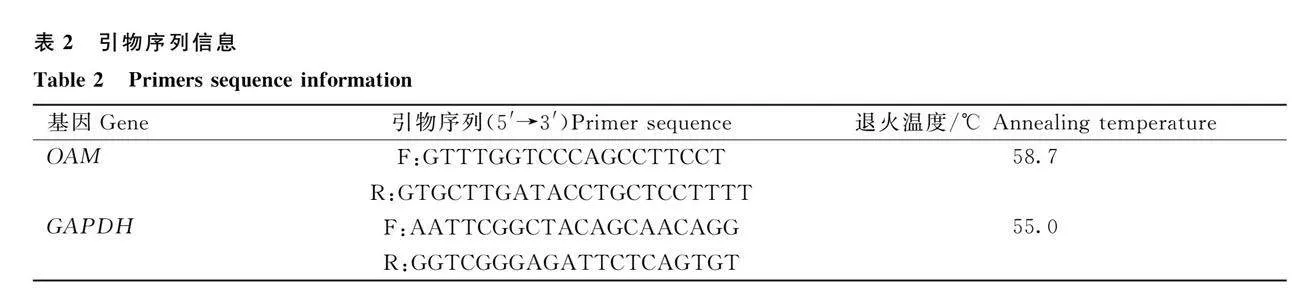
根据绵羊线粒体基因组序列(GenBank:AF010406.1),采用Primer Premier 6.0和Beacon designer 7.8软件设计覆盖绵羊线粒体基因组序列引物,引物序列如表2所示,qRT-PCR反应体系:SDW 8.0 μL,Power SYBR Green Master Mix 10.0 μL,上、下游引物各0.5 μL,DNA1.0 μL;反应程序:95℃1min;95℃15s,63℃ 25s,55℃ 15s,95℃ 15s。根据mtDNA特异引物用于定量颗粒细胞的mtDNA含量,使用甘油醛-3-磷酸脱氢酶(GAPDH)基因作为内参基因,各个基因的相对表达水平以2-△△Ct进行统计分析,通过计算线粒体DNA与核DNA的丰度比值(mtDNA/nDNA)来反映样品的mtDNA拷贝数。
1.6.8 Western blot检测编码蛋白表达水平
使用线粒体分离试剂盒进行线粒体分离,参考BCA蛋白定量试剂盒中实验说明书,对所制取的13个蛋白(ND1、ND2、ND4、ND5、DN6、ND4L、COI、COII、COIII、Ctyb、ATP6、ATP8、COX IV)。参考文献[19]的Western blot方法检测颗粒细胞内线粒体编码相关蛋白表达水平。其中一抗为山羊抗鼠、二抗为山羊抗兔。
1.7 数据分析
试验结果均为重复3次的数据,以“平均数±标准差”表示,使用SPSS 23.0统计分析软件进行单因素方差分析,对均值进行差异性比较,*Plt;0.05为差异显著,**Plt;0.01为差异极显著。
2 结 果
2.1 线粒体基因组拷贝数
为明确不同基因型颗粒细胞的线粒体DNA拷贝数,采用荧光定量PCR检测每株细胞线粒体拷贝数。如图1所示,G基因型颗粒细胞线粒体拷贝数与T基因型差异极显著(Plt;0.01),为T基因型细胞的1.78倍。
2.2 线粒体呼吸复合物酶活性
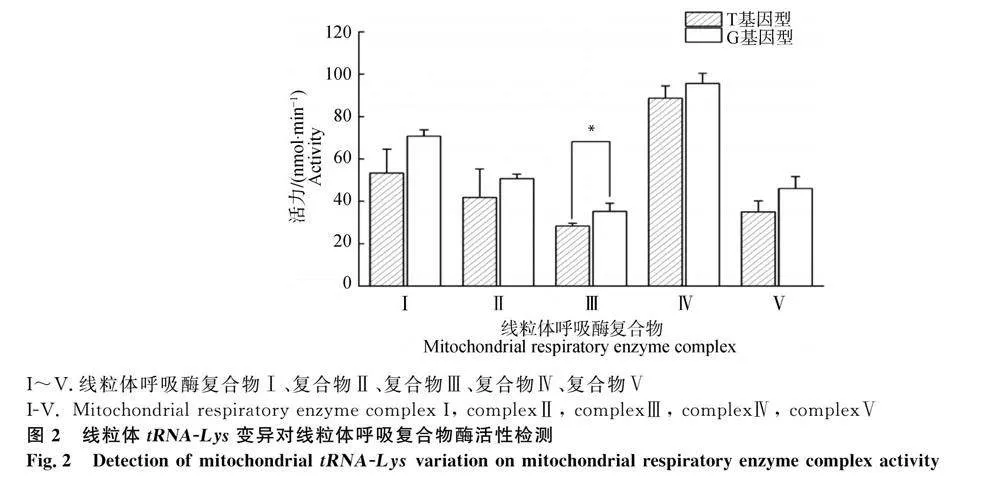
提取颗粒细胞中线粒体蛋白,检测其中线粒体呼吸酶复合物Ⅰ、复合物Ⅱ、复合物Ⅲ、复合物Ⅳ、复合物Ⅴ的表达水平。结果表明G基因型细胞线粒体复合物Ⅲ活性是T型细胞的1.25倍(Plt;0.05),两组间差异显著,T基因型细胞与G型细胞复合物Ⅰ、Ⅱ、Ⅳ、Ⅴ的活性均无显著差异(图2),表明G基因型细胞氧化呼吸功能增强。
2.3 线粒体耗氧量(OCR)和胞外产酸能力(ECAR)产量
检测G、T两种基因型颗粒细胞分析氧耗速率的差异,如图3所示,携带G基因型颗粒细胞与T基因型相比基础OCR、ATP偶联OCR分别提高了6.84%(Plt;0.05)和15.46%(Plt;0.01),而最大OCR、缓冲OCR分别降低了14.75%(Plt;0.01)、32.82%(Plt;0.01),质子漏OCR和非线粒体OCR并没有显著差异(Pgt;0.05)。
胞外酸化速率可以反映糖酵解水平。对不同基因型分组处理的细胞加入葡萄糖、寡霉素和2-DG,检测基础糖酵解能力、最大糖酵解能力和糖酵解潜力部分。结果表明,G基因型糖酵解能力显著降低(Plt;0.01)(图4),起到保护线粒体的作用。
2.4 线粒体活性氧(ROS)产量
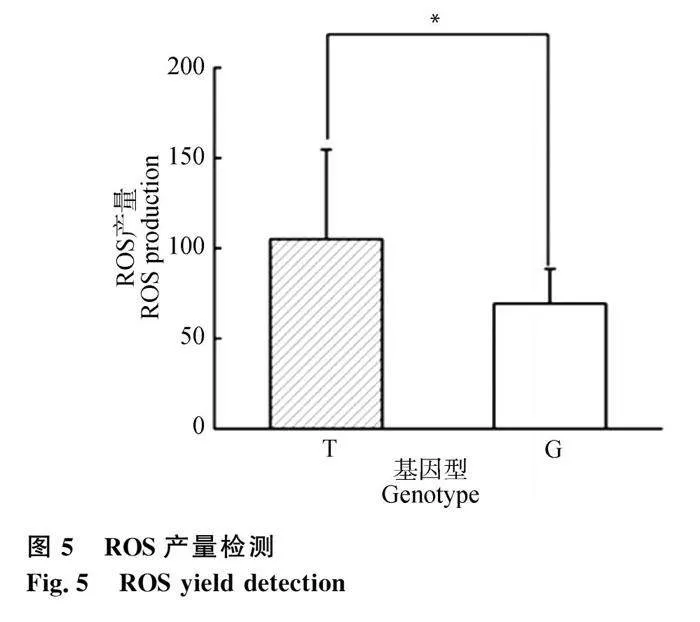
氧化呼吸链复合体亚基下调会抑制线粒体氧化呼吸链并发生障碍,从而会增加ROS的产生,因此检测G、T两种基因型颗粒细胞ROS的生成。结果表明,G基因型细胞ROS水平较T基因型细胞显著降低,平均降低了34%(图5),表现出更好的抗氧化作用。
2.5 线粒体ATP水平
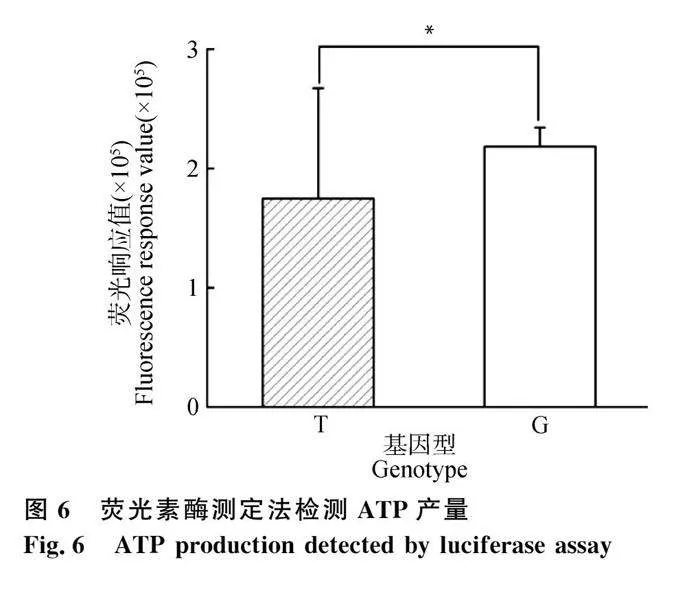
为检测不同基因型氧化磷酸化能力,采用荧光素/荧光素酶测定法检测ATP产量。如图6所示,G基因型组ATP含量明显上升,为T基因型的1.25倍(Plt;0.05)。
2.6 线粒体膜电位
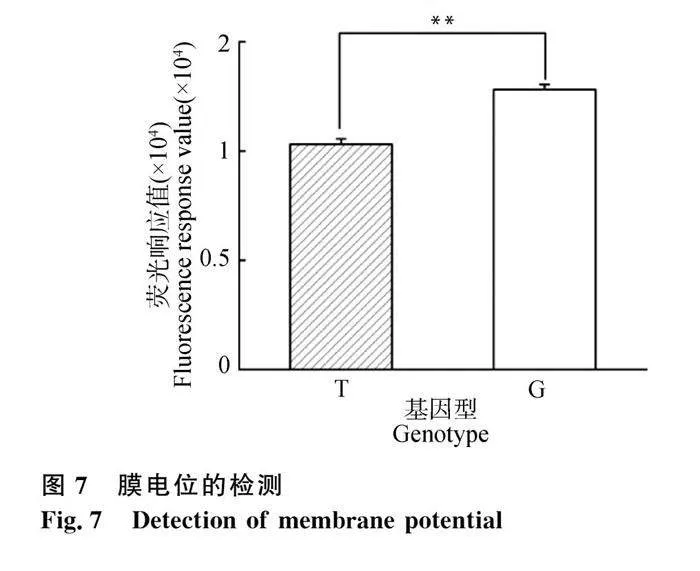
线粒体膜电位的改变往往是细胞凋亡的征兆。过量产生的ROS和线粒体膜电位的下降触发线粒体通透性转换孔开放,最终诱导细胞凋亡。JC-10染色后检测细胞荧光值,观察G、T两种基因型线粒体膜电位的变化。结果表明,G基因型细胞线粒体膜电位为T基因型的1.24倍(Plt;0.01,图7)。
2.7 线粒体tRNA-Lys生理状态
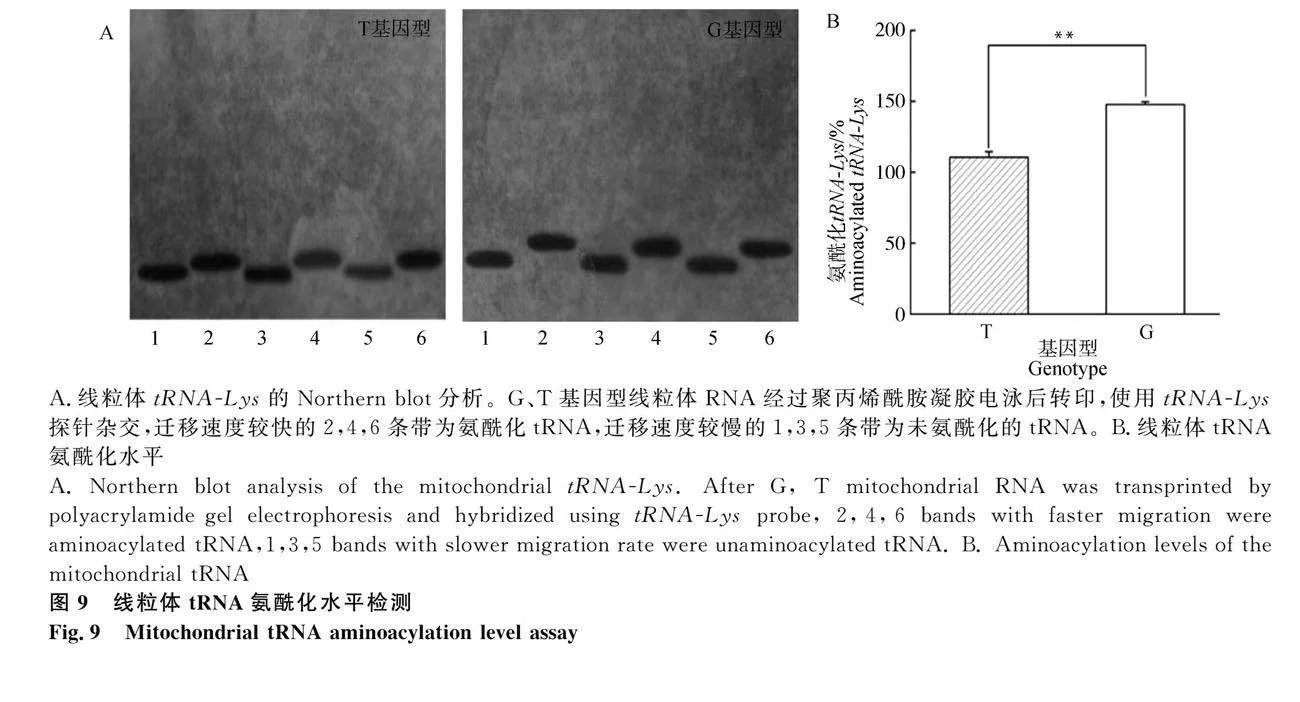
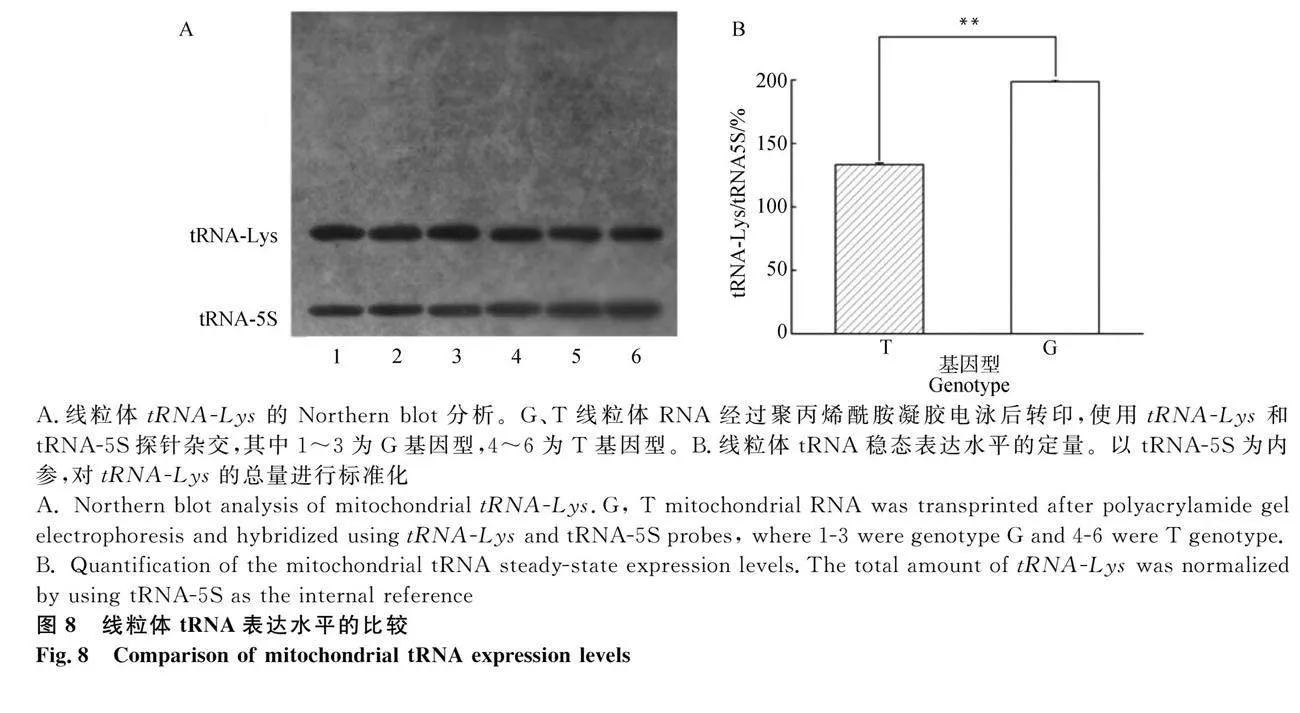
为确定T7719G变异是否对线粒体tRNA-Lys的代谢产生影响,提取G、T两种基因型的线粒体tRNA,与地高辛标记的线粒体tRNA-Lys以及核基因编码的线粒体5S RNA 寡核苷酸探针进行Northern杂交。比较不同基因型颗粒细胞tRNA-Lys的稳态水平。如图8所示,以细胞自身tRNA-5S作为参照,G基因型颗粒细胞较T基因型tRNA-Lys总量显著提高50%(Plt;0.01)。
氨酰化tRNA与未氨酰化的tRNA经酸性-尿素变性聚丙烯酰胺凝胶(PAGE)电泳分离后,与地高辛标记的线粒体tRNA-Lys寡核苷酸探针进行Northern杂交,根据迁移速度,检测线粒体tRNA氨酰化水平。结果表明,无论是否氨酰化,G基因型细胞在凝胶中的迁移速度明显高于T基因型样品(图9A),G基因型细胞氨酰化tRNA-Lys比例较T型细胞提高33.4%(Plt;0.01,图9B)。因此,G型细胞含有赖氨酸的多肽翻译效率可能会提高。
2.8 线粒体基因编码蛋白质表达水平
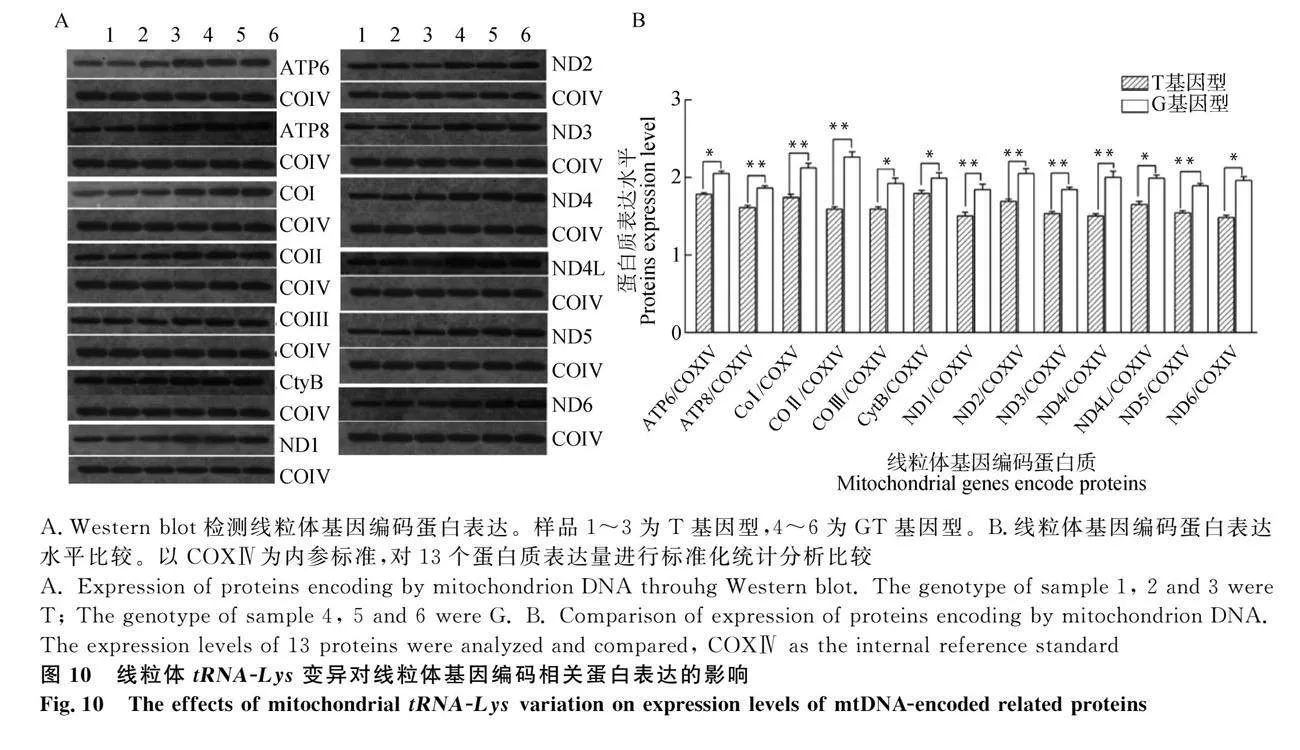
为了探究蛋白质翻译表达是否与线粒体7719位点的变异相关,提取G、T基因型颗粒细胞蛋白,用Western blot方法检测NADH脱氢酶(复合体I)的ND1、ND2、ND3、ND4、ND4L、ND5、ND6亚基;细胞色素C还原酶(复合体Ⅲ)的细胞色素B亚基(CtyB);细胞色素C氧化酶(复合体Ⅳ)的Ⅰ、Ⅱ、Ⅲ亚基:COⅠ、COⅡ、COⅢ;ATP合成酶的ATP6、ATP8两个亚基。结果表明(图10):以COXⅣ为内参标准,G基因型细胞线粒体编码的蛋白质表达水平均显著升高(Plt;0.05)。
3 讨 论
在蛋白质翻译过程中,线粒体tRNA的D环与氨基酰tRNA合成酶结合,使氨基酸与受体位点连接,很多研究指出线粒体变异与其自身的生理状态有关[19-22],线粒体功能活性与二级结构的D环和茎环息息相关,因此,D环被认为是线粒体正常功能发挥至关重要的元素之一。D环变异可能导致线粒体功能受损,从而引起多种疾病。因此,了解D环的结构和功能对于阐明线粒体疾病的分子基础和开发有效的治疗策略至关重要。现已证实T7719G变异会导致D环的U变为G[23],从而影响含有赖氨酸组成的蛋白质合成效率,进而影响一些由上述含有赖氨酸蛋白质调控的表型性状。在本研究中,G基因型颗粒细胞氨酰化tRNA的比例平均提高了33%,维持内环境稳态,改善tRNA的稳定性,使得tRNA-Lys水平提高了50%,进而避免了线粒体蛋白缺陷。表明G型细胞中含有赖氨酸的多肽翻译效率可能会提高。
线粒体是细胞中进行氧化反应并产生能量的主要细胞器,是细胞中的糖、脂质、氨基酸与氧气进行氧化还原反应,进而产生能量的唯一场所[24]。在细胞质基质中进行的糖酵解反应和在线粒体基质中进行的三羧酸循环可以生成多种高能分子,如还原型烟酰胺腺嘌呤二核苷酸(NADH)及还原型黄素二核苷酸(FADH2),然后通过氧化磷酸化作用释放能量合成ATP[25]。线粒体tRNA-Lys 7719位点上的变异可以促进细胞产能,特别是线粒体ATP的生成,与T基因型细胞相比提高了25%。线粒体膜电势决定了细胞活力,反映了在氧化磷酸化和电子传递过程中,氢离子泵出线粒体内膜的情况[26]。线粒体跨膜电位的降低是细胞凋亡级联反应中的第一步,会引起线粒体膜通透性的增加,触发凋亡级联反应的凋亡因子增加[27]。本研究中,携带G 基因型颗粒细胞的膜电位与对照组相比平均提高了24%,表明线粒体tRNA-Lys 变异对线粒体功能起到了调节作用。
当线粒体功能发生障碍时,呼吸链中的氧化磷酸化水平降低,电子在传递过程中的泄漏[28],尤其是复合体Ⅲ的损伤会造成更多电子的泄漏,伴随着NADH或FADH2的呼吸作用,会生成大量的ROS[29]。作为细胞中重要的活性分子,ROS水平不同对细胞调控结果也不同[30]。在正常生理条件下,ROS作为多种信号通路的信号分子,具有信号刺激的作用,对细胞和机体维持正常功能发挥了重要作用[31]。相反浓度较高时,会氧化损伤DNA导致线粒体DNA断链,干扰转录合成,对细胞造成严重的损伤;同时也会毒害细胞,破坏膜结构,释放细胞色素C导致凋亡[32]。当线粒体中的ROS水平增加,线粒体结构中的脂质物质如线粒体DNA分子,线粒体内、外膜的磷脂分子,线粒体的酶会通过ROS被过氧化导致拷贝数异常,线粒体氧化磷酸化功能受到相应的干扰,引发相应的功能障碍,导致ATP合成水平降低[33]。线粒体功能紊乱的增加反过来又导致自由基的产生增多,继续上述的过程并最终导致细胞和组织的死亡[34]。本研究中,G基因型颗粒细胞与T基因型相比,线粒体复合体Ⅲ活性及相应的编码蛋白表达水平得到改善,ROS的生成量减少,拷贝数增加。当线粒体呼吸链活性被抑制,细胞及机体的活动所需的能量将依赖于糖酵解,当糖酵解途径过度被激活,将会抑制丙酮酸的代谢,从而造成细胞内乳酸大量堆积。本研究中,G基因型变异组的糖酵解速率明显下降,这一现象与前面线粒体膜电位、OCR的结果完全一致。
4 结 论
本研究初步解析了线粒体tRNA-Lys(T7719G)变异影响绵羊颗粒细胞凋亡的生理机制,即tRNA-Lys(T7719G)变异影响tRNA-Lys稳态和氨酰化水平,影响mtDNA 编码的多肽翻译效率,同时引起拷贝数、ATP水平、ROS含量和部分酶活性变化,进而改变线粒体能量代谢功能和细胞凋亡。
参考文献(References):
[1] LIU H,SHI W S,WANG D,et al.Association analysis of mitochondrial DNA polymorphisms with oocyte number in pigs[J].Reprod Fertil Dev,2019,31(4):805-809.
[2] WANG D,NING C,XIANG H,et al.Polymorphism of mitochondrial tRNA genes associated with the number of pigs born alive[J].J Anim Sci Biotechnol,2018,9:86.
[3] CHEN X Y,WANG D,XIANG H,et al.Mitochondrial DNA T7719G in tRNA-Lys gene affects litter size in small-tailed Han sheep[J].J Anim Sci Biotechnol,2017,8:31.
[4] MATSUDA F,INOUE N,MANABE N,et al.Follicular growth and atresia in mammalian ovaries:regulation by survival and death of granulosa cells[J].J Reprod Dev,2012,58(1):44-50.
[5] LUDDI A,GORI M,MARROCCO C,et al.Matrix metalloproteinases and their inhibitors in human cumulus and granulosa cells as biomarkers for oocyte quality estimation[J].Fertil Steril,2018,109(5):930-939.e3.
[6] KULUS M,KRANC W,SUJKA-KORDOWSKA P,et al.The processes of cellular growth,aging,and programmed cell death are involved in lifespan of ovarian granulosa cells during short-term IVC-study based on animal model[J].Theriogenology, 2020,148:76-88.
[7] AGUIAR F L N,GASTAL G D A,ALVES K A,et al.Supportive techniques to investigate in vitro culture and cryopreservation efficiencies of equine ovarian tissue:a review[J].Theriogenology,2020,156:296-309.
[8] 郗红燕,张 杨,赵小萱,等.卵巢早衰病理机制最新研究进展[J].辽宁中医药大学学报,2019,21(12):103-106.
XI H Y,ZHANG Y,ZHAO X X,et al.Recent research progress on pathological mechanisms of premature ovarian failure[J].Journal of Liaoning University of Traditional Chinese Medicine,2019,21(12):103-106.(in Chinese)
[9] SZCZEPANOWSKA J,MALINSKA D,WIECKOWSKI M R,et al.Effect of mtDNA point mutations on cellular bioenergetics[J]. Biochim Biophys Acta,2012,1817(10):1740-1746.
[10] LABARTA E,DE LOS SANTOS M J,ESCRIB M J,et al.Mitochondria as a tool for oocyte rejuvenation[J].Fertil Steril,2018, 111(2):219-226.
[11] ZHOU M,WANG M,XUE L,et al.A hypertension-associated mitochondrial DNA mutation alters the tertiary interaction and function of tRNA-Leu(UUR)[J].J Biol Chem,2017,292(34):13934-13946.
[12] FLORENTZ C,SOHM B,TRYOEN-TTH P,et al.Human mitochondrial tRNAs in health and disease[J].Cell Mol Life Sci,2003, 60(7):1356-1375.
[13] WITTENHAGEN L M,KELLEY S O.Impact of disease-related mitochondrial mutations on tRNA structure and function[J]. Trends Biochem Sci, 2003,28(11):605-611.
[14] CHOMYN A,ENRIQUEZ J A,MICOL V,et al.The mitochondrial myopathy,encephalopathy,lactic acidosis,and stroke-like episode syndrome-associated human mitochondrial tRNALeu(UUR) mutation causes aminoacylation deficiency and concomitant reduced association of mRNA with ribosomes[J].J Biol Chem,2000,275(25):19198-19209.
[15] YASUKAWA T,SUZUKI T,UEDA T,et al.Modification defect at anticodon wobble nucleotide of mitochondrial tRNAsLeu(UUR) with pathogenic mutations of mitochondrial myopathy,encephalopathy,lactic acidosis,and stroke-like episodes[J].J Biol Chem,2000,275(6):4251-4257.
[16] GONG S S,PENG Y Y,JIANG P P,et al.A deafness-associated tRNAHis mutation alters the mitochondrial function,ROS production and membrane potential[J].Nucleic Acids Res,2014,42(12):8039-8048.
[17] 张 晔.冠心病相关线粒体m.15927Ggt;A突变致病机制及其组织特异性研究[D].杭州:浙江大学,2019.
ZHANG Y.Pathogenesis and tissue specificity of 5927Ggt;A mutation in mitochondria associated with coronary artery disease[D].Hangzhou:Zhejiang University,2019.(in Chinese)
[18] 向军军,赖菁菁,胡跃强.近3年线粒体介导细胞凋亡的研究进展[J].中西医结合心脑血管病杂志,2016,14(13):1497-1499.
XIANG J J,LAI J J,HU Y Q.Research progress of mitochondria-mediated apoptosis in the last 3 years[J].Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease,2016,14(13):1497-1499.(in Chinese)
[19] 黄慧敏,管敏鑫.携带线粒体tRNAMet4435Agt;G突变的原发性高血压家系的线粒体功能研究[J].中国细胞生物学学报, 2020,42(2):220-229.
HUANG H M,GUAN M X.A study of mitochondrial function in an essential hypertension family carrying mitochondrial tRNAMet4435Agt;G mutation[J].Chinese Journal of Cell Biology,2020,42(2):220-229.(in Chinese)
[20] 韩红叶.CTSB基因对绵羊卵巢颗粒细胞功能的影响[D].保定:河北农业大学,2021.
HAN H Y.Effect of CTSB gen on the function of ovarian granulosa cells in sheep[D].Baoding:Hebei Agricultrual University,2021.(in Chinese)
[21] 李雨佳,庞米米,鲍登克.线粒体功能异常与肿瘤[J].生理科学进展,2020,51(4):283-288.
LI Y J,PANG M M,BAO D K.Mitochondrial dysfunction and tumor[J].Progress in Physiological Sciences,2020,51(4):283-288.(in Chinese)
[22] 闫明静,沈 涛.线粒体功能障碍与血管内皮损伤的研究进展[J].中国动脉硬化杂志,2021,29(10):829-837.
YAN M J,SHEN T.The research progress on mitochondrial dysfunction and vascular endothelial cell injury[J].Chinese Journal of Arteriosclerosis,2021,29(10):829-837(in Chinese)
[23] 陈晓勇.绵羊产羔数性状线粒体基因效应研究[D].北京:中国农业大学,2014.
CHEN X Y.Study on ovine mitochondrial DNA effect for litter size[D].Beijing:China Agricultural University,2014.(in Chinese)
[24] 李昌凡,林铭鑫,卢雪瑶,等.线粒体代谢物转运及其在微生物细胞工厂应用中的研究进展[J].食品与生物技术学报,2022,41(7):32-43.
LI C F,LIN M X,LU X Y,et al.Research progress in mitochondrial metabolite transport and its application in microbial cell factories[J].Journal of Food Science and Biotechnology,2022,41(7):32-43.(in Chinese)
[25] 齐瑞芳,李 娜,王立军,等.低氧预适应对小鼠海马HT22细胞线粒体能量代谢的影响[J].安徽医科大学学报,2022,57(10):1585-1588,1594.
QI R F,LI N,WANG L J,et al.Effects of hypoxic preconditioning on energy metabolism of mitochondria in mouse hippocampal HT22 cells[J].Acta Universitatis Medicinalis Anhui,2022,57(10):1585-1588,1594.(in Chinese)
[26] 缪 鑫,林俊卿,郑宪友.线粒体功能障碍在脊髓损伤中的作用及相关治疗研究进展[J].中国修复重建外科杂志,2022,36(7):902-907.
MIAO X,LIN J Q,ZHENG X Y.Advances of the role of mitochondrial dysfunction in the spinal cord injury and its relevant treatments[J].Chinese Journal of Reparative and Reconstructive Surgery,2022,36(7):902-907.(in Chinese)
[27] 曹纪辉,吴贤波,丁若兰,等.参芪复方对GK大鼠骨骼肌线粒体膜电位及相关促凋亡蛋白的影响研究[J].世界科学技术-中医药现代化,2021,23(7):2302-2308.
CAO J H,WU X B,DING R L,et al.Effects of Shenqi compound prescription on skeletal muscle mitochondrial membrane potential and related pro-apoptotic proteins in GK rats[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2021,23(7):2302-2308.(in Chinese)
[28] 文禹粱,刘 秀,王继卿,等.哺乳动物线粒体动力学和氧化磷酸化研究进展[J].畜牧兽医学报,2021,52(2):273-285.
WEN Y L,LIU X,WANG J Q,et al.Research progress of mitochondrial dynamics and oxidative phosphorylation in mammal[J].Acta Veterinaria et Zootechnica Sinica,2021,52(2):273-285.(in Chinese)
[29] 刘 娟.二甲双胍靶向AMPK/TFEB/LAMP1轴增强颗粒细胞及小鼠卵巢抗氧化损伤的作用及机制研究[D].贵阳:贵州大学,2021.
LIU J.Effect and mechanism of metformin targeting AMPK/TFEB/LAMP1 axis on antioxidant damage of granulosa cells and mouse ovary[D].Guiyang:Guizhou University,2021.(in Chinese)
[30] 张暄琳,李 毅,刘 丽,等.炎症因子对非PCOS患者颗粒细胞活性氧水平及线粒体DNA拷贝数的影响[J].天津医药,2016,44(9):1099-1101.
ZHANG X L,LI Y,LIU L,et al.Effects of inflammatory markers on the level of reactive oxygen species and mitochondria DNA copy numbers in granulosa cells of patients without PCOS[J].Tianjin Medical Journal,2016,44(9):1099-1101.(in Chinese)
[31] 邓毕华,陈晓峰.干扰FSCN1基因表达对前列腺癌细胞凋亡、活性氧水平影响的研究[J].中华细胞与干细胞杂志(电子版),2020,10(1):1-6.
DENG B H,CHEN X F.Effect of interfering FSCN1 gene expression on apoptosis and ROS content in prostate cancer cells[J]. Chinese Journal of Cell and Stem Cell (Electronic Edition),2020,10(1):1-6.(in Chinese)
[32] BETARELLI R P,ROCCO M,YESTE M,et al.The achievement of boar sperm in vitro capacitation is related to an increase of disrupted disulphide bonds and intracellular reactive oxygen species levels[J].Andrology,2018,6(5):781-797.
[33] LIU S Y,WANG S,ZHAO Y Z,et al.Depleted uranium causes renal mitochondrial dysfunction through the ETHE1/Nrf2 pathway[J].Chem Biol Interact,2023,372:110356.
[34] MADSEN-BOUTERSE S A,ZHONG Q,MOHAMMAD G,et al.Oxidative damage of mitochondrial DNA in diabetes and its protection by manganese superoxide dismutase[J].Free Radic Res,2010,44(3):313-321.
(编辑 郭云雁)

