基于转录组测序研究绿光影响鹅胚心脏早期发育的候选基因



摘 要: 旨在通过分析鹅胚心脏在绿光光照刺激下的基因表达差异,挖掘心脏发育的候选基因。本研究将512枚鹅种蛋,随机均分在正常黑暗孵化以及补充绿光的两台孵化机中,每台孵化机内放置4层(64枚·层-1),绿光孵化机提供15 min开灯和15 min关灯的间歇光照。在孵化第13、16、20、24、28和30天时,每组随机挑选种蛋8枚,称取胚胎重量,分离胚胎心脏组织并称重;采集孵化第13天的胚胎心脏组织(每组各3),进行转录组测序(RNA-Seq),筛选差异表达基因(DEGs)并进行功能富集分析,鉴定与绿光促进心脏发育相关的候选基因。并通过荧光定量PCR(qRT-PCR方法)验证测序结果的可靠性。结果表明:绿光显著提高16和30胚龄胚重比例(胚胎重/入孵蛋重×100)(Plt;0.05),以及13和16胚龄心脏指数(心脏重/胚胎重×100)(Plt;0.05)。心脏转录组测序分析共筛选出1 643个DEGs。随机选择 7个DEGs 进行 RT-qPCR 验证,表达趋势与测序结果一致。功能富集分析表明,DEGs 主要涉及PI3K-Akt信号通路、AMPK信号通路等通路,最终筛选出GATA4、GATA5、Smad4和GHR这4个候选基因。对它们在不同胚龄阶段心脏组织中的mRNA表达量进行分析,其表达模式进一步表明了其在绿光调控心脏发育过程中的作用。本研究发现,鹅蛋孵化期绿光处理促进了胚胎和心脏发育,进一步通过心脏组织转录组数据分析,鉴定到了4个鹅胚心脏发育候选基因 GATA4、GATA5、Smad4和GHR,为鹅胚心脏组织发育的分子调控机制提供了线索,并为绿光应用于鹅种蛋孵化提供了理论基础。
关键词: 鹅;绿光;孵化;心脏;转录组;GATA4
中图分类号:S835.2
文献标志码:A""" 文章编号:0366-6964(2024)05-1978-11
收稿日期:2023-09-26
基金项目:国家现代农业产业技术体系(CARS-42-20);国家自然科学基金青年项目(32202622);江苏省农业科技自主创新资金项目(CX(21)2013)
作者简介:陈 哲(1982-),男,山东泰安人,副研究员,博士,主要从事动物繁育与环境控制研究,E-mail:chenzzju@163.com
*通信作者:闫乐艳,主要从事家禽繁殖调控与健康养殖研究,E-mail:yanleyan198469@126.com
Study on Candidate Genes for Green Light Affecting Early Development of Goose Embryo Heart Based on Transcriptome Sequencing
CHEN" Zhe1,2, QU" Xiaolu3, GUO" Binbin1,2, SUN" Xuefeng1,2, YAN" Leyan1,2*
(1.Institute of Animal Science, Jiangsu Academy of Agricultural Sciences, Nanjing 210014,
China;
2.Key Laboratory for Crop and Animal Integrated Farming, Ministry of Agriculture
and Rural Affairs, Nanjing 210014," China;
3.Agricultural Genomics Institute at Shenzhen,
Chinese Academy of Agricultural Sciences, Shenzhen 518100," China)
Abstract:" The aim of this study was to identify candidate genes for heart development in goose embryos by analyzing the gene expression differences in embryonic hearts tissue under green light stimulation. The 512 goose eggs were randomly divided equally into green light and dark incubators, with 4 layers and 64 eggs per layer placed in each incubator. During the entire incubation period, the green light incubator provided intermittent light regimen of 15 minutes on and 15 minutes off. On the 13, 16, 20, 24, 28, and 30 day of incubation, 8 eggs were randomly selected from each group, the embryo weight was measured, and the embryonic heart tissue was separated and weighed. The embryonic heart tissues were collected at day13 of incubation, and transcriptome sequencing (RNA-Seq) were performed. Differentially expressed genes (DEGs) were screened, and subjected to functional enrichment analysis to identify candidate genes related to green light promoting heart development. And the reliability of the sequencing results was validated using fluorescence quantitative PCR (qRT-PCR). The green light significantly increased the proportion of embryo weight at 16 and 30 embryonic ages (embryo weight/hatched egg weight×100) (Plt;0.05), and the heart index (heart weight/embryo weight×100) at 13 and 16 embryonic ages in the green light group were significantly higher than individuals in the dark group (Plt;0.05). A total of 1 643 DEGs were screened from the green light group and the dark group, 7 DEGs were randomly selected for RT-qPCR validation, and the expression trend was consistent with the sequencing results. Enrichment analysis showed that DEGs were mainly enriched in the PI3K-Akt signaling pathway, AMPK signaling pathway, and other pathways. Four candidate genes: GATA4, GATA5, Smad4 and GHR were ultimately screened out. Their expression in heart tissues at different embryonic ages were analyzed to further validated their regulatory role in heart development. Through the analysis of transcriptomic data of heart tissue, we identified GATA4, GATA5, Smad4 and GHR as candidate genes for goose embryonic heart development, which provide clues to the molecular regulatory mechanism of green light on embryonic heart development, and provide a theoretical basis for the application of green light in goose egg hatching.
Key words: goose; green light; incubation; heart; transcriptome; GATA4
*Corresponding author:YAN Leyan, E-mail:yanleyan198469@126.com
商业化生产中,禽蛋通常在闭灯黑暗环境下进行孵化。但在自然孵化过程中,母禽会离巢采食和饮水,使得种蛋会接受一部分外界的光照刺激[1]。禽类对光照敏感,因此在家禽生产中,光照调控逐渐成为调节家禽生产性能的重要手段[2]。在肉鸡、蛋鸡、鹌鹑和火鸡上的研究表明,在孵化期给予禽蛋适宜的光照刺激可以影响胚胎肌肉发育、改变出雏窗口期,并对雏禽生长等具有重要影响,且对家禽出壳后健康及福利生长具有长期效应[3-8]。胚胎在孵化第2天便可以感受到光刺激[9-10]。进一步研究表明,不同波长的光线调控禽类胚胎发育存在区别,而单色绿光是促进胚胎发育的优势光色[11-12]。绿光改善禽蛋孵化效率的调控机制目前还不明确,本课题组最近的一项研究表明,绿光可能通过影响肝脏糖代谢从而促进胚胎发育[13],是否存在其它调控机制还需要进一步的研究。
在禽类胚胎中,心脏是第一个发育的功能性器官[14],孵化第2天可见发育成型并出现节律性泵动;伴随卵黄膜血管的发育,将血液分配到各种组织以满足氧气和营养需求,维持胚胎体循环和能量代谢过程。研究发现,孵化期1~18 d单色绿光照射(12L:12D)可极显著提升初生肉种鸡心脏相对重量[15]。此外,光照对胚胎心率水平也有潜在影响,暴露在光照条件下的体外心脏组织[16]以及光照条件下的鸡胚胎心脏心率都有显著增加[9]。因此推测,孵化期光照可以调节胚胎心脏发育,但具体的作用机制还不明确。且前期研究主要关注光照对孵化后期或出壳当天心脏的影响[12,15],但对心脏发育全程,尤其是胚胎早期心脏发育影响的研究较少。
转录组测序技术(RNA-Seq)已经在家禽研究领域成熟应用,是挖掘特定环境下差异表达基因和调控网络的有效工具[17]。我国肉鹅出栏量占世界总出栏量的94%。但鹅种蛋重量大、孵化时间长、入孵操作程序繁琐,相比于鸡、鸭种蛋,鹅种蛋孵化率不高且不稳定,因此开发有效的孵化技术手段提高鹅种蛋孵化率非常重要。本研究拟分析绿光对鹅种蛋孵化的影响;同时,针对在鹅种蛋孵化期应用绿光,采用转录组分析技术筛选差异表达基因,揭示绿光刺激诱导胚胎心脏发育的信号通路,发掘胚胎心脏发育关键候选基因,为绿光在鹅种蛋孵化中的应用提供理论基础。
1 材料与方法
1.1 试验材料
512枚泰州鹅种蛋(蛋重143.7~152.5 g,均重(147.6±0.15) g)购自泰州金鹏鹅业专业合作社,被随机分配到2个微电脑全自动控制孵化机中(型号:HX-100,南京市恒信孵化设备有限公司)。对照组为正常的不补充光照的黑暗组(D组,256枚),试验组补充绿色光照(G组,256枚)。每台孵化机内放置4层蛋盘(设为4个重复),每层64枚。光源由LED灯带(珠海雷士照明有限公司)提供,蛋壳表面光照强度约为36 W/m2。采用15 min开灯和15 min关灯的间歇光照制度[18]。第1~28天每90 min翻蛋一次,第28天停止翻蛋并转移到出雏机中。孵化第7和18天照蛋,剔除无精蛋和死胚蛋。孵化试验于2021年3月10日至4月9日在江苏省农业科学院畜牧研究所孵化实验室完成。
在孵化第13(E13)、16(E16)、20(E20)、24(E24)、28(E28)和30天(E30)时,每组从每层的蛋盘中随机挑选种蛋2枚,即每组共8枚,破壳后将胚胎表面的膜等剥离后称取重量;解剖胚胎,分离心脏组织,排出心脏内血液后称重;采集心脏组织样置于液氮中速冻,-80℃保存,用于后续的荧光定量PCR分析。对各时间段胚重比例(胚胎重/入孵蛋重×100)和心脏指数(心脏重/胚胎重×100)分析后,选取心脏指数差异最显著时间段(E13)的心脏组织样,每组各3个,-80℃保存用于开展转录组测序分析。
1.2 主要试剂
Trizol、反转录试剂HiScript III RT SuperMix for qPCR (+gDNA wiper)、荧光定量PCR试剂盒(ChamQ Universal SYBR qPCR Master Mix)均购自南京诺唯赞生物科技有限公司;PCR仪(Bio-Rad)购自美国Bio-Rad公司。实时荧光定量PCR仪(ABI 7500)购自美国Applied Biosystems公司。
1.3 鹅胚心脏组织转录组测序
采用Trizol法提取E13阶段鹅胚心脏总RNA,琼脂糖凝胶电泳检测质量,结合核酸分析仪测定总RNA的纯度和浓度,选用OD值为1.8~2.0的RNA为模板,-80 ℃保存。整个转录组文库的制备和测序在Sangon Biotech(中国,上海)进行。对测序合格的RNA使用NEBNext UltraTM RNA Library Pre Kit制备cDNA文库,利用Agilent Bioanalyzer 2100系统评估文库质量,基于Illumina Hiseq平台,对质检合格的文库进行测序,回收测序数据。
1.4 测序数据的处理与分析
对获得的原始数据(Raw reads)通过FastQC软件进行质量评估,使用Trimmomatic消除接头和低质量reads,得到高质量数据(clean reads)用于后续的数据分析。并使用Trinity软件进行转录本组装拼接,完整 Reads 使用Bowtie2(-bowtie2-mismatch-rate)与鹅参考基因组进行比对。基于上述比对结果,对各个样本中比对到参考基因组的各unigene(非重复序列)上的Reads进行定量,并进行FPKM(fragments per kilo base of exon model per million mapped reads)值的转换,从而获取各条unigene的表达水平。基于定量得到的各unigene的FPKM值进行样品间差异基因比较,利用DEGSeq2进行基因差异表达分析,将qlt;0.05和log2(fold change)≥1设置为差异表达基因的阈值,获得D组和G组的差异表达基因。
对获得的显著差异表达基因利用基因本体论分析(Gene Ontology)数据库进行基因功能注释。并导入KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库进行富集分析,确定显著差异表达基因参与的最主要生化代谢途径和信号转导途径。
1.5 实时荧光定量 PCR(qRT-PCR)验证
采用Trizol法提取不同胚龄阶段心脏组织的总RNA。利用HiScript III RT SuperMix for qPCR (+gDNA wiper)将纯化的 RNA 逆转录成 cDNA。根据转录组测序分析结果,选取 GATA4、GATA5、生长激素受体(growth hormone receptor,GHR)、Smad4、FOX3、CYP11B1、Lipocalin等7个差异表达基因,参照GenBank数据库鸿雁(Anser cygnoides)基因组中的相应基因序列,使用Primer 5.0 软件(www. ncbi. nlm. nih. gov/tools/Primer-blast/)Primer-BLAST软件(https://www.ncbi.nlm.nih.gov/tools/Primer-blast/)设计基因特异性引物,并以β-actin为内参基因(表1)。引物合成由生工生物工程(上海)股份有限公司完成。
使用 ChamQ Universal SYBR qPCR Master Mix 试剂盒和ABI 7500 实时荧光定量PCR仪(Applied Biosystems, 美国)进行荧光定量验证。反应体系共 20 μL:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,cDNA 1 μL,ddH2O 8.2 μL。PCR 扩增程序:预变性阶段为 95 ℃ 30 s;循环反应为 95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s(40个循环);熔解曲线为 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样品进行 3 次生物学重复。
除用E13的心脏组织总RNA作为模板验证转录组测序结果的准确性外,还提取不同胚龄心脏组织的RNA,对GATA4、GATA5、GHR、Smad4基因的表达量进行检测。每个样本重复分析3次。
1.6 数据统计分析
采用2-ΔΔCt法对基因相对表达量进行统计分析。试验数据使用“平均数±标准差”表示。利用 SPSS 22.0 软件对所得表达量进行t检验分析或单因素方差分析(One-way ANOVA),以*P<0.05 表示差异显著,**P<0.01 表示差异极显著。采用GraphPad Prism 8 软件进行绘图。
2 结 果
2.1 绿光光照对鹅胚及心脏重的影响
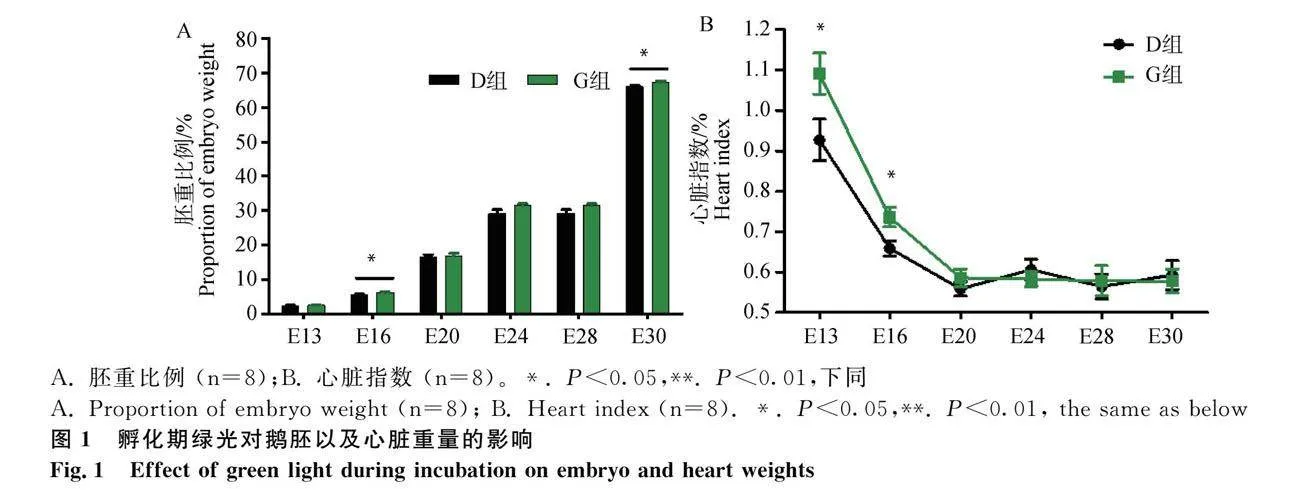
孵化期绿光处理对鹅胚胚胎及心脏重的影响见图1。对孵化期不同胚龄鹅胚及其心脏称重的结果显示,绿光对鹅胚胚胎发育有明显的促进作用,尤其在种蛋孵化至16胚龄和30胚龄时,绿光组鹅胚的胚重比例显著高于在黑暗条件下孵化的鹅胚的胚重比例(Plt;0.05,图1A);其它胚胎阶段绿光对胚胎发育也有促进作用,但与黑暗组的差异不显著。而心脏指数在鹅胚孵化至13胚龄和16胚龄时均显著高于黑暗组中孵化的鹅胚的心脏指数(Plt;0.05,图1B)。
2.2 转录组测序数据分析
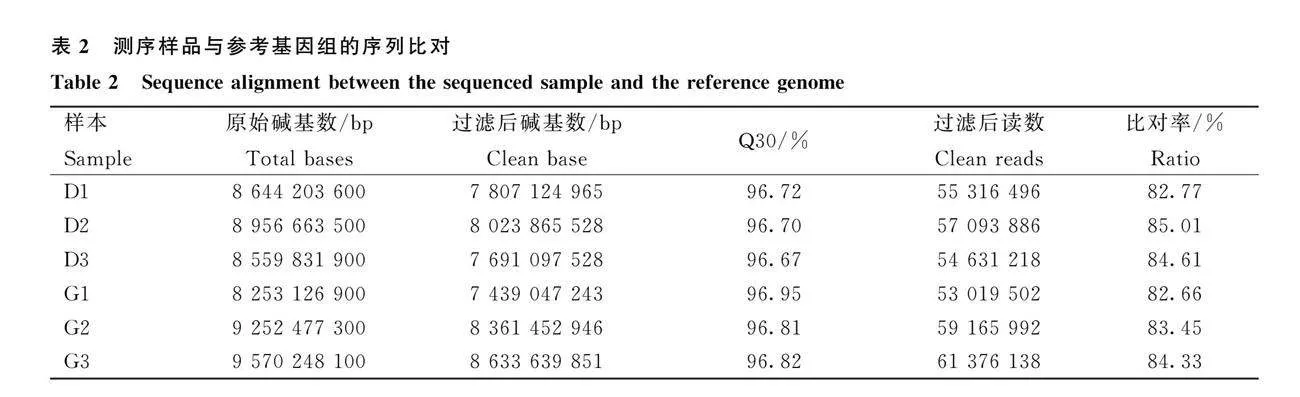
两个组分别取孵化期E13心脏组织样品进行转录组测序。测序结果如表2所示,平均每个样品产出8 872 758 550 bp原始数据(Raw reads),经过质量控制,质控率均在90.08%,Q30碱基百分比都在94%以上。将clean reads与鹅参考基因组(Anser cygnoides)基因组进行比对,比对率为82.66%~85.01%,表明测序数据满足后续分析的要求。
2.3 差异表达基因及功能分析
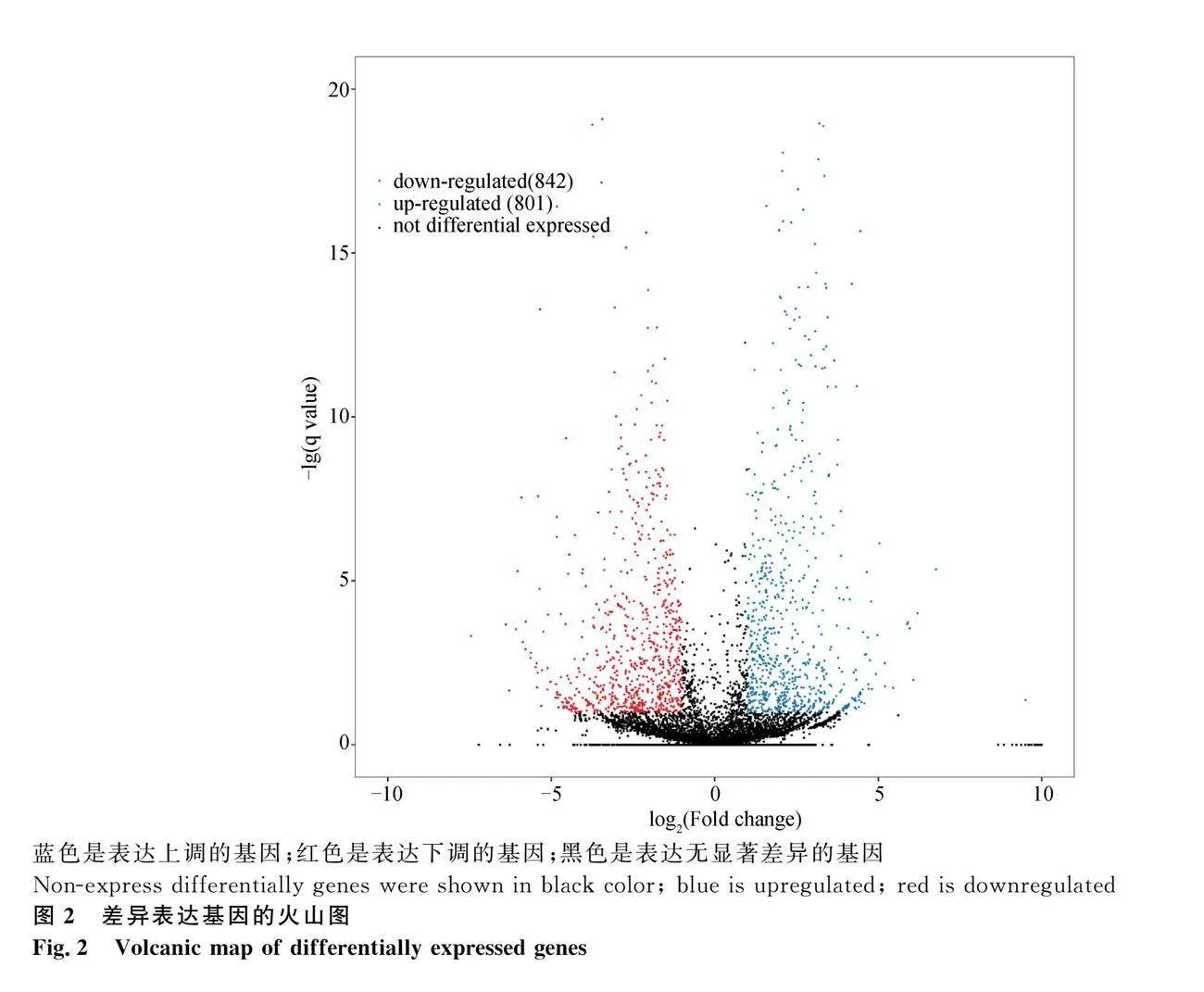
按照显著性qlt;0.05,表达差异倍数log2Fold Change≥1.0标准,绿光处理组和对照黑暗组鹅胚心脏组织中共筛选得到1 643个差异基因(DEGs),其中842个显著上调基因,801个显著下调基因(图2)。
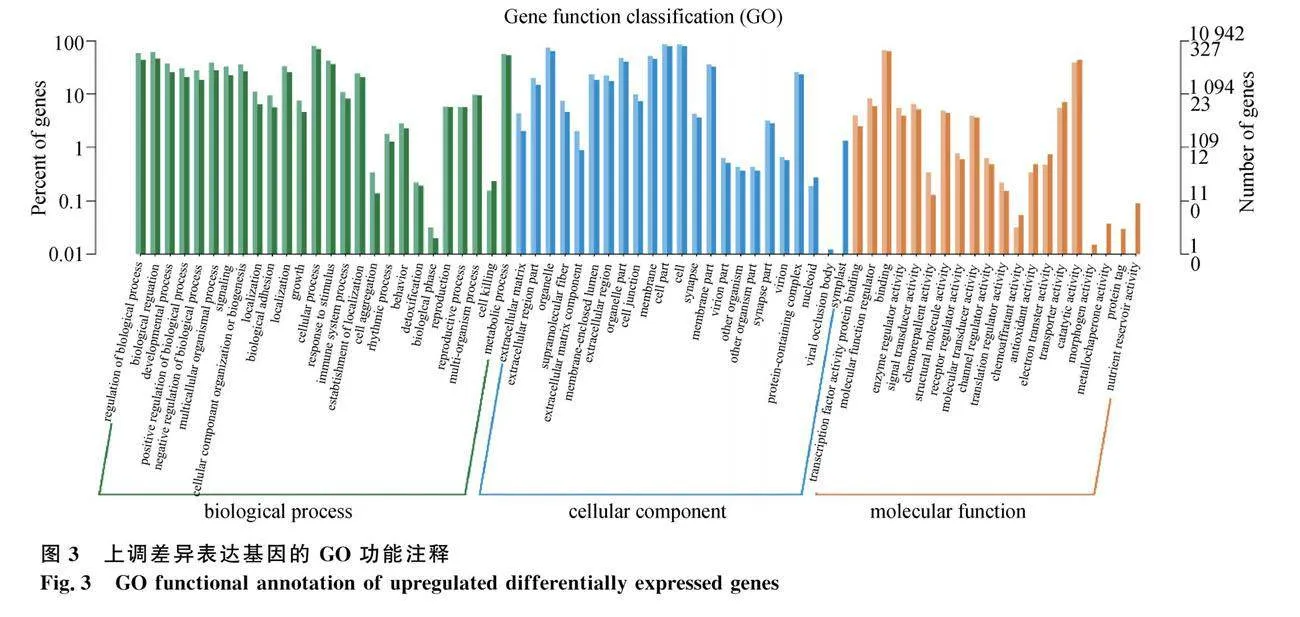
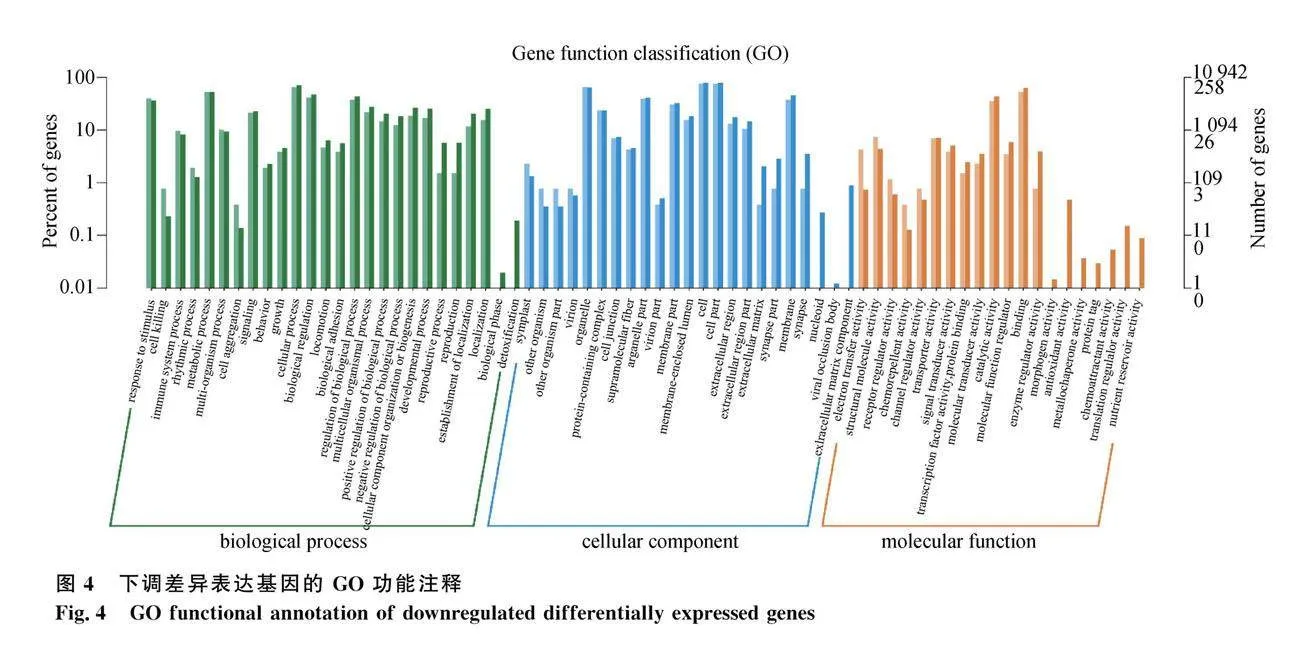
由图3可知,上调差异基因主要富集到在发育过程(developmental process)、细胞进程(cellular process)、代谢进程(metabolic process)、对刺激的反应(response to stimulus)、信号转导(signal transduction)、催化活性(catalytic activity)等GO条目。而下调差异基因富集分析结果见图4,主要集中在代谢进程(metabolic process)、生物学过程(biological process)、发育过程(developmental process)、催化活性(catalytic activity)等GO条目。
KEGG富集分析发现,差异表达基因共富集到240个通路。图5列出了前30个显著富集到的通路,主要包括PI3K-Akt信号通路(PI3K-Akt signaling pathway)、AMPK信号通路(AMPK signaling pathway)、黏着斑(focal adhesion)、轴突导向(axon guidance)、胰岛素信号通路(insulin signaling pathway)、肌动蛋白细胞骨架调节(regulation of actin cytoskeleton)等。包含差异基因较多的通路与心脏发育和细胞发育密切相关。
2.4 差异表达基因的qRT-PCR验证结果
随机选取出GATA4、GATA5、GHR、Smad4、FOX3、CYP11B1、Lipocalin等7个基因进行qRT-PCR检测。如图6所示,E13阶段GATA4、GATA5、GHR、Smad4、FOX3等5个基因在绿光组鹅胚胎心脏中的相对表达量均显著高于黑暗组的胚胎中的表达量(Plt;0.05),而CYP11B1、""""" Lipocalin在E13阶段绿光组胚胎心脏中的表达量均显著低于黑暗组胚胎(Plt;0.05)。qRT-PCR 结果与 RNA-Seq 测序结果表达趋势一致,表明转录组测序结果的真实性和准确性。
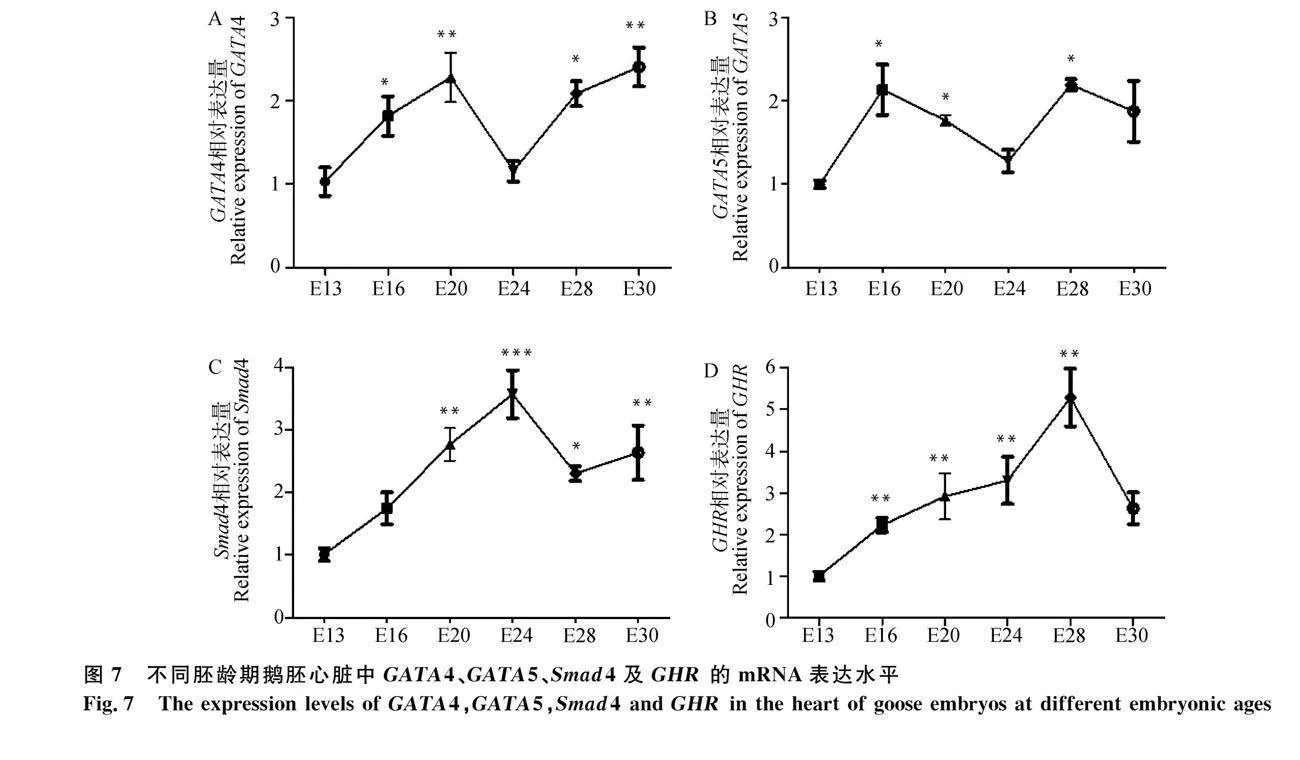
2.5 候选基因在不同胚龄心脏组织中相关基因表达量的分析
对差异表达基因进行功能注释、通路富集和特异性筛选,筛选出GATA4、GATA5、Smad4和GHR这4个调控心脏发育的候选基因。对候选基因在黑暗组孵化期6个阶段的mRNA相对表达量进行检测,发现GATA4的mRNA表达量在E16、E20、E28和E30阶段鹅胚心脏组织中均显著性高于E13阶段(Plt;0.05),而在E24阶段表达有一个明显的下降(Pgt;0.05)(图7A)。从图7B可以看出,GATA5的mRNA表达量与GATA4表达量在趋势基本一致,在E16、E20、E28阶段心脏组织中表达量均显著性高于E13阶段(Plt;0.05)。与13胚龄的鹅胚心脏组织相比,Smad4的表达量在20和24胚龄显著升高(Plt;0.05),在28和30胚龄时表达量略有下降,但仍明显高于13胚龄(Plt;0.05)(图7C)。
此外,对GHR在各胚龄心脏组织中的相对表达量也进行了检测,结果显示:GHR基因的mRNA表达量随着胚龄的增加而显著增加(Plt;0.05),但在出壳前即30胚龄时有明显的下降(图7D)。
2.6 绿光处理对候选基因在30胚龄心脏组织中相关基因表达量的影响
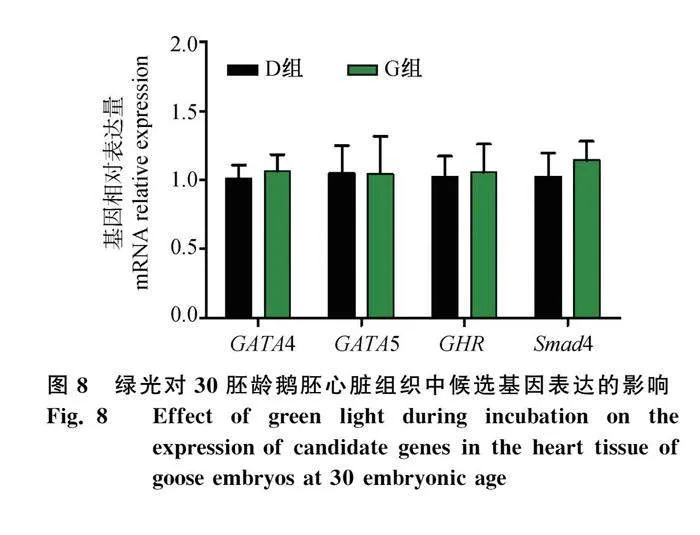
此外,孵化期绿光处理,对30胚龄阶段鹅胚心脏组织中GATA4、GATA5、Smad4以及GHR mRNA表达也进行检测。如图8所示,与对照的黑暗条件下孵化相比,绿光孵化的鹅胚心脏组织中GATA4、GATA5、Smad4以及GHR的表达量均无显著差异(Pgt;0.05)。这也与绿光处理对该胚龄时心脏发育指数无明显影响的结果一致。
3 讨 论
光照是影响家禽繁殖性能的重要环境因素之一,已经在鹅的各个生产环节中广泛应用并明显提高了鹅的产蛋性能[19-20],但对于鹅种蛋孵化这一关键环节,人工光照的应用还十分缺乏。仅有前期的研究结果表明,孵化期绿光处理可能通过调控肝脏组织的糖代谢而促进胚胎发育和提高出雏性能[13]。胚胎期是心脏发育的关键时期,很容易受到自身基因表达变化和外界环境因素的影响而发育异常[21]。在其它禽类上的研究指出,孵化期光照处理可以调节胚胎心脏发育[15],但具体的作用机制还不明确。
本研究对孵化期鹅蛋绿光处理后的胚胎重量和心脏重量进行分析,发现绿光促进胚胎发育,胚重比例高于在黑暗条件下孵化的胚重比例。绿光对心脏的发育也起到促进作用,尤其是在孵化至13胚龄和16胚龄时,心脏指数均显著高于黑暗组中孵化鹅胚的心脏指数;但在孵化后期,对心脏指数并没有显著性影响。这与在肉种鸡上的研究结果有些类似,即孵化期1~18 d单色绿光照射(12L:12D)显著提升16和21胚龄鸡胚心脏的重量[15]。
进一步对绿光孵化和黑暗中孵化第13天的鹅胚心脏组织进行转录组对比分析,筛选出1 643个差异基因,结合GO基因功能分析以及 KEGG富集分析,筛选出了GATA4、GATA5、Smad4和GHR这几个差异表达候选基因,这些基因富集在与心脏发育和细胞发育相关的信号通路上。对不同胚龄阶段心脏组织中这几个候选基因的mRNA检测发现,随着胚龄的增加,GATA4、GATA5、Smad4和GHR的表达都呈现上升的趋势。而在30胚龄时,绿光组心脏组织中这几个基因的表达量与黑暗组并没有明显差异,这与绿光对于这一阶段心脏指数没有明显影响的结果一致。这些结果表明,鉴定到的差异基因可能参与胚胎心血管发育和功能,是研究绿光调控鹅胚心脏发育的候选基因。
GATA4和GATA5(GATA结合蛋白4和5)是一类含锌指的DNA结合转录因子,对正常心脏发育和稳态至关重要[22-23]。尤其是GATA4在胚胎期的作用更为重要,GATA4是心脏前体细胞出现的最早期标志之一[24],在整个发育过程中表达,也在成年机体心脏中表达,缺乏GATA4的小鼠胚胎心脏形态发生缺陷,并在胚胎第8.5天死亡[25]。其基因突变可导致先天性心肌病[26-28]。本研究发现,GATA4和GATA5在各胚胎时期心脏中均有表达,且表达量呈现整体逐渐上升的趋势,暗示其在鹅胚胎期心脏发育过程中均具有较为重要的作用。孵化期绿光处理后,在13胚龄时胚胎心脏指数增加的同时伴随着GATA4和GATA5表达的增加,而在30胚龄时绿光对心脏指数以及GATA4和GATA5的表达均无明显影响,证明GATA4和GATA5在胚胎期的心脏发育过程中发挥了重要作用。
Smads蛋白是转化生长因子β(TGF-β)超家族受体的主要信号转导分子。Smad4是通用型的Smads,与激活的其它Smads形成异源的多聚复合物,从而发挥作用。TGF-β1/Smad4信号通路在SD大鼠胚胎心脏发育不同时期发挥着不同的作用[29]。缺失Smad4将导致心脏α肌动蛋白、α肌球蛋白重链等表达下调,心脏表现为小梁结构破坏、室间隔缺损[30],甚至导致胚胎死亡[31]。本研究发现,Smad4基因表达量在孵化期绿光处理引起的心脏发育变化过程中存在差异,且随着胚龄增加和心脏发育进程,其表达量是上升的,均提示了Smad4在鹅胚心脏发育过程中发挥了作用。
生长激素受体(GHR)是一种单链跨膜糖蛋白,位于动物生长轴中心位置的生长激素(GH)主要通过和靶器官的GHR相结合发挥调控动物生长发育的作用[32]。在鸡胚的器官发育过程中,GH和GHR均可以在胚胎的心脏中检测到[33]。在雏鹅的心脏中也检测到了GHR的表达,且GHR mRNA表达量的峰值出现在0~28 d阶段,提示GHR mRNA可能主要在鹅早期生长发育阶段起调节作用[34]。在鹅胚阶段检测到GHR mRNA的持续表达,但在孵化后期显著降低,这与在鸡胚胎上的结果相似,即在孵化后期和出壳后的早期阶段,GH下调GHR表达,使得GHR 表达急剧下降[35]。孵化期绿光刺激不仅可以增加肌肉中GHR的表达[36],还可以增加肝脏中GHR的表达,从而加速肌肉发育并增加胚胎重量[11]。本试验中,在13胚龄时绿光组心脏中GHR表达高于对照的黑暗组,这与绿光促进心脏发育的结果是相符的;而在30胚龄时,绿光对心脏发育无明显促进作用的同时对GHR mRNA的表达也无显著影响。这些都证明了GHR对鹅胚的心脏发育也起到了重要的作用。
4 结 论
本研究发现,鹅蛋孵化期绿光处理后,胚重比例和心脏指数在16胚龄时均显著高于正常黑暗条件下孵化的鹅胚;而在30胚龄时,仅胚重比例存在显著差异。进一步结合RNA-Seq技术,筛选出GATA4、GATA5、Smad4、GHR可能与心脏发育相关。本研究结果为进一步探究种蛋孵化期绿光处理促进鹅胚和心脏发育的分子机制提供了线索,并为绿光应用于鹅种蛋孵化提供了理论基础。
参考文献(References):
[1] 陈 哲,陈永霞,于建宁,等.光照在禽蛋孵化期的应用和研究进展[J].中国家禽,2018,40(4):1-6.
CHEN Z,CHEN Y X,YU J N,et al.Application and research progress of illumination during avian hatching process[J].China Poultry,2018,40(4):1-6.(in Chinese)
[2] 泮进明,王小双,蒋劲松,等.家禽规模养殖LED光环境调控技术进展与趋势分析[J].农业机械学报,2013,44(9):225-235.
PAN J M,WANG X S,JIANG J S,et al.Advancement and trend of LED light environment control technology for intensive poultry production[J].Transactions of the Chinese Society for Agricultural Machinery,2013,44(9):225-235.(in Chinese)
[3] LI X J,RATHGEBER B,MCLEAN N,et al.Providing colored photoperiodic light stimulation during incubation:2.Effects on early posthatch growth,immune response,and production performance in broiler chickens[J].Poult Sci,2021,100(9):101328.
[4] ALI S,SHERZADA S,USMAN M,et al.Impact of different light intensities to Japanese quail eggs on hatching results and post-hatch performance[J].Trop Anim Health Prod,2023,55(6):387.
[5] ROZENBOIM I,HUISINGA R,HALEVY O,et al.Effect of embryonic photostimulation on the posthatch growth of turkey poults[J].Poult Sci,2003,82(7):1181-1187.
[6] 张 林,张海军,武书庚,等.单色光间歇性刺激胚蛋对肉仔鸡胸肉生长及肉品质的影响[J].中国农业科学,2012,45(5):951-957.
ZHANG L,ZHANG H J,WU S G,et al.Effect of intermittently monochromatic light stimuli during the embryogenesis on breast muscular growth and meat quality in male broiler chicks[J].Scientia Agricultura Sinica,2012,45(5):951-957.(in Chinese)
[7] TANG W Y,TONG Q,LI B M,et al.Effects of different light-emitting diode light on hatch performance,embryo development,eye structure,and plasma melatonin in layer incubation[J].Poult Sci,2023,102(10):102977.
[8] HUTH J C,ARCHER G S.Effects of LED lighting during incubation on layer and broiler hatchability,chick quality,stress susceptibility and post-hatch growth[J].Poult Sci,2015,94(12):3052-3058.
[9] COOPER C B,VOSS M A,ARDIA D R,et al.Light increases the rate of embryonic development:implications for latitudinal trends in incubation period[J].Funct Ecol,2011,25(4):769-776.
[10] MAURER G,PORTUGAL S J,CASSEY P.Review:an embryo’s eye view of avian eggshell pigmentation[J].J Avian Biol,2011,42(6):494-504.
[11] DISHON L,AVITAL-COHEN N,ZAGURI S,et al.In ovo green light photostimulation during the late incubation stage affects somatotropic axis activity[J].Poult Sci,2021,100(2):467-473.
[12] WANG P L,SUN Y Y,LI Y L,et al.Monochromatic green light stimulation during incubation shortened the hatching time via pineal function in White Leghorn eggs[J].J Anim Sci Biotechnol,2021,12,17.https://doi.org/10.1186/s40104-020-00539-x.
[13] CHEN Z,QU X L,FENG C G,et al.Monochromatic green light stimulation during incubation alters hepatic glucose metabolism that improves embryonic development in Yangzhou goose eggs[J].Int J Mol Sci,2023,24(1):405.
[14] WITTIG J G,MNSTERBERG A.The early stages of heart development:insights from chicken embryos[J].J Cardiovasc Dev Dis,2016,3(2):12.
[15] TONG Q,MCGONNELL I M,DEMMERS T G M,et al.Effect of a photoperiodic green light programme during incubation on embryo development and hatch process[J].Animal,2018,12(4):765-773.
[16] GIMENO M A,ROBERTS C M,WEBB J L.Acceleration of rate of the early chick embryo heart by visible light[J].Nature,1967,214(5092):1014-1016.
[17] 陈雪娇,刘会杰,臧 蕾,等.鸡胚心脏组织转录组数据鉴定雪域白鸡高原低氧适应性关键基因[J].畜牧兽医学报,2023,54(10):4154-4163.
CHEN X J,LIU H J,ZANG L,et al.Transcriptome data from chicken embryo heart tissue identified key genes for altitude hypoxia adaptation in Xueyu White chickens[J].Acta Veterinaria et Zootechnica Sinica,2023,54(10):4154-4163.(in Chinese)
[18] ROZENBOIM I,PIESTUN Y,MOBARKEY N,et al.Monochromatic light stimuli during embryogenesis enhance embryo development and posthatch growth[J].Poult Sci,2004,83(8):1413-1419.
[19] ZHU H X,SHAO X B,CHEN Z,et al.Induction of out-of-season egg laying by artificial photoperiod in Yangzhou geese and the associated endocrine and molecular regulation mechanisms[J].Anim Reprod Sci,2017,180:127-136.
[20] LI M Y,LIANG C,ZHAO X H,et al.Reproductive performance of Zi-goose promoted by red color illumination[J].Front Vet Sci,2022,9:879478.
[21] MARTINSEN B J.Reference guide to the stages of chick heart embryology[J].Dev Dyn,2005,233(4):1217-1237.
[22] ZHOU P Z,ZHANG Y,SETHI I,et al.GATA4 regulates developing endocardium through interaction with ETS1[J].Circ Res,2022,131(11):e152-e168.
[23] AFOUDA B A.Towards understanding the gene-specific roles of GATA Factors in heart development:Does GATA4 lead the way?[J].Int J Mol Sci,2022,23(9):5255.
[24] KUO C T,MORRISEY E E,ANANDAPPA R,et al.GATA4 transcription factor is required for ventral morphogenesis and heart tube formation[J].Genes Dev,1997,11(8):1048-1060.
[25] MOLKENTIN J D,LIN Q,DUNCAN S A,et al.Requirement of the transcription factor GATA4 for heart tube formation and ventral morphogenesis[J].Genes Dev,1997,11(8):1061-1072.
[26] GARG V,KATHIRIYA I S,BARNES R,et al.GATA4 mutations cause human congenital heart defects and reveal an interaction with TBX5[J].Nature,2003,424(6947):443-447.
[27] MOSKOWITZ I P,WANG J,PETERSON M A,et al.Transcription factor genes Smad4 and Gata4 cooperatively regulate cardiac valve development[J].Proc Natl Acad Sci U S A,2011,108(10):4006-4011.
[28] LI R G,XU Y J,WANG J,et al.GATA4 loss-of-function mutation and the congenitally bicuspid aortic valve[J].Am J Cardiol,2018,121(4):469-474.
[29] 张全波,陆长青,冉 黎,等.TGF-β1/Smad4信号通路在SD大鼠胚胎心脏发育中的作用及意义[J].实用医学杂志,2010,26(17):3105-3108.
ZHANG Q B,LU C Q,RAN L,et al.Effect of TGF-β1/Smad4 signaling pathway on the development of heart of SD rat embryo[J].The Journal of Practical Medicine,2010,26(17):3105-3108.(in Chinese)
[30] QI X,YANG G,YANG L L,et al.Essential role of Smad4 in maintaining cardiomyocyte proliferation during murine embryonic heart development[J].Dev Biol,2007,311(1):136-146.
[31] NIE X G,DENG C X,WANG Q,et al.Disruption of Smad4 in neural crest cells leads to mid-gestation death with pharyngeal arch,craniofacial and cardiac defects[J].Dev Biol,2008,316(2):417-430.
[32] HALMOS G,SZABO Z,JUHASZ E,et al.Signaling mechanism of growth hormone-releasing hormone receptor[J].Vitam Horm,2023,123:1-26.
[33] HARVEY S,JOHNSON C D,SANDERS E J.Extra-pituitary growth hormone in peripheral tissues of early chick embryos[J].J Endocrinol,2000,166(3):489-502.
[34] 李青竹,李润航,郑艳秋,等.鹅多个组织GHR和IGF-Ⅰ基因表达的发育性变化[J].中国兽医学报,2015,35(5):739-744.
LI Q Z,LI R H,ZHENG Y Q,et al.Developmental changes of GHR and IGF-Ⅰ gene expression in multiple tissues of geese[J].Chinese Journal of Veterinary Science,2015,35(5):739-744.(in Chinese)
[35] KHN E R,VLEURICK L,EDERY M,et al.Internalization of the chicken growth hormone receptor complex and its effect on biological functions[J].Comp Biochem Physiol Part B:Biochem Mol Biol,2002,132(1):299-308.
[36] DISHON L,AVITAL-COHEN N,ZAGURI S,et al.The effect of selected in ovo green light photostimulation periods on post-hatch broiler growth and somatotropic axis activity[J].Poult Sci,2021,100(8):101229.
(编辑 郭云雁)

