藏猪促炎因子(IL-1β、IL-6、TNF-α)多态性及其表达与免疫性状的关联分析




摘 要: 本研究以约克夏猪为对照,旨在分析藏猪和约克夏猪的血液生理指标和免疫相关器官组织表达谱方面的差异,结合藏猪外周血淋巴细胞在LPS刺激下,促炎因子IL-1β、IL-6和TNF-α的表达情况,探究IL-1β、IL-6及TNF-α对藏猪免疫性状的影响。试验选择180日龄的藏猪和约克夏猪各40头按品种分为两个试验组,采集新鲜血液用于检测血液生理指标;采集猪外周淋巴血用于培养外周血淋巴细胞。随机选取藏猪和约克夏猪各8头按品种分为两个试验组,前腔静脉采集新鲜血液、屠宰后采集黄豆样大小的肝脏、脾脏、下颌淋巴结组织Trizol法提取RNA。每个个体样品设置3个重复,借助RT-qPCR和一代测序技术检测IL-1β、IL-6、TNF-α基因表达情况和基因多态性。设置4组浓度的LPS(0、1、10、100 μg·mL-1),每组设置3个重复去刺激外周血淋巴细胞,于0、24、36、48、72 h收集细胞,用RT-qPCR检测促炎因子mRNA的表达情况。结果表明:1)藏猪的WBC、RBC、HGB、HCT和PLT水平极显著高于约克夏猪(P<0.01),同时,平均MCV和PCT也在藏猪中显著高于约克夏猪(P<0.05)。2)RT-qPCR结果表明,在藏猪的血液、脾脏和肝脏组织中,IL-1β、IL-6和TNF-α基因的mRNA表达量也均显著高于约克夏猪(P<0.01);在藏猪的下颌淋巴结中,IL-1β和TNF-α基因的表达量显著高于约克夏猪(P<0.05),IL-6基因的mRNA表达量极显著高于约克夏猪(P<0.01)。3)SNP位点筛选结果发现,在IL-1β基因3′侧翼区存在5个突变位点,其中G690T、C1383G、C1480T、A1497G位点在藏猪和约克夏猪群体间存在极显著差异(P<0.01),C1454T位点在藏猪和约克夏猪群体存在显著差异(P<0.05);IL-6基因3′侧翼区存在1个有义突变位点C265T,两品种间呈显著差异(P<0.05),在5′侧翼区存在1个有义突变位点A-72G,两品种间呈极显著差异(P<0.01);TNF-α基因在5′侧翼区存在1个有义突变位点,但两品种间差异不显著(P>0.05)。4)不同浓度LPS刺激藏猪外周血淋巴细胞试验结果表明,10 μg·mL-1浓度的LPS对藏猪外周血淋巴细胞的增殖效应最为显著。在1、10 μg·mL-1浓度LPS刺激下,IL-1β基因作出较明显应答,在100 μg·mL-1浓度LPS刺激下,IL-6基因作出较强应答。综上所述,和约克夏猪相比,藏猪在血液生理指标、免疫组织器官中促炎因子表达以及基因多态性方面表现出更强的抗病能力。其中IL-6基因的A-72G位点可能与免疫性和抗病能力密切相关。在藏猪外周血淋巴细胞培养试验中,IL-1β和IL-6基因对LPS的显著应答突显了它们在免疫调控中的关键作用。
关键词: 藏猪;LPS;促炎因子;血液生理指标;SNP
中图分类号:S828.2
文献标志码:A""" 文章编号:0366-6964(2024)05-1958-12
收稿日期:2023-10-23
基金项目:国家重点研发项目(2022YFD1600903);国家自然基金地区基金项目(32160773);西藏自治区科技计划项目(XZ202202JD0002N);西藏自治区重大科技专项项目(XZ202101ZD0005N)
作者简介:孙雯莉(1998-),女,河南人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:2097699942@qq.com
*通信作者:商 鹏,主要从事动物遗传育种与繁殖研究,E-mail: nemoshpmh@126.com
Polymorphism of Pro-Inflammatory Factors (IL-1β, IL-6, TNF-
α) in Tibetan Pigs and Its Association Analysis with Immune Traits
SUN Wenli1,2,3, WANG" Haoqi1,2,3, ZE" Licuo1,2,3, GAO" Yufan1,2,3, ZHANG" Feifan1,2,3,
ZHANG" Jian1,2,3, DUAN Mengqi1,2,3, SHANG" Peng1,2,3*, QIANG" Bayangzong1,2,3
(1.College of Animal Science, Xizang Agricultural and Animal Husbandry College,
Linzhi 860000," China;
2.Key Laboratory of Tibetan Pig Genetic Improvement and
Reproduction, Linzhi 860000," China;
3.Tibet Collaborative Innovation Center for the
Research and Development of Unique Agricultural
and Animal Resources, Linzhi 860000," China)
Abstract:" This study, using Yorkshire pigs as controls, aimed to explore the differences in blood physiological indicators and the expression profiles of immune-related organ tissues between Tibetan pigs and Yorkshire pigs. Additionally, the expression levels of pro-inflammatory cytokines IL-1β, IL-6, and TNF-α in Tibetan pig peripheral blood lymphocytes stimulated with LPS was investigated, to understand their impact on the immune characteristics of Tibetan pigs. Forty Tibetan pigs and forty Yorkshire pigs aged 180 days were divided into two experimental groups based on breed. Fresh blood samples were collected for detecting blood physiological indicators, and peripheral blood lymphocytes were cultured for further analysis. Moreover, 8 Tibetan pigs and 8 Yorkshire pigs from each breed were randomly selected and divided into two experimental groups. Fresh blood was collected from the anterior vena cava, and liver, spleen, and submandibular lymph node tissues were collected post-slaughter for RNA extraction using the Trizol method. Each individual sample was subjected to 3 replicates for RT-qPCR and next-generation sequencing analysis to assess the expression levels and genetic polymorphisms of IL-1β, IL-6, and TNF-α genes. Peripheral blood lymphocytes were stimulated with 4 concentrations of LPS (0, 1, 10, 100 μg·mL-1), with 3 replicates per group. Cells were collected at 0, 24, 36, 48, and 72 h, and RT-qPCR was performed to assess the expression of pro-inflammatory cytokine mRNA. Results indicate that: 1) Tibetan pigs exhibited significantly higher levels of WBC, RBC, HGB, HCT, and PLT compared to Yorkshire pigs (Plt;0.01). Additionally, the average MCV and PCT were significantly higher in Tibetan pigs than those in Yorkshire pigs (Plt;0.05). 2) RT-qPCR results revealed significantly higher mRNA expression levels of IL-1β, IL-6, and TNF-α genes in the blood, spleen, and liver tissues of Tibetan pigs compared to Yorkshire pigs (Plt;0.01). In the submandibular lymph nodes of Tibetan pigs, the expression levels of IL-1β and TNF-α genes were significantly higher (Plt;0.05), while the mRNA expression level of the IL-6 gene was extremely significantly higher (Plt;0.01). 3) SNP site screening identified 5 mutation sites in the 3′ flanking region of the IL-1β gene. Among them, G690T, C1383G, C1480T, and A1497G sites showed extremely significant differences between Tibetan pigs and Yorkshire pigs (Plt;0.01), and the C1454T site exhibited significant differences (Plt;0.05).
The IL-6 gene’s 3′ flanking region contained a non-synonymous mutation site C265T, which showed significant differences (Plt;0.05), and a non-synonymous mutation site A-72G in the 5′ flanking region exhibited highly significant differences (Plt;0.01). The TNF-α gene had a non-synonymous mutation site in the 5′ flanking region, but the difference between the two breeds was not significant (Pgt;0.05). 4) Different LPS concentrations stimulated Tibetan peripheral blood lymphocytes, with 10 μg·mL-1 LPS showing the most significant proliferative effect. At concentrations of 1 and 10 μg·mL-1 LPS stimulation, the IL-1β gene responded significantly, and at a concentration of 100 μg·mL-1 LPS, the IL-6 gene exhibited a strong response. In summary, compared to Yorkshire pigs, Tibetan pigs demonstrated stronger resistance in blood physiological indicators, immune organ cytokine expression, and genetic polymorphism. The A-72G site in the IL-6 gene may be closely related to immunological and disease resistance capabilities. The significant responses of IL-1β and IL-6 genes to LPS in Tibetan pig peripheral blood lymphocyte culture experiments highlight their critical role in immune regulation.
Key words: Tibetan pigs; LPS; pro-inflammatory factors; blood physiological parameters; SNP
*Corresponding author:SHANG Peng, E-mail: nemoshpmh@126.com
西藏自治区是中国典型的高原低氧地区,在这种极端环境下长期居住的生物体,经历了遗传上的适应性变化,包括免疫器官、组织和细胞等方面的发展。特别是在高海拔高寒地区生活的动物种群如藏猪,形成了独特的生存特性[1]。藏猪主要分布在海拔约3 000 m的青藏高原农牧区。由于长期适应高寒高海拔环境,藏猪具有强大的免疫功能、耐低氧、耐低温、适应粗饲料和抗紫外线等特性[2]。然而,尽管已经了解到藏猪具有这些独特的特性,目前仍存在一个关键问题,即为什么藏猪在如此恶劣的高原环境下能够表现出如此卓越的抗逆性和抗病能力。这个问题的答案对于理解高原动物的适应性演化以及免疫系统的功能至关重要。
促炎因子IL-1β、IL-6和TNF-α基因在免疫反应中扮演着关键的角色,它们可能是解释藏猪抗病能力和适应高原环境的关键因素之一[3-4]。IL-1β基因是一种自然的促炎细胞因子,其在炎症反应中发挥主导作用,同时也参与了机体适应性免疫应答的调控。有研究指出,异常的IL-1β基因信号传导可能与遗传性自身炎症性疾病有关[5]。TNF-α基因主要由Th1型细胞分泌,在细胞免疫应答中扮演着重要的角色[6-8]。IL-6基因则由Th2型细胞产生,在调节体液免疫反应方面发挥重要作用[9]。这些细胞因子在机体内紧密协作,以维持免疫平衡和应对各种感染和疾病。
脂多糖(LPS),是革兰氏阴性菌细胞壁的主要组成成分,革兰阴性菌在环境中普遍存在,生产活动使用抗生素等药物对其消杀后,其释放出大量的LPS,而LPS对猪可产生广泛的损害,包括发热、炎症反应、组织损伤及生产性能下降等[10-11]。当动物感染LPS时,会触发全身性的免疫反应,导致体内促炎性细胞因子如TNF-α、干扰素-γ、IL-6和IL-1的表达量升高[12-14],继而引发一系列免疫反应,这些促炎因子的表达情况也反映了动物的抗病能力[15-17]。
本试验以长期生活在林芝地区的藏猪为主要研究对象,以同在此地长期饲养的约克夏猪作为对照参考,通过血液生理指标测定、RT-qPCR技术、一代测序技术及藏猪外周血淋巴细胞的培养、设置不同浓度LPS对照组刺激该原代细胞并检测促炎因子mRNA表达情况等方法,查明藏猪与约克夏猪在血液生理方面的表现差异,进一步探究两者间抗逆性、低氧适应性的具体差异表现,为深入开展藏猪低氧适应性、抗逆性等方面的具体调控机制提供参考。通过比较它们与约克夏猪的差异,有望获得有益的信息,不仅可以为养殖业提供重要的参考,还能对动物的健康管理和免疫调节方面提供有价值的数据。
1 材料与方法
1.1 样品采集
试验动物为长期生活在西藏自治区林芝市(海拔2 900 m)的180日龄藏猪(TP,Tibetan pig)和约克夏猪(YY,Yorkshire pig)。随机选取阉割公藏猪(TP)和阉割公约克夏猪(YY)各40头按品种分为两个试验组,分别采集猪外周淋巴血以及新鲜血液快速放入准备好的肝素钠采血管中用于血液生理指标测定及外周血淋巴细胞的培养,并采集耳组织样品,放入含有75%酒精的离心管中,置于-20 ℃冰箱用于SNP的筛选。随机选取藏猪和约克夏猪各8头进行屠宰,使用5 mL的一次性采血针由前腔静脉采集新鲜血液,提取血液RNA,屠宰后采集黄豆样大小的肝脏、脾脏、下颌淋巴结组织放入含有RNA保存液的样品管中,快速放入液氮中速冻,随即-80℃保存用于RNA的提取。
1.2 血液生理指标测定
使用兽用全自动血液细胞分析仪(mindary,BC-2 006Vet)对待测血样进行测定,所有步骤及注意事项按照该设备说明书规范操作。
1.3 检测不同组织中IL-1β、IL-6、TNF-α基因mRNA的表达
Trizol法(Thermo,USA)提取血液及组织样本总RNA,琼脂糖凝胶电泳及微量核酸检测仪(Thermo,NanoDrop 2000C)检测RNA样品的质量。快速反转录cDNA试剂盒(北京天根生化科技有限公司,KR180123)合成cDNA。从NCBI(http://www.ncbi.nlm.nih.gov/)分别下载目的基因IL-1β(登录号:NM_214055.1)、IL-6(登录号:NM_214399.1)、TNF-α(登录号:NM_214022.1)及内参基因β-actin(登录号:AY550069)的mRNA序列,用Primer Premier 5.0软件进行定量引物设计,并送至生工生物工程(上海)股份有限公司进行合成,引物信息见表1。利用RT-qPCR技术对藏猪和大约克猪各8头的脾脏、肝脏、下颌淋巴结和血液组织进行IL-1β、IL-6、TNF-α基因的mRNA的表达情况检测。每个个体样品设置3个重复,检测结果使用2-ΔΔCt法统计。
1.4 SNP位点筛选
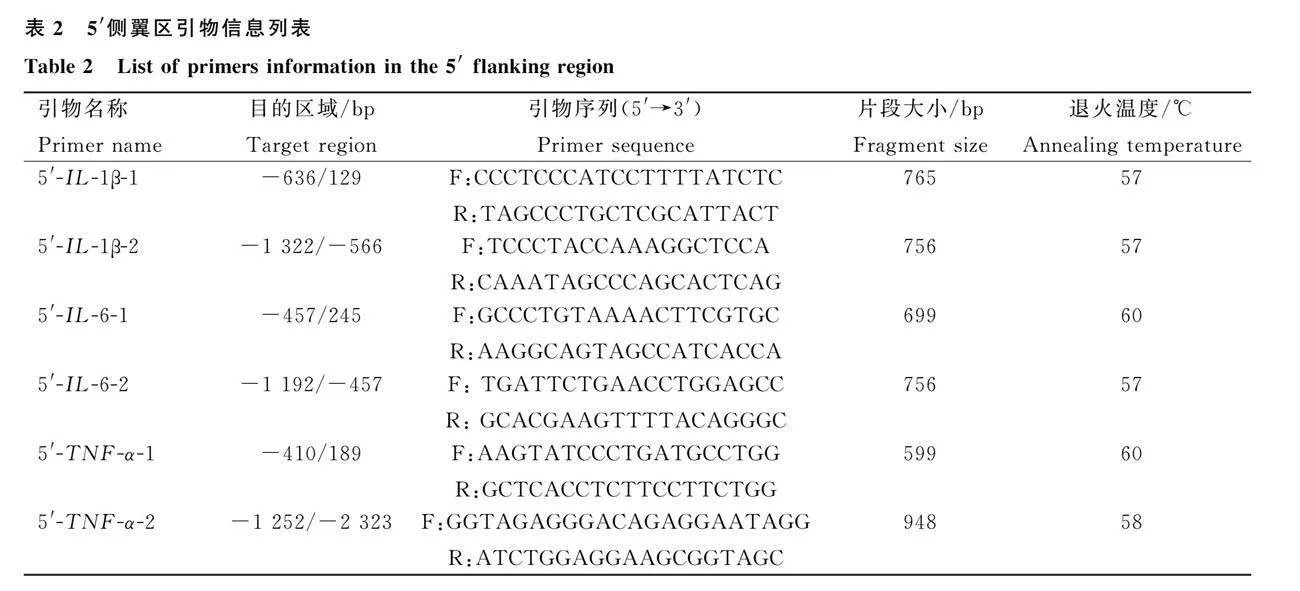
登录GenBank(http://www.ncbi.nlm.nih.gov/genbank),分别下载猪IL-1β、IL-6、TNF-α基因5′端起始密码子(ATG)上游2 000 bp的DNA序列以及3′端终止密码子(TGA)下游2 000 bp的DNA序列(登录号:NC_010 445.4、 NC_010 451.4、NC_010 449.5)。使用Primer Premier 5.0软件设计用于多态性分析的引物,并送至生工生物工程(上海)股份有限公司合成。引物序列和扩增区域见表2、表3。
使用Sanger测序法对IL-1β、IL-6、TNF-α基因各个区域混池产物进行测序,使用SnapGene和Excel软件分别对IL-1β、IL-6、TNF-α基因各个区域测序结果进行分析,筛选SNPs位点。针对所筛选出的SNPs位点进行单个个体扩增测序和基因分型,统计基因型频率与等位基因频率。从NCBI(https://www.ncbi.nlm.nih.gov/)下载IL-1β、IL-6、TNF-α基因序列,进行转录因子预测,查看SNPs位点突变前后转录因子结合位点的变化。
1.5 藏猪外周血淋巴细胞的分离
将采集的新鲜血液放入肝素钠抗凝管内,快速常温运回实验室。加入等量的PBS稀释血液,随后缓慢加入到提前已加入外周血淋巴细胞分离液的离心管中,使血液处于分离液上层,1 000 g离心25~30 min,直至出现明显的四分层现象(从上至下分别为:稀释液+血浆层、淋巴细胞层、分离液层、红细胞+粒细胞层),收集淋巴细胞,PBS/D-Hanks缓冲液清洗2次,最后加入完全培养基(RPMI 1640+5% FBS+1% PS)重悬细胞。
1.6 RT-qPCR法检测不同浓度LPS刺激下藏猪外周血淋巴细胞促炎因子表达情况
以每孔1×106个·cm-2细胞接种至96孔细胞培养板内。设置0、1、10、100 μg·mL-1四个不同浓度LPS的组别,置37℃孵育箱培养0、24、36、48、72 h,每个浓度的LPS重复3份,并在0、24、36、48、72 h收集细胞,进行细胞RNA的提取,反转为cDNA,RT-qPCR技术检测促炎因子IL-1β、IL-6、TNF-α基因mRNA水平表达情况。
1.7 统计分析
使用IBM SPSS Statisties 26.0软件对数据进行单因素方差分析,使用Sigma Plot 10.0软件绘图。数据结果用“平均值±标准误差”表示,*表示差异显著(P<0.05),**表示差异极显著(P<0.01),无标注表示差异不显著(P>0.05)。
2 结 果
2.1 血液生理指标检测结果
血液生理指标测定结果如表4所示,藏猪白细胞数量(WBC)、红细胞数量(RBC)、血红蛋白数量(HGB)、红细胞比容(HCT)、平均红细胞体积(MCV)、血小板数量(PLT)和降钙素原(PCT)的数值都相对较高,其中藏猪的平均MCV和PCT显著高于约克夏猪(P<0.05),WBC、RBC、HGB、HCT和PLT水平极显著高于约克夏猪(P<0.01)。
2.2 藏猪和约克夏猪IL-1β、IL-6、TNF-α基因在免疫组织中的表达差异分析
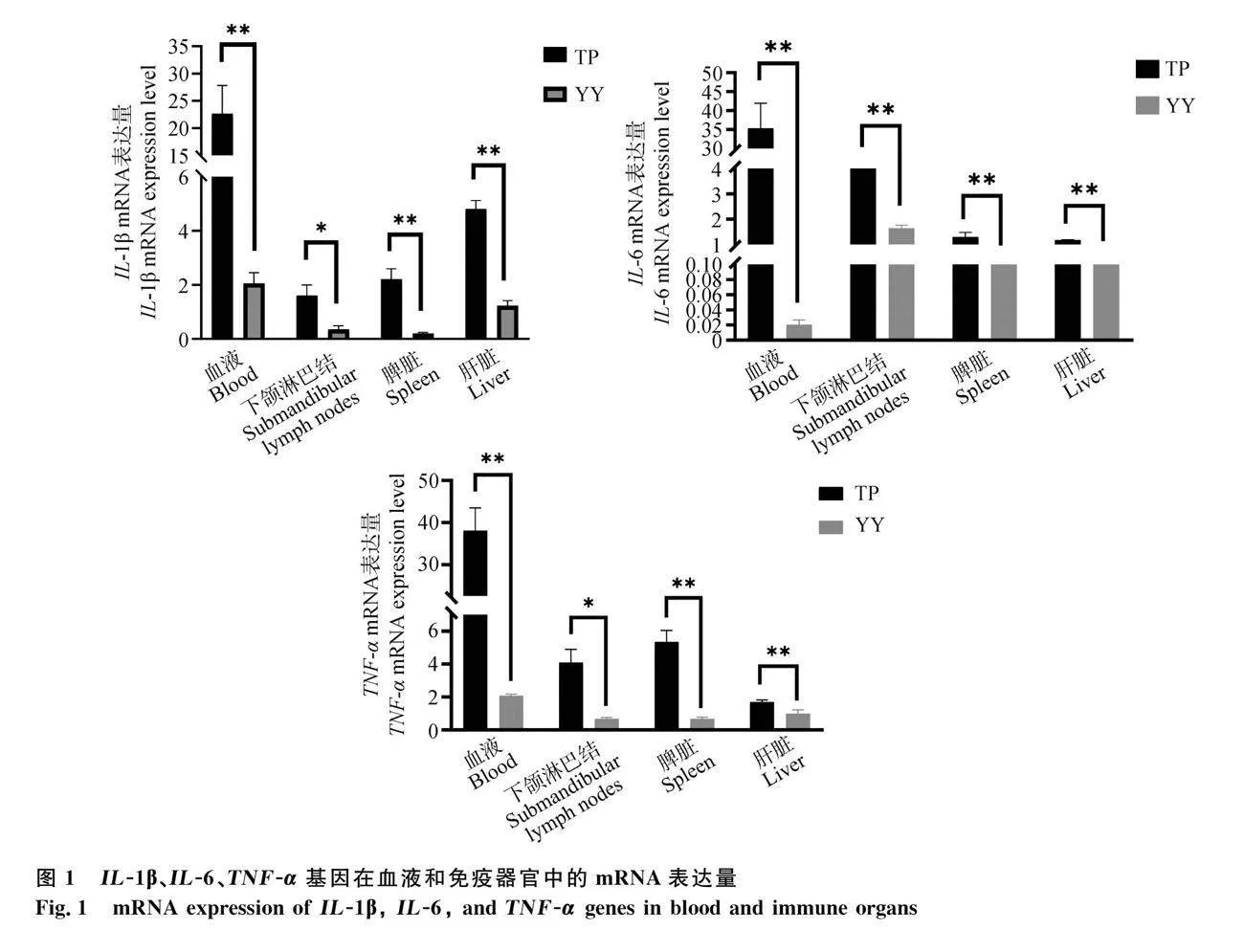
RT-qPCR结果显示(图1),IL-1β、IL-6和TNF-α基因在藏猪血液中的相对表达量最高,且均极显著高于约克夏猪(P<0.01)。在脾脏和肝脏组织中,藏猪的IL-1β、IL-6和TNF-α基因mRNA水平表达量也均极显著高于约克夏猪(P<0.01)。在下颌淋巴结组织中,藏猪的IL-6基因mRNA水平表达量极显著高于约克夏猪(P<0.01),IL-1β和TNF-α基因的表达量显著高于约克夏猪(P<0.05)。
2.3 藏猪与约克夏猪促炎因子SNPs位点筛选及分析
2.3.1 IL-1β、IL-6、TNF-α基因突变位点的基因型频率和等位基因频率
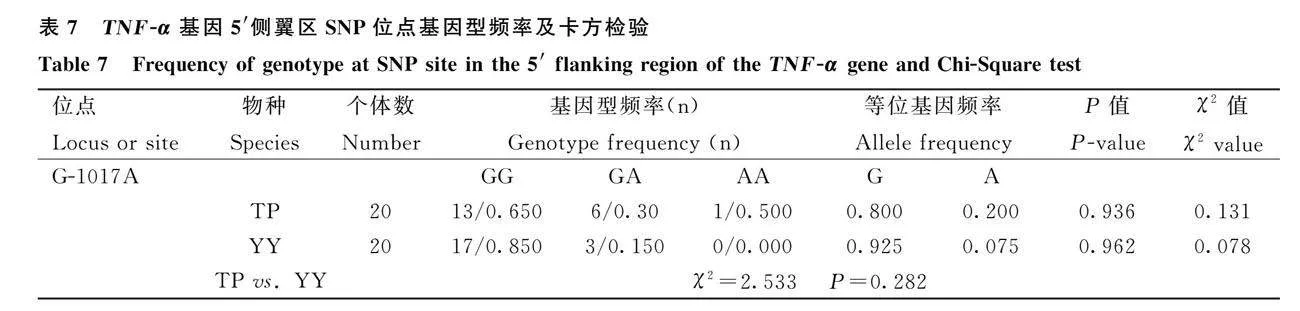
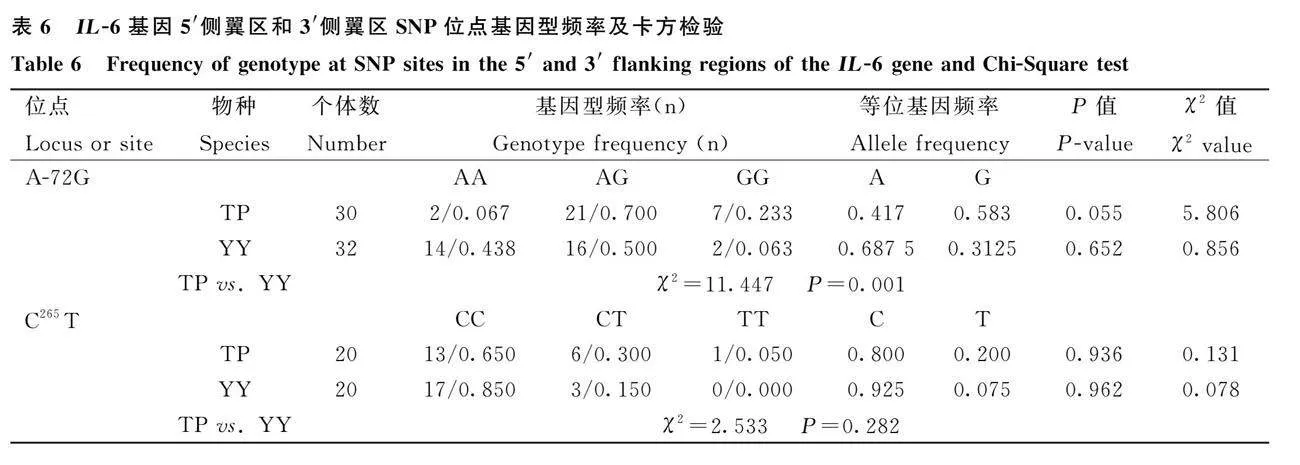
由表5可知,IL-1β基因3′侧翼区共存在5个突变位点,分别为:G690T、C1383G、C1454T、C1480T、A1497G。品种内,上述位点均符合Hardy-Weinberg平衡(P>0.05)。品种间,G690T、C1383G、C1480T、A1497G位点在藏猪和约克夏猪群体存在极显著差异(P<0.01),C1454T位点在藏猪和约克夏猪群体存在显著差异(P<0.05)。由表6可知,IL-6基因5′侧翼区和3′侧翼区各发现一个突变位点,分别为:A-72G、C265T。品种内,上述位点均符合Hardy-Weinberg平衡(P>0.05)。品种间,A-72G位点在藏猪和约克夏猪群体存在极显著差异(P<0.01);C265T位点在藏猪和约克夏猪群体差异不显著(Pgt;0.05)。由表7可知,TNF-α基因3′侧翼区未发现突变位点,5′侧翼区发现一个突变位点,为:G-1017A。品种内,该位点符合Hardy-Weinberg平衡(P>0.05)。品种间,该位点在藏猪和约克夏猪群体差异不显著(P>0.05)。
2.3.2 IL-1β、IL-6、TNF-α基因转录因子预测结果
为进一步探究IL-1β、IL-6、TNF-α基因突变位点前后的转录因子变化情况,将突变位点前后碱基进行转录因子预测(网站:http://jaspar.binf.ku.dk/)。结果显示,IL-1β基因的5个位点、TNF-α基因G-1017A位点突变前后未发生转录因子的变化;IL-6基因A-72G位点突变后,新增了一个转录因子结合位点,为ETS1,同时,在A突变为G之后,造成了转录因子RUNX1和NR2F1的缺失。
2.4 不同浓度LPS对藏猪外周血淋巴细胞及其促炎因子表达情况的影响
2.4.1 不同浓度LPS对藏猪外周血淋巴细胞增殖的影响
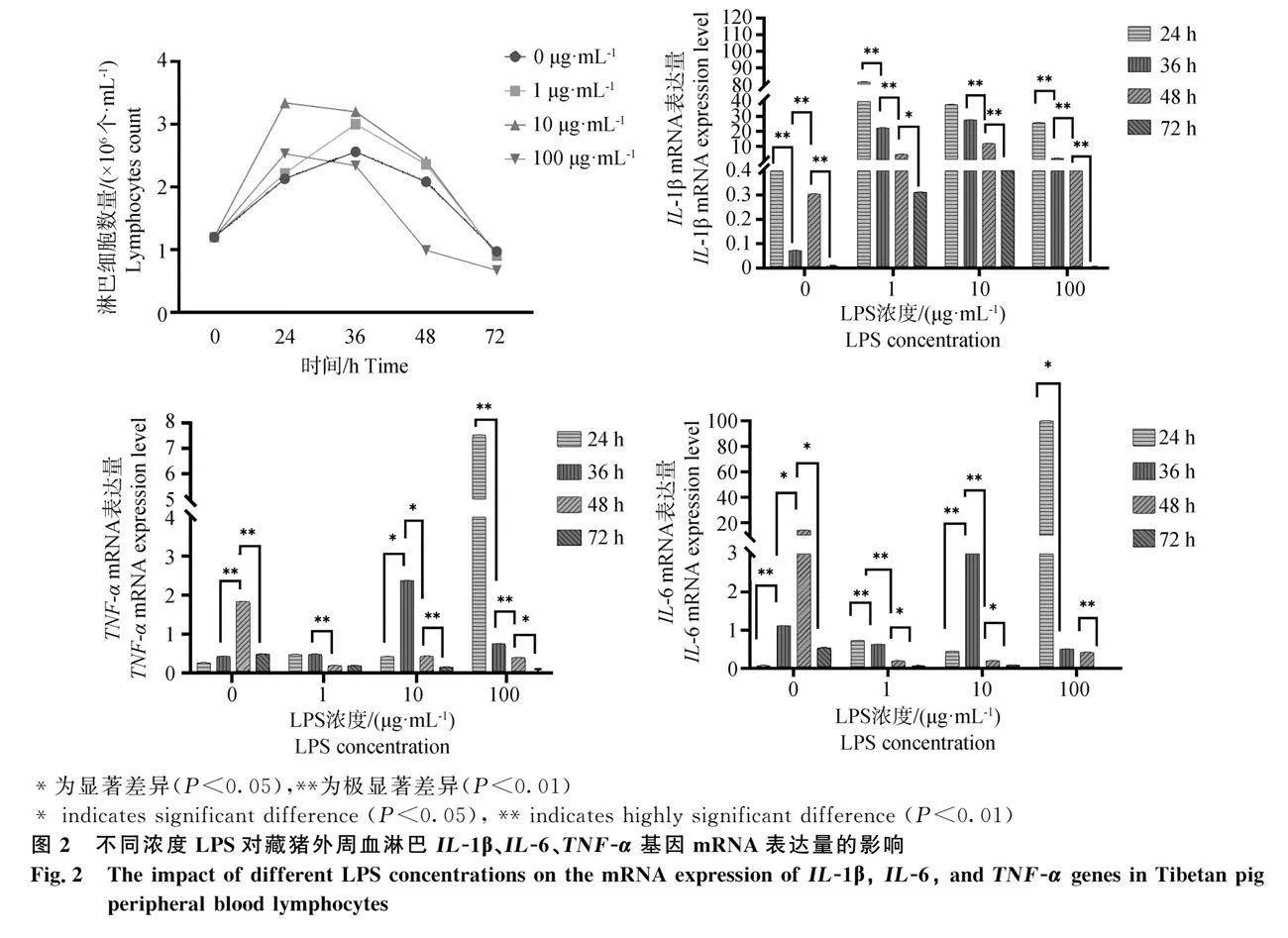
结果如图2所示,在0、1 μg·mL-1浓度的LPS刺激下,藏猪外周血淋巴细胞数量呈逐渐上升的趋势。这种上升趋势始于36 h前,并在一段时间后达到了增殖的高峰,随后开始下降;在10 μg·mL-1浓度的LPS刺激下,与前两种情况不同的是,上升趋势在24 h时达到了增殖的高峰,之后开始下降,保持下降趋势;在100 μg·mL-1浓度的LPS刺激下,对淋巴细胞也有一定的增殖效果,在24h时达到最高峰,随后迅速开始下降。综上,10 μg·mL-1浓度的LPS对藏猪外周血淋巴细胞的增殖效应最为显著。
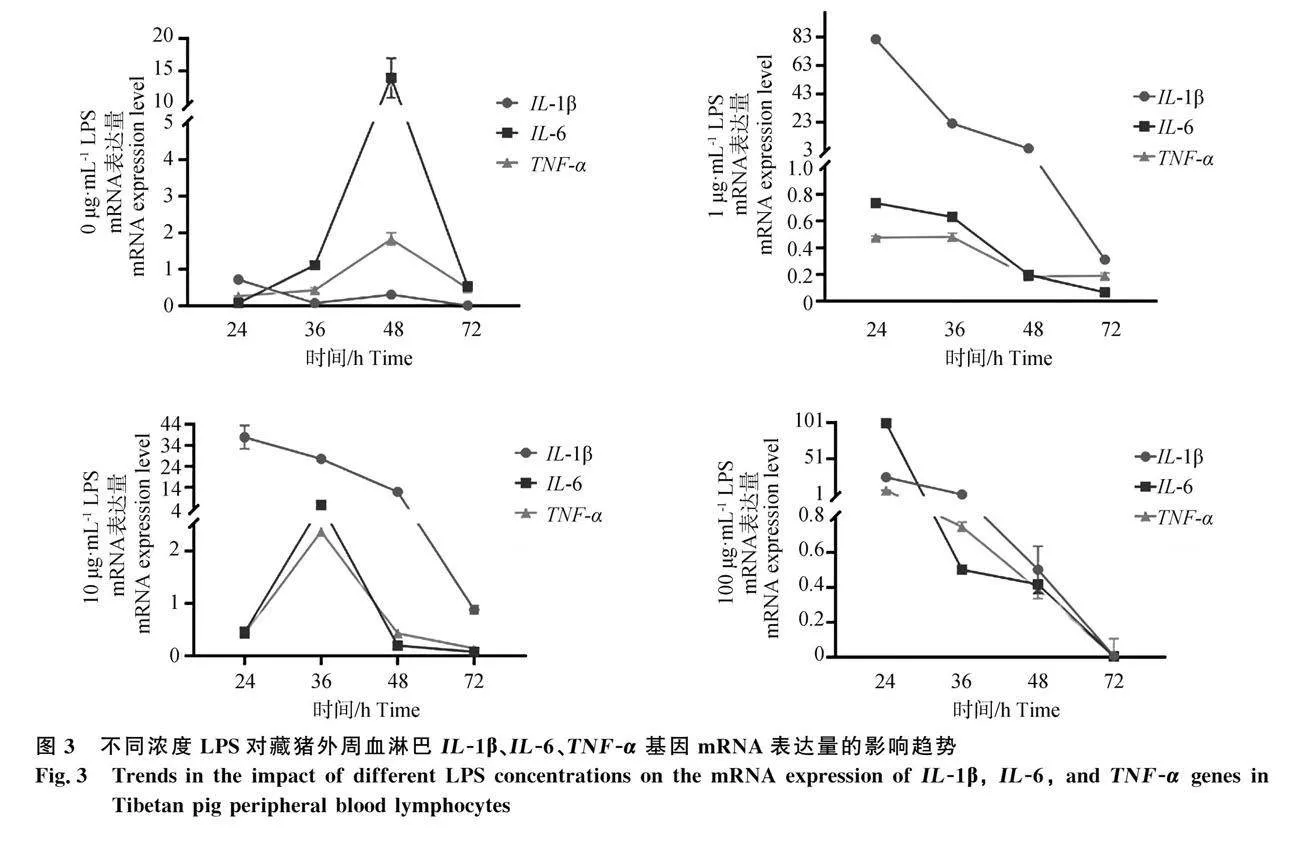
2.4.2 不同浓度LPS对藏猪外周血淋巴IL-1β、IL-6、TNF-α基因mRNA表达量的影响
结果如图2、图3所示,在未添加LPS的情况下,IL-1β基因mRNA的表达量在24h时达到最高点,然后逐渐下降,每个时间段都呈现极显著的变化(P<0.01)。IL-6和TNF-α基因mRNA的表达量在24~48h内逐渐上升,并在48h达到峰值,然后逐渐减少。1 μg·mL-1对比0 μg·mL-1浓度LPS刺激下,浓度的LPS刺激下,IL-1β基因mRNA的表达量总体上呈上升趋势,而IL-6和TNF-α基因mRNA的表达量则在一定程度上减少。在10 μg·mL-1浓度的LPS刺激下,IL-1β基因mRNA的表达量总体上也呈上升趋势,与1 μg·mL-1L浓度LPS刺激时的表达量没有明显差异。然而,随着时间的推移,这些基因的表达量逐渐下降,在48~72h阶段出现急剧下降的情况。在100 μg·mL-1L浓度的LPS刺激下,IL-1β、IL-6和TNF-α基因mRNA的表达量在24h时达到最高点,显著或极显著高于其他时间点(P<0.05或P<0.01)。
3 讨 论
血液生理指标能够在一定程度上反映动物机体应对外界恶劣环境的能力[12],其中WBC和PCT通常被视为常规炎症标志物[18-19],Minasyan[20]在研究中也强调了血液中的红细胞在机体细胞免疫中的重要作用。Poscablo和Forsberg[21]的研究结果表明,血小板含量高有助于释放更多的炎症介质,进一步招募白细胞。本研究对比了藏猪和约克夏猪两个品种,发现藏猪的WBC、RBC、HGB、HCT和PLT水平极显著高于约克夏猪(P<0.01),同时,平均MCV和PCT也在藏猪中显著高于约克夏猪(P<0.05)。这些生理指标结果为藏猪表现出更强的抗病能力提供了重要的表型依据。由于血液中存在大量的免疫细胞和免疫因子,并通过血液迅速响应外部病原体,与机体免疫稳态密切相关[22]。另外,有研究表明红细胞和血小板的表达以及凝血潜能都受到促炎因子IL-6和IL-1β的调控[23]。因此本研究进一步关注了血液和免疫器官中的促炎因子。RT-qPCR结果表明,IL-1β、IL-6和TNF-α基因在藏猪血液中的相对表达量最高,且均极显著高于约克夏猪(P<0.01)。这与张敬梅等[11]的研究中提到的抗病力强的地方猪种的关键细胞因子表达量更高的结论相符。其表明藏猪的免疫器官不仅在细胞免疫方面还是在体液免疫方面都具有更强的优势。总的来说,在同一环境中,藏猪表现出更强的炎症控制反应,这可能是其更强抗病能力的原因之一。
有研究结果显示[24-25],基因多态性差异在个体和品种间导致多样性、基因组进化、药物反应、抗病能力等重要变化。因此,筛选藏猪和约克夏猪IL-1β、IL-6、TNF-α基因的SNPs位点发现,在IL-1β基因3′侧翼区存在5个显著差异突变位点(P<0.05);在IL-6基因3′侧翼区的C265T位点(P<0.05)和5′侧翼区的A-72G位点(P<0.01)也表现出显著差异。IL-6基因A-72G位点突变新增了ETS1转录因子结合位点,并导致了转录因子RUNX1和NR2F1的缺失。ETS1通常与免疫细胞功能有关[26-28],RUNX1与白血病和肿瘤相关[29-30],NR2F1则参与肿瘤特异性[31]。这表明IL-6基因的A-72G位点可能与免疫性和抗病能力密切相关,具有重要的应用潜力。因此,探究藏猪IL-1β、IL-6、TNF-α基因的SNP位点变异为解释其卓越的抗病能力提供了分子基础。
在养猪业实践中,LPS是一种普遍存在于空气、饲料和水中的生物分子,具有炎症性质[32-33]。当单核细胞和巨噬细胞受到LPS刺激后,会刺激淋巴细胞的增殖[34-35],并释放一系列促炎因子包括IL-1β、IL-6、TNF-α等,这些因子在机体的先天免疫反应中扮演着关键角色[5,36-37]。因此本研究在细胞水平,通过不同浓度的LPS刺激,考察了这些基因在藏猪外周血淋巴细胞中的表达情况。研究发现,当LPS浓度为10 μg·mL-1时,对藏猪外周血淋巴细胞的增殖效应最为显著。当LPS浓度为1、10 μg·mL-1时,IL-1β基因作出较明显的应答,而当LPS浓度为100 μg·mL-1时IL-6基因表现出更为强烈的应答。有研究表明[27,38-40],在免疫细胞功能中,IL-1β扮演者关键角色,作为促炎反应的核心中介者,它引发了后续的炎症介质如IL-6和TNF-α的激活。因此,在受到LPS刺激后,IL-1β基因的表达量显著高于IL-6、TNF-α。总之,研究结果强调了IL-1β、IL-6在应对LPS干扰方面的显著作用,为进一步探究藏猪的免疫特性提供了重要的理论基础,但还需要进一步研究来阐明具体的影响机制。
4 结 论
综上所述,血液生理指标结果为藏猪具有更强的抗病能力提供了强有力的表型依据。免疫组织器官中促炎因子(IL-1β、IL-6、TNF-α)的表达情况强调了藏猪在免疫调节方面的优势。此外,在基因多态性的研究结果中,尤其是IL-6基因的A-72G位点,其突变可能与免疫性和抗病能力密切相关。最后,在藏猪外周血原代淋巴细胞培养试验中,发现IL-1β和IL-6在应对LPS干扰时表现出显著的应答,突出了它们在免疫调控中的关键作用。这一系列研究结果共同揭示了藏猪在免疫特性和抗病能力方面的卓越表现,为深入研究提供了有力的理论支持。
参考文献(References):
[1] LI F,QIAO Z L,DUAN Q J,et al.Adaptation of mammals to hypoxia[J].Animal Model Exp Med,2021,4(4):311-318.
[2] 杨天良,杨雅楠,王 彪,等.藏猪适应高原低氧环境的肺脏血管铸型特征[J].中国兽医学报,2021,41(3):526-531.
YANG T L,YANG Y N,WANG B,et al.Characteristics of pulmonary vascular casting in Tibetan pigs adapted to the hypoxic environment at high altitude[J].Chinese Journal of Veterinary Science,2021,41(3):526-531.(in Chinese)
[3] BARICHELLO T,GENEROSO J S,SINGER M,et al.Biomarkers for sepsis:more than just fever and leukocytosis—a narrative review[J].Crit Care,2022,26(1):14.
[4] PFEILER S,WINKELS H,KELM M,et al.IL-1 family cytokines in cardiovascular disease[J].Cytokine,2019,122:154215.
[5] 怀 千,王 华.白细胞介素-1家族细胞因子在肝脏疾病中的研究进展[J].中国药理学通报,2023,39(5):828-832.
HUAI Q,WANG H.Advance in study of interleukin-1 family cytokines in liver diseases[J].Chinese Pharmacological Bulletin, 2023,39(5):828-832.(in Chinese)
[6] 徐叶青,刘菲焱,黄海华,等.肿瘤坏死因子小分子抑制剂的作用机理[J].现代盐化工,2021,48(3):39-40.
XU Y Q,LIU F Y,HUANG H H,et al.Mechanism of action of tumor necrosis factor small molecule inhibitors[J].Modern Salt and Chemical Industry,2021,48(3):39-40.(in Chinese)
[7] WANG Y J,CHE M X,XIN J G,et al.The role of IL-1β and TNF-α in intervertebral disc degeneration[J].Biomed Pharmacother, 2020,131:110660.
[8] DUTKIEWICZ J,POMORSKI Z J H,SITKOWSKA J,et al.Airborne microorganisms and endotoxin in animal houses[J].Grana, 2014, 33(2):85-90.
[9] 王宏艳,严晗光,徐玉花.猪内毒素的综合防治方案研究[J].畜禽业,2015(5):31-32.
WANG H Y,YAN H G,XU Y H.Research on comprehensive prevention and control scheme for pig endotoxin[J].Livestock and Poultry Industry,2015(5):31-32.(in Chinese)
[10] 张祺琪,王俊梅,岳子奇,等.LPS对牦牛瘤胃上皮细胞补体C3激活和ATP生成代谢的影响[J].畜牧兽医学报,2023,54(11): 4664-4675.
ZHANG Q Q,WANG J M,YUE Z Q,et al.Effect of LPS on the complement C3 activation and ATP production in the rumen epithelial cells of yak[J].Acta Veterinaria et Zootechnica Sinica,2023,54(11):4664-4675.(in Chinese)
[11] 张敬梅,顾亦韧,李江淩,等.乌金猪、青峪猪和成华猪免疫器官多种免疫调节基因表达的比较[J].畜牧与兽医,2018, 50(10):43-48.
ZHANG J M,GU Y R,LI J L,et al.Comparison of multiple immunoregulatory gene expressions in the immune organs of Wujin,Qingyu and Chenghua pigs[J].Animal Husbandry amp; Veterinary Medicine,2018,50(10):43-48.(in Chinese)
[12] KAYAGAKI N,WONG M T,STOWE I B,et al.Noncanonical inflammasome activation by intracellular LPS independent of TLR4[J].Science,2013,341(6151):1246-1249.
[13] GINDRI P,DE VILA CASTRO N,MION B,et al.Intrafollicular lipopolysaccharide injection delays ovulation in cows[J].Anim Reprod Sci,2019,211:106226.
[14] 郭咏梅,石惠宇,闫素梅,等.白细胞介素-1受体拮抗剂对脂多糖诱导的奶牛乳腺上皮细胞氧化损伤的保护作用[J].动物营养学报,2023,35(7):4596-4603.
GUO Y M,SHI H Y,YAN S M,et al.Protective effect of interleukin-1 receptor antagonist on lipopolysaccharide-induced oxidative damage in bovine mammary epithelial cells[J].Chinese Journal of Animal Nutrition,2023,35(7):4596-4603.(in Chinese)
[15] EDAMITSU S,MATSUKAWA A,OHKAWARA S,et al.Role of TNFα,IL-1,and IL-1ra in the mediation of leukocyte infiltration and increased vascular permeability in rabbits with LPS-induced pleurisy[J].Clin Immunol Immunopathol,1995,75(1):68-74.
[16] 张吉鹍.内毒素的生物活性及其对猪的危害[J].猪业科学,2020,37(11):134-137.
ZHANG J K.The bioactivity of Endotoxin and its harm to the pigs[J].Swine Industry Science,2020,37(11):134-137.(in Chinese)
[17] 强巴央宗,张 浩,白玛央宗,等.高原环境中藏猪血液生理指标测定与比较[J].西南农业学报,2011,24(6):2382-2384.
CHAMBA Y Z,ZHANG H,BAINA Y Z,et al.Determination of blood physiological parameters in Tibet pig at high altitude[J]. Southwest China Journal of Agricultural Sciences,2011,24(6):2382-2384.(in Chinese)
[18] 李平会,蒲 广,王中宇,等.日粮纤维水平对梅山猪血液和肠道免疫指标的影响及其机理初步解析[J].畜牧兽医学报,2023,54(10):4260-4277.
LI P H,PU G,WANG Z Y,et al.Effect of dietary fiber level on blood and intestinal immune indexes of Meishan pigs and preliminary analysis of its mechanism[J].Acta Veterinaria et Zootechnica Sinica,2023,54(10):4260-4277.(in Chinese)
[19] 栾 皓,邢 爽,余祖胤.血小板生成素调控机体造血免疫的研究进展[J].安徽医科大学学报,2023,58(3):519-522.
LUAN H,XING S,YU Z Y.Research progress on thrombopoietin regulating hematopoietic immunity in the body[J].Acta Universitatis Medicinalis Anhui,2023,58(3):519-522.(in Chinese)
[20] MINASYAN H.Erythrocyte and blood antibacterial defense[J].Eur J Microbiol Immunol,2014,4(2):138-143.
[21] POSCABLO D M,FORSBERG E C.The clot thickens:recent clues on hematopoietic stem cell contribution to age-related platelet biology open new questions[J].Adv Geriatr Med Res,2021,3(4):e210019.
[22] 崔 君,郭文晋,付守鹏,等.热应激对高产和低产奶牛血液生理指标、炎性因子和生产性能的影响[J].中国兽医学报,2020, 40(5): 973-977,987.
CUI J,GUO W J,FU S P,et al.Effects of heat stress on blood physiological indexes,inflammatory factors and performance of high and low yield dairy cows[J].Chinese Journal of Veterinary Science,2020,40(5):973-977,987.(in Chinese)
[23] COVINGTON E W,ROBERTS M Z,DONG J.Procalcitonin monitoring as a guide for antimicrobial therapy:a review of current literature[J].Pharmacotherapy,2018,38(5):569-581.
[24] HUANG Y,XU W,ZHOU R B.NLRP3 inflammasome activation and cell death[J].Cell Mol Immunol,2021,18(9):2114-2127.
[25] 李 妍,蓝婷英,庞 博,等.NLRP3炎症小体及其下游炎症因子在犬乳腺肿瘤组织中的表达[J].畜牧兽医学报,2022, 53(4):1252-1258.
LI Y,LAN T Y,PANG B,et al.Expression of NLRP3 inflammasome signal associated genes in canine mammary tumors and clinical significance[J].Acta Veterinaria et Zootechnica Sinica,2022,53(4):1252-1258.(in Chinese)
[26] GARRETT-SINHA L A.Review of Ets1 structure,function,and roles in immunity[J].Cell Mol Life Sci,2013,70(18):3375-3390.
[27] 王 权,孙文逵.转录因子PU.1与机体免疫功能的相关性及其研究进展[J].医学研究生学报,2013,26(10):1096-1100.
WANG Q,SUN W K.Advances and association of transcription factor PU.1 and immune system[J].Journal of Medical Research amp; Combat Trauma Care,2013,26(10):1096-1100.(in Chinese)
[28] VASUDEVAN S O,RUSSO A J,KUMARI P,et al.A TLR4-independent critical role for CD14 in intracellular LPS sensing[J].Cell Rep,2022,39(5):110755.
[29] LIN T C.RUNX1 and cancer[J].Biochim Biophys Acta Rev Cancer,2022,1877(3):188715.
[30] SOOD R,KAMIKUBO Y,LIU P.Role of RUNX1 in hematological malignancies[J].Blood,2017,129(15):2070-2082.
[31] RODRIGUEZ-TIRADO C,KALE N,CARLINI M J,et al.NR2F1 is a barrier to dissemination of early-stage breast cancer cells[J].Cancer Res,2022,82(12):2313-2326.
[32] PEDERSEN S,NONNENMANN M,RAUTIAINEN R,et al.Dust in pig buildings[J].J Agric Saf Health,2000,6(4):261-274.
[33] CLEAVE J,WILLSON P J,TOWN J,et al.Fractionation of swine barn dust and assessment of its impact on the respiratory tract following repeated airway exposure[J].J Toxicol Environ Health A,2010,73(16):1090-1101.
[34] 翟中金,曹廷兵.内毒素在体外对人外周血淋巴细胞的刺激作用[J].第三军医大学学报,1994,16(6):458-460.
ZHAI Z J,CAO T B.Stimulation of human normal peripheral lymphocytes with endotoxin in vitro[J].Journal of Army Medical University,1994,16(6):458-460.(in Chinese)
[35] 郜康康,扆妍妍,赵一腾,等.内质网应激预适应对LPS诱导的山羊子宫内膜上皮细胞炎性反应的保护作用[J].畜牧兽医学报,2023,54(8):3546-3556.
GAO K K,YI Y Y,ZHAO Y T,et al.Protective effect of endoplasmic reticulum stress preadaptation on LPS-induced inflammatory response in goat endometrial epithelial cells[J].Acta Veterinaria et Zootechnica Sinica,2023,54(8):3546-3556.(in Chinese)
[36] COLMAN R W.The contact system:a proinflammatory pathway with antithrombotic activity[J].Nat Med,1998,4(3):277-278.
[37] DEL GIUDICE M,GANGESTAD S W.Rethinking IL-6 and CRP:why they are more than inflammatory biomarkers,and why it matters[J].Brain Behav Immun,2018,70:61-75.
[38] XIAO Z L,SINGH S,SINGH M.Improving cancer immunotherapy by targeting IL-1[J].Oncoimmunology,2021,10(1):2008111.
[39] 彭孝坤,赵 天,黄晓瑜,等.急性热应激对山羊血液生化指标及血淋巴细胞热休克蛋白70家族基因表达的影响[J].畜牧兽医学报,2019,50(6):1219-1229.
PENG X K,ZHAO T,HUANG X Y,et al.Effects of acute heat stress on blood biochemistry indices and expression of HSP70 family genes in blood lymphocytes in goats[J].Acta Veterinaria et Zootechnica Sinica,2019,50(6):1219-1229.(in Chinese)
[40] WESTERMANN J,RONNEBERG S,FRITZ F J,et al.Proliferation of lymphocyte subsets in the adult rat:a comparison of different lymphoid organs[J].Eur J Immunol,1989,19(6):1087-1093.
(编辑 郭云雁)

