应用高分辨质谱实时分析方法研究口呼气和鼻呼气有机组分的存在特征









关键词二次电喷雾电离;挥发性有机物;口呼气;鼻呼气
人体呼气中含有大量挥发性有机物(Volatileorganiccompounds,VOCs),其中包括通过血气交换经肺部释放的机体组织细胞新陈代谢产物[1],或来自人体暴露的环境空气。因此,呼气可反映人体系统代谢过程的信息[2]或环境暴露信息[3],对呼吸成分的分析在临床诊断和环境暴露等生命健康领域具有重要意义。人体呼气样本的类型可分为口呼气或鼻呼气,由于口呼采样更易实现[4],因此相关研究更为广泛。但是,在采集口呼气和鼻呼气样品过程中,口腔和鼻腔内的物质显然会影响呼出气组分,因此深入研究口呼和鼻呼得到的呼气样品的成分组成,对不同研究选择合适的采样方式具有重要的实用意义。近年来,也有学者对口呼气与鼻呼气的组分差异进行了靶标分析。Wang等[5]采用选择离子流动管质谱(Selectedionflowtubemassspectrometry,SIFT-MS)对3名健康受试者的呼气组分进行了靶标分析,发现异戊二烯、丙酮和甲醇的含量在人体口呼气和鼻呼气中基本相当,而氨、乙醇和氰化氢在鼻呼气中的含量远低于口呼气。Slingers等[4]采用SIFT-MS对人体口呼气与鼻呼气中的9种VOCs进行靶标分析发现,口呼气中乙醛、丙醇、2,3-丁二酮、异戊二烯和戊烷的浓度与鼻呼气存在显著差异;进一步通过线性回归分析发现,这9种VOCs在口呼气和鼻呼气内的含量存在显著相关性,表明这些VOCs在鼻呼气和口呼气中的存在特征相似。然而,目前人体呼气中被检出的VOCs有上千种[6],但基于呼气代谢组非靶标分析探究口呼气和鼻呼气有机组分的差异性的研究未见报道。
相较于传统的气相色谱-质谱(Gaschromatography-massspectrometry,GC-MS)离线分析技术,实时在线质谱分析技术可有效降低呼气样品采集、储存和预处理过程中导致的变质概率,避免呼气组分损耗[7]。在人体呼出气研究领域,质子转移反应质谱(Protontransferreactionmassspectrometry,PTR-MS)和SIFT-MS是较早也较为常用的呼气分析直接质谱技术,而二次电喷雾电离质谱(Secondaryelectrosprayionization-massspectrometry,SESI-MS)是相对较新的直接质谱技术[8],可在常温常压环境下实时在线电离气态化合物,其离子化过程可简述为溶剂通过电喷雾离子化(Electrosprayionization,ESI)产生电喷雾云,电喷雾云与气态样品混合,使分析物形成分子离子进入到质谱仪内检测。相较于SIFT和PTR,SESI离子源与高分辨质谱(Highresolutionmassspectrometry,HRMS)耦合使用的方法具有更高的质量分辨率和更低的检出限(Limitofdetection,LOD),特别适合检测呼气中复杂的痕量有机组分[8-10]。
本研究以人体呼气中9种典型VOCs为检测对象,采用SESI-HRMS建立9种VOCs的定量分析方法(见图1)。以实际复杂呼气样品为检测对象,分别采用靶标与非靶标分析策略,探究了口呼气组分与鼻呼气组分之间的差异,以期为不同应用场景选择适宜的呼气采样方式提供依据。
1实验部分
1.1仪器、试剂与材料
QExactiveTM四极杆组合静电场轨道阱傅里叶变换超高分辨质谱仪(美国赛默飞公司);Luna-3000SESI离子源(广东智普生命科技有限公司);Model2010气体稀释校准仪(美国Sabio公司);D07-19质量流量控制器(Massflowcontroller(MFC)量程5L/min,北京七星华创流量计有限公司);GilianGilibrator2皂泡流量计(美国Sensidyne公司)。
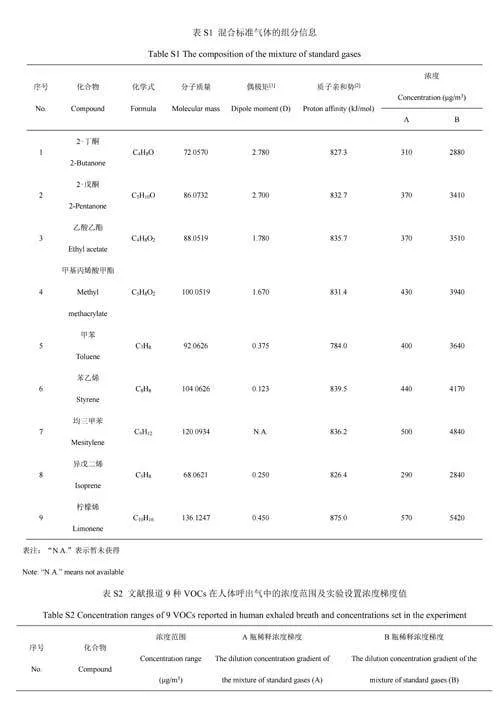
混合标准气体(组分及浓度详见电子版文后支持信息表S1,纯度≥98%,大连大特气体有限公司);N2标准气体(纯度≥99.999%,广州广气气体有限公司);标准校正液(美国赛默飞公司);0.1%甲酸溶液(液相色谱级,德国默克公司)。石英毛细管喷针(内径20μm和50μm,西班牙Fossiliontech公司);口、鼻呼气采样接头(广东智普生命科技有限公司);KQB2T08-00金属T型快插接头(日本SMC公司);不锈钢二通球阀(内径6mm,北京熊川阀门制造有限公司);特氟龙管(内径6mm,泰州纯仕新材料有限公司);特氟龙碳纤维加热带(70℃,230W,淄博星恒电器科技有限公司)。
1.2实验方法
1.2.1定量分析方法的建立
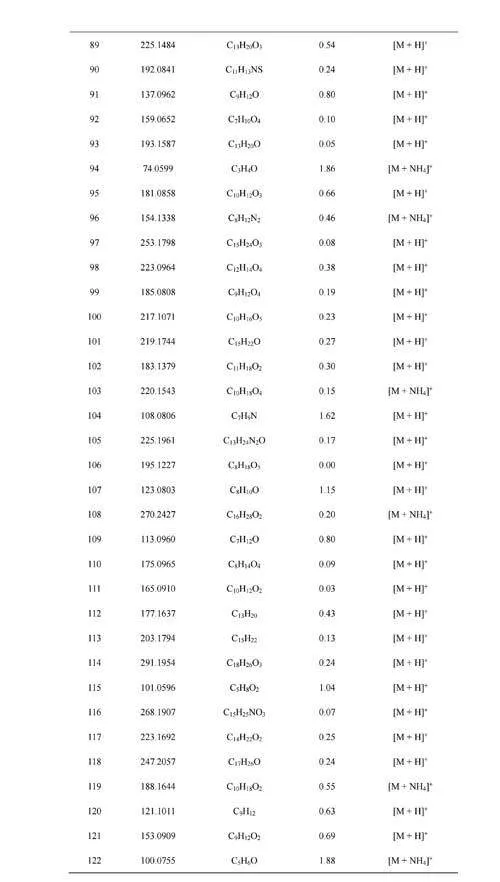
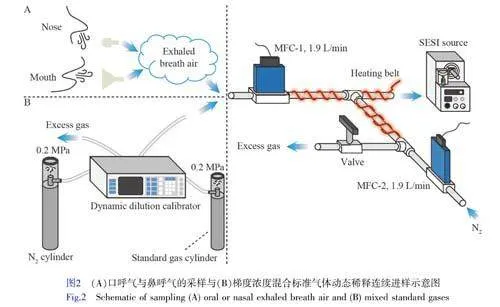
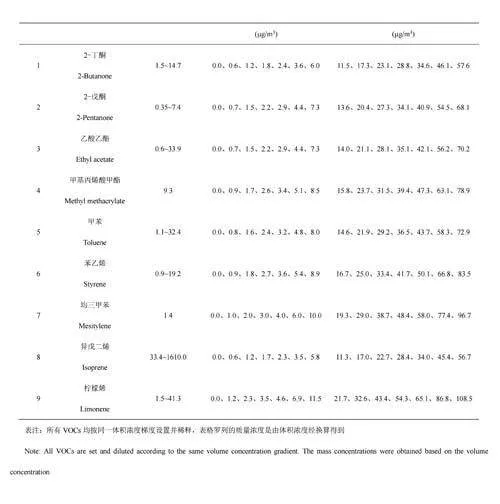
本研究选择9种VOCs建立定量分析方法,主要基于其具有的应用价值。其中,2-丁酮和2-戊酮被认为是肺癌的潜在生物标志物[11-12],乙酸乙酯是硅肺的潜在生物标志物[13],异戊二烯和柠檬烯可分别反映急性组织损伤状态[14]和人体肝脏代谢情况[15],甲基丙烯酸甲酯以及3种苯系物被认为是反映环境暴露情况的重要依据和指标[16-18]。参考人体呼气中9种典型呼气VOCs的浓度范围[16,19-20],共设置14个标准气体浓度梯度(见电子版文后支持信息表S2)。由于受到气体稀释校准仪稀释倍数的限制,依次选用低、高浓度的混合标准气体,通过高纯N2配制目标浓度的标准气体。利用特氟龙管将气体稀释校准仪分别与高纯度N2钢瓶(稀释气体)和混合标准气体钢瓶连接,气体稀释校准仪出气流速设置为1.9L/min,实验时按照浓度由低到高的顺序依次改变配气程序。14个梯度浓度的标准气体样品先经过呼气采样装置(管路加热至70℃),再经SESI源电离后,连续进入质谱进行分析。每个梯度浓度进样时间持续3~5min,实验装置如图2所示。此外,为提高电离效率,降低环境空气对VOCs检测的影响,采用N2作为源内氛围气[21]。采用特氟龙管与废气管道连接,防止多余标准气体泄露到实验室环境中。
根据标准曲线结果,选择适宜浓度,考察9种VOCs日内(n=6)和日间(n=18)相对标准偏差(RSD),评估方法的稳定性。
1.2.2呼气样品采集
选择9名(5名男性,4名女性,年龄23~28岁)无吸烟史的健康受试者提供呼气样本。有研究表明,受试者体位的改变将引起人体血流动力学和肺部通气与血流灌注比值发生变化,进而导致呼气VOCs浓度发生变化[22],因此,本研究要求所有受试者均采用静坐的方式采集呼气样品。为减少呼气吹嘴材质对呼气组分的影响,采用同种材料制成的鼻呼气和口呼气采样吹嘴,接于MFC-1前端的特氟龙管上,以便采集受试者的鼻呼气和口呼气样本。对进样管路加热至70℃,以防止呼气内的水蒸汽冷凝在管壁上。
为保证呼气数据的有效性,受试者按照以下标准程序提供呼出气样品:(1)在呼出气测试前1h内,不进行高强度体育运动,不进食,不喝饮料(水除外),不刷牙,不嚼口香糖,不涂唇膏或口红,不喷香水等[7];(2)在开始采样前采用纯净水漱口3次,再提供呼出气样品;(3)对每位受试者重复采集呼气6次,每次呼气间隔约15s。本研究已得到暨南大学附属医学伦理委员会的批准,受试者均签署知情同意书。
1.3SESI-HRMS分析方法
SESI源:在密封溶液瓶施加0.146MPa压力,并对ESI溶液加高压电,0.1%甲酸溶液通过内径为50μm的石英毛细管并转接至内径为20μm的石英毛细管喷针稳定释放。
HRMS:将质谱端控制的鞘气设置为50,提供ESI溶液瓶内的高压;离子传输管温度设置为275℃;喷雾电压设置为+3.5kV(正离子模式)/–3.5kV(负离子模式);扫描方式为全扫描,质量范围为m/z60~500;分辨率(R)为140000。
1.4数据处理
采用Igor6.3.7.2软件计算9种VOCs被质谱检测的平均响应强度及标准偏差,Origin2017软件用于绘制图形以及计算灵敏度(Sensitivity,S)和相关系数(R2)。LOD和定量限(Limitofquantitation,LOQ)分别按照3×σ/S和10×σ/S原则进行计算,其中,σ代表空白样本中各VOCs分子离子信号峰处的仪器背景噪音的标准偏差[23]。
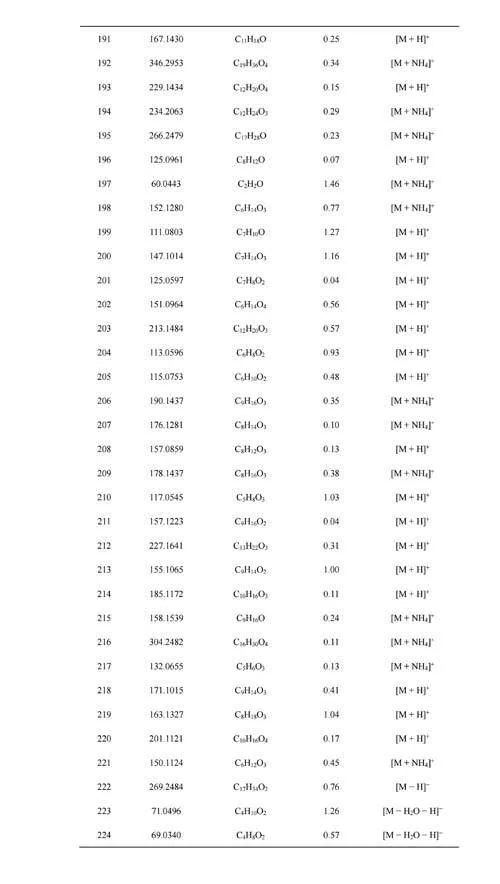
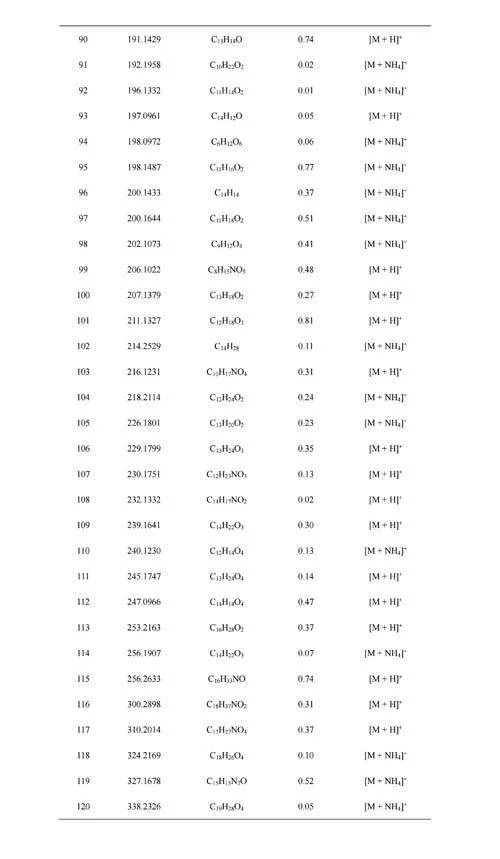
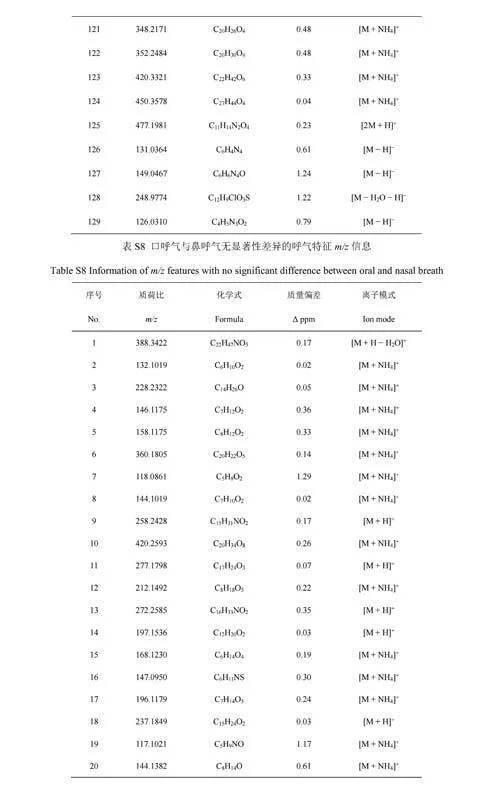
利用软件MSConvert[24]将原始质谱数据文件格式“.Raw”转换为“.MZxml”,再采用Python程序BreathFinder(https://github.com/WanyangSun/BreathFinder)提取质谱数据,将响应强度≥1×105a.u.的离子对应的m/z、扫描时间点及该时间点的响应强度三类数据形成数据矩阵,再将其导入Matlab(R2020a),采用Clustergram算法[25]进行层次聚类分析,生成热图,找出离子响应信号强度随呼气进样时间上升的成分。本研究采用误差校正工具NEAPOLIS(http://bioinformatica.isa.cnr.it/NEAPOLIS/),设置出现频数≥4的成分才能被提取,并将质量偏差在2ppm(10–6)以内的呼气成分认定为同一成分。利用Evenn网上在线绘制Venn图[26],并采用MetaboAnalyst5.0[27]对口呼气与鼻呼气组分进行火山分析,以差异倍数(Foldchange,FC)gt;1.5、plt;0.05作为统计分析参数,筛选口呼气与鼻呼气中存在显著性差异的成分,采用人类代谢组学数据库[28](Humanmetabolomedatabase,HMDB)进行初步定性分析,并采用自编Matlab算法以质量偏差最小为规则确定该成分对应的化合物分子式及其离子加合方式。
2结果与讨论
2.1混合标准气体定量分析方法
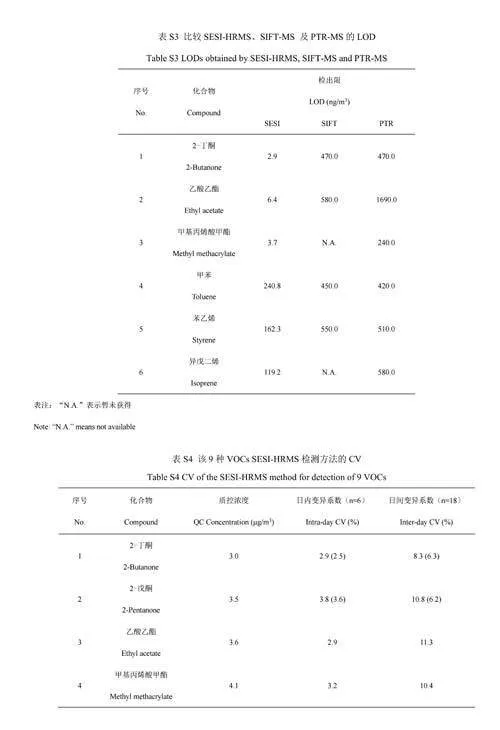
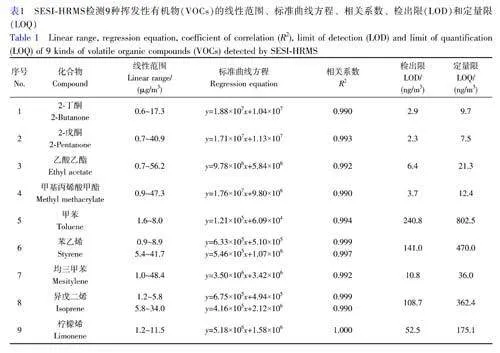
9种VOCs的线性范围、标准曲线方程、LOD和LOQ如表1所示。9种VOCs信号强度和浓度的线性回归方程的R2为0.990~1.000,LOD在2.3ng/m3(2-戊酮)~240.8ng/m3(甲苯)之间。与常见的呼气直接质谱技术PTR-MS和SIFT-MS相比[29-30](电子版文后支持信息表S3),SESI-HRMS的LOD均低于两者,其中,对于2-丁酮,SESI-HRMS的LOD均低于PTR-MS和SIFT-MS2个数量级;对于乙酸乙酯,SESI-HRMS分别低于两者2个和3个数量级。从检测范围来看,SESI-HRMS对9种VOCs的LOD均低于人体呼气浓度下限(见电子版文后支持信息表S2),对2-丁酮、2-戊酮、乙酸乙酯、甲基丙烯酸甲酯和均三甲苯的线性范围上限均高于人体呼气浓度上限报道值,表明利用此装置和方法定量分析呼气中9种VOCs具有可行性。
一天内在同一体积浓度下通过6次重复检测评估日内变化。9种VOCs的日内RSD在0.6%(柠檬烯)~4.6%(甲苯)之间,低于5%。此外,通过连续3d的重复检测,对日间变化情况进行评估,日间RSD在4.3%(异戊二烯)~12.2%(柠檬烯)之间,低于15%。以上结果与文献[10]的结果相当(电子版文后支持信息表S4),表明本方法具有良好的重现性和稳定性。
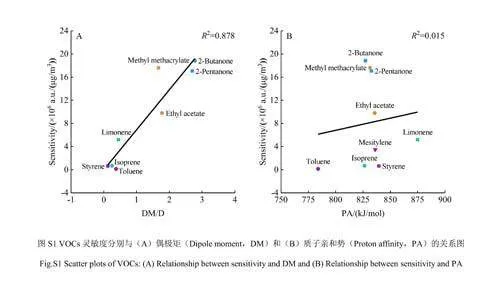
研究了SESI-HRMS检测酮类、烯烃类、芳香烃类和酯类VOCs的普适性规律,由于SESI的电离过程主要受配体切换反应控制[31],该反应可能与物质的偶极矩(Dipolemoment,DM)和质子亲和力(Protonaffinity,PA)相关。对9种VOCs的检测灵敏度与DM和PA的相关性进行分析,结果见电子版文后支持信息图S1,灵敏度与DM和PA均呈正相关(R2分别为0.878和0.015),并且与DM的相关性远高于PA。灵敏度与DM的相关性分析结果表明,随着化合物极性上升,SESI-HRMS的检测灵敏度也随之上升,可能是因为VOCs与电喷雾云内的带电微液滴发生相互作用的过程与物质的DM有关[31]。例如,DM越高代表物质极性越强,其水溶解度也越高,因此极性更强的VOCs更容易溶解于带电微液滴内,进而发生电离。质子亲和力与灵敏度的相关性分析结果表明,这4类VOCs在被SESI源电离的过程中可能包含质子转移反应,VOCs的PA越高,越容易从带电微液滴获得质子。但是,此规律还需要更多标准品实验予以证明。
2.2口呼气与鼻呼气组分分析
口呼气与鼻呼气中9种VOCs的定量分析结果表明,仅在一位受试者的口呼气和鼻呼气中检测出柠檬烯,浓度分别为0.8和0.2μg/m3,其余受试者口呼气或鼻呼气中9种VOCs的浓度均未达到LOQ。
利用Venn图初步分析口呼气和鼻呼气组分的差异,结果如图3所示。人体口呼气与鼻呼气组分被检测到的共同存在成分数量为565个(正离子模式395个(图3A),负离子模式170个(图3B))。口呼气特有成分数量167个(正离子模式112个(图3A),负离子模式55个(图3B)),鼻呼气特有成分数量76个(正离子模式34个(图3A),负离子模式42个(图3B)),前者是后者的2.2倍。无论在正离子还是负离子电离模式下,口呼气内特有成分数量均高于鼻呼气,推测是口腔环境中的细菌或食物残渣、唾液也会释放VOCs[32-33],导致口呼气中VOCs组成更复杂。
2.3口呼气与鼻呼气差异组分分析
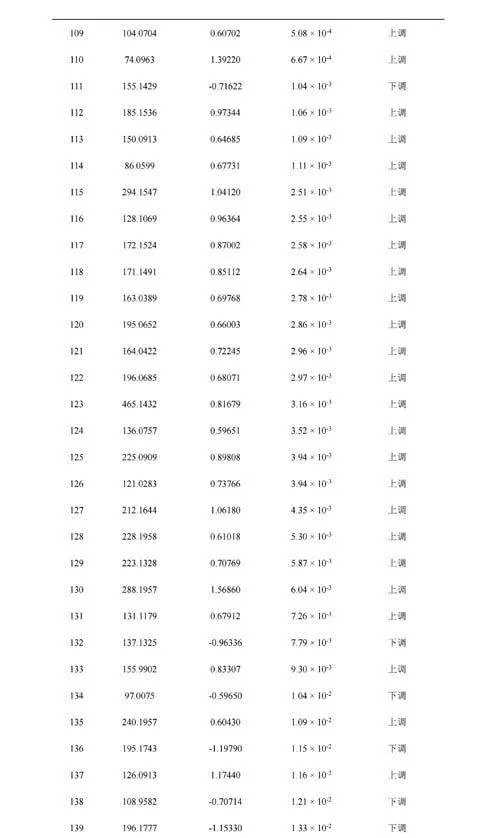
为进一步探究人体口呼气与鼻呼气组分的差异,将上述口呼气与鼻呼气共同检测到的565个成分对应的信号强度进行火山分析(图4A)发现,163个成分的强度存在显著差异,其中以口呼气相对鼻呼气信号强度显著上升的成分为上调成分(85个),反之则为下调成分(78个)(电子版文后支持信息表S5)。
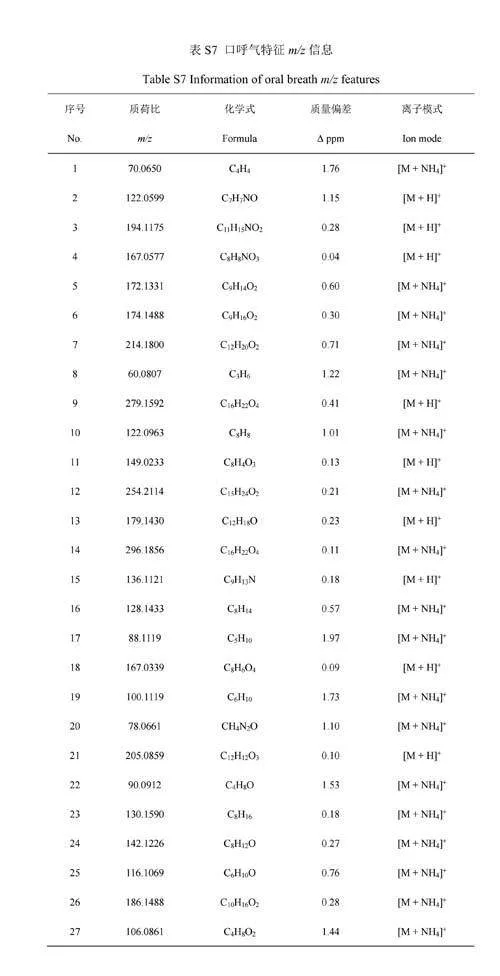
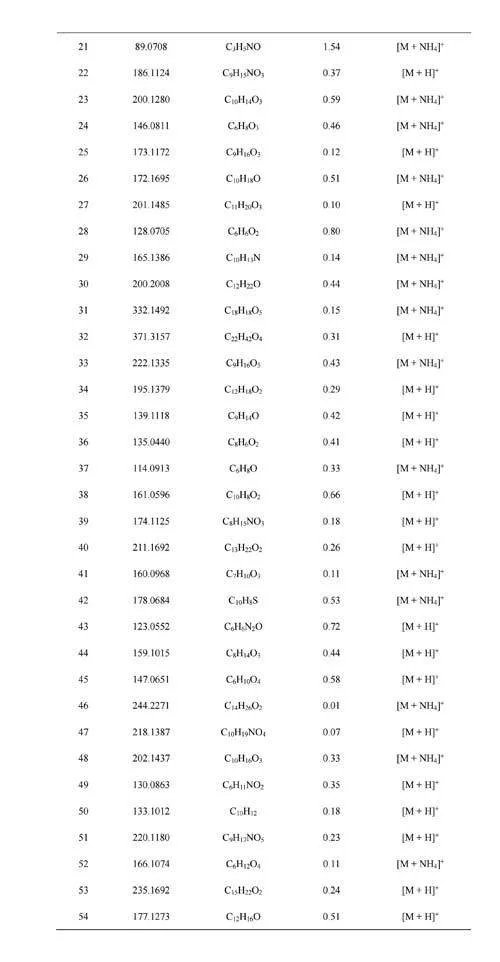
将口呼气和鼻呼气中特有的成分以及口呼气和鼻呼气中具有强度差异性的成分均导入HMDB,再将其精确质量与原始数据比较,确定相应成分对应的化学式及其离子加合方式(电子版文后支持信息表S6和S7)。从上述成分对应的离子形式来看,口呼气中被SESI源电离形成氨加合分子离子[M+NH4]+占所有离子形式的比例为53.5%,而鼻呼气内[M+NH4]+的占比为25.0%。由于人体呼气中含有的氨主要由口腔释放,其含量高于鼻呼气[34],这可能是因为口呼气组分内氨加合分子离子占比更高的原因。口呼气中高浓度的氨气会导致呼气组分经口腔呼入离子源后更易形成氨加合态分子离子,增加了后续定性分析的难度。进一步,以各化学式H原子数与C原子数的比例(H/C)为横坐标,以O原子数与C原子数的比例(O/C)为纵坐标,对鼻呼气与口呼气的组分进行元素组成分析,发现口呼气组分既含有与鼻呼气组分种类相似的一系列化合物,也包括有别于鼻呼气组分的一类化合物(图4B)。O/C能反映化合物的极性,O/C越高,极性越强[35]。将O/Cgt;0.4的化合物个数进行统计,发现鼻呼气组分中O/Cgt;0.4的化合物所占比例为41.9%,口呼气中该比例为10.5%。化合物的极性越强,其在水中的溶解度也会随之上升。有研究表明,鼻呼气的湿度低于口呼气[36],加之口腔内含有大量唾液,导致极性化合物更易滞留在口腔环境中,这也可能是鼻呼气特异性组分中极性化合物占比更高的原因。此外,尽管口呼气采样相对鼻呼气采样更易实现,当口腔释放出的VOCs对呼气生物标志物的发现或筛查造成干扰时[37],可以考虑采集鼻呼气以减少影响。
3结论
以9种VOCs为检测对象,建立了基于SESI-HRMS的定量分析方法。结果表明,本方法的重现性和稳定性良好,满足人体呼气中9种VOCs的定量分析需求。进一步,以实际人体呼气样品为研究对象,与以往只针对特定VOCs的分析研究不同,本研究采用非靶标分析策略探究口呼气组分与鼻呼气组分的差异。分析结果表明,由于氨主要源自口腔环境释放,口呼气氨的含量高于鼻呼气,这解释了在口呼气内氨加合分子离子所占比例更高的现象。进一步根据元素组成的分析结果,发现鼻呼气内极性化合物的占比更高,推测可能由于人体鼻呼气湿度低于口呼气湿度,减少了极性化合物在鼻腔内的滞留,表明采集鼻呼气可能更有利于分析极性化合物组分。同时,应考虑呼气内源性组分是否受口腔内VOCs释放的影响,避免产生错误结果。后续研究还需进一步基于更大样本量,以精准定性和定量分析口呼气与鼻呼气的组分为目标,更加系统且深入地探索两种呼气样本类型间的差异性组分及其来源,为进一步明确合适的呼气方式应用场景和优化SESI-HRMS呼气检测方法提供更多的理论依据。

