基于负载在碳基底上的钌纳米颗粒的类过氧化物酶活性比色检测抗氧化剂





关键词纳米酶;晶格应变;抗氧化剂;比色分析
天然抗氧化剂具有重要的生物学功能和药理作用,能够预防氧化应激相关疾病,如心血管疾病、癌症和糖尿病等[1],因此,发展针对这些抗氧化剂的定量检测方法具有重要意义。常见的抗氧化剂的检测方法包括气相色谱法[2]、液相色谱法[3]、电化学分析法[4]和极谱法[5]等。尽管上述方法灵敏度较高,但需要昂贵的设备且操作步骤繁琐,限制了其广泛应用。相比之下,比色法因具有操作简单、响应迅速、可重复性良好等特点备受关注[6-7]。
天然酶的催化活性高且特异性好,在比色分析中表现出良好的应用潜力[8]。但是,天然酶存在易失活、成本高及难储存等缺点,限制了其在比色分析中的应用[9]。纳米酶是一类具有内在类酶活性的纳米材料,具有可调的催化活性、成本低及易储存等优势,有望成为天然酶的有效替代物[10-11]。自2007年首次报道Fe3O4纳米颗粒具有类过氧化物酶活性以来[12],许多纳米材料包括金属氧化物[13]、金属有机骨架[14]、碳基材料[15]和贵金属[16]等被发现同样具有类酶活性,其中,具有类过氧化物酶活性的贵金属基纳米酶被广泛应用于生物传感、肿瘤治疗和抗菌等领域[17-19]。贵金属纳米酶的催化活性与其颗粒尺寸密切相关。一般而言,减小粒径有助于增强其催化效率,但小尺寸的贵金属纳米粒子由于表面能高,在催化反应过程中容易聚集,使其催化活性不断降低[20]。因此,寻找合适的载体用于稳定和负载贵金属纳米酶对提高贵金属纳米颗粒的催化活性具有重要意义[21-22]。
本研究合成了一种均匀稳定地负载在氮改性碳纳米片上并且具有晶格应变效应的钌纳米颗粒(RuNPs/NC)。其中,RuNPs的晶格应变效应以及NC基底中氮元素的引入有效提高了RuNPs/NC的稳定性以及类过氧化物酶催化活性。基于抗坏血酸(AA)、没食子酸(GA)和单宁酸(TA)对RuNPs/NC催化的3,3′,5,5′-四甲基联苯胺(TMB)-H2O2显色反应的抑制[23],RuNPs/NC-H2O2-TMB体系被成功应用于AA、GA和TA等的比色检测。本研究不仅为调节贵金属纳米酶的催化活性提供了良好的思路,也为抗氧化剂的检测提供了一种简便且有效的方法。
1实验部分
1.1仪器与试剂
SmartLab9KW型原位X-射线粉末衍射仪(XRD,日本理学公司);JEM2100F透射电子显微镜(TEM,日本电子株式会社);K-AlphaX射线光电子能谱仪(XPS,美国赛默飞世尔科技公司);UV-8000紫外-可见分光光度计(上海元析仪器有限公司);MagnettechESR5000电子顺磁共振谱仪(EPR,德国布鲁克公司)。
氯化钌(99.9%,美国Sigma-Aldrich公司);乙酸(99.8%)、AA(99%)、乙酸钠(99%)和TMB(98%)(上海麦克林试剂有限公司);TA(95%)、GA(99%)、乙醇(99.7%)、双氰胺(99%)、均苯三甲酸(97%)、蔗糖(Sucrose)、果糖(Fru)、葡萄糖(Glu)和乳糖(Lac)(上海阿拉丁试剂有限公司)。
1.2RuNPs/NC-x复合材料的制备
采用湿化学-热解法制备了RuNPs/NC[24]。将10mg氯化钌溶解在10mL乙醇中,搅拌直至完全溶解,得到溶液A。将10mg均苯三甲酸和1g双氰胺溶解在30mL乙醇中,搅拌1h至完全溶解,得到溶液B。将上述A、B溶液充分混合后,置于80℃油浴中继续搅拌至蒸干乙醇溶剂。随后,将干燥的混合物在不同温度(800、900和1000℃)的氮气氛围中热解1h,得到一系列具有不同氮含量的RuNPs/NC-x(x代表热解温度)样品。另外,以双氰胺和均苯三甲酸为原料制备了NC-x。
1.3RuNPs/NC-x的类过氧化物酶活性测试
以TMB-H2O2显色反应考察RuNPs/NC的类过氧化物酶活性。在2mL离心管中依次加入10μLRuNPs/NC(0.1mg/mL)、50μLH2O2(0.1mol/L)、50μLTMB(5mmol/L)和890μLHAc-NaAc缓冲溶液(0.2mol/L,pH=4.0),混合均匀后,于室温下反应20min,然后记录反应体系在500~800nm波长范围内的吸收光谱。将RuNPs/NC在室温下放置3个月后重复上述步骤,记录其在500~800nm波长范围内的吸光度,考察其稳定性。
在含有HAc-NaAc缓冲溶液(0.2mol/L,pH4.0)体系中,分别改变TMB和H2O2的浓度,记录体系在652nm处的吸光度随时间变化的曲线。利用Michaelis-Menten方程拟合计算反应体系的动力学参数[25]:
其中,v为反应初速率,S为底物浓度,Km为Michaelis常数,vmax为最大反应速率。
1.4比色法检测抗氧化剂
配制不同浓度的抗氧化剂标准样品(AA:1~10μmol/L;GA:2~16μmol/L;TA:0.25~3.5μmol/L)。将10μLRuNPs/NC(0.1mg/mL)、50μLTMB(5mmol/L)、50μLH2O2(0.1mol/L)和840μLHAc-NaAc缓冲溶液(0.2mol/L,pH=4.0)混合后,在室温下反应20min,然后分别加入不同浓度的3种抗氧化剂(50μL),孵育40s后,测定溶液的吸光度。通过抗氧化剂浓度与吸光度之间的线性关系进行抗氧化剂的定量分析。
1.5实际样品中抗氧化剂的检测
柠檬和西红柿富含AA,茶叶富含TA,五倍子和芒果果皮富含GA。因此,以上述物质为代表,对实际样品中的抗氧化剂进行检测和评估。柠檬、西红柿、茶叶(红茶和绿茶)和芒果均购买于本地超市,五倍子购买于本地中药店。柠檬、西红柿和芒果榨汁后,离心取上清液,稀释5倍后备用;将1g茶叶和五倍子分别加入50mL沸水中,5min后取上清液,备用。除用实际样品代替标准抗氧化剂溶液外,检测步骤与1.4节的方法相同。
2结果与讨论
2.1RuNPs/NC的结构表征
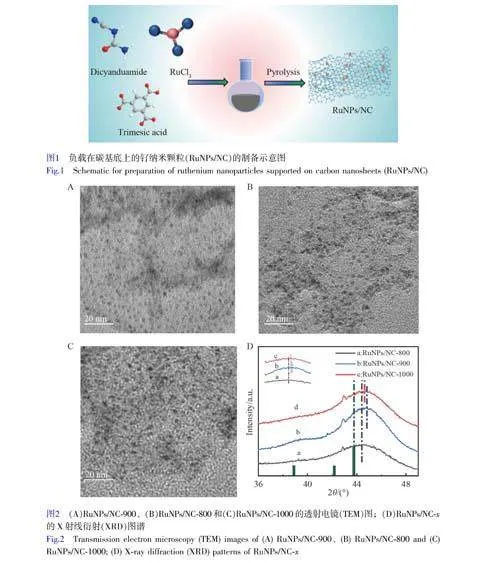
将氯化钌、均苯三甲酸和双氰胺混合乙醇溶液在80℃加热,直至乙醇完全蒸发,得到的固体样品在不同温度下高温处理1h,制得不同含量氮掺杂的RuNPs/NC-x样品(图1)。利用TEM对RuNPs/NC-x的形貌进行了表征。如图2A~2C所示,RuNPs均匀地分散在NC上,表明3种热解温度下获得的RuNPs的形貌无明显区别。
通过XRD对RuNPs/NC-x的晶体结构进行了表征。如电子版文后支持信息图S1A所示,钌为六方密排堆积相(JCPDSNo.06-0663)[27]。与标准卡片相比,3种热解温度下获得的RuNPs的衍射峰均向高角度方向移动(图2D),表明RuNPs与载体之间的强相互作用导致RuNPs的晶格压缩[28]。其中,RuNPs/NC-900的偏移程度高于RuNPs/NC-800和RuNPs/NC-1000,表明在900℃下,RuNPs的晶格应变程度更大[29]。
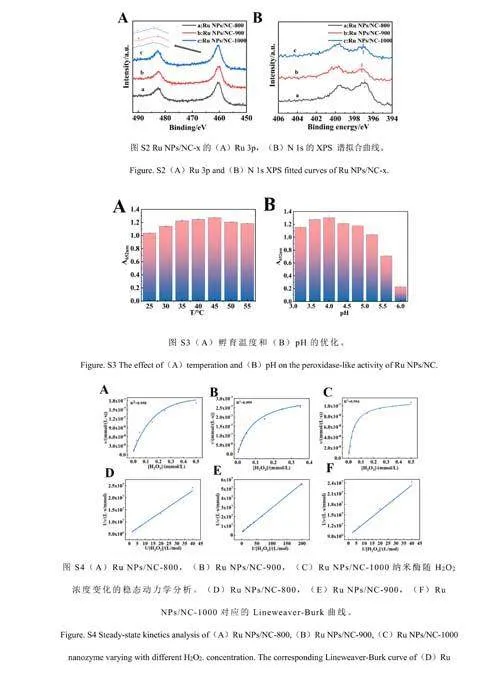
利用X-射线光电子能谱(XPS)研究了RuNPs/NC-x的化学组成和金属价态。如图3A所示,RuNPs/NC-x样品中存在C、N、O和Ru元素。以RuNPs/NC-900为例,对其各元素存在形式进行了分析。如图3B所示,C1s的XPS拟合曲线显示C—C(284.4eV)、C—N(285.4eV)和C—O(288.7eV)的特征峰。如图3C所示,Ru3p的XPS拟合曲线显示位于464.4、486.9、461.4和483.6eV处的4个峰分别对应Ru4+3p3/2、Ru4+3p1/2、Ru03p3/2和Ru03p1/2,表明钌的价态为0和4。N1s的XPS谱显示了4种类型的氮物种,包括吡啶氮(398.1eV)、吡咯氮(399.5eV)、石墨氮(400.8eV)和氧化氮(402.3eV)(图3D和3F)。由电子版文后支持信息图S2A和S2B可知,RuNPs/NC-x的Ru3p和N1s的XPS衍射峰发生了相对位移,说明在RuNPs和NC之间发生了电子转移。通过XPS结果计算氮含量,发现RuNPs/NC-900中氮含量最高(电子版文后支持信息图S1B)。相对于RuNPs/NC-800和RuNPs/NC-1000,RuNPs/NC-900具有最高比例的吡啶氮(电子版文后支持信息图S1C)。由于吡啶位点上的孤对电子可以与金属原子形成强的化学键,从而限制了金属原子的扩散和聚集,使得纳米颗粒可以更加稳定的负载在NC基底上[30],有效提高了材料的类酶活性[31]。
2.2类过氧化物模拟酶活性评估及催化机理
如图4A所示,只有当H2O2、TMB和RuNPs/NC-900共存时(曲线a),在652nm处出现氧化态TMB(oxTMB)的特征吸收峰,表明RuNPs/NC-900具有类过氧化物酶活性。如图4B所示,在含有TMB及H2O2的溶液中加入相同质量的RuNPs/NC-800(曲线b)、RuNPs/NC-1000(曲线c)和NC(曲线d),发现RuNPs/NC-900的吸光度最大,表明RuNPs/NC-900具有最高的类过氧化物酶活性。上述结果表明,RuNPs/NC中氮含量越高,吡啶氮越多,其类过氧化物酶活性越好[32]。另外,由于NC的吸收峰与其它吸收峰相比可以忽略不计,表明RuNPs/NC-x的类酶活性主要源于RuNPs。
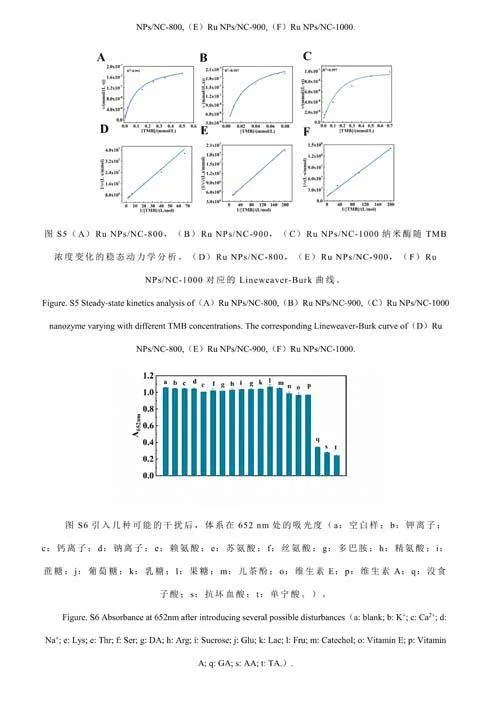
纳米酶的催化活性与催化反应孵育温度和反应体系的pH值有关。对温度(25~55℃)和pH值(3.2~6.0)的影响进行了考察。由电子版文后支持信息图S3A和S3B可知,最佳反应温度为45℃,最佳pH为4.0。在25~55℃范围内,温度对纳米酶的催化活性影响不大,因此选择室温进行后续测试。考察了RuNPs/NC的储存稳定性。结果表明,RuNPs/NC在保存3个月之后其活性仍保持在初始活性的95%以上,证明其具有良好的稳定性(图4C)。以H2O2和TMB为底物,进行了稳态动力学实验。如电子版文后支持信息图S4和S5所示,在合适的底物浓度范围内,RuNPs/NC-x的催化反应遵循典型的Michaelis-Menten动力学模型[33],计算得到动力学常数(电子版文后支持信息表S1),相对于天然酶及已报道的其它纳米酶,RuNPs/NC-x在与底物的亲和力和反应速率方面均具有优势。另外,RuNPs/NC-900的动力学常数优于RuNPs/NC-800和RuNPs/NC-1000,也说明RuNPs/NC-900具有最高的类酶活性[34]。
过氧化物酶活性与活性氧(ROS)的产生密切相关[35-37]。因此,为阐明RuNPs/NC的催化机理,对RuNPs/NC催化过程中的活性氧类型进行了测试。首先,利用异丙醇、色氨酸和超氧化物歧化酶分别作为·OH、1O2和O2·的捕获剂[38-40],将上述捕获剂分别加入到RuNPs/NC-H2O2-TMB体系中,测定其在652nm处的吸光度。结果表明,只有在加入色氨酸后,体系在652nm处的吸光度明显降低,表明体系中产生了1O2(图4D)。电子顺磁共振(EPR)x∶y∶z三重峰的出现进一步证实了1O2的存在(图4E)。
2.3抗氧化剂的检测
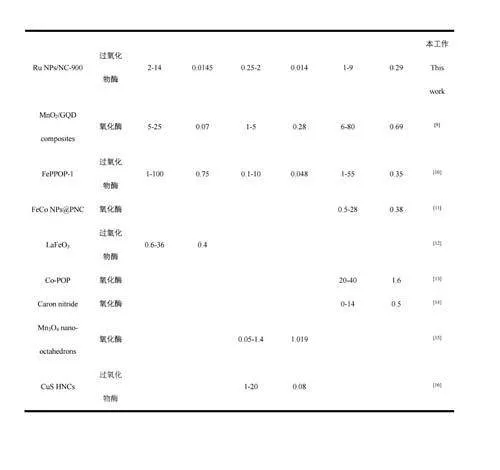
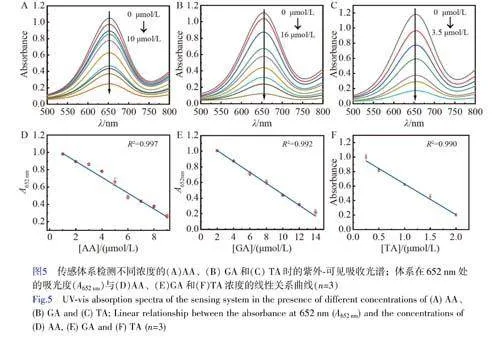
考察了RuNPs/NC-H2O2-TMB体系用于AA、TA和GA检测的可行性。当向体系中分别加入3种抗氧化剂(图4F曲线b、c和d)时,体系在652nm处的吸光度(A652nm)相对于未加入抗氧化剂(曲线a)时明显降低,且A652nm随抗氧化剂浓度升高而逐渐降低(图5),证明RuNPs/NC-H2O2-TMB体系可用于AA、TA和GA的检测。A652nm与AA、GA和TA的浓度分别在在1~10μmol/L、2~16μmol/L和0.25~3.50μmol/L范围内呈线性关系。根据3σ/S(σ表示空白样的标准偏差,S表示曲线的斜率)计算得到AA、GA、TA的检出限分别为0.29、0.014和0.014μmol/L。与已报道的检测AA/GA/TA的方法相比(电子版文后支持信息表S2),本体系对抗氧化剂AA、GA和TA的灵敏度更高。选择食品和中药中常见的氨基酸、离子、糖类以及其它抗氧化剂(儿茶酚、维生素E、维生素A)作为干扰物质考察体系的选择性。如电子版文后支持信息图S6所示,加入干扰物质后,体系的A652nm未发生明显的变化,表明本体系对AA、TA和GA具有良好的选择性。
2.4抗氧化剂对RuNPs/NC类过氧化物酶活性的抑制机理
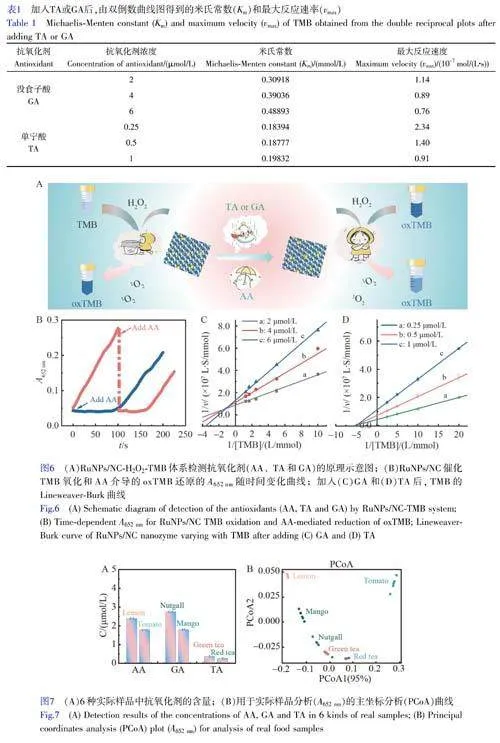
AA、GA和TA作为抗氧化剂,可抑制RuNPs/NC催化TMB的氧化反应,如图6A所示。AA作为抗氧化剂和自由基清除剂,可有效抑制酶引发的显色反应[41]。通过猝灭动力学[42]研究了AA对RuNPs/NC催化的TMB-H2O2反应的抑制作用。如图6B所示,将AA加入到预先反应的RuNPs/NC-H2O2-TMB体系中,652nm处的吸光度迅速下降(曲线a),证实AA可还原氧化的TMB(oxTMB)。如在反应的初始阶段引入AA时(曲线b),RuNPs/NC催化的TMB的氧化反应被抑制;随着AA被消耗,氧化反应逐渐恢复,证明AA可以清除来自RuNPs/NC-H2O2-TMB体系的1O2。上述结果表明,AA通过还原oxTMB及消耗1O2抑制RuNPs/NC催化TMB的氧化反应。TA和GA作为抗氧化剂,能够抑制RuNPs/NC催化TMB的氧化反应。通过抑制动力学研究了TA和GA对RuNPs/NC催化TMB-H2O2反应的抑制作用[43]。抑制动力学遵循Michaelis-Menten方程。TA和GA的Lineweaver-Burk曲线图如6C和6D所示,各曲线线性关系良好,并且相交于第二象限。由公式(1)和(2)计算得到的Km和vmax见表1,可见随着TA和GA浓度的增大,Km增大,vmax减小,表明TA和GA抑制RuNPs/NC催化TMB氧化的机理为混合型抑制[44]。
2.5实际样品的比色分析
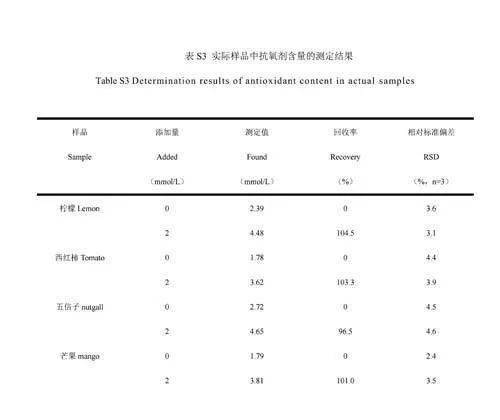
考察了RuNPs/NC-H2O2-TMB体系在检测实际样品中抗氧化剂的应用潜能,测定结果如图7A所示。同时进行了标准添加回收实验,回收率为96.0%~104.5%,相对标准偏差(RSD)小于5%(电子版文后支持信息表S3),表明本方法在实际样品检测中具有较高的准确性和较好的重现性。为了评价本体系对真实样品的识别和区分能力,对获得的数据进行了主坐标分析(PCoA)[45]。将制备的柠檬、番茄、芒果果皮、五倍子、红茶和绿茶待测液分别加入到RuNPs/NC-H2O2-TMB体系中,测量A652nm,每个样品重复测定6次。通过PCoA分析对数据降维处理,将数据转换为两个规范因子,如图7B所示。可以看出,这6种样品分别形成了6个不重叠的区域,说明通过PCoA可将不同的样品很好地区分开。
3结论
采用简单的湿化学-热解法制备了均匀分散在NC基底上的RuNPs。通过不同的热解温度处理对RuNPs/NC中的氮含量以及吡啶氮、吡咯氮、石墨氮和氧化氮的相对含量进行了有效调控。结果表明,吡啶氮的相对含量越多,RuNPs/NC可表现出更优异的类过氧化物酶活性。晶格应变的压缩增强了催化活性位点与底物之间的结合强度,从而提高了RuNPs/NC的类过氧化物酶活性。RuNPs/NC-H2O2-TMB体系被成功应用于AA、GA和TA的检测。本研究不仅提供了一种合成稳定钌基纳米酶的简便方法,并且拓展了纳米酶在生物传感领域的应用范围。

