大概念视域下金属与盐溶液反应思维模型建构

摘要: 根据课程标准和教材,基于金属与盐溶液置换反应的本质提出“金属为什么在性质上具有一定的相似性”的本原问题,认为其受“结构决定性质”的大概念所统摄。由金属活动性顺序衍生出的得失电子强弱顺序以及电子得失过程构建的思维模型。结合中考试题分析,指出该思维模型能较好地揭示反应的本质,既可以作定性分析,还能进行半定量比较,帮助学生建立认识视角,形成思路和方法,促进大概念的认知进阶。
关键词: 金属与盐反应; 金属活动性顺序; 大概念教学; 思维模型; 化学教学研讨
文章编号: 1005-6629(2024)07-0092-06 中图分类号: G633.8 文献标识码: B
1 研究现状及背景
金属与盐溶液反应是初中化学的重要内容,查阅资料发现,研究者多从不同角度探讨解题策略和技巧,但一般仅涉及定性分析而没有做定量比较,更没有探讨问题的化学本质,融入新课程理念的研究也比较少见。调查日常教学发现,大多数教师在应试压力下以传授具体解题方法为主,或就题论题没有和前后教学内容或学段知识做结构化归纳梳理。可见目前的教学及评价仍停留在纸笔测试等应试层次,没有上升到化学大观念与高阶科学思维。《义务教育化学课程标准(2022年版)》[1]提出大概念统领教学后,“金属与盐溶液反应”的教学和评价是否符合新课程理念?能否促进学生从具体知识学习转到重视基本思路方法的形成?本文基于课程标准和教材,构建大概念视域下“金属与盐溶液反应”的思维模型,结合中考试题探讨其学科本质和教学价值。
2 课程标准及教材分析
金属与盐溶液反应属于课程标准中“物质的性质与应用”主题下“金属与金属矿物”主题的具体内容。课程标准相关描述有:通过实验探究等活动认识常见金属的主要化学性质及金属活动性顺序。了解废弃金属对环境的影响及金属回收再利用的价值。了解物质的共性和差异性,认识一类物质性质的方法。从物质类别的视角,依据金属活动性顺序初步预测常见金属的主要性质,解释有关的实验现象,进行证据推理,得出合理结论。能依据物质类别、金属活动性顺序等,预测、判断与分析常见物质的性质及其转化产物。可见金属与盐溶液的反应主要体现在金属的化学性质及金属活动性顺序、判断与分析转化的产物等方面。
金属与盐溶液反应是义务教育人教版九年级《化学》(2012年版)下册第八单元“金属和金属材料课”题2“金属的化学性质”的内容,其标题是“金属活动性顺序”而不是“金属与盐溶液的反应”,说明该内容是学习了金属与酸的反应以及置换反应后,为建立金属活动性顺序规律而进行的科学探究活动,弱化了以往传统教学中以金属化学性质知识逻辑为主的教学思路。在比较分析事实的基础上,引导学生建构“金属活动性”这一认识视角,并形成基于金属活动性顺序判断金属活动性的一般思路[2]。所以就标题的呈现上看,教材试图从学科知识体系逻辑结构的完整性向促进学生认识视角的建立转变,教育立场也从知识为本向素养为本发生转变。
3 金属活动性与大概念分析
金属与盐溶液反应是学生建构“金属活动性”认识视角,建立金属活动性顺序,判断金属活动性的科学探究活动。理解好金属活动性顺序是建立金属与盐溶液反应模型的前提和条件。那么什么是金属活动性,和活泼性有什么不同?通常情况下,物质的活泼性是指物质参加化学反应时表现的活泼程度[3]。金属在气态中失去电子的难易程度而表现的活泼性,通常就叫金属的活泼性大小,如果是指金属在水溶液中形成水合阳离子的趋势,一般称为金属活动性[4]。金属活动性顺序是金属在水溶液中的活泼性顺序[5]。可见二者有区别又有联系,适用条件和范围并不相同,活泼性泛指各种物质,而活动性一般用来描述金属在水溶液中的活泼性。金属的活泼性与元素的原子结构有着密不可分的关系,原子失电子能力越强,金属越活泼[6]。历史上人们对“金属活动性”的认识是不断深化的,逐渐明晰金属活动性反映的是金属单质在水溶液里失电子形成水合离子倾向的大小,即反映金属单质在水溶液里发生氧化反应的难易程度[7]。
郑长龙指出,只有将大概念与认识视角有机结合,才能更为有效地解决化学问题[8]。课程标准中该学习主题大概念是“物质的多样性”。凝练金属与金属矿物二级主题大概念是“同类物质在性质上具有一定的相似性”,以此统摄金属的共性。金属活动性顺序既是金属单质具有的一类共性又蕴含差异性,正是差异性导致(混合)金属与(混合)盐溶液反应变得复杂,反应顺序、反应进程、产物成分随反应条件的改变而改变。基于学科理解提出“金属为什么在性质上具有一定的相似性”这一本原问题有助于诱发学生从微观视角思考金属与盐溶液反应的本质,以及深度理解金属活动性顺序规律。因此该内容便串连起“物质的性质与应用”和“物质的组成与结构”两大学习主题,将物质的宏观性质和微观结构建立起联系,体现了跨学科主题的“结构决定性质”这一学科大概念。正如杨玉琴所述,课标的“一级大概念”一般是通过教材的多个单元“二级大概念”持续建构的,通过对不同物质的持续学习逐步建立起来的[9]。
“结构决定性质”大概念不仅是化学学科常见的学科观点,而且还是跨学科、超学科的大概念,具有一定的哲学意义[10],贯穿整个化学课程。课程标准要求在教学中要注重学科主题大概念的抽提,引导学生建构大概念,发挥主题大概念对学生化学观念形成和发展的独特价值[11]。吴庆生认为根据教学内容存在的因果关系,采用能够反映相互关系的表述作为大概念[12]。以此抽提“结构决定性质”大概念统摄的初中化学相关内容汇总见表1。
大概念学习是循序渐进的。吴星认为大概念并非是学习完本主题内容就能达到的最高水平,需要以前置单元学习为基础、后置单元学习为补充,在整体课程中不断学习加深理解[13]。由表1可知“结构决定性质”大概念的形成和建立不是一蹴而就的,是基于多种物质从原子结构、原子排列、微粒种类到分子结构不断地完善的。
4 基于活动性和大概念建构思维模型
金属与盐溶液的反应是金属活动性顺序在工农业生产和科学研究的重要应用之一,是典型的置换反应,为何成为教学的重点与难点?究其原因可能是:金属与盐溶液反应体系物质多、反应多,物质关系影响反应进程、产物成分,且反应物、生成物均有固、液两态,判断某一阶段滤渣、滤液成分时,需要综合考虑反应顺序与进程。现有文献大多以图形或表格罗列各种情况的物质组成,再根据现象一一比对。罗列既费时费力而且无法定量比较,本质上是运用数学思想的枚举原理,枚举的结果属性易造成对产生原因的漠视,所以上述策略不能从根本上解决问题。建立科学思维模型除了必须理顺反应顺序、进程外,还需帮助学生形成化学观念,发展科学思维。
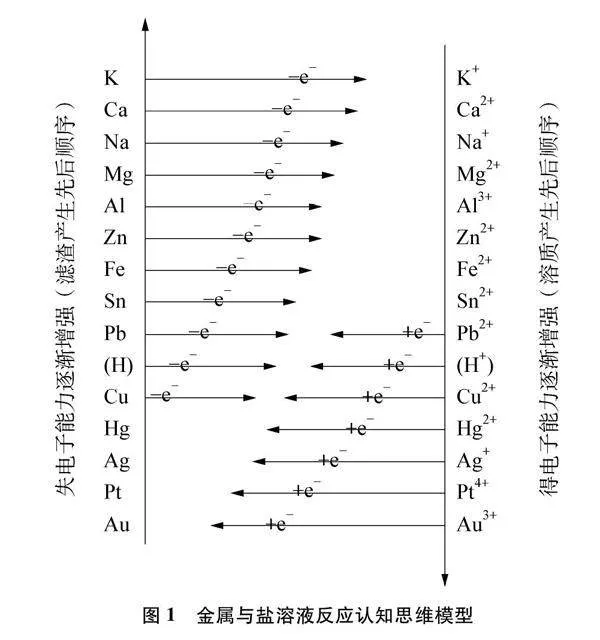
基于此,建构思维模型既要考虑金属因素,还要考虑盐的因素。由表1知金属活动性顺序是“结构决定性质”大概念在金属中的具体化,那么“结构决定性质”大概念在盐溶液中的具体化是什么?我们知道,活动性强的金属在溶液中易失去电子,活动性弱的金属在溶液中难失去电子。因此金属活动性顺序便转化为金属单质在溶液里失电子能力的顺序。反之,金属离子得电子能力顺序恰好和金属单质失电子能力顺序相反。“结构决定性质”大概念在盐溶液中的具体化就是金属离子得电子强弱顺序。金属与盐溶液置换反应的本质是电子从失电子能力强的金属单质转移到得电子能力强的金属离子。由此建立金属与盐溶液反应的认知思维模型(见图1)。
该思维模型是由金属失电子顺序、离子得电子顺序以及金属和离子间得失电子过程构成的顺时针环路。竖线位置高低表示反应先后顺序,横线箭头长短表示电子得失强弱。反应过程中得失电子数守恒,元素种类不变,金属转化为离子成为溶质,离子转化为金属成为滤渣。滤渣、溶质产生的顺序和离子、金属得、失电子强弱的顺序一致,故滤渣、溶质产生的先后顺序见图1。根据思维模型,最高位的金属先失电子,最低位的离子先得电子,得失顺序依强弱顺序而改变。如反应至某一阶段时,后产生的滤渣、溶质存在,则按顺序易判断之前的滤渣、溶质一定存在。若某反应恰好完全反应,则反应物一定消失、生成物一定存在;若不是恰好完全反应,需分别考虑金属剩余或离子剩余,判断剩余物能否满足下个顺时针环路,直到不能满足环路反应结束为止。
5 运用模型解答金属与盐溶液反应举例
5.1 利用模型解释金属与混合盐溶液反应过程及物质组成
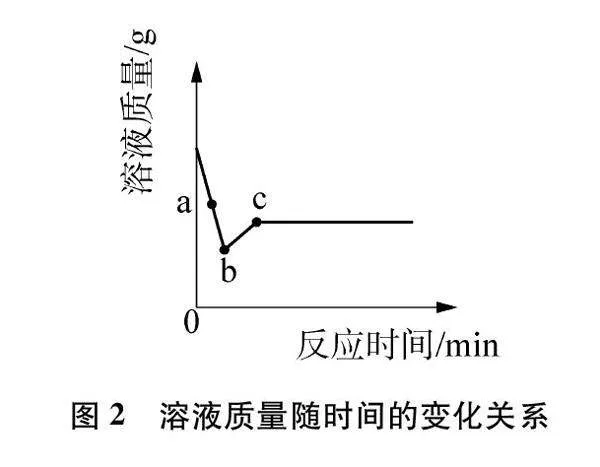
例1 竞争无处不在,微观粒子之间的反应也是如此。将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中发生反应,溶液的质量随时间的变化关系见图2。下列说法不正确的是( )
A. a点对应的溶液中含有三种金属阳离子。
B. b点处的固体中含Ag和Zn。
C. 取少量b点处的溶液于试管中,滴加稀盐酸会有沉淀出现。
D. 溶液先不变色,一段时间后由蓝色逐渐变为无色。
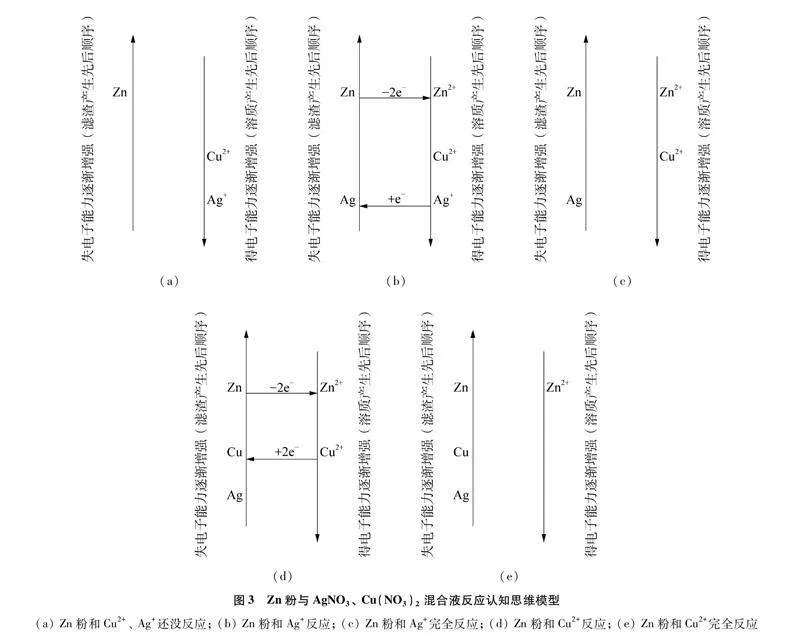
(1) 绘制思维模型,在相应位置标出Zn和Cu2+、 Ag+。见图3(a)。
(2) 根据得失电子强弱标出电子得失情况,Zn失去2个电子形成Zn2+、 Ag+得到1个电子形成Ag,构成第一个顺时针环路。见图3(b)。书写方程式Zn+2AgNO3Zn(NO3)2+2Ag。由于Zn粉足量,随着反应进行至AgNO3完全反应,第一个置换反应结束,则Ag+不存在而Zn粉有剩余,生成的Zn2+、 Ag存在。见图3(c)。
(3) 足量Zn粉和Cu2+构成第二个顺时针环路。见图3(d)。书写方程式Zn+Cu(NO3)2Zn(NO3)2+Cu。随着反应进行至Cu(NO3)2完全反应,第二个置换反应结束,则Cu2+不存在而Zn粉有剩余,生成的Zn2+、 Cu存在。见图3(e)。
解答:由图2中a点对应溶液质量减少知正在进行第一个置换反应,反应物生成物均存在,且Cu(NO3)2还没参加反应。见图3(b)。溶液中有三种阳离子,由溶质产生先后顺序知其为Zn2+、 Cu2+、 Ag+。故A正确。折点b对应溶液质量最小,说明第一个置换反应结束第二个置换反应还没开始。根据第一个顺时针环路知,AgNO3完全反应则Ag+不存在,而Zn粉有剩余,生成的Zn2+、 Ag存在。见图3(c)。b点处固体有Ag和Zn。故B正确。由于无Ag+,取少量b点处的溶液于试管中,滴加稀盐酸没有沉淀出现。故C不正确。随着两个置换反应依次结束,溶液中的Ag+、 Cu2+依次生成滤渣Ag、 Cu,溶液中只有Zn2+。见图3(e)。由于Ag+、 Zn2+无色,Cu2+蓝色,所以溶液先不变色,一段时间后由蓝色逐渐变为无色。故D正确。实际运用思维模型时可在一张图上进行,在相应物质上画“√”表示存在,画“×”表示不存在,更加直观明了。
思维模型将复杂多变的置换反应细化成得失电子的环路模型,可清晰反映多步反应的先后顺序、反应进程和产物成分。不同环路代表不同的置换反应,各步反应之间既有相同之处又有差异所在,既环环相扣又层层递进。思维模型基于活动性和大概念指明解决问题的认识思路和实现路径,帮助学生迁移知识,解决较复杂情境问题。
5.2 利用模型解释金属与盐溶液不能反应的本质原因
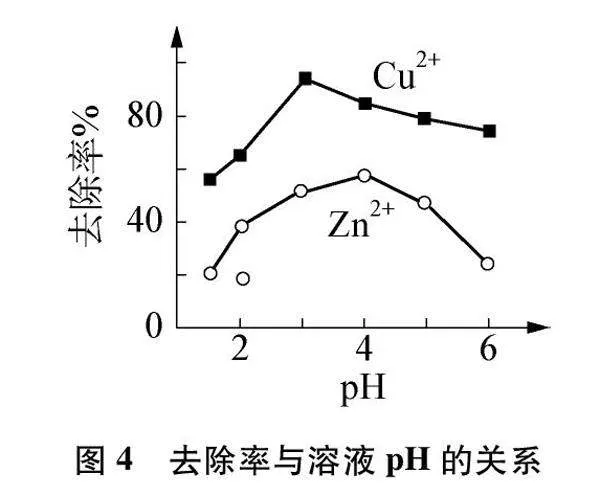
例2 中国古代已掌握了铜冶炼和铸造技术,现代铜冶炼废气、废水需经过处理后排放。湿法炼铜产生酸性废水,含有的CuSO4、 ZnSO4可用铁炭混合物(铁粉和活性炭的混合物)除去。其他条件不变,废水pH对Cu2+、 Zn2+去除率的影响如图4所示。
① pH<3时,铁炭混合物表面有大量气泡产生,产生该现象的化学方程式为____。
② 相同pH条件下,Cu2+的去除率远高于Zn2+的原因可能是____。
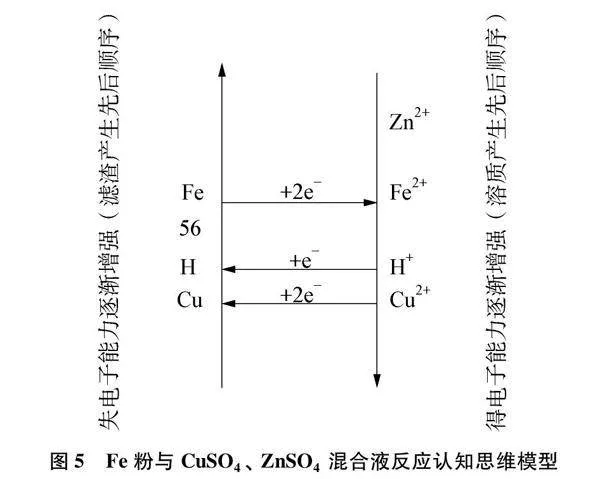
(1) 绘制思维模型,在相应位置标出Fe和Zn2+、 Cu2+。见图5。
(2) pH<3时溶液呈酸性,在相应位置标出H+。金属与酸反应先于金属与盐溶液。产生气泡是Fe粉失电子形成Fe2+,H+得电子形成H再生成H2,化学方程式为Fe+H2SO4=FeSO4+H2↑。
(3) 相同pH条件下,即不考虑H+影响,Fe失电子形成Fe2+,而Cu2+得电子能力比Zn2+强,故Fe粉和Cu2+构成一个顺时针环路而不能和Zn2+构成顺时针环路,所以Fe粉不与ZnSO4反应。Cu2+的去除率远高于Zn2+的原因可能是Fe能置换出Cu但不能置换出Zn,即宏观上铁的活动性比铜强而比锌弱,微观上Fe在溶液中失电子能力比Cu强而比Zn弱。
思维模型从金属和离子得失电子能力入手,将宏观物质和微观粒子建立联系。不仅能解释发生置换反应的原因,还能从本质上解释不能发生反应的原因。可引导学生辩证地看待置换反应实质,从死记硬背事实性知识到形成认识视角和分析反应过程。所以思维模型不是具体知识经验总结,而是体现学科大概念“结构决定性质”的抽象概括,具有迁移性和本原性。
5.3 利用模型半定量解释混合金属与盐溶液反应
例3 向硝酸银溶液加入一定质量的锌粉和铜粉的混合物,充分反应后过滤,得到滤渣和滤液。以下推断正确的是( )
A. 若向滤渣中加入稀盐酸有气泡产生,则滤渣中一定有银、铜、锌。
B. 若滤液为无色,则滤渣中一定有锌。
C. 若滤液为蓝色,则滤液中一定有硝酸银、硝酸铜和硝酸锌。
D. 滤渣的质量可能比反应前锌粉和铜粉混合物质量小。
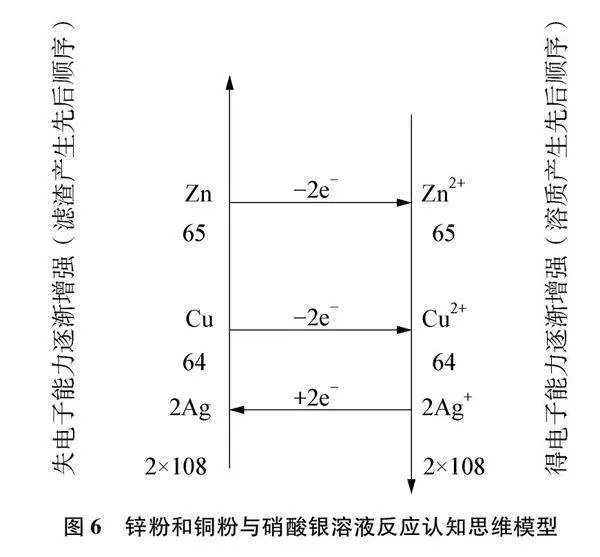
(1) 绘制思维模型,在相应位置标出Zn、 Cu和Ag+。见图6。
(2) 根据得失电子强弱标出电子得失情况,Zn失去2个电子形成Zn2+、 2Ag+得到2个电子形成2Ag,构成一个顺时针环路。书写方程式Zn+2AgNO3Zn(NO3)2+2Ag。如果Ag+过量还会和Cu构成第二个顺时针环路。书写方程式Cu+2AgNO3 Cu(NO3)2+2Ag。标出Zn、 Cu和2Ag的相对原子质量。
解答:若向滤渣中加入稀盐酸有气泡产生,则滤渣中一定有活泼金属锌。说明只进行第一个置换反应且锌粉有剩余。根据滤渣产生顺序,还一定有银、铜。故A正确。若滤液为无色,则溶质一定无Cu2+,说明还没有发生第二个置换反应,根据溶质产生顺序,溶质一定有Zn2+无Ag+。但第一个置换反应是否恰好完全反应却无法判断,即锌粉可能有剩余,也可能恰好完全反应。故B不正确。若滤液为蓝色,则溶质一定有Cu2+,说明第二个置换反应已经发生,根据溶质产生顺序,溶质一定有Zn2+、 Cu2+。同样第二个置换反应是否恰好完全反应也无法判断,即铜粉可能有剩余,Ag+也可能有剩余,所以是否有硝酸银无法判断。故C不正确。根据得失电子数守恒,无论反应进程如何,都存在Zn或Cu置换2Ag的微观过程,而Zn、 Cu相对原子质量65、 64都小于2Ag的相对原子质量216。即反应后滤渣的质量一定大于原锌粉和铜粉混合物的质量。故D不正确。
思维模型将物质成分按滤渣、溶质分别依次呈现,直观清晰,可以定性预测、判断与分析不同阶段的转化产物,还能基于电子守恒半定量比较各成分的质量变化。凸显思维可视AEWx9wFN+UUSC4fJ7BxRmA==化,帮助学生理顺每一步反应,有助于学生从定性定量认识角度、深层次理解金属和盐溶液的反应,培养深刻、灵活、系统的思维品质。
6 结语
综上所述,金属与盐溶液反应的思维模型是基于“金属活动性”认识视角和“结构决定性质”大概念建立的,能较好地揭示置换反应的微观本质,体现反应顺序、反应进程和产物成分。其特点是将金属活动性顺序衍生为金属和离子得失电子强弱顺序,形式上从一维线型抽象规律转化为二维平面环状递进图形,内容上将滤渣、溶质的产生顺序与得失电子的顺序有机融合,认识方式上将宏观和微观建立对应联系,进一步理顺和丰富金属活动性顺序的内涵。帮助学生认识金属参加置换反应失电子的共性,又能激发学生深度理解微观粒子决定宏观性质的化学观念,发展比较、分类、推理、预测等科学思维。
参考文献:
[1]中华人民共和国教育部制定. 义务教育化学课程标准(2022版)[S]. 北京: 北京师范大学出版社, 2022.
[2][8][11]郑长龙. 核心素养导向的化学教学——义务教育化学教学改革的新方向[J]. 课程·教材·教法, 2022, 42, (9): 41~46.
[3][6]何盼, 钱胜, 高明哲等. 单质活泼性与键能的关系初探[J]. 化学教育, 2013, 34(12): 86~87, 91.
[4]金嗣安. 金属的活泼性与活动性[J]. 安徽教育, 1982, (12): 46~32.
[5]鲁梅. 金属的电极电位、电离势和活动顺序[J]. 化学通报, 1978, (4): 46~48, 11.
[7]乔国才. 金属活动性顺序的变迁研究——从人教版《义务教育教科书·化学》(九年级下册)修订谈起[J]. 中学化学教学参考, 2013, (4): 48~51.
[9]杨玉琴, 陆海燕, 吕荣冠. 学科大概念: 从课标到教材到教学的转化——基于《义务教育化学课程标准(2022年版)》的分析[J]. 化学教学, 2022, (10): 3~9.
[10][12]吴庆生. 浅析化学大概念的凝练与建构[J]. 化学教学, 2021, (11): 37~40.
[13]吴星. 以大概念统领设计义务教育化学课程内容——《义务教育化学课程标准(2022年版)》解读(二)[J]. 化学教学, 2022, (11): 3~8.
(无锡市教育科学“十三五”规划2020年度立项课题“教育解释学视阈下初中化学课程前期启蒙行动研究”(课题编号:C/D/2020/05)的研究成果。)

