压强对化学平衡影响的实验探究

摘要: 为探究压强对二氧化碳溶解平衡的影响,通过压缩与抽拉注射器,实现升压与降压的条件变化,借助压强传感器,及时收集与记录不同条件下气体的压强变化。从实验结果可知,升高压强,二氧化碳溶解平衡会向气体分子数减小的方向移动;降低压强,二氧化碳溶解平衡会向气体分子数增大的方向移动。实验操作简单安全,适合学生进行自主探究活动,有助于学生深入理解压强对化学平衡的影响规律。
关键词: 二氧化碳溶解平衡; 化学平衡; 压强传感器; 实验探究
文章编号: 1005-6629(2024)07-0078-04 中图分类号: G633.8 文献标识码: B
1 问题提出
化学平衡是高中化学教学的重点内容之一。而在实际教学中,化学平衡的移动过程难以从微观角度表征,原理抽象不易理解。课标的“情境素材建议”中提到,化学平衡影响因素的证据素材有压强对NO2和N2O4平衡影响的数字传感器实验[1]。该实验在实际操作中,有三点不足之处:
(1) 二氧化氮是有毒气体,操作不当容易发生泄漏,影响实验者的安全。
(2) 压缩注射器到指定体积时,力度不好控制,难以维持活塞在指定位置。
(3) 气体颜色变化不够明显,学生的观察更多依赖于主观感受,非客观数据。
为了让学生更容易和更安全地观察实验,本研究选择二氧化碳溶解平衡作为研究对象,利用注射器与止水夹控制压强大小,连接数字传感器及时记录不同条件下的体系压强变化,数字化处理数据并绘制图像作进一步分析。
2 实验原理
2.1 二氧化碳的制备
泡腾片含有碳酸氢钠和柠檬酸,当泡腾片溶于水时,两种成分相互接触,快速产生大量的CO2气体。
2.2 二氧化碳的溶解
CO2溶于水时,先后发生两个反应:
溶解在水中的CO2大部分以弱的水合分子存在,只有1%~4%的CO2与H2O反应生成H2CO3[2]。因此,本实验主要研究CO2溶于水的第一步反应,正方向指气体溶解,逆方向指气体释放,本文以气体溶解与释放作反应方向的判断。
2.3 压强条件控制
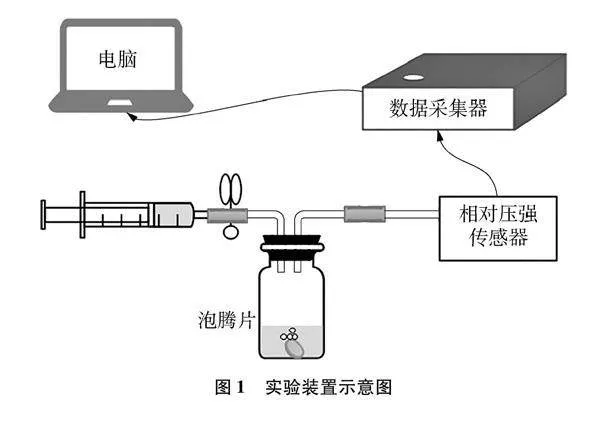
用橡胶管连通反应容器与注射器,通过压缩与回拉注射器,实现升压与降压。进行升压与降压操作后及时用止水夹夹紧橡胶管,以确保体系压强条件不变,排除无关变量对实验数据的影响。
3 实验试剂与仪器
实验药品:CO2泡腾片、蒸馏水
实验仪器:集气瓶、100mL注射器、导管、橡胶塞、数据采集器、相对压强传感器、平板电脑
实验装置:主要分为四个部分:反应装置、相对压强传感器、数据采集器与电脑终端,详见图1。本次实验所得数据用Origin8.5软件进行作图分析。
4 实验步骤、结果与讨论
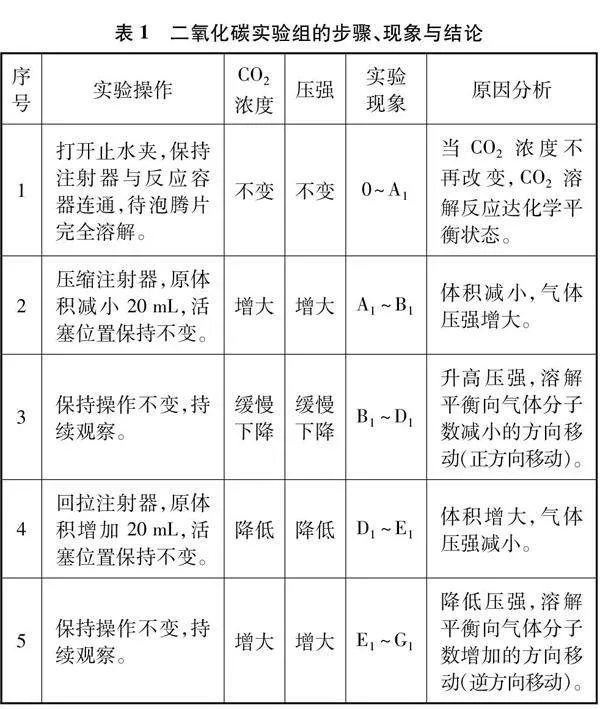
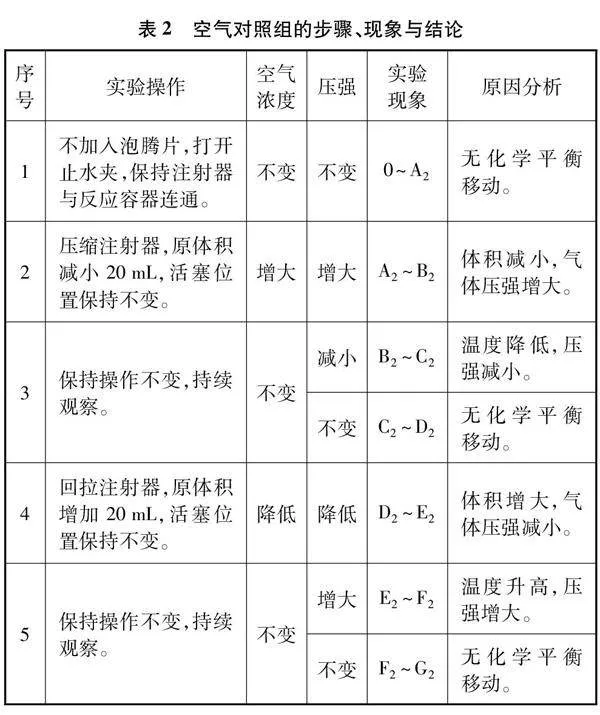
本实验分为两组实验:实验组1研究压强改变对CO2溶解平衡的影响;实验组2作为补充实验,目的为了探究充入不参与溶解平衡的气体对平衡移动的影响,实验组2以空气为例。实验总体设计如表1所示,前一步操作的最终状态是后一步操作的初始状态,因此在同一实验中可观察溶解平衡的建立、升压与降压过程中的不同变化。装置内气体有新产生的CO2和空气,同一体积下,气体压强实质是各气体的分压之和,因此通过压强的大小变化能推断出CO2浓度的大小变化,进而判断溶解平衡的移动方向。
4.1 二氧化碳溶解实验组(实验组1)
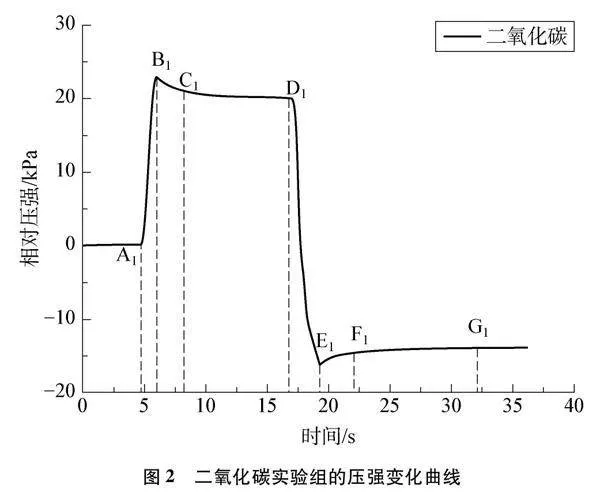
收集二氧化碳实验组数据,绘制曲线如图2所示。为方便讨论,图2作简要标注,详细分析见表1。
4.2 空气对照组(实验组2)
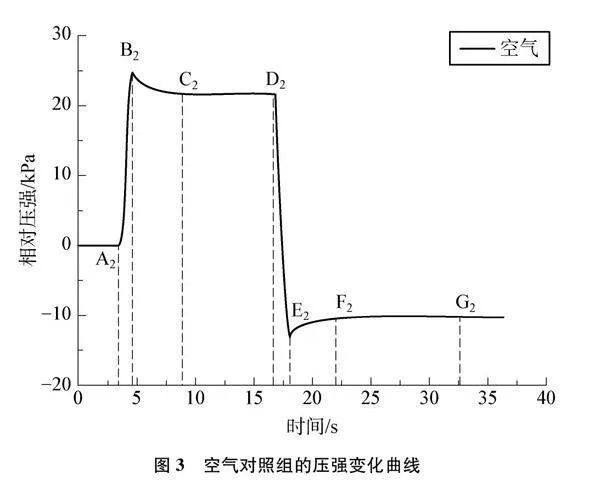
空气中含有N2的体积分数约为78%,O2的体积分数约为21%,常温常压下N2难溶于水,O2微溶于水。收集空气对照组数据,绘制曲线如图3,该图作简要标注,详细分析见表2。
4.3 实验数据分析
(1) 压缩气体时,图2中B1点产生突跃效应的原因:由于CO2是非极性分子,它溶入水的速度较慢[3],在压缩过程中气体产生压缩热效应,使气体温度升高,压强变大。在回拉注射器时,也产生相似效果(见图2中E1点),体积增大,温度降低,压强变小。
(2) 分析B1~D1段下降耗时长且幅度小的原因:一是CO2在水中扩散系数的数量级为10-5cm2·s-1[4],扩散阻力很大,溶解速度较慢;二是常温常压下,饱和水溶液里CO2的浓度约为0.035mol·L-1[5],CO2的溶解度不高。因此在相同原理下,降压时,E1~G1段也呈现耗时长且幅度小的变化。
(3) 图3有类似的突跃点,如B2和E2。空气中O2、 N2等也是非极性分子,它溶入水的速度也较慢,同样这也是由于压缩气体,气体做功,其内能增大,使温度升高所致[6],气体压强增加。可见普通的注射器与外界存在热传递,若能找到绝热的注射器,实验效果更佳。
(4) 对比两图变化,相同操作后,C1~D1段曲线缓慢下降,C2~D2段曲线保持水平不变。C1~D1段下降的原因是压缩气体时,体积减小,压强增加,CO2溶解平衡向气体分子数减小方向移动,CO2发生溶解,气体压强逐渐下降。C2~D2段压强保持不变,说明空气实验组不存在平衡移动,排除了空气对CO2实验的影响。因此在相同原理下,回拉注射器时,F1~G1段表现为压强逐渐上升,F2~G2段压强保持不变。
4.4 探究二氧化碳溶解速度(拓展实验)
步骤如下:用同一注射器先后收集相同体积的CO2气体和蒸馏水,用胶塞封住针口,垂直静置,观察活塞下移速度。实验现象如下:刚开始,活塞没有明显变化,经过30分钟,活塞有少许下移,振荡注射器,下移速度加快。由实验结果可知,CO2在水中的溶解速度较慢。
在探究压强对CO2溶解平衡影响的实验中,由于CO2溶解速度较慢,气体压强减小不明显,当进行压缩气体时,压缩热效应使气体温度升高,气体压强增大,这就出现了像B1点的突跃效果。相同原理下,在升压时,CO2溶解平衡会发生移动,平衡向气体分子数减小的方向移动,CO2会发生溶解,而由于其溶解速度有限,溶解过程需持续一定时间,这就出现了像图2中C1~D1段缓慢下降的现象。
5 结语
(1) 对比教材实验研究压强对反应N2O4(g)2NO2(g)的化学平衡移动,由于NO2气体有毒,不宜用于学生实验。CO2是一种安全气体,其溶解过程符合化学平衡移动的一般规律,学生能自主完成实验并记录实际变化,发展“变化观念与平衡思想”的核心素养。
(2) CO2溶解平衡受压强影响明显。借助数字传感器技术,收集并处理数据,绘制曲线,帮助学生完成从定性到定量的思维跃迁,提高对图像的分析能力。改变压强前后的曲线变化,一定程度上验证了勒夏特列原理[7],纠正学生的迷思概念。
(3) CO2溶解平衡涉及教材中多个学习背景,如侯氏制碱法[8]、海洋酸化、血液的酸碱平衡[9]、呼吸中毒等,本实验可做补充案例,帮助学生进一步拓展与探究反应原理。
参考文献:
[1]中国人民共和国教育部制定.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:31.
[2]吴国庆.无机化学[M].北京:高等教育出版社,2003:567.
[3][5]陈明元.中学化学中二氧化碳溶于水的问题[J].化学教学,2014, (9):93~94.
[4]郑萍,陈明元.相平衡与CO2在水中的扩散速率[J].贵州教育学院学报(自然科学版), 2004, 15(2):70.
[6]陈锦华.两用气体做功内能变化实验仪的创新改进[J].实验教学与仪器, 2022, 39(6):27~28.
[7]白俊杰.利用实验教学探究勒夏特列原理的内涵[J].中小学实验与装备, 2018, (6):20~21.
[8]人民教育出版社等.普通高中教科书·化学必修1[M].北京:人民教育出版社, 2019: 37.
[9]人民教育出版社等.普通高中教科书·化学选择性必修1[M].北京:人民教育出版社, 2020: 65.
(广州市教育科学规划2022年度课题“基于手持技术的高中化学实验教学研究”(课题批准号:202214287)的研究成果。)

