pH传感器测定难溶电解质沉淀溶解平衡实验的设计
摘要: 针对教材中构建难溶电解质沉淀溶解平衡概念实验的不足,利用pH传感器和“五口H管”的数字化创新实验,通过一个装置测定水中加Mg(OH)2晶体和继续加水后溶液的pH变化,引导学生认识难溶电解质在水中存在少量溶解且电离,并通过两次溶液pH趋于不变的事实,让学生认识难溶电解质在水中的平衡状态。实验设计新颖,操作简单,有助于培养学生的思维能力。
关键词: 五口H管; Mg(OH)2; pH传感器; 沉淀溶解平衡; 实验设计
文章编号: 1005-6629(2024)07-0075-03 中图分类号: G633.8 文献标识码: B
1 问题的提出
《普通高中化学课程标准(2017年版2020年修订)》中关于“沉淀溶解平衡”提出了相关的教学策略,即通过对沉淀溶解平衡等存在的证明及平衡移动的分析,形成并发展学生的微粒观、平衡观和守恒观。结合实验现象、数据等证据素材,引导学生形成认识水溶液中离子反应与平衡的基本思路。在组织学生开展实验探究活动时,注意实验前的分析预测和对实验现象的观察分析,对假设预测、实验方案、实验结论进行完整论证,培养学生的系统思维能力[1]。
对照不同版本的新教材,关于沉淀溶解平衡概念的建构方法各不相同。人教版中没有设置相关实验,只是从“AgCl固体溶解度很小”的文字描述中提出了概念。苏教版是通过实验探究提出了概念,即将少量PbI2固体加入盛有一定量水的烧杯中,搅拌静置后,取烧杯上层2mL清液于试管中,滴加AgNO3溶液出现黄色AgI沉淀[2]。鲁科版则是通过“观察思考”提出了概念,即将少量PbI2固体加入3mL蒸馏水中,搅拌静置后,向其中滴加几滴0.1mol/L的KI溶液,上层清液出现黄色PbI2沉淀[3]。查阅相关文献发现,在2014年使用旧版教材时已有相关实验改进的报道,如曾凤英等利用电导仪传感器测定不同种难溶电解质饱和溶液的电导率[4];郑晓红利用氯离子传感器测定AgCl相关实验中的氯离子浓度变化[5];近年又有杨玲等利用pH传感器与电导率传感器探究碳酸钙的溶解平衡[6];顾仲良利用电导率传感器测定难溶电解质PbI2饱和溶液的电导率变化[7]。上述三个版本教材不管是文字描述还是实验现象都主要是阐述或证明了难溶电解质在水中是存在极少量溶解的,并没有让学生构建沉淀溶解平衡概念中的“平衡”思想;在文献报道的某些实验改进中,对沉淀的选择以及电导率传感器的使用居多,导致实验现象和数据分析相对比较复杂,学生缺乏更直观的体会。
2 设计思路
2.1 难溶电解质的选择
不同版本的新教材中均选择AgCl、 PbI2两种难溶电解质,主要是因为这两种晶体在验证难溶电解质在水中存在极少量溶解的实验中能达到宏观现象明显的要求,但在沉淀溶解平衡概念中“平衡”思想的进一步建构却很难继续使用,主要是因为高中阶段实验室中很少配备以上难溶电解质对应离子的传感器,或此类传感器及配套软件的价格相对昂贵。本研究选择氢氧化物难溶电解质作为研究对象,可使用常规的pH传感器完成实验,成本低且使用方便,因此本实验选用难溶电解质Mg(OH)2晶体作为研究对象。Mg(OH)218℃时的溶度积为1.2×10-11。
2.2 进阶论证的选择
先向水中加入Mg(OH)2晶体,检测溶液的pH变化,发现溶液的pH先增大后不变,从而让学生体会难溶电解质在水中是存在极少量溶解的,以及可能存在的动态平衡现象,但此现象只是完成了沉淀溶解平衡概念的假设预测,并没有形成完整论证。因此继续注入蒸馏水再检测pH变化,发现pH先减小后增大,最后不变且与第一次实验时的最大pH相同。通过两次pH增大且趋于不变让学生完整地从问题、假设、验证、结论的进阶探究过程中逐步建构沉淀溶解平衡概念。
2.3 仪器的选择
若在同一个试管或烧杯容器中完成向水中加入Mg(OH)2晶体并检测其pH先增大后不变过程很易实现,但向试管或烧杯中再注入蒸馏水继续检测pH的变化就很难实现:一是因为加少量蒸馏水是很难检测到pH明显变小的(水溶液体积增大10倍,pH才能变化1左右),且加入大量蒸馏水则会因受到试管或烧杯容器容积的限制无法完成;二是因为同一个试管或烧杯容器中,未溶解的Mg(OH)2晶体在磁力搅拌器的搅拌下导致分散在整个悬浊液中,易对pH传感器的pH检测产生极大影响,pH变化会出现明显抖动现象。因此可以将未溶解的Mg(OH)2晶体和pH传感器分设在两个相通的容器中进行,并通过抽水机带动液体循环,同时利用滤纸阻断Mg(OH)2晶体的移动。最终,将仪器设置一个上位出水口,可以无体积限制地注入大量蒸馏水,从而实现pH明显变小的现象。
3 实验部分
3.1 仪器与药品
仪器:有线pH传感器、数据采集器、电脑及投影仪、橡胶管、烧杯、磁力搅拌器、抽水机、夹滤纸的双层钢丝网、五口H管
药品:Mg(OH)2晶体、蒸馏水
夹滤纸的双层钢丝网:高5cm、直径5cm圆形桶状双层钢丝网中间夹滤纸,用于防止难溶电解质晶体被抽水机抽出。
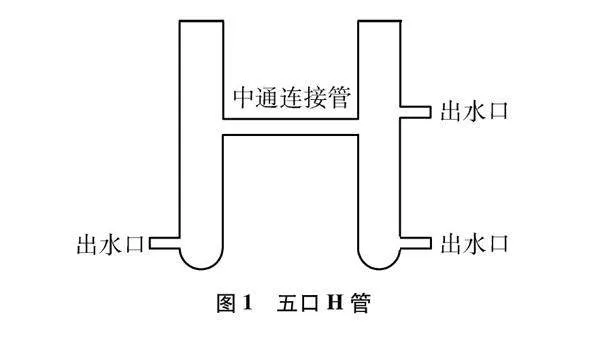
五口H管:如图1所示。由两高22cm、直径5cm的大试管中间连接一根10cm的中通玻璃管构成,并分别在两大试管的底部左侧和右侧以及中通连接管的上沿处各开一个直径1cm的出水口(可定制),其中下方两个出水口用于连接抽水机,从而实现液体循环。右上方的出水口用于当体系中注入大量蒸馏水时可让液体流出。
3.2 实验装置
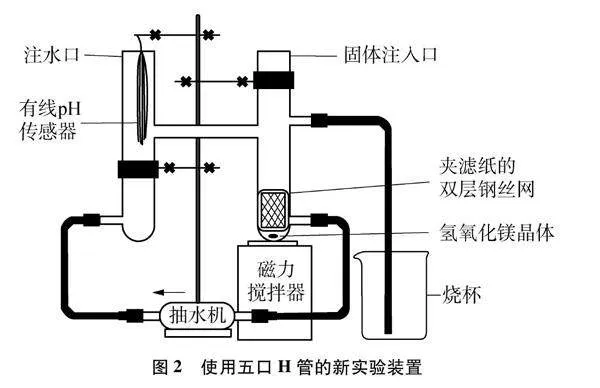
实验装置如图2所示。
3.3 实验步骤及现象
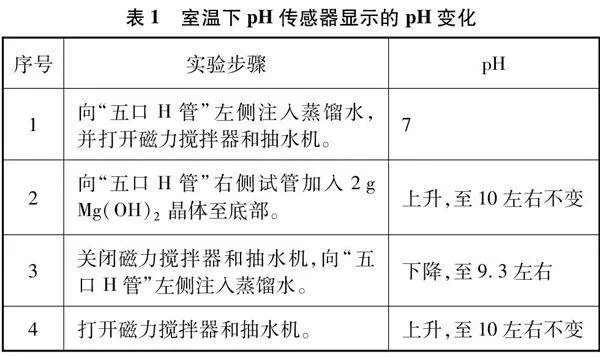
(1) 室温下向“五口H管”左侧大试管中注入蒸馏水至“五口H管”的中通连接管刚刚充满状态。打开磁力搅拌器和抽水机。此时左侧大试管中的pH传感器对应的数据采集电脑中显示pH约为7。
(2) 向“五口H管”右侧大试管中加入2g Mg(OH)2晶体至底部。此时左侧大试管中的pH传感器对应的数据采集电脑中显示pH不断增大,一段时间后趋于不变(略大于10)。
(3) 关闭磁力搅拌器和抽水机,向“五口H管”左侧大试管中匀速加入蒸馏水。此时左侧大试管中的pH传感器对应的数据采集电脑中显示pH不断减小。
(4) 打开磁力搅拌器和抽水机,一段时间后左侧大试管中的pH传感器对应的数据采集电脑屏显示pH又增大,且增大后又趋于不变,而趋于不变的pH数值与第二步实验的pH几乎相同。
以上实验步骤及现象归纳如表1所示。
3.4 实验现象分析
(1) 当Mg(OH)2晶体放入蒸馏水中后pH传感器的数据采集电脑屏显示的pH由7变大,一段时间后趋于不变(约为10左右)。pH由7变大让学生体会到Mg(OH)2晶体在水中因溶解电离产生了OH-导致c(OH-)大于c(H+)从而使pH增大,即Mg(OH)2晶体在水中并不是不溶的,而是存在溶解并电离成离子的现象。一段时间后pH趋于不变(约为10左右),让学生体会到Mg(OH)2晶体此温度下在水中溶解电离不能继续增大了,再增大Mg2+可能又要与OH-结合产生沉淀了,从而让学生体会并提出此时可能存在“沉淀溶解动态平衡”现象的假设。
(2) 从装置中加入大量蒸馏水后pH传感器的数据采集电脑屏显示的pH又减小了,让学生体会到加入蒸馏水后溶液中的OH-离子被稀释,从而c(OH-)又下降了。
(3) 从上一步一段时间后pH传感器的数据采集电脑屏显示的pH,让学生看到pH又增大且增大后又趋于不变(数值与第二步实验的pH几乎相同),让学生体会到加入蒸馏水后,Mg(OH)2晶体又继续溶解且继续电离产生了OH-,导致c(OH-)又增大了,即可能存在的动态平衡又正向移动了,最终pH又趋于不变,恰好验证了沉淀溶解平衡的存在,从而完整地建构了沉淀溶解平衡概念。
4 实验优点
(1) 实验操作简单,仅利用一个装置既能得出难溶电解质不是完全不溶而是有少量溶解且电离的,又能从两次pH增大趋于不变让学生完整地建构了沉淀溶解平衡概念,从而发展学生“宏观辨识与微观探析”、“变化观念与平衡思想”的化学学科核心素养。
(2) 利用夹滤纸的双层钢丝网防止Mg(OH)2晶体移动,以及利用抽水机将五口H管中的溶液进行循环,只要测定没有Mg(OH)2晶体的左侧大试管溶液的pH变化即可,避免了Mg(OH)2晶体对数据的干扰。
(3) 利用右侧中通连接管上沿处开的出水口,可以增大或减小注入蒸馏水的用量,以便实现注入蒸馏水后使pH明显变小。
(4) 利用数字化实验,能让学生方便且直观地体会到pH的变化,进而上升到对微观变化的逻辑思考,从而发展学生“证据推理”的化学学科核心素养。
5 几点说明
(1) 完成该实验需要足够的时间,建议先录制视频再用快速播放向学生展示。
(2) 夹滤纸的双层钢丝网务必要与试管壁紧贴,以防止Mg(OH)2晶体移动而分散。
(3) 用倾倒法注入蒸馏水时尽量要匀速,否则pH会出现抖动现象,建议利用定速水泵注入蒸馏水。
(4) 此装置还可以测定Mg(OH)2悬浊液中加入NaOH固体、MgCl2固体、稀硫酸等物质的pH变化,可进一步探究沉淀溶解平衡的移动。
(5) 此装置还可以更换电导率传感器以测定水中加入固体及继续加蒸馏水后的溶液电导率的变化实验。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 34~35.
[2]王明召, 王磊, 高盘良主编. 普通高中教科书·化学反应原理(选择性必修1)[M]. 济南: 山东科学技术出版社, 2020: 108~109.
[3]王祖浩主编. 普通高中教科书·化学反应原理(选择性必修1)[M]. 南京: 江苏凤凰教育出版社, 2021: 110~111.
[4]曾凤英, 潘祥泰. 基于数字化实验的沉淀溶解平衡实验的创新设计[J]. 化学教与学, 2014, (8): 91~93.
[5]郑晓红. 利用手持技术探究难溶电解质的溶解平衡[J]. 中学化学教学参考, 2016, (9): 56~57.
[6]杨玲, 吴晓红, 王亚涛. 借助传感器探究难溶电解质的溶解平衡[J]. 教育与装备研究, 2020, 36(7): 71~73.
[7]顾仲良. 测量难溶电解质溶解平衡的电导率实验探究[J]. 化学教学, 2022, (2): 67~69.

