红大戟水提物的急性毒性及抗炎、镇痛、抗凝血作用研究



【摘 要】 目的:对红大戟水提物的急性毒性及抗炎、镇痛、抗凝血作用进行研究。方法:采用最大给药量法对小鼠进行急性毒性试验,用二甲苯致小鼠耳肿胀试验、脂多糖(LPS)诱导炎症小鼠模型评价其抗炎作用,用小鼠热板试验和醋酸扭体试验评价其镇痛作用。通过检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)评价其抗凝血作用。结果:红大戟水提物最大给药量(120 g/kg/d)灌胃后连续观察14 d,全部小鼠均未出现死亡和明显的急性毒性反应。在抗炎研究中,红大戟水提物高、中、低剂量均能显著降低小鼠耳肿胀度(P<0.05或P<0.01),肿胀抑制率分别为39.5%、28.6%和20.2%,且能显著降低炎症模型小鼠血清中IL-6和TNF-α含量(P<0.05或P<0.01),而对IL-1β无显著性影响。在镇痛研究中,红大戟水提物各剂量在120 min时均能显著提高小鼠的热板痛阈值(P<0.01),且能显著降低小鼠扭体次数(P<0.05或P<0.01),扭体抑制率分别为36.7%、29.3%和23.5%。抗凝研究中,红大戟水提物高剂量能显著延长小鼠血浆PT值(P<0.05),而对APTT、TT无显著性影响。结论:红大戟水提物在最大给药量(120g/kg/d)条件下无明显的急性毒性反应,其具有明显的抗炎镇痛抗凝血作用。
【关键词】 红大戟;急性毒性;抗炎;镇痛;抗凝血
【中图分类号】R285.5
【文献标志码】A 【文章编号】1007-8517(2024)12-0035-05
DOI:10.3969/j.issn.1007-8517.2024.12.zgmzmjyyzz202412008
Study on Acute Toxicity, Anti-inflammatory, Analgesic,and Anticoagulant of the Water Extract of Knoxia valerianoides
ZENG Sen1 LI Yan2 WANG Lu2 WU Chaoquan3 NING Ling3 ZHAO Yue3 CHEN Yufeng2*
1. Guilin Tianhe Pharmaceutical Yiwei Co.Ltd,Guilin 541000,China;
2.Guilin Huarun Tianhe Pharmaceutical Co.Ltd,Guilin 541000,China;
3.Guangxi Institute For Food and Drug Control, Nanning 530000,China
Abstract:Objective To study the acute toxicity,anti-inflammatory,analgesic and anticoagulant effects of the water extract of Knoxia valerianoides.Methods Mice were given the maximum dose of Knoxia valerianoides to observe the acute toxicity. The anti-inflammatory were studied by xylene-induced ear swelling and an inflammation model of lipid polysaccharides(LPS) induced mice. Analgesic effects were studied by hot plate test and glacial acetic acid-induced writhing text. The anticoagulant effect was evaluated by the prothrombin time(PT),activated partial prothrombin time(APTT),thrombin time(TT).Results At the maximum dose of the water extract of Knoxia valerianoides,no death or acute toxicity was observed within 14 days in the mice.At the anti-inflammatory study, all dose of the water extract of Knoxia valerianoides had inhibitory effects on xylene induced auricle inflammation(P<0.05 or P<0.01),the inhibition rates were 39.5%, 28.6% and 20.2%. It could significantly reduce the contents of IL-6 and TNF-α(P<0.05 or P<0.01), but had no significant effect on IL-1β.At the analgesic study. All dose of the water extract of Knoxia valerianoides had inhibitory effects on acetic acid-induced writhing in mice(P<0.05 or P<0.01),the inhibition rates were 36.7%, 29.3% and 23.5%. The pain threshold of mice could be significantly prolonged (P<0.01). At the anticoagulant study,the high dose of the water extract of Knoxia valerianoides could significantly prolonged the prothrombin time(P<0.05). Conclusion Knoxia valerianoides has no obvious acute toxicity at the maximum dose of 120 g/kg/d. It has anti-inflammatory,analgesic and anticoagulant effects.
Key words:Knoxia valerianoides;Acute Toxicity;Anti-inflammatory;Analgesic;Anticoagulant
《中国药典》中记载,红大戟是茜草科植物红大戟(Knoxia valerianoides Thorelet Pitard)的干燥块根,其性苦、寒;有小毒;具有泻水逐饮、攻毒消肿散结的功效,临床上用于治疗胸腹积水、二便不利、痈肿疮毒、瘰疬痰核等症[1],对咽炎亦有治疗作用[2-3]。红大戟主要含有蒽醌类、三萜类、豆甾酮、木脂素、香豆素等成分[4-9],其药理活性研究较少,仅发现一篇关于红大戟抑制结核杆菌报道[10]。与红大戟泻水逐饮、攻毒消肿散结功效相关的药理作用有泻下、利尿、抗菌、抗炎等 [11-12],据此推测,红大戟可能有抗炎的作用。此外,中医认为的肿、结、痈、疮、瘰疬共同的病机为血瘀证,是与微循环障碍有联系的病理过程[13-14]。抗凝能改善血瘀证的高凝状态、改善微循环,从而达到消肿散结的效果。红大戟的攻毒消肿散结功效是否与抗凝血相关,值得探究。因炎症与疼痛密切相关[15],且红大戟有“小毒”,故本研究以红大戟为研究对象,研究其水提物的急性毒性和抗炎镇痛抗凝血作用,以期为红大戟的药理研究和临床应用提供参考。
1 仪器与材料
1.1 药物与试剂 红大戟(Knoxia valerianoides)由桂林华润天和药业有限公司提供。二甲苯(批号:20141020,国药集团化学试剂有限公司);醋酸(批号:20150505,国药集团化学试剂有限公司);罗通定(批号:210301,四川迪菲特药业有限公司);阿司匹林(批号:22102103,沈阳奥吉娜药业有限公司);生理盐水(批号:22306003,广西昆泽药业有限公司);PT试剂盒(批号:568056A,德国西门子医学诊断产品有限公司);APTT试剂盒(批号:568056A,上德国西门子医学诊断产品有限公司);TT试剂盒(批号:00685,德国西门子医学诊断产品有限公司);LPS(批号:P2636866,Sigma Aldrich);Mouse TNF-αELISA Kit(批号:052211002104840522,江莱生物);Mouse IL-6 ELISA Kit(批号:052211002202680522,江莱生物);Mouse IL-1β ELISA Kit(批号:052211002184420522,江莱生物)。
1.2 实验动物 SPF级昆明种小鼠,共450只,雌性200只,雄性250只,体质量18~22 g,由广西壮族自治区食品药品检验所生产,实验动物生产许可证号:SCXK桂2022-0001。
1.3 仪器 8 mm打孔器(得力手握式打孔器);AL204-IC精密电子天平(梅特勒);HI1220热板(LEICA);CS-1300全自动血凝分析仪[希森美康医用电子(上海)有限公司];多功能酶标仪(TECAN)。
2 方法
2.1 红大戟最大给药浓度水提物的制备 称取红大戟粉(过20目筛)400 g,加入8倍量的水,浸泡60 min后大火煮沸,保持微沸状态回流1 h,纱布过滤药液;药渣继续加入8倍量的水,同法第2次煎煮,过滤,将两次滤液合并,浓缩成浓浸膏。加适量水研磨配制成刚好能通过12号灌胃针的最大浓度 [16],此时浓度相当于1.0 g红大戟药材/mL。
2.2 急性毒性试验
2.2.1 预试验 50只小鼠随机分5组,每组10只, 雌雄各半。用水将1.0 g/mL的红大戟水提物按0.85比例逐级稀释配制得1.0、0.85、0.72、0.61 g/mL浓度组的药液,空白组给纯净水,各组灌胃体积为40 mL/kg,观察记录给药后14 d内小鼠体重、一般行为活动及死亡数。
2.2.2 最大给药量试验 40只小鼠随机分为空白组和红大戟组,每组20只,雌雄各半。空白组给纯净水,红大戟组以最大给药浓度1.0 g/mL和最大给药体积40 mL/kg灌胃给药,24 h内给药3次,给药剂量为120 g/kg/d,观察并记录给药后14 d内小鼠的急性毒性反应。
2. 3 红大戟水提物抗炎作用研究
2.3.1 耳肿胀试验 50只雄性小鼠,随机分为红大戟水提物高剂量组(10 g/kg)、红大戟水提物中剂量组(5 g/kg)、红大戟水提物低剂量组(2.5 g/kg)、阳性组(阿司匹林0.2 g/kg)、模型组(纯化水),按0.1 mL/10 g灌胃给药,1次/d,连续给药7 d。末次给药45 min后,每只小鼠的左耳前后两面用0.04 mL的100%二甲苯均匀涂抹,右耳作对照。涂抹45 min后将脱颈处死小鼠,沿耳廓剪下两耳片,用直径8 mm的打孔器在两耳同一部位打下圆耳片,立即称量两耳片的质量,以左右两耳片质量之差表示肿胀度,计算肿胀抑制率。
肿胀抑制率=(模型组肿胀度-试验组肿胀度)/模型组肿胀度×100%[17]
2.3.2 LPS诱导的炎症小鼠模型 50只雄性小鼠,随机分为红大戟水提物高剂量组(10 g/kg)、红大戟水提物中剂量组(5 g/kg)、红大戟水提物低剂量组(2.5 g/kg)、模型组(纯化水)和空白组(纯化水),每组10只,按0.1 mL/10 g灌胃给药,1次/d,连续7 d,末次给药60 min后,除空白组外,其他各组按20 mg/kg腹腔注射LPS制作炎症小鼠模型[18],注射60 min后,摘眼球取血,分离血清,并按照试剂盒说明书测定IL-6、TNF-α和IL-1β含量。
2.4 红大戟水提物镇痛作用研究
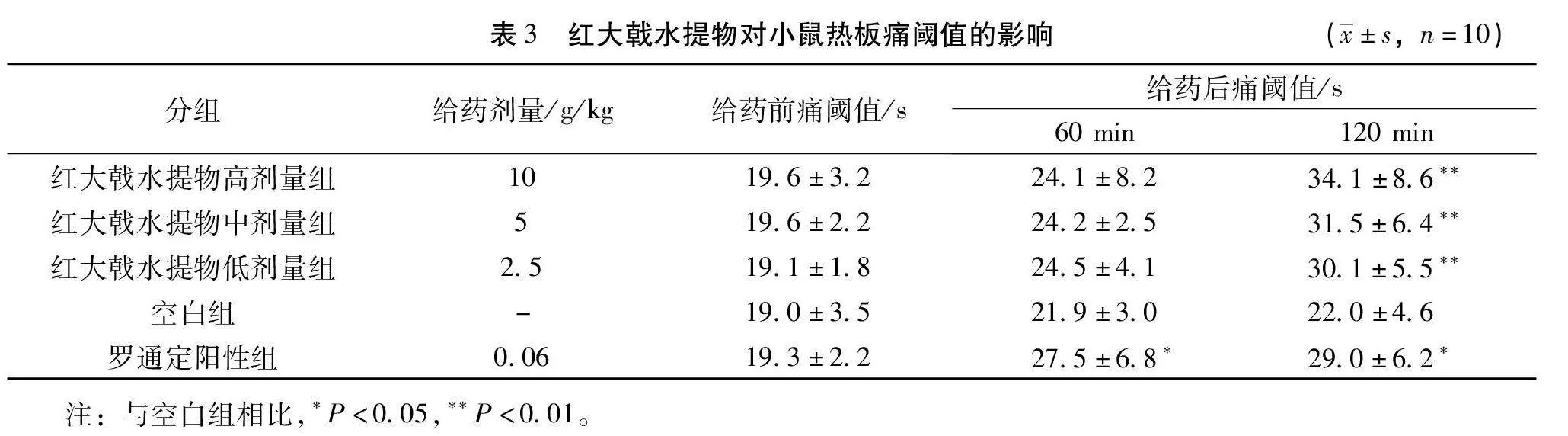
2.4.1 热板试验 选取雌性小鼠,将小鼠置于(53±0.5)℃的热板上,以小鼠足底接触热板至出现舔后足的时间作为痛阈指标,选取痛阈在5~30 s的小鼠用于后续试验。第1次测定后60 min测第2次,取2次痛阈的平均值作给药前痛阈值。将选出来的小鼠随机分为红大戟水提物高剂量组(10 g/kg)、红大戟水提物中剂量组(5 g/kg)、红大戟水提物低剂量组(2.5 g/kg)、阳性组(罗通定0.06 g/kg)、空白组(纯化水),每组10只,按0.1 mL/10 g灌胃给药,1次/d,连续给药7d。末次给药后于60、120 min检测痛阈值(s),如痛阈值超过60 s按60 s记并立即停止测试。
2.4.2 醋酸扭体试验 50只雄性小鼠,随机分为红大戟水提物高剂量组(10 g/kg)、红大戟水提物中剂量组(5 g/kg)、红大戟水提物低剂量组(2.5 g/kg)、阳性组(罗通定0.06 g/kg)、模型组(纯化水),每组10只,按0.1 mL/10 g灌胃给药,1次/d,连续给药7 d。末次给药90 min后按10 mL/kg腹腔注射0.8% 冰醋酸溶液,记录15 min内小鼠扭体次数,扭体以小鼠表现出“腹部内凹、臀部抬高、躯体扭曲”为依据,计算扭体抑制率。
扭体抑制率=(模型组扭体次数-给药组扭体次数)/模型组扭体次数×100%
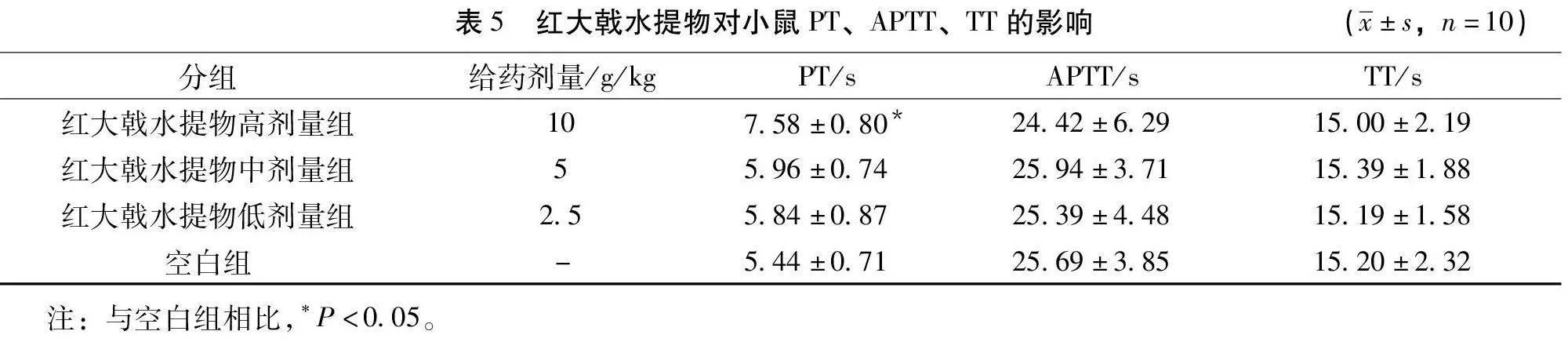
2.5 红大戟水提物抗凝血作用研究 50只雄性小鼠,随机分为红大戟水提物高剂量组(10 g/kg)、红大戟水提物中剂量组(5 g/kg)、红大戟水提物低剂量组(2.5 g/kg)、空白组(纯化水),每组10只,按0.1 mL/10g灌胃给药,1次/d,连续7 d,末次给药90 min后,摘眼球取血,分离血浆并测定PT、APTT、TT值。
2. 6 统计分析 用 SPSS 17.0软件进行数据统计分析,结果以(x±s)表示,采用单因素方差分析法进行多组间比较。P<0.05时,认为有统计学意义。
3 结果
3.1 小鼠急性毒性试验 预试验结果显示,给药后14 d内,各组小鼠行为活动正常,未见急性中毒症状。因此,以最大给药量法进行急性毒性试验,给药剂量达到120 g/kg/d。给药后,红大戟组和空白组的全部小鼠状态及行为活动等均正常,连续观察14 d,各组小鼠未出现死亡,全部小鼠一般状况良好,未发现急性毒性反应。
3.2 红大戟水提物的抗炎作用
3.2.1 红大戟水提物对二甲苯致小鼠耳肿胀的影响 由表1可知,与模型组相比,红大戟水提物高、中、低剂量组均能显著抑制小鼠耳肿胀度(P<0.05或P<0.01),抑制率分别为39.5%、28.6%和20.2%。结果提示,红大戟水提物对二甲苯诱导的小鼠耳肿胀急性炎症具有较好的抑制作用。
3.2.2 红大戟水提物对炎症小鼠模型的IL-6、TNF-α和IL-1β的影响 由表2可知,与空白组相比,LPS腹腔注射60 min后模型组的IL-6、IL-1β和TNF-α含量显著提高(P<0.01),提示造模成功[18]。与模型组相比,红大戟水提物高、中、低剂量组能显著降低炎症小鼠模型血清中的IL-6和TNF-α的含量(P<0.05或P<0.01),对IL-1β无显著影响。
3.3 红大戟水提物的镇痛作用
3.3.1 红大戟水提物对小鼠热板痛阈值的影响 由表3可知,给药前各组痛阈值无显著性差异,给药60 min后,与空白组相比,红大戟水提物各剂量组痛阈值无显著变化,给药120 min后,红大戟高、中、低剂量组痛阈值显著升高(P<0.01)。结果提示,红大戟水提物对热板致小鼠疼痛有一定镇痛作用。
3.3.2 红大戟水提物对小鼠醋酸扭体试验的影响 由表4可知,与模型组相比,红大戟水提物高、中、低剂量组均能显著减少小鼠的扭体次数(P<0.05或P<0.01),抑制率分别为36.7%、29.3%和23.5%,结果提示,红大戟水提物对醋酸致小鼠疼痛有一定抑制作用。
3.4 红大戟水提物对小鼠血浆PT、APTT、TT 的影响 由表5可知,与空白组相比,红大戟水提物高剂量组(10 g/kg)使小鼠PT有显著性延长(P<0.05),对APTT、TT值无显著性影响,中低剂量对PT、APTT、TT值无显著影响。结果提示,红大戟水提物有一定的抗凝作用。
4 讨论
李兴华等[19]按最大剂量为40 g/kg/次,1次/d灌胃给药的方法未发现红大戟水提物的急性毒性反应,但此方法的给药剂量未达到红大戟水提物的最大给药量,而有“小毒”的药物,只有超大剂量才会发生中毒[20]。为了进一步研究红大戟水提物的急性毒性,本研究采用最大给药量法,给药剂量达到120 g/kg/d,试验结果显示,红大戟水提物在最大给药量的条件下,无明显的急性毒性反应。
炎症是众多疾病共同的病理表现。二甲苯致小鼠耳肿胀模型主要是通过化学物质引发炎症介质释放,使局部血管扩张,最终使小鼠耳部发生急性肿胀,本研究发现红大戟水提物可显著抑制二甲苯诱导的小鼠耳肿胀。LPS诱导的炎症小鼠模型符合受到革兰氏阴性菌感染发生的症状。LPS进入小鼠体内会刺激巨噬细胞产生进而使得促炎细胞因子如IL-6、IL-1β和TNF-α大量分泌[21],诱导炎症反应。抑制炎症因子如IL-6、IL-1β和TNF-α的生成,表明拮抗了炎症反应[22]。本研究发现,红大戟水提物能显著降低LPS诱导的炎症小鼠模型血清中IL-6和TNF-α的含量,试验结果表明,红大戟水提物具有较好的抗炎作用。
炎症与疼痛关系密切,本研究利用热板试验和小鼠醋酸扭体试验来评价红大戟水提物的镇痛作用。热板试验结果显示,红大戟水提物能显著提高小鼠的热板痛阈值。醋酸扭体试验是通过腹腔注射一定剂量的冰醋酸造成的大面积深部的炎性疼痛,导致小鼠发生扭体反应,本研究发现红大戟水提物能抑制小鼠醋酸扭体的次数。以上结果提示,红大戟水提物具有较好的镇痛作用。
本研究选取了凝血四项中的PT、APTT、TT三项来评价红大戟水提物的抗凝作用。抗凝血试验结果显示,红大戟水提物高剂量能显著的延长PT值,结果提示红大戟水提物具有较好的抗凝作用。
本研究证实了红大戟水提物具有抗炎镇痛抗凝血的作用,对红大戟的药理研究和临床的应用具有一定的参考意义。有研究表明,红大戟所含的三萜类化合物阿江榄仁酸[7]和2α-3β-23-三羟基乌苏-12烯-28-酸[7]具有较好的抗炎[23]和抑制凝血因子Xa活性作用 [24],但本研究所用的红大戟水提物未进行指纹图谱研究,亦未对三萜类化合物进行含量分析,因此,红大戟抗炎镇痛抗凝血的“谱-效关系”还有待进一步研究。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:156-157.
[2]李兴华. “红芽大戟”的实名考证[J].中药材,2013,36(2):322-324.
[3]李治方.红芽大戟含服治疗慢性咽炎54例[J].江西中医药,1987,18(4):3.
[4]赵峰,王素娟,吴秀丽,等.红大戟中的蒽醌类化学成分[J].中国中药杂志,2011,36(21):2980-2986.
[5]ZHAO F,WANG S,WU X,et al. Anthraquinones from the roots of Knoxia valerianoides[J].Journal of Asia Natural ProductsResearch,2011,13(11):1023-1029.
[6]赵峰,王素娟,吴秀丽,等.红大戟中的非蒽醌类化学成分[J].中国中药杂志,2012,37(14):2092-2099.
[7]洪一郎,马丽,王垣芳,等.红大戟中的蒽醌和三萜类化学成分[J].中国中药杂志,2014,39(21):4230-4233.
[8]赵峰,马丽,孙居锋,等.红大戟中的1个新降碳三萜[J].中草药,2014,45(1):28-30.
[9] ZHAO F,WANG S,LIN S,et al. Natural and unnatural anthraquinones isolated from the ethanol extract of the roots of Knoxia valerianoides[J].Acta Pharm Sin B,2012,2(3):260-266.
[10]秦海宏,贾琳钰,高阳,等.红大戟提取物对结核杆菌的抑制作用观察[J].山东医药,2013,53(10):77-78.
[11]方晓艳,王琳琳,焦河玲,等.中药药理泻下药概述部分对比分析教学法的应用.[J].中国中医药现代远程教育,2016,14(15),19-20.
[12]罗良涛,黄国维,刘仁慧,等.结合《药理学》和《中药药理学》讲授《中药学》.[J].继续医学教育,2022,36(2),49-52.
[13]冷媛媛,陈林,王念,等.血瘀证与活血化瘀治法的古代文献溯源[J].江苏中医药,2023,55(5),59-63.
[14]李小茜,何建成.血瘀证之溯源[J].中华中医药学刊,2014,32(10):2449-2452.
[15]唐铭泽,申圳,高天乐,等.中药天然产物在疼痛管理中应用的研究进展[J].中国实验方剂学杂志.
[16]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:113-119.
[17]王灿红,弓宝,刘洋洋,等.通体结香技术产沉香的镇痛抗炎作用研究[J].生物资源,2021,43(4):363-369.
[18]贾航航,罗生杰,谭莉萍,等.基于LPS诱导小鼠炎症模型对苦苣菜抗炎机制的初步研究[J].塔里木大学学报,2022,34(2):8-15.
[19]李兴华,钟丽娟,王晶晶.京大戟与红大戟的急性毒性和刺激性比较研究[J].中国药房,2013,24(3):208-210.
[20]翁成国.有毒中药的传统药性特征研究[D].南京:南京中医药大学,2013.
[21]ZAMYATINA A,HEINE H. Lipopolysaccharide recognition in the crossroads of TLR4 and caspase-4/11 mediated inflammatory pathways[J]. Front Immunol,2021(12):649442.
[22]ZHAO Y,COOPER DAVID K C,WANG H Y,et al. Potential pathological role of pro-inflammatory cytokines (IL-6,TNF-α,and IL-17) in xenotransplantation[J].Xenotransplantation,2019,26(3):e12502.
[23]权洪峰,闫欣,彭晓东.阿江榄仁酸对LPS 诱导的小鼠 RAW264.7巨噬细胞的抗炎作用初步研究[J]. 医学信息,2017,30(23):30-32.
[24]王琼. 泽兰和丹参中凝血因子 Xa 抑制成分的研究[D]. 南京:南京中医药大学,2013.
(收稿日期:2023-09-12 编辑:刘 斌)

